Если не помог немозол что делать
Современный взгляд на проблему гельминтозов у детей и эффективные пути ее решения
По данным Всемирной организации здравоохранения, из 50 млн человек, ежегодно умирающих в мире, более чем у 16 млн причиной смерти являются инфекционные и паразитарные заболевания. В структуре инфекционных заболеваний кишечные гельминтозы находятся на тре
По данным Всемирной организации здравоохранения, из 50 млн человек, ежегодно умирающих в мире, более чем у 16 млн причиной смерти являются инфекционные и паразитарные заболевания. В структуре инфекционных заболеваний кишечные гельминтозы находятся на третьем месте. Согласно оценке Всемирного банка, экономический ущерб от кишечных гельминтозов занимает четвертое место среди наносимого всеми болезнями и травмами. Учитывая важность борьбы с паразитарными болезнями для многих стран, 54-я сессия Всемирной ассамблеи здравоохранения в 2001 г. одобрила стратегию борьбы с геогельминтозами до 2010 г. [5].
В РФ ежегодно на гельминтозы обследуются более 10 млн человек, большинство из них — дети. В 2002 г. было выявлено 813 тыс. зараженных, из них 681 тыс. (83,8%) составили дети в возрасте до 14 лет [4]. У детей встречаются более 15 видов гельминтов, из которых наиболее распространены энтеробиоз, аскаридоз, описторхоз, дифиллоботриоз, трихоцефалез, гименолепидоз. В последние годы все чаще регистрируется токсокароз, что связано с широким внедрением в практику диагностической тест-системы для его выявления.
В структуре гельминтозов ведущее место занимают энтеробиоз (91%) и аскаридоз (8%). Среди всех инвазированных на долю детей приходится 92,3% случаев энтеробиоза, 71,1 % — аскаридоза, 61,5% — трихоцефалеза и 66,2% — токсокароза.
Заболеваемость энтеробиозом и аскаридозом детей в сельской местности значительно выше, чем в городах, что, по-видимому, связано с разными санитарно-гигиеническими условиями в детских учреждениях города и села, а также со степенью загрязненности яйцами гельминтов окружающей среды (рис. 5).
Аскаридоз представляет собой один из наиболее распространенных гельминтозов, в формировании очагов которого основное значение имеет загрязненность почвы яйцами аскарид. В 2002 г. выявлено 74 196 случаев аскаридоза, в том числе 52 801 — у детей в возрасте до 14 лет, по сравнению с 2001 г. заболеваемость увеличилась на 3,5% и составила 217,7 на 100 тыс. детей.
Заболеваемость трихоцефалезом при явной тенденции к снижению за последнее десятилетие в 2002 г. выросла на 2,8% и составила 7,4 на 100 тыс. детей. Трихоцефалез регистрируется в основном в Южном федеральном округе (Республика Дагестан, Чеченская Республика).
Энтеробиоз по-прежнему занимает первое место по степени распространенности среди других гельминтозов. В 2002 г. зарегистрировано 614 955 случаев заболевания среди детей, что составило 2535,5 на 100 тыс. пациентов.
Максимальное число инвазированных энтеробиозом в 2002 г. выявлено в Сибирском, Северо-Западном, Уральском, Дальневосточном, Приволжском федеральных округах.
Особенностью большинства гельминтозов является хроническое течение заболевания, связанное с длительным присутствием возбудителя заболевания в организме и многократными повторными заражениями. Гельминтозы у детей, как правило, сопровождаются разнообразными неспецифическими клиническими проявлениями: слабостью, утомляемостью, раздражительностью, нарушениями сна, диспепсическими явлениями, замедлением роста и прибавки в весе, снижением иммунного статуса. Важнейшим компонентом патологии при гельминтозах является сенсибилизирующее действие продуктов обмена и выделения гельминтов, приводящее к развитию аллергических реакций в виде атопического дерматита, астматического бронхита, ринита, блефарита и др.
Выборочный анализ результатов диспансеризации 520 детей, проведенной в Свердловском районе г. Перми в 2002 г., показал, что аскаридоз выявлен у 1,35%, а энтеробиоз — у 5,8% обследованных. При этом в среднем показатель числа нарушений состояния здоровья на 1 ребенка у детей с энтеробиозом в группе дошкольников составил 2,5, а у школьников — 2,9. Чаще других отмечались заболевания мочеполовой системы (у девочек), аллергодерматит, анемия, синдром вегетативной дистонии, невропатические состояния и заболевания желудочно-кишечного тракта. Из заболеваний, диагностированных у детей с аскаридозом, наиболее часто встречались синдром вегетативной дистонии, функциональные заболевания желудочно-кишечного тракта, пневмония, аллергодерматит. Среди детей с аскаридозом показатель заболеваемости на 1 ребенка составил в среднем 2,0. В контрольной группе, в которую входили дети без паразитарных болезней (37 человек), среднее число нарушений здоровья было существенно ниже, чем среди инвазированных аскаридозом и энтеробиозом, и составило 0,2. Таким образом, наличие аскаридоза и энтеробиоза приводит к ухудшению общего состояния здоровья детей. При этом ими чаще заражаются дети с имеющимися разнообразными фоновыми заболеваниями, приводящими к ослаблению организма.
Остановимся подробнее на значении в развитии патологии у детей наиболее распространенных гельминтозов — аскаридоза и энтеробиоза [1, 3].
Аскаридоз. Развитие возбудителя аскаридоза (рис. 2, 3) в организме человека происходит с миграцией личинок, вышедших из яиц, по кровеносному руслу через легкие; затем личинки заглатываются с мокротой и развиваются во взрослые особи в кишечнике. Продолжительность жизни аскариды в организме человека составляет несколько месяцев. Аскаридоз оказывает значительное влияние на качество питания и иммунологические механизмы у детей. Аскаридный аллерген является самым сильным из аллергенов паразитарного происхождения. Он может вызывать реакции в легких, коже, конъюнктиве, желудочно-кишечном тракте. Аллергические реакции бывают столь выраженными, что нередко представляют угрозу для жизни ребенка.
Иммунодепрессивным действием аскарид обусловлено отсутствие эффекта от вакцинации и ревакцинации против кори, дифтерии, столбняка, полиовирусов у детей.
Ведущими механизмами патогенеза миграционной стадии аскаридоза являются травмирующее действие личинок и сенсибилизация паразитарными антигенами. При этом в разных органах и тканях возникают 2 основных вида поражений.
В кишечной фазе аскаридоза важными патогенетическими факторами являются способность аскарид, достигающих в длину 20–40 см, к спиральным движениям вперед и стремление проникать в небольшие отверстия (фатеров сосок, дренажные трубки и проч.). Наличие инвазии приводит к гипертрофии мышечных слоев стенки кишечника, уменьшению глубины крипт, изменению химического состава содержимого кишечника, нарушению моторно-секреторной функции желудка и кишечника. Аскариды выделяют ингибиторы трипсина и хемотрипсина, вследствие чего ухудшаются процессы всасывания пищевых веществ, белков, жиров. При аскаридозе развивается функциональная недостаточность пиридоксина, снижается уровень ретинола и аскорбиновой кислоты, уменьшается толерантность к лактазе. Аскаридоз, как правило, сопровождается дисбиозом кишечника.
Часто симптомами кишечной фазы аскаридоза являются тошнота, рвота, диарея, утомляемость, головокружение, плохой сон, боли в животе. Повышенный уровень эозинофилов в периферическом русле крови характерен для миграционной фазы аскаридоза.
Осложнения кишечной фазы аскаридоза: кишечная непроходимость, вызванная клубком взрослых аскарид; перитонит вследствие перфорации кишечной стенки или проникновения аскарид в полость живота через операционный шов; механическая желтуха при миграции гельминтов в общий желчный проток; блокада протоков поджелудочной железы; асфиксия из-за миграции аскарид в верхние дыхательные пути.
Энтеробиоз. Развитие возбудителя энтеробиоза (рис. 1) в организме человека происходит в пределах желудочно-кишечного тракта. Личинки выходят из яиц (рис. 4) и в среднем в течение 2 недель развиваются во взрослые особи, которые паразитируют в нижних отделах тонкого и верхних отделах толстого кишечника. Продолжительность жизни остриц может достигает 100 дней, а состояние инвазированности у детей вследствие повторных заражений может продолжаться намного дольше.
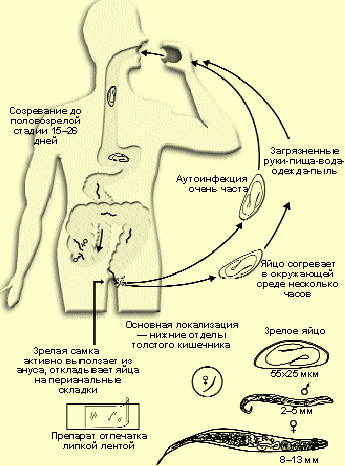 |
| Рисунок 1. Жизненный цикл возбудителя энтеробиоза (по H. C. Jeffrey, R. M. Leach, 1975) |
Воспалительные реакции при энтеробиозе развиваются уже под действием личинок, которые вырабатывают гиалуронидазу, протеолитические ферменты, лектиноподобные вещества, способствующие активации системы комплемента, выделению простагландинов клетками окружающих гельминта тканей хозяина [1, 2, 3].
При энтеробиозе нарушаются процессы всасывания и переваривания пищевых продуктов. У 30–40% инвазированных снижается кислотность желудочного сока вплоть до анацидоза и угнетения пепсинобразующей функции. У большинства детей изменяется микробиоценоз кишечника. Нарушения всасывания и переваривания пищевых веществ в кишечнике приводят к потере массы тела, задерживают рост и развитие ребенка.
Дополнительным фактором патогенеза энтеробиоза является механическое воздействие остриц в кишечнике, ведущее к точечным кровоизлияниям, эрозиям, проникновению бактериальной флоры, в частности возбудителей кишечных инфекций.
Ярким симптомом энтеробиоза является перианальный зуд, возникающий при движении самки во время яйцекладки (рис. 6). Выраженный зуд возникает, как правило, во время сна, чаще ночью, с 23.00 до 1.00 ч. Именно в это время гельминты могут, оставаясь незамеченными, отложить яйца, которые созреют до инвазионной, заразной, стадии уже к утру. Несмотря на кажущуюся безобидность, перианальный зуд тяжело переносится детьми и может сохраняться довольно долго после излечения энтеробиоза в результате формирования стойкого очага возбуждения в коре головного мозга. Осложнениями, возникающими в результате перианального зуда, являются повреждения кожи при расчесах, перианальные прурит, экзема, мокнущий дерматит. Этиологическим агентом воспалительного процесса чаще всего бывают стрептококки.
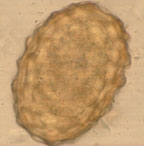 |
| Рисунок 2. Яйцо аскариды (70 мкм) |
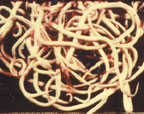 |
| Рисунок 3. Взрослые особи аскарид |
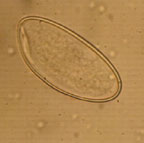 |
| Рисунок 4. Яйцо острицы (50–60 мкм) |
Боли в животе — частый симптом энтеробиоза. Боль преходящего характера отмечается у большинства инвазированных. Иногда острая боль в животе может быть причиной обращения за хирургической помощью. В таких случаях конкретной патологии обнаружить зачастую не удается, выявляется только скопление газов.
В последние годы увеличилось число случаев формирования у детей перианальных гранулем или абсцессов, внутри которых обнаруживались самки остриц или яйца гельминта. В связи с этим целесообразно проводить обследование на энтеробиоз всех детей с данными состояниями.
Во многих случаях энтеробиоз протекает длительно и многократно повторяется. В результате этого нарушается кишечный биоценоз, снижаются антагонистические свойства кишечной микрофлоры по отношению к возбудителям острых кишечных инфекций. У большинства инвазированных детей уменьшается число кишечных палочек и увеличивается доля лактонегативной кишечной флоры. Повышается активность энтерокиназы и щелочной фосфатазы в фекалиях. Так как микрофлора кишечника является одним из факторов, поддерживающих активность ферментов кишечника, развивающиеся вследствие энтеробиоза нарушения процессов переваривания и всасывания пищевых веществ приводят к потере массы тела и задерживают рост и развитие ребенка. Острицы оказывают механическое действие на слизистую кишечника, что ведет к точечным кровоизлияниям, эрозиям, проникновению бактериальной флоры, в частности возбудителей кишечных инфекций. Снижаются антагонистические свойства флоры по отношению к возбудителям брюшного тифа и других кишечных инфекций [1, 3].
В случае миграции остриц в брюшную полость, мочевыводящие и половые пути могут развиваться воспалительные и аллергические реакции вне кишечника.
 |
| Рисунок 5. Заболеваемость городских и сельских детей энтеробиозом и аскаридозом в 2002 г. |
Одним из распространенных осложнений при энтеробиозе является вульвовагинит вследствие проникновения остриц в половые пути и присоединения бактериальных инфекций. В случае развития вульвовагинита у девочки следует назначить паразитологическое обследование на энтеробиоз и при положительном результате провести лечение этой инвазии с одновременным бактериологическим обследованием и при необходимости антибактериальной терапией.
На фоне энтеробиоза у детей часто развиваются инфекции мочевыводящих путей, особенно у девочек, поскольку энтеробиоз служит фактором, предрасполагающим к развитию этого осложнения.
Паразитирование остриц у детей приводит к подавлению неспецифического иммунитета, проявляющемуся снижением уровня a-интерферона в сыворотке крови. Снижение неспецифической резистентности организма ребенка ведет к повышению заболеваемости вирусными, бактериальными инфекциями.
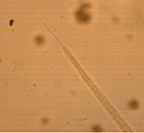 |
| Рисунок 6. Хвостовой конец самки острицы |
Наличие энтеробиоза приводит к снижению эффективности профилактических прививок. Иммунная прослойка против дифтерии исходно ниже среди инвазированных острицами детей. Не развивается защитный иммунитет при первичной вакцинации против этой опасной инфекции, а при ревакцинации во многих случаях иммунный ответ отсутствует. Затрудняется формирование иммунитета при вакцинации против кори столбняка, поэтому для повышения эффективности прививок сначала необходимо убедиться в том, что организм ребенка свободен от возбудителей гельминтозов.
У детей с аллергическими заболеваниями энтеробиоз развивается существенно чаще. В связи с относительно высокой степенью вероятности выявления энтеробиоза у детей с аллергическими заболеваниями пациентам этой группы следует рекомендовать обследование на энтеробиоз и дегельминтизацию в случае выявления инвазии.
Энтеробиоз отрицательно влияет на нервно-психическое развитие детей. Эта инвазия ведет к отставанию от соответствующих возрастных норм. Среди инвазированных энтеробиозом высок процент раздражительных детей, с нарушением процесса засыпания, имеющих отрицательные привычки (грызть ногти, сосать пальцы и др.).
При энтеробиозе у детей существенно снижается уровень меди, цинка и магния в крови. Поскольку недостаток этих микроэлементов может отрицательно влиять на физическое и психическое развитие детей, следует возмещать их потерю, вводя в рацион ребенка определенные продукты, назначая медикаменты (или пищевые добавки) вплоть до нормализации данных показателей после излечения энтеробиоза.
Основные показания к обследованию на гельминтозы:
Диагноз энтеробиоза и аскаридоза ставится только при получении положительных результатов лабораторного паразитологического обследования пациента. При подозрении на энтеробиоз исследуют перианальный соскоб (отпечаток), на аскаридоз — пробы фекалий. На бланке направления в лабораторию следует указать, какой именно гельминтоз врач подозревает у ребенка. От этого будет зависеть выбор наиболее эффективного метода исследования специалистами лаборатории.
Лечение аскаридоза и энтеробиоза
Поиск средств для лечения гельминтозов, в том числе энтеробиоза и аскаридоза, начался много веков назад. Ибн Сина рекомендовал для изгнания остриц принимать девясил и чистотел с сахаром, запивая их водой. Лекарство для изгнания глистов («умерщвления червей»), указанное в «Папирусе Эберса», содержит среди прочих компонентов косточки финика и растения дисарт, сладкое пиво. Салернский кодекс здоровья, который относится к началу XVI века, рекомендует другое средство — мяту [3].
Современный арсенал лекарственных средств, используемых для лечения кишечных гельминтозов, включает значительное количество препаратов различных химических классов. Они применяются как в клинической практике для лечения выявленных больных или паразитоносителей, так и с целью массовой профилактики.
На российском фармацевтическом рынке в настоящее время представлены несколько антигельминтных препаратов, действующих на возбудителей аскаридоза и энтеробиоза (табл. 1).
Наиболее эффективными препаратами для лечения энтеробиоза и аскаридоза являются производные карбаматбензимидазола (мебендазол, медамин) и тетрагидропиримидина (пирантел). Помимо способности к воздействию на зрелые формы гельминтов их отличает высокая овицидная и ларвицидная активность. Препараты этих фармакотерапевтических групп нарушают окислительные процессы, угнетают транспорт глюкозы у гельминтов, действуют на мускулатуру кишечных нематод путем деполяризации их нервно-мышечных соединений и блокируют действие холинэстеразы.
Эффективность лекарственных средств, используемых для лечения энтеробиоза и аскаридоза, очень высока, способ приема весьма прост и рассчитан в первую очередь на детей. Очень важно, что вследствие их приема не активизируется процесс выделения возбудителя в окружающую среду. Таким образом, человек во время лечения не становится более опасным для окружающих. Однако яйца остриц, уже попавшие в окружающую среду, в частности в помещение, сохраняются долго — более 2 недель. Поэтому рекомендуется повторить лечение энтеробиоза через 2-3 недели в той же дозе на тот случай, если гигиенические мероприятия оказались недостаточно эффективными. По этой же причине одновременно с лечением инвазированных нужно сделать все возможное для того, чтобы очистить помещения от возбудителей.
В течение многих лет для лечения аскаридоза и энтеробиоза во всем мире применяется пирантел, завоевавший популярность среди врачей-педиатров и пациентов. Согласно рекомендациям, разработанным в США (Medical Letter, 2002), пирантел считается препаратом первой линии для лечения энтеробиоза у детей и взрослых.
Антигельминтное действие пирантела памоата связано со стимулирующим влиянием на Н-холинорецепторы ганглионарных синапсов гельминтов, приводящим к спастическому параличу и последующему изгнанию их из организма человека. Клинические испытания эффективности и переносимости пирантела показали его высокую лекарственную активность при энтеробиозе и аскаридозе — 94—100%, а также хорошую переносимость [1, 3].
Пирантел для лечения энтеробиоза назначают из расчета 10 мг/кг в сутки однократно во время или после еды. Для лечения аскаридоза пирантел назначается в дозе 5 мг/кг однократно. Препарат хорошо переносится детьми, в отдельных случаях могут развиться тошнота, рвота, понос, боли в животе, очень редко возникают транзиторное повышение активности печеночных трансаминаз, головная боль, головокружение, нарушения сна. Пирантел противопоказан детям с болезнями печени.
Мы имеем большой опыт лечения энтеробиоза у детей препаратом пирантел (таблетки, суспензия). Пирантел хорошо известен на мировом рынке антигельминтных препаратов и широко применяется для лечения энтеробиоза в России многими поколениями врачей. По нашему мнению, этот препарат имеет ряд преимуществ по сравнению с другими антигельминтными средствами. Во-первых, препарат в форме суспензии легко давать детям, во-вторых, пирантел имеет приятный персиковый вкус, вследствие чего, во время лечения у ребенка не возникает отрицательных эмоций, и, наконец, в-третьих — пирантел обладает приемлемой ценой и широко продается в аптеках. Флакон снабжен мерной ложечкой со шкалой деления 2,5 и 5,0 мл, что позволяет легко дозировать препарат в зависимости от массы тела инвазированного ребенка (или взрослого). Пирантел-суспензия может применяться у детей уже с 6-месячного возраста.
Наряду с пирантелом, хорошим антигельминтным действием при энтеробиозе и аскаридозе обладают мебендазол и медамин.
Мебендазол (вермокс) для лечения энтеробиоза детям 2–5 лет назначается из расчета 5 мг/кг в сутки, старше 5 лет — 100 мг в сутки. Для лечения аскаридоза детям 2–5 лет препарат назначают из расчета 5 мг/кг в 2 приема в сутки в течение 3 сут, детям старше 5 лет мебендазол назначается в дозе 10 мг/кг в сутки в 2 приема в течение 3 сут.
Мебендазол не рекомендуется применять в первом триместре беременности. Необходимо помнить, что препарат противопоказан детям до 2 лет. К побочным действиям мебендазола относятся боли в животе, жидкий стул.
Медамин (2-медоксикарбаниламино-бензимидазол) по химическому строению и спектру антигельминтного действия близок к мебендазолу. Для лечения энтеробиоза он назначается в дозе 10 мг/кг в сутки в 2-3 приема (возможен и одномоментный прием) после приема небольшого количества пищи, таблетки рекомендуется разжевать и запить водой. Для лечения аскаридоза медамин назначают в тех же дозах в течение 3 дней.
К побочным действиям медамина относятся тошнота, слабость. При аллергических проявлениях препарат отменяют. Медамин противопоказан в первом триместре беременности.
Для восстановления микробиоценоза толстой кишки у больных кишечными нематодозами, в том числе энтеробиозом и аскаридозом, и повышения эффективности специфической терапии рекомендуется назначение бификола, молочного бифидум-бактерина. Давно известны пищевые продукты и лекарственные растения, которые могут применяться для лечения и профилактики энтеробиоза. Хорошее антигельминтное действие оказывают морковь и морковный сок. Также можно использовать антигельминтную активность грецких орехов, лесной земляники, граната (особенно гранатового сока), чеснока и любистока.
Из лекарственных растений применяют зверобой продырявленный в виде отваров и настоев, чая, а также девясил высокий (Inula helenicum). Эффективность фитотерапии энтеробиоза невысока, однако введение в рацион питания пищевых продуктов, обладающих антигельминтным действием, является хорошей мерой профилактики энтеробиоза и усиливает действие назначаемых врачом медикаментозных препаратов.
Критериями эффективности лечения гельминтозов является отрицательный результат контрольного паразитологического исследования проб фекалий (при аскаридозе) и перианального соскоба или отпечатка (при энтеробиозе), а также исчезновение клинических симптомов инвазии.
Профилактика гельминтозов
Особенности профилактики гельминтозов зависят от особенностей их эпидемиологии. При энтеробиозе и аскаридозе единственным источником инвазии является человек. Заражение происходит при заглатывании зрелых инвазионных яиц гельминтов. Однако в остальном эпидемиология этих гельминтозов сильно различается. Яйца остриц созревают в помещениях и на теле человека в течение нескольких часов и сохраняются в среднем до 1 месяца на различных предметах обихода. Яйца аскарид созревают при попадании в почву в течение нескольких месяцев и сохраняются там до 10 лет и больше. Энтеробиоз передается внутри помещений от одного человека к другому в основном через грязные руки, постельное и нательное белье, загрязненные яйцами остриц игрушки, посуду и другие предметы обихода.
Аскаридозом человек заражается при заглатывании частиц почвы, содержащей инвазионные яйца аскарид (с немытыми овощами, зеленью, фруктами). Повышает опасность заражения (в случае аскаридоза) наличие у ребенка такой вредной привычки, как геофагия (пробование или поедание земли, песка, глины), которая встречается довольно часто (у 3—10% детей в возрасте до 7 лет).
Профилактика энтеробиоза и аскаридоза — важнейшая задача медицинских, воспитательных учреждений, родителей. Она может быть решена при одновременном выполнении комплекса мероприятий, основными компонентами которого считаются выявление и лечение зараженных и санитарно-гигиенические меры. Профилактика аскаридоза, энтеробиоза и других гельминтозов в Российской Федерации регламентируется новыми санитарными нормами и правилами, утвержденными Минздравом РФ в 2003 г.
По вопросам литературы обращайтесь в редакцию.
Т. И. Авдюхина, кандидат медицинских наук, доцент
Т. Н. Константинова, кандидат медицинских наук, доцент
М. Н. Прокошева
РМАПО, Москва ДКБ им. П. И. Пичугина, Пермь
ТОКСОКАРОЗ: современный подход
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).