Желчные протоки забиты после удаления желчного пузыря что делать
ПХЭС: к чему быть готовым после удаления желчного пузыря?
Постхолецистэктомический синдром (ПХЭС) – явление не самое распространённое в гастроэнтерологии. Принято считать, что ПХЭС относится к группе заболеваний желчного пузыря. В действительности это даже не болезнь, а собирательное название комплекса симптомов, которые проявляются сразу или вскоре после операций на желчные протоки или удаления (резекции) желчного пузыря.
Симптомы постхолецистэктомического синдрома
По своей сути ПХЭС является следствием операции по резекции (удалению) желчного пузыря. Это значит, что после резекции у пациента могут проявиться неприятные симптомы, такие, как:
При ПХЭС возможны и другие симптомы, обусловленные обострившимися болезнями:
Причины развития постхолецистэктомического синдрома
Диагностика постхолицистэктомического синдрома
Сложности в точном определении причин, приведших к развитию ПХЭС, и размытость самого определения синдрома требуют тщательного обследования пациента. Чтобы правильно выбрать лечение, необходимо четко установить, что привело к появлению ПХЭС.
Вот почему эффективная диагностика постхолицистэктомического синдрома включает сразу несколько методов:
Лечение постхолицистэктомического синдрома
Так как ПХЭС – это не самостоятельное заболевание, лечение синдрома всегда определяется его причинами. Не зная, как правильно лечить постхолицистэктомический синдром, можно лишь усугубить состояние и усилить неприятную симптоматику.
Принципы лечения ПХЭС включают два ключевых момента:
Лечение в основном строится на:
Применение ферментных препаратов при постхолицистэктомическом синдроме
В некоторых случаях ПХЭС может сопровождаться нарушениями со стороны пищеварительной системы. Это связано с тем, что сигналом для выработки желчи и панкреатических ферментов становится приём пищи. Если сигнал не поступает или поступает с перебоями, последующие события также нарушаются. В результате пища не обрабатывает должным образом, и организм недополучает полезные вещества. Это может сказываться на общем состоянии организма и проявляться тяжестью после еды, дискомфортом, вздутием или диареей.
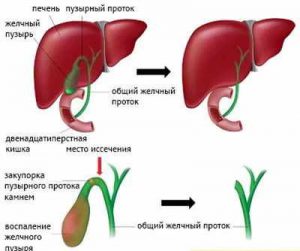
Закупорка желчных протоков
Закупорка желчных протоков – механическое препятствие на пути продвижения желчи из печени и желчного пузыря в двенадцатиперстную кишку. Развивается на фоне желчнокаменной болезни, опухолевых и воспалительных заболеваний желчевыводящих путей, стриктур и рубцов общего желчного протока. Симптомами патологии являются боли в правом подреберье, желтуха, ахоличный кал и темная моча, значительное повышение уровня билирубина в крови. Диагноз ставится на основании исследований биохимических проб крови, РХПГ, УЗИ, МРТ и КТ органов брюшной полости. Лечение обычно хирургическое – возможно проведение эндоскопического, лапароскопического либо расширенного оперативного вмешательства.
Общие сведения
Затруднение оттока желчи из печени и желчного пузыря сопровождается постепенным развитием клинической картины подпеченочной (механической) желтухи. Острая закупорка желчных путей может развиться сразу после приступа желчной колики, однако этому практически всегда предшествуют симптомы воспаления желчных путей. Несвоевременное оказание помощи пациенту с закупоркой желчных протоков может привести к развитию печеночной недостаточности и даже смерти больного.
Причины
Вызвать обструкцию желчных путей может как их закупорка изнутри, так и сдавление извне. Механическое препятствие оттоку желчи может быть полным или частичным, от степени обструкции зависит яркость клинических проявлений. Существует ряд заболеваний, которые могут способствовать нарушению прохождения желчи из печени в двенадцатиперстную кишку. Закупорка протоков возможна при наличии у пациента: конкрементов и кист желчных путей; холангита или холецистита; рубцов и стриктур протоков.
Патологическое состояние может возникать на фоне опухолей поджелудочной железы, гепатобилиарной системы; панкреатита, гепатита и цирроза печени; увеличения лимфатических узлов ворот печени; паразитарных инвазий; травм и оперативных вмешательств на желчных путях. Факторами риска являются ожирение или, наоборот, быстрая потеря веса; травмы правой половины брюшной полости; недавние оперативные вмешательства на желчных путях; инфекции гепатобилиарной системы и поджелудочной железы на фоне значительного ослабления иммунитета.
Патогенез
Патогенез закупорки желчных протоков многокомпонентный, началом обычно служит воспалительный процесс в желчных путях. Воспаление приводит к утолщению слизистой, сужению просвета протоков. Если в этот момент в протоки попадает конкремент, он не может самостоятельно покинуть холедох и вызывает полное или частичное перекрытие его просвета. Желчь начинает скапливаться в желчных путях, вызывая их расширение. Из печени желчь может сначала попадать в желчный пузырь, значительно растягивая его и вызывая обострение симптомов холецистита.
Если в желчном пузыре есть конкременты, они могут попадать в пузырный проток и перекрывать его просвет. При отсутствии оттока желчи по пузырному протоку может развиться эмпиема или водянка желчного пузыря. Неблагоприятным прогностическим признаком при закупорке желчных путей является секреция слизистой холедоха беловатой слизи (белой желчи) – это говорит о начале необратимых изменений в желчных протоках. Задержка желчи во внутрипеченочных протоках приводит к деструкции гепатоцитов, попаданию желчных кислот и билирубина в кровоток.
В кровь попадает активный прямой билирубин, не связанный с белками крови, из-за чего он вызывает значительное повреждение клеток и тканей организма. Желчные кислоты, содержащиеся в желчи, облегчают всасывание и обмен жиров в организме. Если желчь не попадает в кишечник, нарушается всасывание жирорастворимых витаминов А, D, Е, К. Из-за этого у пациента развивается гипопротромбинемия, нарушение свертываемости крови, другие симптомы гиповитаминоза. Дальнейший застой желчи во внутрипеченочных путях приводит к значительному повреждению паренхимы печени, развитию печеночной недостаточности.
Симптомы
Осложнения
На фоне деструкции гепатоцитов нарушаются все функции печени, развивается острая печеночная недостаточность. В первую очередь страдает дезинтоксикационная деятельность печени, что проявляется слабостью, повышенной утомляемостью, постепенным нарушением функционирования других органов и систем (легких, сердца, почек, головного мозга). Если пациенту не будет оказана помощь до наступления этого этапа заболевания, прогноз крайне неблагоприятный. При отсутствии своевременного хирургического лечения патологии у больного может развиться сепсис, билирубиновая энцефалопатия, цирроз печени.
Диагностика
Начальные проявления закупорки желчных протоков напоминают симптомы холецистита или желчной колики, с которыми пациент может быть госпитализирован в отделение гастроэнтерологии. Предварительная диагностика осуществляется с помощью такого простого и безопасного метода, как ультрасонография поджелудочной железы и желчных путей. Если будут обнаружены конкременты желчных путей, расширение холедоха и внутрипеченочных желчных протоков, для уточнения диагноза может потребоваться проведение МР-панкреатохолангиографии, КТ желчевыводящих путей.
Для уточнения причины механической желтухи, расположения конкремента, степени закупорки желчных путей проводится чрескожная чреспеченочная холангиография, динамическая сцинтиграфия гепатобилиарной системы. Они позволяют обнаружить нарушение динамики желчи, ее оттока из печени и желчного пузыря. Наиболее информативным методом диагностики является ретроградная холангиопанкреатография. Данная методика включает в себя одновременное эндоскопическое и рентгенологическое исследование желчевыводящих путей. При обнаружении камней в просвете протока во время проведения этой процедуры может быть произведена экстракция конкрементов из холедоха. При наличии опухоли, сдавливающей желчный проток, берется биопсия.
В биохимических пробах печени отмечается повышение уровня прямого билирубина, щелочной фосфатазы, трансаминаз, амилазы и липазы крови. Протромбиновое время удлиняется. В общем анализе крови может быть выявлен лейкоцитоз со сдвигом лейкоформулы влево, снижение уровня эритроцитов и тромбоцитов. В копрограмме обнаруживается значительное количество жира, желчные кислоты отсутствуют.
Лечение закупорки желчных протоков
Всем пациентам требуется консультация абдоминального хирурга. После проведения всех обследований, выяснения локализации и степени обструкции, определяется тактика оперативного лечения. Если состояние пациента тяжелое, может потребоваться его перевод в отделение интенсивной терапии для проведения антибактериальной, инфузионной и дезинтоксикационной терапии.
До стабилизации состояния больного проведение расширенной операции может быть опасным, поэтому используют неинвазивные методики облегчения оттока желчи. К ним относят экстракцию конкрементов желчных протоков и назобилиарное дренирование при РПХГ (через зонд, введенный выше места сужения желчных протоков), чрезкожную пункцию желчного пузыря, холецистостомию и холедохостомию. Если состояние пациента не улучшается, может потребоваться более сложное вмешательство: чрескожное транспеченочное дренирование желчных протоков.
После того, как состояние больного нормализуется, рекомендуют использование эндоскопических методик лечения. Во время эндоскопии проводят расширение (эндоскопическое бужирование) желчных путей при их рубцовом стенозе и опухолевых стриктурах, введение в желчные пути специальной пластиковой или сетчатой трубки для сохранения их просвета (эндоскопическое стентирование холедоха). При обтурации конкрементом рубцово-суженного сосочка двенадцатиперстной кишки может потребоваться эндоскопическая баллонная дилатация сфинктера Одди.
Прогноз и профилактика
Прогноз при своевременном оказании медицинской помощи благоприятный. Значительно ухудшает течение заболевания и результаты лечения раковая обструкция холедоха. Профилактика заключается в лечении хронических воспалительных заболеваний гепатобилиарной системы, желчнокаменной болезни. Рекомендовано соблюдение здорового образа жизни, правильное питание с исключением жирной, жареной и экстрактивной пищи.
Постхолецистэктомический синдром
Постхолецистэктомический синдром (ПХЭС) — состояние после операции удаления желчного пузыря (холецистэктомии) по поводу хронического калькулезного холецистита. ПХЭС — это условное обозначение различных нарушений, повторяющихся болей и диспепсических проявлений, которые возникают у больных после холецистэктомии.
Постхолецистэктомический синдром. Причины
Функциональные нарушения сфинктерного аппарата желчевыводящих путей
В настоящее время считается доказанным факт, что после удаления желчного пузыря наблюдается повышение тонуса сфинктера Одди, причиной которого является исключение регулирующей роли сфинктера желчного пузыря и мышечной активности желчного пузыря на сфинктер Одди.
После удаления желчного пузыря включаются механизмы приспособления к работе желчевыводящих путей без желчного пузыря. Изменение моторной функции сфинктера Одди является одной из причин формирования острой или хронической боли в животе и диспепсического синдрома в послеоперационном периоде. Перестройка работы желчевыводящих путей после холецистэктомии может продолжаться до 1 года после операции.
Дисфункция сфинктера общего желчного протока и других сфинктеров желчевыводящей системы может приводить к повышению давления в протоках, застою желчи в них, что проявляется болями в правом подреберье или в подложечной области. Если преобладает дисфункция панкреатического протока, то появляется клиническая картина, характерная для панкреатита.
Разнообразие клинических проявлений ПХЭС затрудняет не только определение типа функциональных нарушений сфинктерного аппарата желчевыводящей системы, но затрудняет диагностику ПХЭС.
Нарушения печени, поджелудочной железы и кишечного тракта после холецистэктомии
Удаление желчного пузыря перестраивает процессы желчеобразования и желчевыделения.
Вследствие этого, обострения хронического панкреатита после удаления желчного пузыря встречаются достаточно часто — от 5 до 90 %. Такой разброс объясняется тем, что до операции не проведено достаточное обследование для оценки состояния поджелудочной железы, но в ряде случаев имеет место гипердиагностика хронического панкреатита.
В медицинской практике отмечается, что чем дольше существуют камни в желчном пузыре, тем чаще возникает хронический панкреатит.
В поджелудочной железе снижается объем секреции ферментов, развивается внешнесекреторная недостаточность функции поджелудочной железы, нарушаются процессы пищеварения. Холецистоэктомия, вовремя проведенная, способствует улучшению или нормализации показателей ферментативной функции поджелудочной железы.
После удаления желчного пузыря нередко нарушается функция 12-перстной кишки, что подтверждается появлением дуоденогастрального рефлюкса, т.е., заброс содержимого 12-перстной кишки в желудок, и вызывающего морфологические изменения в выходном отделе желудка и формирование хронического рефлюкс-гастрита (желчного).
После удаления желчного пузыря нарушается функция тонкой кишки (всасывания пищевых компонентов) и моторная функция толстой кишки (запоры, поносы).
Постхолецистэктомический синдром. Диагностика
Диагностика направлена на выявление различных заболеваний желудочно-кишечного тракта, которые пациент имел до операции, возникших после операции, возможные послеоперационные осложнения.
Диагноз устанавливается на основе:
Постхолецистэктомический синдром. Лечение и профилактика
В раннем послеоперационном периоде большое значение имеет лечебное питание, которое предусматривает часто дробное питание до 6 раз в день, небольшими порциями с ограничением жиров до 60-70 г в сутки.
С целью более быстрой адаптации пищеварительной системы к новым физиологическим условиям – функционирование без желчного пузыря, с учетом сопутствующих болезней рекомендуется более раннее расширение питания близкого к рациональному.
Постхолецистэктомический синдром. Лекарственная терапия по показаниям
С целью улучшения качества желчи, продуцируемой печенью, назначакются препараты урсодезоксихолевой кислоты (Урсосан, Урсофальк, Урсодез, Ливодекса, Эксхол, Холудексан, Урсодокса и др.). Доза продолжительность приема препарата определяется лечащим врачом.
Для связывания избытка желчи в кишечник и особенно наличие холагенной диареи назначаются сорбенты (Смекта) и антациды (Фосфалюгель, Маалокс, Алььагел и др.) по 1 пакету 3-4 раза в день через 1 час после еды в течение 7- 14 дней, режим приема и продолжительность определяется индивидуально.
При наличии боли в верхних отделах живота назначаются спазмолитики (например, Дюспаталин по 1 капсуле 2 раза в день, Дицетел по 50-100 мг 3 раза в день в течение 2-4 недель).
При наличии дуоденита, папиллита, появлении условно-патогенной флоры в посевах кала проводится 7-дневный курс антибактериальных препаратов. Препаратами выбора могут быть Эрцефурил, Интетрикс, Фуразолидон и др., реже антибиотики в общепринятых дозах.
При наличии сопутствующей патологии (панкреатит и др.) по показаниям назначаются ферментные препараты (Панкреатин, Мезим форте, Креон и др.).
Постхолецистэктомический синдром. Профилактика
Профилактика ПХЭС начинается уже в процессе подготовки к операции с целью выявления и своевременного лечения заболеваний гепатопанкреатодуоденальной зоны (заболеваний печени, панкреатита, дуоденита и эрозивно-язвенного процесса в 12-перстной кишке).
Особенно врача беспокоит состояние поджелудочной железы, и если до операции выявлен хронический панкреатит, необходимо провести курс лечения (антисекреторные препараты, спазмолитики, ферментные препараты, препараты урсодезоксихолевой кислоты). Эти мероприятия снижают риск возникновения обострений панкреатита в послеоперационный период в 2.5-3 раза.
Реабилитация
Опыт показывает, что признаки постхолецитэктомического синдрома чаще возникают в первый год наблюдения в период адаптации пищеварительного тракта в новых анатомических условиях.
Через 3-6 месяцев, хотя в настоящее время имеются сведении об успешном применении минеральных вод низкой минерализации после 10 дня после операции, показан прием минеральных вод, оптимальнее в условиях гастроэнтерологического питьевого курорта (Железноводск, Кашин, Дорохово, Карловы Вары и др.) с повторением курса минеральной воды в домашних условиях через полгода.
Диспансерное наблюдение пациентов проводится в течение первого года после операции.
Постхолецистэктомический синдром: диагностика и лечение
Желчнокаменная болезнь (ЖКБ) чрезвычайно распространена в цивилизованных странах, в том числе и в России. Особенно высока заболеваемость среди женщин в возрасте 35–40 лет и старше. ЖКБ характеризуется образованием желчных
Желчнокаменная болезнь (ЖКБ) чрезвычайно распространена в цивилизованных странах, в том числе и в России. Особенно высока заболеваемость среди женщин в возрасте 35–40 лет и старше. ЖКБ характеризуется образованием желчных камней в билиарной системе, главным образом в желчном пузыре, и осложнениями, возникающими в связи с прогрессированием патологического процесса.
Основным методом лечения данного заболевания является холецистэктомия. У 25% перенесших холецистэктомию больных или сохраняются, или через некоторое время появляются абдоминальные боли и диспепсические расстройства, требующие лечения. Адекватная терапия больных зависит от правильного понимания патогенеза клинических симптомов, развивающихся после холецистэктомии. Особенности их формирования связаны, с одной стороны, с нарушениями в обмене холестерина, присущими желчнокаменной болезни, с другой — тем обстоятельством, что патологический процесс протекает в новых анатомо-физиологических условиях, т. е. при отсутствии желчного пузыря.
Известно, что удаление желчного пузыря по поводу калькулезного холецистита не избавляет больных от обменных нарушений, в том числе от печеночно-клеточной дисхолии, которая сохраняется и после операции. У большинства больных после холецистэктомии определяется литогенная желчь с низким холатохолестериновым коэффициентом. Выпадение физиологической роли желчного пузыря, а именно концентрация желчи в межпищеварительный период и выброс ее в двенадцатиперстную кишку во время еды, сопровождается нарушением пассажа желчи в кишечник и расстройством пищеварения. Изменение химического состава желчи и хаотическое ее поступление в двенадцатиперстную кишку нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к микробному обсеменению двенадцатиперстной кишки, ослаблению роста и функционирования нормальной кишечной микрофлоры, расстройству печеночно-кишечной циркуляции и снижению общего пула желчных кислот. Под влиянием микрофлоры желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки двенадцатиперстной, тонкой и толстой кишки с развитием дуоденита, рефлюкс-гастрита, энтерита и колита. Дуоденит сопровождается дуоденальной дискинезией и, в первую очередь, дуоденальной гипертензией с развитием дуодено-гастральных рефлюксов и забросом содержимого в общий желчный проток и проток поджелудочной железы.
В результате формируются дискинезии сфинктера печеночно-поджелудочной ампулы, желчного и панкреатического протоков (сфинктера Одди), а деконъюгированные желчные кислоты обусловливают развитие диареи. Таким образом, у больных с удаленным желчным пузырем имеющиеся клинические проявления могут быть связаны с изменением химического состава желчи, нарушенным пассажем ее в двенадцатиперстную кишку, дискинезией сфинктера Одди, а также с избыточным бактериальным ростом в кишечнике, синдромами мальдигестии и мальабсорбции, дуоденитом и другими патологическими нарушениями в системе пищеварения. Кроме того, у ряда больных могут сохраняться или развиваться вновь органические препятствия для оттока желчи, связанные с проведенной холецистэктомией. Патологические состояния, которые наблюдаются у больных после холецистэктомии, можно разделить на 3 группы.
В настоящее время термином «постхолецистэктомический синдром» принято обозначать только дисфункцию сфинктера Одди, обусловленную нарушением его сократительной функции и препятствующую нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии органических препятствий. При этом предлагается, вместо принятых ранее определений «постхолецистэктомический синдром», «билиарная дискинезия» и др., использовать термин «дисфункция сфинктера Одди».
Клинические проявления дисфункции сфинктера Одди зависят, в первую очередь, от вовлечения в процесс той или иной его структуры. При изолированной дисфункции сфинктера холедоха развиваются билиарные, при преимущественном вовлечении в процесс сфинктера панкреатического протока — панкреатические, а при патологии общего сфинктера — сочетанные билиарно-панкреатические боли. Для дисфункции сфинктера Одди характерны рецидивирующие приступы сильных или умеренных болей продолжительностью 20 и более минут, повторяющиеся в течение 3 и более месяцев. При билиарном типе боль локализуется в эпигастрии или правом подреберье с иррадиацией в спину и правую лопатку, при панкреатическом типе — в левом подреберье с иррадиацией в спину уменьшающаяся при наклоне вперед, при сочетанном типе — имеет опоясывающий характер. Боль может сочетаться со следующими признаками: а) начало после приема пищи; б) появление в ночные часы; в) тошнота и/или рвота.
Однако оценка только клинических симптомов недостаточна для исключения органической патологии билиарной системы. С этой целью используются ряд скрининговых и уточняющих методов (табл.).
Неинвазивные методы, позволяющие предположить дисфункцию сфинктера Одди, включают определение в крови уровня билирубина, щелочной фосфатазы, аминотрансфераз, амилазы и липазы. Лабораторные исследования необходимо проводить во время или не позднее 6 ч после окончания болевого приступа, а также в динамике. Транзиторное повышение в 2 и более раз уровня печеночных или панкреатических ферментов в период не менее чем при 2 последовательных приступах болей является важным в подтверждении дисфункции сфинктера Одди.
Аналогичное значение имеет провокационный морфино-простигминовый тест, когда парентеральное введение препаратов провоцирует развитие болевого приступа, чаще смешанного билиарно-панкреатического типа в сочетании с повышением в крови уровня аминотрансфераз, щелочной фосфатазы, панкреатических ферментов. Однако диагностическая ценность данного теста ограничена его низкой чувствительностью и специфичностью.
При УЗИ важное значение придается расширению холедоха и главного панкреатического протока, которое свидетельствует о нарушении тока желчи и панкреатического секрета на уровне сфинктера Одди. В то же время у 3-4% больных, перенесших холецистэктомию и не имеющих симптомов, отмечается расширение общего желчного протока. Определенное значение имеет ультразвуковое исследование диаметра общего желчного протока с использованием жирных завтраков, стимулирующих выработку эндогенного холецистокинина и увеличивающих холерез. После пробного завтрака измерение диаметра холедоха проводится каждые 15 мин в течение 1 ч. Увеличение его диаметра на 2 мм и более по сравнению с исходным позволяет предположить наличие неполной обтурации холедоха как в результате дисфункции сфинктера Одди, так и из-за органической патологии билиарной системы.
Для оценки состояния панкреатических протоков используется проба с введением секретина в дозе 1 мг/кг. В норме после стимуляции панкреатической секреции секретином при УЗИ отмечается расширение панкреатического протока в течение 30 мин с последующим его уменьшением до исходного уровня. Если проток остается расширенным более 30 мин, это свидетельствует о нарушении его проходимости.
При билисцинтиграфии о наличии дисфункции сфинктера Одди свидетельствует увеличение времени транзита радиофармпрепарата от ворот печени до двенадцатиперстной кишки, при этом оно пропорционально уровню базального давления сфинктера Одди. В то же время при расширенном холедохе данное исследование малоинформативно для оценки функции сфинктера Одди.
К инвазивным методам оценки функции сфинктера Одди относится непрямой способ — эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Косвенными признаками повышения тонуса сфинктера Одди являются диаметр холедоха более 12 мм, задержка контраста в холедохе свыше 45 мин. О дисфункции сфинктера главного панкреатического протока свидетельствуют расширение последнего до более чем 5 мм и замедление эвакуации контраста из его просвета. Однако аналогичные изменения могут наблюдаться и при наличии органической патологии.
Наиболее точным методом, подтверждающим дисфункцию сфинктера Одди, является манометрия. При этом возможно канюлирование раздельно холедоха и вирсунгова протока с проведением манометрии их сфинктеров, что позволяет выделить преимущественно билиарный или панкреатический тип расстройств, а также установить этиологию рецидивирующих панкреатитов у больных, перенесших холецистэктомию и папиллотомию. Признаками дисфункции сфинктера Одди при манометрическом исследовании являются:
Манометрия сфинктера Одди показана далеко не всем больным. Выбор данного исследования основывается на оценке тяжести клинических проявлений и эффективности консервативной терапии.
Таким образом, предположить, что речь идет о дисфункции сфинктера Одди можно в следующих ситуациях:
Примерные формулировки диагнозов у больных, перенесших холецистэктомию:
Диагноз: желчнокаменная болезнь, холецистэктомия в 1994 г. (для случаев, при которых отсутствуют клинические симптомы).
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1999 г.
Диагноз: хронический рецидивирующий (обструктивный) панкреатит с внешнесекреторной и инкреторной недостаточностью в фазе обострения.
Сопутствующее заболевание: желчнокаменная болезнь, холецистэктомия в 1994 г.
Диагноз: синдром раздраженного кишечника с преобладанием запоров в фазе обострения.
Сопутствующий диагноз: желчнокаменная болезнь, холецистэктомия в 1994 г.
Ведение больных, перенесших холецистэктомию. Цель лечения: восстановить нормальное поступление желчи и панкреатического секрета из билиарных и панкреатических протоков в двенадцатиперстную кишку. Задачи лечения: нормализовать химический состав желчи; восстановить проходимость сфинктера Одди; восстановить нормальный состав кишечной микрофлоры; нормализовать процессы пищеварения и моторику тонкой кишки для профилактики дуоденальной гипертензии.
Для профилактики образования желчных сладжей или камней во внепеченочной билиарной системе рекомендуется:
Медикаментозное лечение дисфункции сфинктера Одди направлено на снятие спазма гладкой мускулатуры последнего. С этой целью используется ряд препаратов, обладающих спазмолитическим эффектом. Нитраты: нитроглицерин используется с целью быстрого купирования болей, нитросорбит — для курсового лечения. Механизм действия нитратов сводится к образованию в гладких мышцах свободных радикалов оксида азота (NO), которые активируют гуамилатциклазу и увеличивают содержание цГМФ, что приводит к их расслаблению. Однако выраженные кардиоваскулярные эффекты, побочные действия и развитие толерантности делают их малоприемлемыми для длительной терапии дисфункции сфинктера Одди.
Антихолинергические средства блокируют мускариновые рецепторы на постсинаптических мембранах органов-мишеней. В результате происходит блокада кальциевых каналов, прекращается вход ионов кальция в цитоплазму гладкомышечных клеток и, как следствие, достигается снятие мышечного спазма. В качестве спазмолитиков используются как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М-холиноблокаторы (гастроцепин и др.). Однако при приеме препаратов данной группы может наблюдаться достаточно широкий спектр побочных эффектов: сухость во рту, задержка мочеиспускания, нарушения зрения, повышение внутриглазного давления, тахикардия, запоры, сонливость. Сочетание довольно низкой эффективности с широким спектром побочных действий ограничивает применение препаратов этой группы при дисфункции сфинктера Одди.
Блокаторы медленных кальциевых каналов — фенилалкиламины (верапамил, галлопамил), 1,4-дигидроперидины (нифедипин, амлодипин) и бензотиазепины (дилтиазем и др.) закрывают кальциевые («медленные») каналы клеточных мембран, препятствуют входу ионов кальция в цитоплазму клеток гладкой мускулатуры и вызывают ее релаксацию. Препараты обладают многочисленными кардиоваскулярными эффектами, в первую очередь вазодилатирующими, в связи с чем не нашли широкого применения при лечении дисфункции сфинктера Одди. Имеются лишь единичные публикации по использованию нифедипина при дисфункции сфинктера Одди, и целесообразность их применения требует дальнейшего изучения.
Миотропные спазмолитики, механизм действия которых сводится к ингибированию фосфодиэстеразы, или к активации аденилатциклазы, или к блокаде аденозиновых рецепторов, что приводит к снижению тонуса и двигательной активности гладкой мускулатуры. Представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте), бенциклан (галидор), дицикловерин (триган-Д), альверин (метеоспазмил) и др.
Основными недостатками препаратов всех вышеуказанных групп являются:
В отличие от них, гимекромон (одестон) обладает избирательным спазмолитическим действием на сфинктер Одди и сфинктер желчного пузыря. Кроме того, препарат не повышает давление в желчных путях, не оказывает влияния на секреторную функцию пищеварительных желез и процессы кишечной абсорбции.
В восстановлении нормального оттока желчи при отсутствии желчного пузыря, наряду с проходимостью сфинктера Одди, большое значение имеет уровень давления в двенадцатиперстной кишке. Если он превышает секреторное давление желчи и панкреатического сока, они будут депонироваться в билиарных и панкреатических протоках с соответствующими последствиями.
В связи с этим разрешение дуоденальной гипертензии считается непременным условием ведения больных с дисфункцией сфинктера Одди. При выборе тактики лечения следует учитывать, что основным патогенетическим механизмом развития дуоденальной гипертензии является избыточное содержание жидкости и газа в просвете двенадцатиперстной кишки в результате бродильно-гнилостных процессов, обусловленных микробной контаминацией.
Для деконтаминации двенадцатиперстной кишки проводятся 1-2 семидневных курса антибактериальной терапии со сменой препарата при очередном курсовом лечении. Препаратами выбора являются: доксициклин 0,1 г 2 раза в день, тетрациклин 0,25 г 4 раза в день, бисептол 960 мг 2 раза в день, фуразолидон 0,1 г 3 раза в день, эрсефурил 0,2 г 4 раза в день, ципрофлоксацин 250 мг 2 раза в день, метронидазол 0,25 г 4 раза в день, интетрикс 1 капсула 4 раза в сутки, реже — левомицетин 0,25 г 4 раза в день.
Подбор лекарственных средств проводится, как правило, эмпирически. При выраженных симптомах диспепсии назначаются сразу 2 препарата, один из которых должен действовать преимущественно на анаэробную микрофлору (например, метронидазол). Одновременно с приемом кишечных антисептиков в ряде случаев назначаются пребиотики: при наличии поносов — хилак форте 60 капель 3 раза в день в течение 1 нед, затем по 30 капель 3 раза в день в течение 2 нед; в случаях преобладания запоров — лактулоза по 1-2 столовые ложки 1 раз в день до нормализации стула.
После окончания антибактериальной терапии показаны пробиотики (препараты, содержащие нормальные штаммы кишечной флоры). Одним из известных представителей группы пробиотиков является бифиформ, содержащий в одной капсуле, покрытой энтерорастворимой оболочкой, энтерококки 107, бифидумбактерии 107 и питательную среду, способствующую их росту в тонкой и толстой кишке. Назначается препарат по 1 капсуле 2 раза в день в течение 2 нед. В комплексе с антибактериальными средствами необходимо назначать алюминийсодержащие буферные антациды (алюгастрин, алюмаг, маалокс, фосфалюгель, смекта и др.). Любой из препаратов принимается по 1 дозе через 1 ч после завтрака, обеда и ужина и перед сном (не сочетаются с хилаком форте). Продолжительность лечения составляет 5–7 дней. Целесообразность использования данных препаратов обусловлена следующими их способностями:
Наличие у большинства больных относительной ферментной недостаточности в результате разрушения пищеварительных ферментов дуоденальной и тонкокишечной микрофлорой, снижения интрадуоденального уровня рН, а также нарушения процесса смешивания их с пищевым химусом является обоснованием назначения ферментных препаратов. При склонности к поносам назначаются препараты панкреатина: мезим форте, креон, ликреаза, панцитрат и другие по 1 дозе 2-3 раза в день в начале еды; при склонности к запорам — комбинированные средства, содержащие панкреатин, желчные кислоты, гемицеллюлозу: фестал, энзистал, дигестал по 1 драже 2-3 раза в день в конце приема еды. Продолжительность лечения индивидуальна и, как правило, не превышает 10 дней.
Приведем ориентировочные схемы ведения больных с дисфункцией сфинктера Одди.
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1996 г.
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1989 г. Сопутствующие заболевания: хронический катаральный, преимущественно дистальный дуоденит. Синдром избыточного бактериального роста в тонкой кишке.
Таким образом, своевременная и правильная оценка клинической симптоматики, развивающейся у больных после операции холецистэктомии, дает возможность подобрать адекватную терапию и в результате существенно улучшить качество жизни пациентов с заболеваниями гепатобилиарной системы.
По вопросам литературы обращайтесь в редакцию.
П. Я. Григорьев, доктор медицинских наук, профессор, Э. П. Яковенко, доктор медицинских наук, профессор
Н. А. Агафонова, кандидат медицинских наук, А. С. Прянишникова, кандидат медицинских наук
И. П. Солуянова, кандидат медицинских наук, З. В. Бекузарова, А. В. Яковенко, кандидат медицинских наук
РГМУ, Москва