Жесткость и щелочность воды в чем разница
Жесткость и щелочность природных вод
Одной из важных характеристик природных вод, во многом определяющих возможности их использования человеком, является жесткость воды. Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния. Единицей жесткости воды в нашей стране является моль (жесткости) на кубический метр — моль/м3 (обычно дополнение «жесткости» после слова «моль» опускается). Числовое значение жесткости, выраженное в моль/м3, равно числовому значению жесткости, выраженному в миллиграмм-эквивалентах на литр (мг-экв./л); 1 мг — экв./л соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+. Величину жесткости можно определить по уравнению:
Ж = [Са2+]/(МСа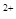
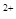
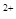
Ж = [Са2+]/20,04 + [Mg2+]/12,16, (2.19)
где Ж — жесткость воды, моль/л; [Са2+] и [Mg2+] — концентрации ионов кальция и магния, мг/л;
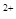
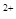
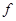
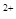
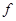
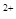
Определяемую по уравнению жесткость принято называть общей жесткостью воды, поскольку в воде различают карбонатную, некарбонатную, устраняемую и неустраняемую жесткость воды.
Классификация природных вод по величине жесткости
Жесткость, моль/м 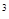 | Группа воды |
 10,7 10,7 | Очень мягкая Мягкая Средней жесткости Жесткая Очень жесткая |
Под карбонатной жесткостью понимается количество ионов кальция и магния, связанных с карбонат- и гидрокарбонат-ионами. Поэтому численное значение карбонатной жесткости равно сумме концентраций карбонат- и гидрокарбонат-ионов, выраженных в мг-экв./л. Если эта величина оказывается больше значения общей жесткости, т. е. карбонат- и гидрокарбонат-ионы связаны с другими катионами, то значение карбонатной жесткости принимается равным значению общей жесткости воды.
Некарбонатная жесткость воды определяется как разность значений общей и карбонатной жесткости.
Устраняемая жесткость воды представляет собой часть карбонатной жесткости, которая удаляется при кипячении воды. Устраняемую жесткость определяют экспериментально.
Неустраняемая жесткость воды определяется как разность значений общей и устраняемой жесткости.
По величине общей жесткости природные воды принято делить на ряд групп (табл. 2.4).
Среди природных вод наиболее мягкими являются дождевые воды, жесткость которых составляет примерно 70-100 ммоль/м3ч. Жесткость подземных вод меняется в широких пределах — от 0,7 моль/м3 (грунтовые воды Карелии) до 18-20 моль/м3 (грунтовые воды Донбасса) — и зависит от состава контактирующих с ними горных пород. В речных водах жесткость помимо состава горных пород, контактирующих с питающими данную реку водами, зависит от климатических факторов и испытывает сезонные колебания. Наименьшее значение жесткости речной воды наблюдается в период паводка.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Химические показатели качества воды
Характеристика основных показателей качества воды
К основным показателям качества относятся показатели, величина которых существенно, влияет на свойства подготовленной воды. Отклонения от заданных норм этих показателей ведут к образованию шлама, накипи и коррозии в котлах.
Общая жесткость, мг-экв/дм 3
Общей жесткостью воды называют сумму молярных концентраций эквивалентов ионов кальция и магния в воде. Эти элементы в природных условиях попадают в воду вследствие вымывания из карбонатных минералов и в результате биохимических процессов, происходящих в увлажненных слоях почв. Соли кальция и магния в отличие от других солей имеют обратную растворимость, а, именно, с повышением температуры воды уменьшается их растворимость, и при температуре близкой к кипению воды соли кальция и магния имеют свойство выпадать в осадок и прикипать к поверхности труб.
Щелочность, мг-экв/дм 3
Щелочность воды определяется суммой содержащихся в воде гидроксильных ионов и анионов угольной кислоты. Различают гидрокарбонатную, карбонатную и гидратную щелочность, сумма которых составляет общую щелочность.
Расход кислоты на титрование до значения рН 8,3 ед. (до изменения окраски по фенолфталеину с малиновой на бесцветную) выражает щелочность воды по фенолфталеину, расход кислоты на титрование до значения рН 4,5 ед. (до изменения окраски по метилоранжу или смешанному индикатору) совместно с предыдущим титрованием выражает общую щелочность.
Щелочность по фенолфталеину – это косвенный показатель присутствия или отсутствия свободной углекислоты: если есть щелочность по фенолфталеину, значит углекислота отсутствует, а рН выше 8,3ед.
Карбонатный индекс (мг-экв/дм 3 ) 2
Карбонатным индексом называется предельное произведение общей щелочности и кальциевой жесткости, выше которого протекает карбонатное накипеобразование с интенсивностью более 0,1 г/м 2 ×ч.
Карбонатный индекс (Ик) рассчитывается по формуле: Ик = Щ×ЖСа, (мг-экв/дм 3 ) 2
ЖСа – кальциевая жесткость воды, мг-экв/дм 3
Реагентная обработка подпиточной и сетевой воды комплексонатами наиболее эффективна при карбонатном индексе не более 8 (мг-экв/дм 3 ) 2 .
Мутность воды обусловлена содержанием взвешенных веществ в воде мелкодисперсных примесей нерастворимых или коллоидных частиц различного происхождения.
Мутность воды обуславливает и некоторые другие характеристики воды такие как:
Прозрачность по шрифту, см
Прозрачность, величина обратная мутности и содержанию взвешенных веществ, характеризует наличие в воде частиц песка, глины, ила, планктона, которые способствуют образованию шлама и отложений в котлах. Определение прозрачности по шрифту можно заменить на определение прозрачности по кольцу, как более удобное в эксплуатации.
Низкая прозрачность воды свидетельствует о присутствии шлама в системе и является основанием для назначения продувки котлов, грязевиков, гидропневмопромывки трубопроводов.
Взвешенные вещества – это нерастворимые твердые примеси различной степени дисперсности разнообразные по своему составу. Их обычно подразделяют на органические и минеральные. К первым относятся частицы гумуса, остатки растений и животных. Минеральные вещества представлены песком, тонкой глинистой взвесью, частичками минералов. Взвешенные вещества способствуют образованию шлама и отложений в котле.
Содержание соединений железа (в пересчете на Fe), мг/дм 3
Железо в природных водах встречается в виде органических и неорганических соединений, находящихся в коллоидном состоянии, или в виде тонкодисперсных взвесей (органокомплексы железа, гидроксиды окисного и закисного железа, сульфиды и т.д.) В поверхностных водах железо, обычно в окисной форме, содержится главным образом в органических комплексах (гуматы), а также в виде коллоидных и тонкодисперсных взвесей. В подземных водах при отсутствии растворенного кислорода железо преимущественно находится в виде двухвалентных ионов.
Железо способствует образованию шлама и отложений в котле. Двухвалентное железо способствует образованию и развитию коррозии трубопроводов.
Значение рН, единицы рН
При рН менее 8,3 ед. в воде присутствует углекислота, повышающая агрессивность воды, что способствует коррозии. При рН=8,3 ед. и более углекислота отсутствует. Значение рН более 8,5 – 9 ед. способствует образованию кальциевых отложений, поэтому допускается только при подпитке системы теплоснабжения химически очищенной водой (жесткость 0,1 – 0,5 мг-экв/дм 3 ).
Сухой остаток, солесодержание, мг/дм 3
Сухой остаток характеризует содержание в воде нелетучих растворенных веществ (главным образом минералов и органических веществ, температура кипения которых превышает 105-110°С). Солесодержание дополнительно к сухому остатку включает в себя летучие растворенные вещества.
Для природной воды величина сухого остатка равна сумме массовых концентраций анионов и катионов.
Удельная электропроводимость, мкСм/см
Содержание кислорода, мкг/дм 3
Кислород относится к агрессивным газам, которые являются агентами коррозии трубопроводов и оборудования.
Содержание углекислоты, мг/дм 3
Если количество свободной углекислоты в воде больше ее равновесной концентрации, то избыток СО2 называют агрессивной углекислотой, вызывающей коррозию трубопроводов и оборудования.
Содержание нефтепродуктов, мг/дм 3
Нефтепродукты это неполярные и малополярные углеводороды, составляющие главную и наиболее характерную часть нефти и продуктов ее переработки. По растворимости нефтепродуктов в воде различают три вида:
Нефтепродукты способствуют образованию маслянистой пленки на поверхностях нагрева, которая значительно увеличивает термическое сопротивление металла.
Содержание соединений кремния (в пересчете на SiO2), мг/дм 3
Содержание соединений кремния в водах обусловлено присутствием в грунте кварца и алюмосиликатных минералов (например, глины). Кремний способствует образованию твердых отложений в котле.
Содержание хлоридов, мг/дм 3
Источником хлоридов в исходной воде являются осадочные породы и продукты выветривания магматических пород. В химически очищенной воде повышение содержания хлоридов может быть обусловлено попаданием продуктов регенерации (NaCl, CaCl2, MgCl2).
Содержание хлоридов выше 50мг/дм 3 делает воду агрессивной: разрушает карбонатную пленку, усиливает эффект кислородной и углекислотной коррозии.
Содержание сульфатов, мг/дм 3
Сульфат-ионы являются важнейшим компонентом химического состава поверхностных вод. В маломинерализованных водах сульфаты находятся преимущественно в ионной форме. При увеличении минерализации они склонны к образованию ассоциированных нейтральных ионных пар типа CaSO4, MgSO4.
В поверхностные воды сульфаты поступают главным образом за счет процессов химического выветривания и растворения серосодержащих минералов, в основном гипса и ангидрита, а также окисления сульфидных минералов и серы.
При химическом связывании кислорода сульфитом натрия содержание сульфатов в обработанной воде увеличивается.
Сульфат-ионы способствуют как коррозионным процессам, так и накипеобразованию.
Окисляемость, мг/дм 3
Содержание полифосфатов, мг/дм 3
Полифосфаты являются основным рабочим веществом комплексонатов – реагентов, применяемых для стабилизационной обработки сетевой воды. Контроль содержания полифосфатов необходим для своевременной корректировки режима дозирования реагента.
Недостаток реагента в сетевой воде снижает эффективность обработки, что приводит к образованию отложений. Избыток реагента может привести к вымыванию загрязнений из трубопроводов и, соответственно, к снижению прозрачности, увеличению содержания железа в сетевой воде, а также к образованию «вторичных» фосфатно-кальциевых отложений.

Схему проезда, а также другую информацию о том как с нами связаться вы можете получить на странице «контакты»
Звоните, будем рады ответить на Ваши вопросы!
ООО «Воды Урала» г. Екатеринбург, ул. Парниковая, д.10, к.121.
Телефон (343) 306-89-09, факс (343) 368-69-34
Пользуясь сайтом, вы соглашаетесь с политикой конфиденциальности и даете согласие на обработку Ваших персональных данных
Определение общей щелочности и карбонатной жесткости воды
Определение основано на титровании раствора, содержащего NaOH и Na 2 CO 3, стандартным раствором хлорводородной кислоты с двумя индикаторами – фенолфталеином и метиловым оранжевым, применяемыми последовательно. При титровании раствора, содержащего эти вещества, хлорводородной кислотой в присутствии фенолфталеина происходят следующие реакции:
Следовательно по фенолфталеину оттитровывается вся щелочь и карбонат до бикарбоната и обесцвечивание фенолфталеина указывает на то, что обе реакции полностью завершились, и вместо исходных веществ в растворе имеются NaCl и NaHCO 3. Бесцветный раствор, содержащий эти продукты реакции, имеет слабощелочную реакцию, при добавлении метилового оранжевого он окрашивается в желтый цвет, и если продолжать титрование кислотой, будет происходить следующая реакция:
Следовательно, по метиловому оранжевому оттитровывается бикарбонат. Изменение желтой окраски на розовую свидетельствует о том, что реакция полностью закончилась.
Порядок выполнения работы. 1. Из общего раствора объемом 100 мл исследуемой воды, отбирают 20 мл пипеткой или цилиндром в коническую колбу вместимостью 100 мл.
2. Добавляют 2-3 капли раствора фенолфталеина и быстро титруют кислотой. До 12-15 мл титрование проводят быстро, перемешивая раствор, а под конец титрант добавляют по каплям до обесцвечивания. Записывают отсчет по бюретке ( VHCl ф-ф ),
3. Прибавляют в колбу 2 капли метилового оранжевого и продолжают титрование до перехода окраски из желтой в оранжевую. Производят второй отсчет по бюретке ( VHCl м-о ).
pH, углекислый газ, щелочность и жесткость в пруду
Качество воды в пруду изменяется под действием нескольких химических веществ. Концентрация углекислого газа, pH, щелочность и жесткость взаимосвязаны и оказывают серьезное влияние на продуктивность пруда, уровень стресса, здоровье рыб, количество доступного кислорода и токсичность аммония и некоторых металлов. Большинство характеристик воды не постоянны. Концентрация углекислого газа и pH подвержены ежедневным флуктуациям. Щелочность и жесткость относительно стабильны, однако могут меняться с течением времени, обычно в течение недель и месяцев. Их стабильность зависит от pH или минерального состава толщи воды и донной породы.
pH и углекислый газ
Рыбы и другие позвоночные имеют кровь со значением pH 7.4. Кровь рыб находится в тесном контакте с водой (граница раздела – 1-2 клеточных слоя). В пруду рекомендуется поддерживать диапазон, близкий к pH крови рыб – 7.0-8.0. Если водородный показатель упадет ниже 5 единиц или поднимется выше 10 (т.е. низкая щелочность, вместе с активным фотосинтезом водорослей), рыба почувствует себя плохо и погибнет.
Значения pH в пруду варьируют в течение дня. Ночью концентрация растворенного кислорода снижается, потому что останавливается фотосинтез, растения и животные дышат и расходуют кислород. При плотной посадке концентрация углекислого газа становится высокой в результате дыхания. Свободный CO2 реагирует с водой, приводя к возникновению угольной кислоты (H2CO3), и pH снижается:
В таблице обобщены относительные изменения концентрации растворенного кислорода, CO2 и pH в течение 24 часов
| Время | Растворенный кислород | Растворенный углекислый газ | pH |
| День | Возрастает | Снижается | Возрастает |
| Ночь | Снижается | Возрастает | Снижается |
Углекислый газ редко напрямую оказывает токсическое влияние на рыб. Однако его высокие концентрации снижают pH и, вследствие снижения pH в крови жабр, ограничивают возможность крови рыб переносить кислород. При заданной концентрации кислорода (например, 2 мг/л) рыба может задохнуться, когда уровень CO2 высокий, либо остаться невредимой, когда уровень CO2 низкий. Сом толерантен к концентрации CO2 20-30 мг/л, если газ накапливается постепенно и уровень кислорода 5 мг/л. В водохранилище или естественном пруду концентрация CO2 редко превышает 5-10 мг/л.
Высокие значения концентрации углекислого газа практически всегда обусловлены низкими концентрациями растворенного кислорода (высокая дыхательная активность). Для повышения низких значений кислорода проводится аэрация воды. Она же помогает снизить высокий уровень CO2, вследствие обратной диффузии газа в атмосферу. Хронически высокая концентрация CO2 снижается внесением гидратной извести Ca(OH)2. Примерно 1 мг/л извести удаляет 1 мг/л углекислого газа. Однако такую обработку нельзя производить в воде с плохими буферными свойствами (низкая щелочность), потому что pH поднимется до смертельного для рыб уровня. Кроме того, возникает опасность для рыб, если известь вносится в воду с избытком уровнем аммония. Высокий pH усугубляет токсическое влияние аммония.
Щелочность
Общая щелочность характеризует количество оснований, присутствующих в воде. Как правило, в пруду присутствуют карбонаты, бикарбонаты, гидроксиды, фосфаты и бораты. Карбонаты и бикарбонаты самые распространенные и наиболее важные компоненты щелочности. Этот показатель измеряется по количеству кислоты (H + ) в воде, которое может абсорбироваться (буферизация) перед достижением назначенного уровня pH. Общая щелочность выражается в мг/л или млн-1 карбоната кальция CaCO3. Щелочности 20 мг/л более чем достаточно для хорошей продуктивности пруда. Желателен диапазон общей щелочности 75-200 мг/л CaCO3.
Карбонатная-бикарбонатная щелочность (и жесткость) поверхностных и колодезных вод создается преимущественно в ходе взаимодействия растворенного в воде CO2 и извести грунта. Дождевая вода имеет естественную кислую реакцию, потому что насыщена атмосферным углекислым газом. Как только она проходит сквозь почву, каждая капля насыщается CO2, и pH снижается. Колодезная вода выкачивается из крупных, естественных подземных резервуаров (водоносный слой) или маленьких, локальных участков грунтовых вод (подземные воды). Обычно, грунтовая вода имеет высокую концентрацию CO2, низкие pH и концентрацию кислорода. Накопление CO2 в них обусловлено протеканием бактериальных процессов в почве и минеральных образованиях. Как только дождевая, подземная вода проходит пласт, содержащий кальциевый известняк CaCO3 или доломитизированный известняк CaMg(CO3)2, происходит растворение минералов с образованием кальциевых и магниевых бикарбонатных солей:
В результате, возрастают щелочность, кислотность и жесткость воды.
Щелочность, pH и концентрация углекислого газа
В воде с умеренной или высокой щелочностью (хорошая буферная емкость) и схожим уровнем жесткости, pH был нейтральным или слегка основным (7.0 – 8.3) и не колебался в широких пределах. Более высокие концентрации CO2 (т.е. угольная кислота) или другие кислоты требуют для снижения pH больше оснований, которые могли бы нейтрализовать или буферизировать кислоту.
В таблице можно видеть взаимосвязь между щелочностью, pH и концентрацией CO2


Число (фактор), отмеченный в таблице и соответствующий определенным значениям pH и температуры, умножается на значение щелочности (мг/л CaCO3). Результат этого уравнения позволяет оценить концентрацию CO2 (мг/л).
Например, в пруду с сомами pH = 7.2, температура = 25°C, и общая щелочность = 103 мг/л. Значение фактора = 0.124. Концентрация углекислого газа равна = 0.124 x 103 мг/л щелочности = 12.8 мг/л CO2.
Для минимизации ошибки этих расчетов необходимо в течение 30 минут регистрировать pH. Вследствие нескольких источников погрешности предпочтительно прямое измерение концентрации углекислого газа при помощи химических тестов.
Щелочность, pH и фотосинтез
Основания, обуславливающие щелочность, влияют и нейтрализую кислоты. Карбонаты и бикарбонаты могут реагировать с кислотами и щелочами, и буферизировать (минимизировать) изменения pH среды. Кислотность воды с высокими буферными свойствами колеблется в пределах 6.9-9 единиц. В воде с низкими буферными свойствами pH может достигать угрожающе низких (углекислый газ и угольная кислота образуются вследствие дыхания) или угрожающе высоких значений (высокая активность фотосинтеза).
Фитопланктон представляет собой микроскопические или около микроскопические водные растения, ответственные за продукцию значительной части кислорода в пруду и реализацию фотосинтеза. При стабильном значении pH около 6.5 или выше, щелочность улучшает продуктивность фитопланктона, потому что повышает доступность нутриентов (растворимые фосфаты). Щелочность выше 20 мг/л захватывает CO2 и увеличивает его концентрацию, доступную для фотосинтеза.
Так как фитопланктон использует CO2 в фотосинтезе, pH в воде возрастает со снижением концентрации углекислого газа и угольной кислоты. Кроме того, фитопланктон и другие растения переводят бикарбонаты (HCO3 — ) в углекислый газ для фотосинтеза и высвобождает карбонаты:
Высвободившийся при посредничестве растительной биомассы карбонат из бикарбоната, может вызывать значительное возрастание pH (выше 9) в периоды активного фотосинтеза фитопланктона. Этот подъем pH наблюдается при низкой щелочности воды (20-50 мг/л) или в воде с умеренной и высокой карбонатной щелочностью (75-200 мг/л) и жесткостью менее 25 мг/л. Высокая бикарбонатная щелочность в мягкой воде обусловлена карбонатами натрия и калия, более водорастворимыми, чем карбонаты кальция и магния, влияющими на жесткость. Если присутствуют кальций, магний и образующийся фотосинтетический карбонат, когда pH выше 8.3, формируется известняк. Пруды с щелочностью ниже 20 мг/л обычно не имеют вспышек роста водорослей и, соответственно, вызванного фотосинтезом, резкого подъема pH.
Жесткость
Жесткость является важным показателем воды при культивировании рыб. В гидрохимическом анализе он обычно присутствует. Жесткость определяется по концентрации двухвалентных ионов — кальцием, магнием и/или железом. Она может включать смесь двухвалентных солей, но кальций и магний всегда преобладают.
Традиционно, жесткость измеряется в ходе химического титрования. Жесткость образцов воды выражается в миллиграммах на литр в эквиваленте карбоната кальция (мг/л CaCO3). Кальциевая карбонатная жесткость основной индикатор количества двухвалентных солей, который не проводит различий между кальцием, магнием и солями других двухвалентных элементов.
Часто жесткость путают с щелочностью (общая концентрация оснований). Путаница возникает из-за того, что оба параметра измеряются в мг/л эквивалента CaCO3. Если известняк ответственен за оба параметра, жесткость и щелочность, их концентрация будет схожей. Однако, если в растворе, где на щелочность влияет NaHCO3, жесткость будет низкой, а щелочность, напротив, высокой. Кислые, подземные и колодезные воды могут иметь низкую или высокую жесткость и очень низкую щелочность (либо вообще не иметь её).
Кальций и магний важны для протекания ряда биологических процессов в организме рыб (формирование костей и чешуи, свертывании крови и других метаболических реакциях). Рыбы способны абсорбировать кальций и магний непосредственно из воды или с кормом.
Кальций наиболее важный двухвалентный элемент в культуральной воде. Присутствие свободного (ион) кальция в воде помогает снизить потери других солей (т.е. натрия и калия) из внутренних жидкостей рыб (крови). Натрий и калий входят в состав крови рыб. Они участвуют в реализации ряда процессов, в том числе, деятельности сердца, иннервации и мышечной деятельности. Исследования показали, что кальций окружающей среды также требуется для ре-абсорбции потерянных солей натрия и калия. В воде с низкой концентрацией кальция моет наблюдаться утечка значительных количеств натрия и калия в воду. Для вторичного впитывания этих элементов затрачивается энергия тела. Для некоторых видов рыб (Sciaenops ocellatus, Morone saxatilis) для выживания важно высокое значение кальциевой жесткости.
Рекомендуемый диапазон свободного кальция в культуральной воде составляет 25-100 мг/л (65-250 мг/л CaCO3). Канальный сом толерантен к низкой концентрации кальция до тех пор, пока его корм содержит минимальный уровень кальция, однако скорость его роста низкая. Аналогично, радужная форель переносит низкие концентрации кальция (10 мг/л), если pH выше 6.5. Для выращивания Sciaenops ocellatus, Morone saxatilis или раков желательна концентрация свободного кальция 40-100 мг/л (100-250 мг/л CaCO3), что соответствует концентрации кальция в крови рыб (100 мг/л Ca или 250 мг/л CaCO3). Жесткость источников воды для этих видов должна быть проверена.
Низкая карбонатная жесткость надежный индикатор низкого содержания кальция. Однако высокая жесткость необязательно отражают высокую концентрацию этого элемента.
Карбонатная жесткость 100 мг/л включает 40 мг/л свободного кальция (делим CaCO3 на 2.5), в случае, если она обусловлена лишь присутствием кальция. Аналогично, если значение карбонатной жесткости 100 мг/л и представлена свободным магнием, концентрация магния составляет 24 мг/л (делим CaCO3 на 4.12). Эти факторы (2.5 и 4.12) связаны с молекулярной массой CaCO3 и различиями массы атомов магния и кальция. Там, где жесткость обусловлена присутствием известняка, значение CaCO3 обычно отражает смесь свободного кальция и магния. Но магния все равно преобладает в смеси.
Известняк может использоваться в сельском хозяйстве для повышения концентрации кальция (и карбонатной-бикарбонатной жесткости) в областях с кислой водой или почвой. Однако при pH 8.3 или выше известняк не растворяется. Мягкую, щелочную воду можно обогатить кальцием с помощью гипса (CaSO4) или CaCl2. Большие объемы обработки могут привести к серьезным расходам, и более практичным будет поиск другого источника воды.
Влияние pH, щелочности и жесткости на токсичность аммония и металлов
Аммоний становится более токсичным при возрастании pH. Высокие концентрации токсичной неионизированной формы аммония (NH3) формируются в основной воде, тогда как NH4 + преобладает в кислой воде. Так как щелочность повышается с ростом pH, аммоний становится более ядовитым в воде с высокой общей щелочностью. Жесткость обычно не связана с токсичностью аммония.
Металлы, такие как медь и цинк, более распространены в быту (в бассейнах, сантехнике и CuSO4). Они становятся лучше растворяются в кислой воде. Растворимость или свободная ионизированная форма этих металлов токсична для рыб. Высокая общая щелочность повышает pH и доступность оснований, которые способствуют образованию менее токсичных нерастворимых форм меди и цинка. Высокие концентрации кальция и магния (жесткость) блокируют эффекты меди и цинка в местах их токсического влияния. Поэтому, эти металлы более ядовиты для рыб в мягкой, кислой воде с низкой общей щелочностью.
