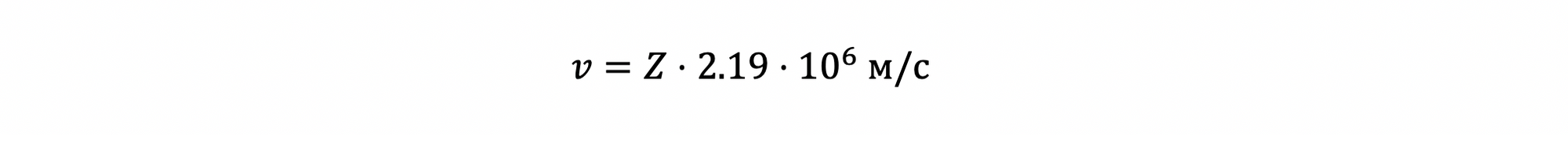Жидкая ртуть практически не сжимается потому что частицы ртути при ее сжатии
Почему ртуть жидкая? Потому же, почему заводятся машины!
Anton Morgunov
Если вы подписаны на нашу инсту, вы, наверняка, видели наши периодические тематические дни, когда вы задаете нам любые вопросы по определенному предмету, а мы весь день отвечаем на них.
Недавно, во время химической пятницы, кто-то спросил: «А почему ртуть жидкая?»
Нам очень понравился этот вопрос – действительно, а почему ртуть жидкая? Изначально, админы нашего химического сообщества предположили следующее:
Для начала, нужно понять: а почему другие металлы твердые? Вообще, любые атомы/молекулы предпочли бы газообразное состояние – когда у них максимальное количество степеней свободы (а значит и энтропия максимальна, если вам это о чем-то говорит). Но, есть маленькая проблема – зачастую между частицами действуют межмолекулярные силы притяжения или эти молекулы собираются в какие-нибудь металлические или ионные структуры. В случае металлических решеток – нужны неспаренные электроны. Т.е. и без них можно обойтись, но чем больше неспаренных электронов – тем лучше. Именно поэтому пик по температурам плавления в переходном блоке приходится на элементы посередине этого блока: V, Cr, Mn, Nb, Mo, W. Конечно, есть и другие факторы, которые влияют на температуру плавления – такие как тип кристаллической решетки, но все равно тренд определенно есть.
А ртуть как раз находится в конце d-блока с конфигурацией 4f14 5d10. И тут вы спросите, но ведь цинк и кадмий тоже находятся в конце блока, но они не жидкие металлы. И да, совершенно, верно. Только стоит заметить, что и у цинка, и у кадмия довольно низкие температуры плавления. Чем же особенна ртуть?
Изначально, мы сказали, что наверняка здесь играет роль размер – мол, из-за большого количества электронных слоев эффективный заряд ядра довольно низкий и соответственно энергия образования металлической решетки пониже. Возможно в этом есть правда, но мы совершенно забыли про один очень интересный эффект, связанный с элементами 6-го периода.
Вопрос почему ртуть жидкая очень близок по своей природе к вопросу: почему углерод предпочитает образовывать оксиды +4, а свинец +2?
Итак, возьмитесь покрепче за ручки ваших кресел – ответ лежит в специальной теории относительности. Ртуть жидкая, а ваши машины заводятся благодаря специальной теории относительности.
Обо всем по порядку.
Специальная Теория Относительности
Специальная Теория Относительности (СТО) – это крайне важная, экспериментально подтвержденная, теория, впервые представленная Альбертом Эйнштейном в 1905 году. Она основывается всего на двух постулатах:
Тут же возникает вопрос – а что такое система исчисления (правильней добавить, что речь идет только о инерциальных системах исчисления). Инерциальная система исчисления – это набор координатов, которые можно использовать для описания наблюдателя, движущегося с нулевым ускорением (как только появляется ускорение – нужно обращаться к общей теории относительности). Грубо говоря, вы все знаете координатную плоскость – вы используете ее на уроках математики. А теперь в зависимости от того, где в пространстве вы поставите начало координат и будет ли эта точка зависеть от времени (если да, то скорость ее передвижения должна быть постоянной) вы получите разные системы исчисления.
Прелесть СТО в том, что используя простейшие алгебраические вычисления (теорему Пифагора, например), применяя их к далеко неочевидным мысленным экспериментам, можно прийти к выводу, что наблюдатели в разных системах исчисления измеряют разные временные и пространственные интервалы между двумя событиями. Иными словами, движущиеся часы замедляются, а движущиеся линейки становятся короче.
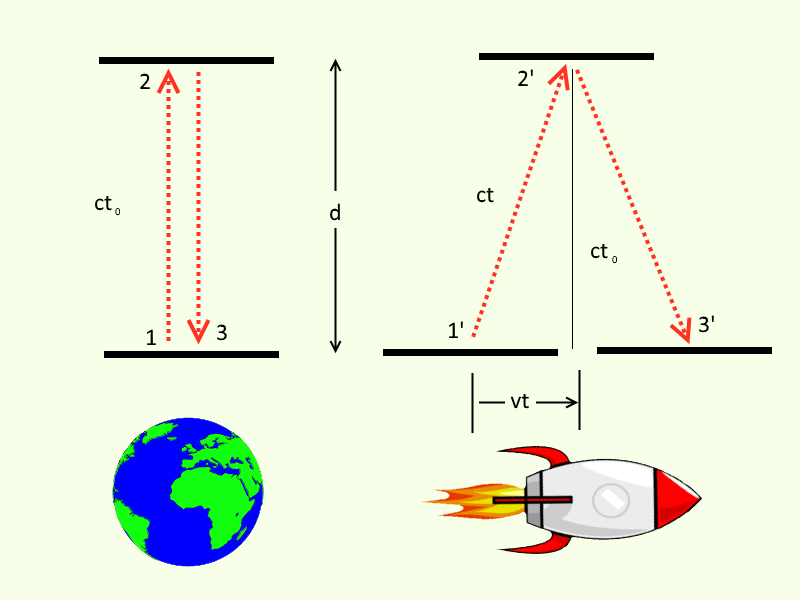
Мы не будем вдаваться в вывод математических формул, которые мы используем чуть ниже, а просто скажем, что любой заинтересованный, может пройти сюда – там действительно очень простые, но долгоиграющие вычисления.
Но как специальная теория относительности применима к нашему случаю?
Модель атома
Как ни странно, но у нас до сих пор нет теоретической модели, которая могла бы описывать многоэлектронные атомы. Да, у нас есть уравнение Шредингера (и квантовая механика в целом) – но мы можем решить это уравнение только для водородоподобных атомов (т.е. тех, у кого 1 электрон и у которых не нужно учитывать отталкивание электронов друг от друга). Если мы добавим хоть один электрон – пиши пропало – надо использовать математические приемы (и суперкомпьютеры) для примерной оценки решений этих уравнений.
А для водородоподобных атомов у нас есть еще теория Бора, которая строится на двух тождествах: электрон испытывает Кулоновское притяжение к ядру и центробежную силу (за счет кругового движения), находясь в состоянии покоя (иными совами, эти силы равны). Второе тождество – о квантовании углового импульса, иными словами, угловой импульс (angular momentum) может принимать лишь определенные значения (а именно натуральные множители приведенной постоянной Планка). Так вот, скорость 1s электрона (единственного) в водородоподобном атоме с зарядом ядра Z равна:
Иными словами, масса 1s электрона у ртути на 23% выше, чем масса электрона в состоянии покоя. Увеличенная масса приводит к уменьшенному радиусу орбиты (тоже в 1.23 раза). Иными словами, мы имеем дело с сжатием электронной орбитали при учете релятивистских эффектов (релятивистский эффект – эффект, описываемый теорией относительности). У нас нет теоретической модели, которая позволяла бы также определить степень сжатия электронов на более высших электронных уровнях, но мы уже убеждены в том, что релятивистский эффект есть и он значителен.
А расчеты (и экспериментальная практика) показала, что этот эффект сжатия настолько значителен для 6s электронов (а это внешняя оболочка ртути), что эта самая электронная пара зачастую является инертной (эффект инертной электронной пары). Просто проговорю – электроны двигаются быстро, за счет этого их масса увеличивается, а радиус орбиты уменьшается, они становятся ближе к ядру, а значит сильнее к нему притягиваются и меньше готовы участвовать в образовании химической связи.
Сжатие 6s орбитали имеет феноменально широкие последствия.
Во-вторых, сжатие 6s орбитали объясняет понижение энергии этой орбитали, что приводит к уменьшению разницы в энергии между заполненной 5d орбиталью и полу-заполненной 6s-орбиталью. И что спросите вы? А то, что это объясняет желтый цвет золота! Ибо цвет – это поглощение энергии определенной длины волны при переходе с одной орбитали на другую. А еще это объясняет почему золото считается благородным (малореактивным или почти инертным металлом) – валентные 6s электроны очень сильно притягиваются к ядру.
В-третьих, это объясняет электронную конфигурацию Вольфрама (5d4 6s2). Еще на ранних стадиях изучения химии вы знакомитесь с таким феноменом, как проскок электрона (например, у хрома 3d5 4s1 вместо 3d4 4s2). А с Вольфрамом такое не прокатит из-за повышенной стабильности 6s-электронов.
В-четвертых, это объясняет повышенную нестабильность степени окисления +4 у свинца. Почему это важно? Расчеты показали, что ЭДС (электродвижущая сила) в свинцовом аккумуляторе без учета релятивистских эффектов равна 0.39В, а с учетом 2.13В (при экспериментальном значении в 2.107В). Если вы не знали, в свинцовом аккумуляторе на катоде восстанавливается свинец (+4) до свинца (+2). Иными словами, машины заводятся благодаря СТО.
Если вы хотите почитать больше о эффектах специальной теории относительности в структурной химии – я направляю вас сюда.
Хочешь получать рассылку от нас?
WRO-2019-дағы Қазақстан командасы: Робототехникада нақты нұсқаулық жоқ
Осы жылдың \(10\) қарашасында Қазақстан өзінің Халықаралық Робототехника Олимпиадасына (WRO) қатысу тарихында алғашқы рет жоғары-шығармашылық санатта жүлделі үшінші орынды иеленді. WRO-\(2019\) Венгриядағы Дьор қаласында өтті. Оған дейін Талдықорған қаласының командасы \(2014\) жылы орта-шығармашылық санатта үшінші орынға және \(2016\) жылы жоғары-шығармашылық санатта «Creativity Award» (креативтілік үшін) жүлдесіне ие болған. Талдықорған
[Математика ғажабы] Пифагор теоремасы
«Пән ғажабы неде» жобаның барлық мақалалары «Математика ғажабы» циклдың басқа мақалалары Визуалды дәлелдемелер Байес теоремасы Ойлаудың көркемдігі Сымдарды кесеміз Геометриямен жасырынбақ ойнау Шексіздік Математика тек формулалар ғана емес. Математика — бізді қоршайтын барлық нәрселер. Онда теоремалар мен аксиомаларды білу ғана емес, фундаментал қағидаларды түсініп, сезе білу де маңызды. Мұндай фундаментал білім
[Математика ғажабы] Геометриямен жасырынбақ ойнау
«Пән ғажабы неде» жобаның барлық мақалалары «Математика ғажабы» циклдың басқа мақалалары Визуалды дәлелдемелер Байес теоремасы Ойлаудың көркемдігі Сымдарды кесеміз Шексіздік Пифагор теоремасы Кез-келген геометриялық есепті аналитикалық жолмен шығаруға болады деп қабылданған. Шыныменде, егер сізде жеткілікті түрде тәжірибе болса онда сізге декарттық немесе бариентрлік координаттарды тұрғызу арқылы барлық геометрияны «сандар» арқылы
Если не указано иначе, все текстовые материалы блога ОФ Beyond Curriculum лицензированы под CC BY-NC-SA 4.0
Ртуть
Ртуть очень ядовита
Даже разбитый медицинский термометр может вызвать мгновенное отравление. Металлическая ртуть ядовита настолько же, насколько ядовит любой другой тяжелый металл (например, медь). В средние века алхимики даже принимали ртуть во внутрь в качестве «лечебных» пилюль и, тем не менее, оставались живы. Следует оговориться, что при попадании в пищеварительную систему относительно безопасна именно металлическая ртуть, а не ее соли! Пресловутая же «ядовитость» обусловлена её парами, содержащимися в воздухе. При температуре 18°С начинается интенсивное испарение ртути в атмосферу, вдыхание такого воздуха способствует её накоплению в организме откуда она уже не выводится (как и другие тяжелые металлы). Однако чтобы накопить серьезную долю ртути в организме, необходимо в течение нескольких месяцев или лет регулярно пребывать в помещении с серьезным превышением ПДК этого металла в воздухе.
В медицинском термометре так мало ртути, что можно не обращать внимания, если его разобьешь
Шарика ртути размером с булавочную головку достаточно, чтобы в комнате средних размеров с закрытыми окнами и работающей вентиляцией концентрация паров ртути превысила ПДК в сотни, а то и в тысячи раз (однако, при интенсивном проветривании практически сразу установится норма). Поэтому пренебрегать разливом ртути даже в малых количествах не стоит.
Можно предотвратить испарение ртути, храня ее под слоем воды
Растворимость ртути в воде хоть и мала, но намного выше растворимости ртути в воздухе. Поэтому очевидно, что ртуть из водного раствора все равно будет испаряться в воздух.
Шарики ртути можно собрать пылесосом
Ни в коем случае этого делать нельзя. Во-первых, это не очень эффективно, так как ртуть имеет очень высокую плотность, и большинство пылесосов просто не смогут убрать шарики из труднодоступных мест. Во-вторых, воздух, проходя по патрубкам, нагревается, что приводит к еще более интенсивному испарению попавшей в мешок ртути, и распространению этих паров по всему объему помещения. Фактически, из пылесоса получается очень эффективный «испаритель» ртути. В-третьих, после такой «обработки» придется также выбрасывать и пылесос.
Ртуть можно вылить в канализацию (унитаз, раковину)
Этим вы нанесете вред, прежде всего себе, так как ртуть просто останется лежать на дне водяного затвора (колена трубы), откуда она будет годами испаряться обратно в квартиру. Лучше просто выбросить собранную ртуть в уличный мусорный контейнер (но не мусоропровод!).
Ртуть радиоактивна
У ртути есть радиоактивные изотопы, но они, естественно, не используются в производстве бытовых термометров, да и вообще во всех случаях, где это не является необходимым. Но почему-то регулярно приходится слышать высказывания о радиационной опасности ртути.
Ртуть дорого стоит
Стоимость ртути имеет тот же порядок, что и цены на другие металлы. Цена на рынке зависит от чистоты предлагаемой ртути и объема поставляемой партии. В свободной продаже ее естественно нет, так как ртуть относится к АХОВ (аварийно химически-опасные отравляющие вещества). В быту же, чтобы ртуть забрали на утилизацию, придется еще и заплатить соответствующим организациям.
Ртуть собирают с помощью сложных средств, доступных только специалистам
Демеркуризацию (сбор ртути) проводят в два этапа. Сначала удаляют всю видимую металлическую ртуть механическим путем (вычерпывание, сметание жесткой щеткой, всасывание спринцовкой или шприцем, собирание шариков на скотч и т.д.). Затем проводят химическую обработку поверхности (если эту поверхность нельзя удалить саму по себе, как ковролин или верхний слой грунта). Из широкого спектра химических демеркуризаторов наиболее доступно хлорно железо (FeCl3, которым радиолюбители вытравливают печатные платы), а также раствор марганцовки (перманганат калия), НО обязательно с добавлением соляной кислоты (HCl). При разливах промышленного масштаба для связывания ртути используется сера, переводящая ртуть в сульфид.
Есть особые растворы полностью «уничтожающие» ртуть
Любой демеркуризационный раствор, просто переводит ртуть из металлического состояния в связанное (обычно в хлорид HgCl2). Испаряемость солей ртути намного ниже испаряемости в свободном состоянии, на чем и основан эффект химической обработки (поэтому-то всегда лучше избавиться от загрязненной поверхности, чем ее обрабатывать).
Почему ртуть жидкая, в отличие от других металлов
Для того, чтобы разобраться в этом вопросе, сначала разберемся с твердыми металлами. Почему остальные металлы твердые? Есть ли элементы похожие на ртуть или она единственная в своем роде?
Почему остальные металлы твердые?
У каждого металла есть своя кристаллическая решетка. Из-за атомов, которые постоянно находятся в процессе колебания, но далеко не отходят от своего места, решётка получается очень прочной. Этим обуславливается “твердость” металлов.
Все металлы, кроме ртути, находятся в твердом состоянии при нормальных условиях. Но что будет с металлом, если его нагреть до определенной температуры? Сначала он становится мягче, потом более тягучим, а затем и вовсе переходит в жидкое состояние, подобно воде. Все дело в температуре плавления и для каждого материала она своя.

Внутренняя структура металла определяет при какой температуре тот или иной металл начнет плавиться. На это влияет связь молекул или атомов и расстояние, на котором они находятся друг от друга.
Следовательно, у ртути молекулы располагаются также, как и у воды? Поэтому она жидкая? Не совсем. Ртуть также имеет прочную кристаллическую решетку, все дело в температуре.

Ртуть может быть не только в жидком состоянии, но и газообразном, поскольку при комнатной температуре происходит её нагрев и она начинает испаряться. Пары ртути очень вредны для организма человека, поэтому с этим металлом нужно обращаться очень осторожно.
В домашних условиях вы можете встретить ртуть в чистом виде только в градусниках. Не забывайте, что обязательно нужно вызывать специальную службу, если вы его разобьете.
Существуют ли еще жидкие металлы?
Ртуть единственный металл, который при нормальных условиях имеет жидкую форму. Дело в температуре плавления. Существуют также металлы, которые становятся жидкими при температуре тела человека.
Например, температура плавления Галлия составляет 29,8 градуса. Это значит, что в наших ладонях он станет таким же жидким как ртуть. Также, существует металл Цезий, который плавится при 28,5 градусах, но лучше в руки его не брать, поскольку он является щелочным металлом. Нельзя не упомянуть Франций, который “растает” в руках при 26,5 градусах.
Ложка из галлия
Становится ясно, что все дело в температуре плавления. Ртуть является исключением из правил, ведь это единственный металл, у которого температура плавления ниже 0. Именно это делает её необычной. Без неё просто невозможно представить современный мир. Но всегда следует помнить, что при работе с любым подобным металлом, нужно соблюдать все меры предосторожности.
Наука и технологии 26 июня, 2020 1 266 просмотров
Жидкая ртуть практически не сжимается потому что частицы ртути при ее сжатии
Ртуть * (живое серебро, Hydrargirum, Quecksilber, mercure), Hg — принадлежит к числу 7 металлов, известных в глубокой древности: золото, серебро, медь, железо, свинец, олово и Ртуть * По сравнению с остальными 6 металлами человек, по всей вероятности, познакомился с ней позже всего, хотя уже за 300 лет до Ртуть * Х. о ней упоминается Теофрастом. Греки и римляне знали свойство Ртуть * растворять золото и пользовались этим для позолоты. Они умели искусственно готовить сернистую Ртуть *, киноварь, представляющую прекрасный красящий материал. В средние века Ртуть * играет важную роль в теоретических воззрениях химии; она считается элементом носителем металлических свойств (см. Металлы и Металлоиды). Тогда же она находит широкое применение и в медицине, что способствовало более полному изучению ее свойств. Даже еще в XVIII в. свойства Ртуть * представляли много странного, не вязавшегося с господствовавшими воззрениями. Жидкий вид Ртуть * при обыкновенной температуре резко отличающий ее от других металлов, долго возбуждал недоумение, пока Браун в СПб. 1769—70 не заморозил ее в смеси снега и HNO3 и не показал, что она так же, как и другие металлы, обладает ковкостью, тягучестью и пр. Ртуть * ставила в тупик и последователей флогистона (см.). Желая выделить из Ртуть * флогистон, получить землю, они подвергали ее сильному накаливанию в течение нескольких месяцев и действительно находили немного землистого красного вещества (окиси Ртуть *), но это вещество при новом нагревании снова обращалось в металлическую Ртуть *, чего не наблюдалось при других металлах, и только работы Лавуазье (см.) объяснили это недоразумение.
Ртуть * самородная встречается в виде капель на киновари и редко образует более значительные количества в пустотах пород. В своем составе часто содержит некоторое количество серебра. Главным образом Ртуть * находится в соединении с серой HgS — киноварь, с хлором (HgCl)2 — роговая Ртуть *, с йодом HgI2 — кокцинит, с селеном, в виде серебряной амальгамы Hg2Ag2 и Hg3Ag2; она находится в воде некоторых источников. Главнейшие залежи ртутных соединений находятся в Идрии (Австрия), в Альмадене, S.-Phili р p о, Albaracia (Испания), в Калифорнии, Чили, Перу, Китае, в России — в Никитовке (Бахмутский уезд, Екатеринославской губернии).
Физические свойства. Ртуть * металл серебристого цвета, жидкий при обыкновенной температуре. При взбалтывании с водой, растворами солей и при растирании, например, с жиром и пр. Ртуть * способна распадаться на мельчайшие капельки, не сливающиеся между собой и образующие очень тонкий порошок. Чистая Ртуть * не смачивает стекла, при растворении же в ней различных металлов, при окислении ее — она начинает прилипать к стеклу и пачкать его. При температуре около —39° она замерзает, превращаясь в ковкий металл (Браун, см. выше); при переходе из жидкого состояния в твердое она сильно сжимается; около температуры плавления удельный вес твердой Ртуть * = 14,39, жидкой = 14,19. В следующей таблице приведены удельный вес и объем 1 гр. Ртуть * при разных температурах (Brach):
По Реньо, коэффициент расширения Ртуть * 0—100° = 0,0001815. Ртуть * кипит около 357° (при давлении 760 мм), но уже ниже 0° она заметно испаряется, что легко заметить поместив над ней золотую пластинку (она белеет). Упругость паров Ртуть * в мм, по Реньо и Рамзаю-Юнгу:
Теплоемкость Ртуть * представляет ту особенность, что с увеличением температуры она уменьшается (Winkelmann); C=0,033266—0,0000092t (Mithaler). Капиллярная постоянная 58,79. Коэффициент упругости = 0,0000035 (Реньо); с увеличением температуры он увеличивается. Теплопроводность = 0,02 (серебро = 1). Сопротивление электрическому току для Ртуть * с температурой увеличивается Wt=Wo(1+0,000929t+0,0000006t 2 ). Сопротивление 1 м столба Ртуть * сечения 1 мм, при 0° называется единицей сопротивления Сименса S. Омом называется сопротивление такого же столба 106,9 S. Электропроводность Ртуть * сильно возрастает при переходе из жидкого состояния в твердое. Пар Ртуть * плохой проводник. Как соли Hg, так и соединения ее вообще ядовиты.
Химические свойства. Атомный вес Ртуть * = 200,171 (Clarke, при O =16). Исследования плотности пара показывают, что частица Ртуть * содержит 1 атом. В периодической системе Менделеева Ртуть * находится в одном ряду с цинком и кадмием и имеет с ними много общего. В связи с высоким атомным весом она труднее вступает в соединения, чем Zn и Cd, и соединения ее вообще легче разлагаются. Подобно Zn и Cd, она очень легко дает основные и двойные соли; подобно Zn и Cd, P. образует соединения вида HgX2 (X — одноатомная группа); но для нее известно также соединение вида HgX или Hg2X2. Ртуть * прямо соединяется с кислородом (в особенности при нагревании); на воздухе, особенно влажном, она мало-помалу окисляется; воды не разлагает. Ртуть * легко соединяется с галоидами, с серой; серная кислота, в особенности нагретая, растворяет ее; азотная кислота растворяет ее очень легко; соляная кислота не действует на нее; йодисто-водородная и бромисто-водородная кислоты легко разлагаются ею. Ртуть * растворяет большинство металлов, образуя так называемые амальгамы или сортучки.
Кислородные соединения Ртуть * С кислородом Ртуть * дает закись Hg2O и окись HgO. Закись P. Hg2O получается при осаждении избытком едкого кали или натра растворимых солей, отвечающих Hg2O, например азотнокислой соли HgNO3, которая легко получается растворением Ртуть * в HNO 3 на холоде. При получении Нg 2 О лучше всего приливать раствор ртутной соли к щелочи, а не наоборот, чтобы избежать образования основных солей. Она получается также при окислении амальгамы калия на воздухе. Закись Ртуть * — черный тяжелый порошок удельного веса 8,95—10,69 (по разным исследователям) заключает обыкновенно примесь HgO и Hg; она разлагается на HgO и Hg при нагревании или на свету, легко отдает свой кислород веществам, способным окисляться, на воздухе же сама окисляется. Теплота образования 42,2 кал. (Hg жидкая). При осаждении едким кали сильно охлажденного спиртового раствора HgNO3 получается сначала желтый, затем темнеющий осадок, вероятно, гидрат Hg2O. Окись Ртуть * HgO получается при продолжительном нагревании Hg на воздухе почти до кипения (этот способ был известен еще Геберу); она получается также при разложении (нагреванием) азотно-ртутной соли (окиси) Hg(NO3)2 и при действии избытка KHO, NaHO на растворы ртутных солей (окиси) и пр. HgO известна в двух видоизменениях. HgO, полученная при нагревании Hg на воздухе или при разложении Hg(NO3)2, красного цвета, при выделении же щелочами из солей она вообще получается желтого цвета. Различие заключается в том, что красная разновидность имеет кристаллическое сложение (принадлежит, по Норденшильду, к ромбической системе и имеет удельный вес около 11,1), желтая же HgO аморфна. В химическом отношении между ними также есть некоторое различие. Желтая HgO легче подвергается действию различных реагентов, чем красная HgO; например, щавелевая кислота в растворе легко соединяется с желтой HgO, а на красную не действует и пр. Эти различия объясняются большей раздробленностью желтой HgO. Окись Ртуть * слегка растворима в воде (по Bineau, 1 часть в 20000—30000 частях воды, по Wallace — 1 в 200000), растворяется в расплавленном KHO, N a HO и в известковой воде; ядовита. При нагревании она легко диссоциирует на Hg и О. По Мейеру упругость диссоциации при 240° — 2 мм, при 350° — 3 мм, при 400° — 16 мм, при 500° — 343 мм. HgO легко отдает свой кислород горючим веществам; с веществами, легко окисляющимися, например с S, Р, она взрывает, с аммиаком при нагревании дает азотистую Ртуть * Hg3N2. Теплота образования HgO 30,67 кал.
Соли. Ртуть * соответственно закиси и окиси Hg2O и HgO образует два ряда солей. Соли закиси вообще бесцветны, они получаются главным образом из HgNO3. Соли, растворимые в воде, остаются без изменения обыкновенно только в присутствии свободной кислоты: в противном случае очень легко выделяют основные соли; двойные соли образуются тоже очень легко. Галоидные соединения в воде нерастворимы, что отличает, между прочим, соли закиси от солей окиси. Восстановители (SnCl2, фосфористая кислота, SO2 и т. п.) и металлы Zn, Sn, Fe, Cu легко выделяют Hg из ее солей. Соли окиси Ртуть * получаются главным образом из Hg(NO3)2 и сулемы HgCl2. Они также образуют множество основных и двойных солей, восстановителями переводятся в соли закиси, которые далее выделяют Hg. Все соли Ртуть * очень ядовиты.
Хлористые соединения: каломель Hg2Cl2 и сулема HgCl2. Каломель встречается в природе в виде минерала ромбической системы. Она получается при действии хлора на избыток Hg при нагревании (рядом получается и сулема, которая удаляется водой), при восстановлении раствора сулемы, например сернистым газом SO2, а также при растирании ее с Ртуть *, при действии растворимых хлористых металлов в избытке на HgNO 3; при этом могут получаться и двойные соли. При накаливании она улетучивается; ее, между прочим, и очищают возгонкой. Возгнанная она образует кристаллическую массу волокнистого сложения, удельного веса около 7,1, осаждением же получается в виде белого порошка. На свету она становится сероватой, благодаря выделению металлической Ртуть * В воде, спирте, эфире очень малорастворима. В воде в присутствии соляной кислоты постепенно переходит в раствор, образуя сулему; с йодом (HgCl)2 дает HgCl2Hg2I2. Щелочи KHO, N a HO разлагают ее; с аммиаком она образует меркуриаммониевое соединение черного цвета (отличие (HgCl)2 от хлористого серебра AgCl). Определение плотности пара при 440° дает для каломели число 8,2, вдвое меньше, чем требуется для формулы (HgCl)2. Исследования Одлинга, В. Мейера, Рарриса показывают, что такая плотность получается благодаря тому, что частица (HgCl)2 в парах разлагается на Hg и сулему, (HgCl)2=Hg+ HgCl2. Теплота образования 81,8 кал. (Ртуть * жидкая). Сулема HgCl2 (Mercurius sublimatus seu corrosivus) была известна еще Геберу в VIII столетии. Она образуется при действии хлора в избытке на Ртуть * при нагревании, при действии HCl на HgO, при растворении Hg в царской водке, при обменном разложении солей Ртуть * с хлористыми металлами, например при накаливании сернокислой Ртуть * HgSO4 с NaCl, из (HgCl)2 и пр. HgCl 2 бесцветное кристаллическое вещество, удельный вес около 5,4, слегка летучее уже при обыкновенной температуре; при нагревании плавится около 265° и улетучивается легче каломели. 100 частей воды растворяют при 0° — 5,73 частей; при 10° — 6,57 частей, при 20° — 7,39 частей; при 30° — 8,43 частей; при 40° — 9,62 частей; при 50° — 11,34 частей; при 60° — 13,86 частей; при 70° — 17,29 частей; при 80° — 24,30 частей; при 90° — 37,05 частей; при 100 — 53,96 частей (Roggiale). В присутствии Н Cl растворимость увеличивается. HgCl растворяется в спирте, эфире, бензоле, глицерине, летучих маслах; 100 частей спирта растворяют при обыкновенной температуре 33 части, 100 частей эфира — 25 частей, 100 частей глицерина — 7 частей сулемы. Восстановители SO2, SnCl2 дают с сулемой (HgCl)2 и металлическую Ртуть * Щелочи KHO, NaHO выделяют из нее Hg O, а при недостаточном количестве образуют хлорокиси; аммиак дает белый осадок хлористого меркуриаммония. С белком HgCl 2 образует нерастворимое соединение, не ядовитое, так что белок может служить противоядием при отравлении сулемой. Многие органические вещества выделяют из нее Hg; даже водный раствор на свету дает осадок Hg2Cl2. HgCl2 обладает сильными антисептическими свойствами и для этой цели широко применяется как в медицине, так и в технике (например, для консервирования дерева). Теплота образования HgCl 2 62,8 кал. Сулема дает многочисленные соединения с NaCl, KCl, HCl, BaCl2, MgCl2, CaCl2 и пр. Хлорокиси получаются при прямом соединении HgO с HgCl 2 и при действии щелочей в недостаточном количестве. Их известно несколько 2HgCl 2HgO, HgCl22HgO, HgCl23HgO и пр. Хлорноватые и хлорные соли получаются растворением Hg2O или Hg O в НСlO 3 или в НСlO 4; они легко разлагаются; с горючими веществами взрывают.
Бромистые соединения: (HgBr)2 и HgBr 2. Бромистая Ртуть * (HgBr)2 получается при действии HBr на металл. Hg, при восстановлении HgBr 2 сернистым газом, при обменном разложении HgNO3 с растворимыми бромистыми металлами. Удельный вес 7,3, теплота образования 78,4 кал. (Hg жидкая, Br газ). По своим свойствам она напоминает Hg2Cl2. Бромная Ртуть * HgBr2 получается при действии брома на Hg, при растворении Hg O в HBr, при накаливании HgSO4 с KB r или NaBr и пр. HgBr2 образует ромбические кристаллы, изоморфные с HgCl2. Удельный вес 5,7. В воде она растворяется меньше, чем HgCl2, растворы на свету выделяют Hg2Br2. Она растворима в спирте, эфире, в бензоле (при нагревании). Подобно сулеме HgBr2 дает многочисленные двойные соединения, с Hg O образует бромокиси. Теплота образования 59,8 кал. (Br газ). Бромноватые соли получаются растворением Hg2O и Hg O в НВrО 3.
Йодистые соединения: однойодистая Ртуть * Hg2I2 и двуйодистая HgI2. Однойодистая Ртуть * Hg2I2 получается при нагревании или растирании йода с избытком Ртуть *, при двойном разложении HgNO 3 с растворимыми йодистыми металлами и пр. Hg2I2 кристаллическое вещество желто-зеленого цвета. Удельный вес 7,6—7,7. При нагревании она краснеет, при охлаждении возвращает свой прежний цвет. В воде, спирте, эфире Hg2I2 очень малорастворима. При нагревании или на свету легко выделяет Hg и образует HgI2. Теплота образования 58,4 кал. (I газ). Двуйодистая Ртуть * HgI2 получается при действии йода в избытке на Ртуть *, при растворении Hg O в HI, при действии йодистых металлов на HgCl 2, HgSO4 и пр. HgI2 существует в двух кристаллических видоизменениях: одно красного цвета, квадратной системы, другое желтого, ромбической; эти видоизменения переходят одно в другое в соответственных условиях. Красная HgI2 получается при двойном разложении растворимых ртутных солей окиси, например HgCl2, Hg(NO3)2 и пр. с йодистыми металлами. При действии раствора KI на HgCl2 получается красный осадок HgI2, который при избытке K I переходит в раствор, образуя двойную соль с K I. Удельный вес красной HgI2 — 6,3; при нагревании она плавится (около 253°) и дает желтую жидкость; последняя застывает в желтую кристаллическую массу, которая вновь переходит в красную HgI2. При осторожном нагревании HgI2 обращается в пар, который, охлаждаясь, дает желтое видоизменение (отчасти смешанное с красным). Желтая HgI2 является стойкой при высокой температуре; при охлаждении, под влиянием многих причин (трения, сжатия и пр.), она переходит в красную HgI2, сохраняя иногда свой внешний кристаллический вид. Переход этот сопровождается выделением тепла. Кроме указанного способа, желтая HgI2 получается и из растворов. По Warrington’y, при действии йодистых металлов на раствор солей окиси Ртуть * вообще вначале образуется желтая HgI2, которая быстро превращается в красную; если растворить красную HgI2 в спирте и к раствору прибавить воды, то выделяются ромбические кристаллы желтой HgI2. Удельный вес HgI2 около 6,2; она малорастворима в воде (1 часть в 150 частях), но легко растворима в слабых кислотах HCl, HI и в растворах многих солей, образуя с ними двойные соли; известны соединения HgI2 с HgO; HgI2 растворима в спирте, глицерине, малорастворима в эфире. Zn, Cu, Ag и многие др. металлы при действии на HgI2 отнимают от нее йод, давая Hg2I2 или Hg; теплота образования красной HgI2 44,8 и желтой 41,8 кал. (I газ). Кроме Hg2I2 и HgI2, известно еще соединение HgI6, получающееся при действии HgCl 2 на спиртовой раствор K I2; оно легко выделяет йод. Йодноватые соли получаются при двойном разложении HgNO3 и Hg(NO3)2 с KIO3.
Фтористые соединения. Hg2F2 получается растворением Hg2CO3 в HF, желтое кристаллическое вещество, легко растворимое в HF; на свету, в особенности в присутствии Н 2 O оно разлагается. HgF22H2O получают, растворяя HgO в HF. С водой оно легко дает HF и HgO; последняя соединяется с HgF2 и дает основную соль HgF2.HgO.H2O.
Сернистые соединения. Hg2S очень непрочно; оно легко разлагается на Hg и сернистую Ртуть * (окиси): Hg 2S=Hg+ HgS; по некоторым указаниям существование Hg2S возможно только при температуре ниже 0°. Сернистая Ртуть * HgS получается в аморфном виде и в кристаллическом. Аморфная HgS получается прямым соединением Hg и S при нагревании, при растирании их вместе; она образуется при действии многосернистых щелочей на Hg, Н 2 S на растворы ртутных солей (в последнем случае, если имеются соли закиси, то получается смесь Hg и HgS). Реакция Н 2 S с растворами солей Ртуть * (окиси) несколько сложнее; вначале, когда Н 2 S еще недостаточно, осаждаются двойные соли, заключающие HgS; они имеют различный цвет (белый, серый, бурый и пр.); при достаточном количестве Н 2 S получается HgS. Аморфная HgS вещество черного цвета, удельного веса 7,5—7,7, в воде нерастворима. Крепкая азотная кислота очень мало действует на нее; после продолжительного нагревания она дает 2HgSHg(NO3)2, вещество белого цвета, в воде нерастворимое. HgS легко растворяется в царской водке, в сернистых (и многосернистых) щелочах K2S, Na2S в присутствии KHO и NaHO в сернистом барии BaS, но нерастворима в сернистом аммонии. Крепкая серная кислота и соляная разлагают ее при нагревании; при накаливании на воздухе дает Hg и SO2; при прокаливании с железом, щелочами и углекислыми солями их выделяет Hg; при накаливании HgS улетучивается. Кристаллическая HgS — киноварь — получается сухим путем при возгонке аморфной HgS и мокрым — при действии на нее сернистых и многосернистых щелочей (см. Киноварь). Для сернистой Ртуть * известны многочисленные соединения с сернистыми металлами K 2S, Na2S, с BaS, As2S5, H2S и пр., с галоидными солями Ртуть *; например, при действии Н 2S на растворы HgCl2, HgBr2 легко получаются 2HgSHgCl2, 2HgSHgBr2 и пр. Сернокислые соли получаются при действии H2SO4 на Hg. При легком нагревании и при избытке Hg получаются соли закиси Ртуть * Hg2SO4, а при избытке Н 2 SО 4 и сильном нагревании получается HgSO 4; как в том, так и в другом случае происходит выделение SO2; Hg2SO4 белое кристаллическое вещество, в воде очень малорастворимое (1 часть в 300 частях воды при кипячении), лучше растворимое в крепкой серной кислоте при нагревании; на свету темнеет; при кипячении с водой разлагается. HgSO4 лучше растворима в воде; в растворе она отчасти разлагается с выделением малорастворимых основных солей, например 3HgO.SO3 и серной кислоты; дает гидрат HgSO4+H2O. Подобно другим солям Ртуть * Hg2SO4 и HgSO4, легко образуют двойные соли.
Родановые соединения. HgCNS получается при действии KCNS на HgNO3; белое вещество, нерастворимое в воде, соляной кислотой разлагается, растворяется в царской водке. Hg(CNS)2 получается растворением HgO в HCNS. При действии KCNS на HgCl2 или Hg(NO3)2 получается осадок Hg(CNS)2, который растворяется в избытке KCNS или ртутной соли, вследствие образования растворимых двойных солей. Hg(CNS)2 в воде малорастворима, при накаливании взрывает, при зажигании на воздухе горит, сильно увеличиваясь в объеме (служит для приготовления так называемых «фараоновых змей»). Hg(CNS)2 легко образует двойные соли.
С большинством металлов Ртуть * вступает в соединения и образует сплавы или так называемые амальгамы или сортучки. Одни металлы дают амальгамы прямо соединяясь с Ртуть *, для других амальгамы получаются при действии амальгамы калия или натрия на соответственные соли или при электролизе этих солей, употребляя Hg в виде катода. Одни амальгамы образуются с большим выделением тепла, как, например, амальгамы калия и натрия, другие, например олова или свинца, с поглощением. Образование амальгам сходно с получением соляных растворов: растворение металлов в Ртуть * сопровождается образованием определенных химических соединений их со Ртуть * Соединения эти вообще малопрочны, нагреванием разлагаются, и состав их довольно трудно установить, так как нелегко освободиться от избыточной Ртуть * Амальгама аммония получается в виде объемистой массы при действии амальгамы натрия на крепкий раствор нашатыря или — электролизом. Амальгама распадается уже при обыкновенной температуре, выделяя NH3 и Н. Амальгама натрия получается при действии Na на Ртуть *, с большим выделением тепла (происходит вспышка). Амальгама, содержащая меньше 80 частей Hg на 1 часть Na — твердая; другие полужидкие или жидкие; водой разлагаются. Выделены соединения Hg6Na2, Hg12Na2. Амальгама натрия имеет большое применение в органической химии для реакций восстановления в щелочной среде. Амальгама калия получается при действии калия на Ртуть *, причем выделяется значительное количество тепла. Уже при содержании 1 части K на 200 частей Hg она имеет полужидкую консистенцию; водой разлагается. Выделены Нg 24K2, Hg20K2, HgK2. Амальгамы кальция, стронция и бария получаются при электролизе хлористых соединений их в присутствии Hg, которая берется катодом, а также действием на хлористые соединения амальгамой натрия. На воздухе они окисляются, водой разлагаются. Таким же образом получаются амальгамы железа, никеля, кобальта, марганца, платины и др. Амальгама алюминия получается при нагревании Al и Hg в атмосфере углекислоты или при действии амальгамы натрия на квасцы; разлагает воду, служит для удаления малейших следов воды при изготовлении различных химических препаратов. Серебро и золото прямо растворяются в Ртуть *, лучше при нагревании. Амальгамы серебра существуют в природе; для золота приводятся амальгамы Au9Hg и Au3Hg. Подобно этому прямо дают амальгамы цинк, олово, свинец, медь и др. Подробности см. соответственные металлы.
Анализ ртутных соединений. Качественные определения. Если имеется твердое вещество, то для открытия в нем Ртуть * его смешивают с безводной содой или с известью, кладут в узкую стеклянную трубку, запаянную с одного конца, и накаливают; Ртуть * выделяется в виде отдельных капелек или образует зеркало. В трубочку кладут кусочек йода; получается сначала желтая, а потом красная HgI2; бумага, смоченная аммиачным раствором AgNO3, чернеет от паров ртути. В растворе открывается Ртуть * электролизом. В подкисленный раствор опускается палочка цинка, обернутая медной или золотой проволокой, которая от Ртуть * белеет; при накаливании она получает вновь свой прежний цвет. То же дает и мышьяк; поэтому проволоку прокаливают в стеклянной трубке и налет пробуют йодом. Полухлористое олово, прибавленное в избытке к раствору ртутной соли, дает осадок металлической Ртуть * Соли закиси Ртуть * узнают по образованию белого осадка Hg2Cl2 с HCl (чернеющего с NH 3, в отличие от AgCl). При качественных испытаниях характерно также образование осадков HgS, HgI2, хромовокислой Ртуть * и других. Количественные определения сухим путем. При исследовании ртутных руд наиболее грубый способ определения Ртуть * состоит в том, что берут 1000 гр. измельченной руды, смешивают ее с железными опилками, известью, накаливают в реторте и взвешивают выделившуюся Ртуть * Гораздо более точен способ Эшка (Eschka). Берут 2—10 гр. (смотря по содержанию Hg) измельченной руды, смешивают с половинным количеством железных опилок (не содержащих жира), кладут в фарфоровый тигель и засыпают еще слоем опилок до 1 стм. У тигля край шлифован; его закрывают золотой крышкой с шлифованным краем и несколько вогнутой внутрь. Крышка предварительно взвешена. Тигель сначала нагревается осторожно, а затем до красного каления, в углубление крышки заранее наливается вода. Ртуть образует амальгаму; после операции крышку обмывают спиртом, сушат при 100° и взвешивают. По Розе, определение ведется так же, как при органическом анализе. В трубку для сожжения, запаянную с одного конца, кладут слой двууглекислой соды или магнезита, затем слой извести, потом измельченную руду (около 5 гр.), смешанную с известью или натристой известью; вновь слой извести и асбестовую пробку. Если имеются йодистые или азотнокислые соединения — перед пробкой ставится медная пробка. Трубка затем оттягивается, конец загибается и погружается в воду. Трубка накаливается, начиная от пробки; сода или магнезит нагреваются в конце опыта, чтобы током углекислоты выгнать пары Hg. Кончик трубки отламывают, всю Ртуть * собирают в одно, сушат и взвешивают. Если имеется йодистая Ртуть *, то к извести примешивается цианистый калий KCN или руда смешивается с медными опилками. Определение мокрым путем производится главным образом в виде каломели Hg2Cl2 и сернистой P. HgS. Раствор соли закиси сильно разбавляется водой и осаждается раствором поваренной соли; каломель промывают на взвешенном фильтре и сушат при 100°, если имеются соли окиси Ртуть *, то к раствору приливают соляной кислоты и фосфористой кислоты для перевода окисной соли в закисную. Для полноты осаждения Hg2Cl2 оставляют жидкость стоять 12 часов. Фосфористую кислоту готовят, разлагая водой PCl3 или обрабатывая водой фосфор, лежавший во влажном воздухе. При определении в виде HgS закисные соединения предварительно окисляют царской водкой. К слабокислому раствору прибавляют сероводородной воды или Н 2 S; осадок HgS фильтруют тотчас, когда отстоится, собирают на взвешенном фильтре, промывают холодной водой (если выделилась при осаждении сера, то промывают спиртом и сероуглеродом) и сушат при 100°. Ртуть * легко определяется электролитическим путем в азотнокислых и солянокислых растворах, в двойных солях (йодистых, цианистых, сернистых и пр.) и др. соединениях. При анализе, например, азотнокислых растворов, жидкость помещается во взвешенную платиновую чашку, которая делается катодом; анодом берут платиновый кружок или спирально свернутую проволоку (см. Электролиз). Ток берется плотностью от 0,5 до 1 А. (на кв. дециметр). Ртуть * выделяется в виде зеркала или мелких капелек, ее промывают холодной водой, не прерывая тока; сушат в чашке над H2SO4 и взвешивают. Чашка освобождается от Ртуть * прокаливанием или действием азотной кислоты. Существуют способы и для определения Ртуть * титрованием. По Гемпелю, например, получают Ртуть * в виде Hg2Cl2; ее обрабатывают титрованным раствором йода в KI; происходит следующая реакция:
оставшийся йод определяют титрованием. Отделение Ртуть * от других металлов. При осаждении кислых растворов сероводородом и последующей обработкой полученных сернистых соединений сернистым аммонием, Ртуть * может находиться с серебром, медью, свинцом, кадмием, висмутом и некоторыми редкими металлами (палладием, родием, осмием, рутением). Обработкой сернистых соединений, где вся P. в виде HgS, крепкой азотной кислотой при нагревании, получают одну HgS с возможной примесью сернокислого свинца, от него Ртуть * отделяется, благодаря нерастворимости в воде PbSO4, PbCO3 в KCN или благодаря летучести HgCl 2. От меди и кадмия Ртуть * отделяется в виде Hg2Cl2; в присутствии серебра Ртуть * переводят в соединения окисные и осаждают AgCl.
При сохранении на свету уже влажность воздуха служит причиной существенного изменения. Но и при обыкновенной температуре газообразный аммиак поглощается окисью Ртуть *; получается (Вейль, 1864 —1867), в отсутствие света, желтое соединение NH3+2HgO, которому должно придать следующую формулу: NHg2OH+H2O [Насыщение аммиаком лучше всего производить под давлением, подвергая продукт несколько раз размельчению, или можно действовать на HgO спиртовым раствором NH 3 и полученный после многих часов взбалтывания продукт высушивать при обыкновенной температуре в токе газообразного аммиака. ]; в токе сухого NH 3 при 80—85° вещество это превращается в NHg2.OH, светло-бурый порошок, а при 100° происходит дальнейшая потеря воды и образование темно-бурого соединения (NHg2)2O; здесь имеются, следовательно, предполагаемые гидрат окиси аммония NH4OH и самая окись (NH4)2O, в которых весь аммониевый водород замещен двухвалентной Ртуть *; это гидрат окиси димеркуриаммония и окись димеркуриаммония. Вода к ним легко присоединяется, и снова получается первоначальный гидрат NHg2OH+H2O. Окись возникает также при действии жидкого аммиака; она легко взрывается при нагревании, ударе и растирании в агатовой ступке [По Вейлю, азотистая Ртуть * Плантамура и Гирцеля тождественна с (NHg2)2O. ]. Газообразный хлористый водород быстро и при выделении тепла действует на окись:
а спиртовой раствор HCl на холоде дает хлористый димеркуриаммоний:
Это желтый порошок, не изменяемый даже кипящей водой и трудно растворимый на холоде в соляной кислоте; горячий раствор едкого кали его разлагает при образовании NH 3 и HgO; а при 300° он мгновенно распадается на 2HgCl, 2Hg и N2. Известны и другие соли «сложного металла» димеркуриаммония. Газообразный аммиак способен присоединяться к сухой каломели, приготовленной мокрым путем; получается (Г. Розе, 1830) черный порошок состава HgNH3Cl — хлористый меркуриаммоний [Этому соединению часто придают удвоенную формулу Hg2(NH3)2Cl2, как и самой каломели, т. е. считают Ртуть * двухвалентной и для типа закиси; тогда нижеследующее уравнение будет таково:
уже при слабом нагревании весь NH 3 улетает и вещество становится опять белым. Изамбер исследовал диссоциацию этого соединения. При кипячении с каломелью водного раствора аммиака получается НgNН 2 Cl (Кен, 1839), хлористый димеркуриаммоний по уравнению:
Черный нерастворимый продукт в сухом состоянии обладает темно-серым цветом и при нагревании разлагается на аммиак, азот, каломель и Ртуть *, а с газообразным хлористым водородом реагирует по уравнению:
Соответствующие соединения получаются и из сулемы. Хлористый меркуридиаммоний Hg(NH3)2Cl2 образуется, если прибавлять по каплям раствор сулемы к горячему раствору нашатыря и аммиака до тех пор, пока образующийся в момент прилития осадок переходит в раствор; при охлаждении жидкости кристаллизуется искомый продукт в виде белого порошка или маленьких гранатоэдров; это так называемый «плавкий белый преципитат»; плавится он около 300°, разлагаясь на азот и аммиак и образуя возгон, содержащий NH4Cl, HgCl2 и HgCl. При действии жидкого аммиака на сулему образуется вещество того же состава, но, вероятно, полимерное (Вейль). При взаимодействии растворов сулемы и аммиака без нашатыря, лучше всего — когда вливают по каплям сулему в разбавленный аммиачный раствор, получается «неплавкий белый преципитат» или хлористый меркуриаммоний — HgNH2Cl [Иначе это соединение называется преципитатом Кена, который установил его состав. Прежде его считали тождественным с плавким преципитатом, употребляющимся как лекарство; уже Велер (1832) установил различие их продуктов разложения, и с тех пор они различались, как плавкий и неплавкий преципитаты.]:
При нагревании он разлагается, не плавясь, на аммиак, азот и каломель, которая возгоняется:
при действии сухого хлористого водорода происходит такое разложение:
легко растворим в кислотах и в горячих растворах солей аммония; о действии кипящей воды сказано далее. Когда было установлено (Кен), что старое представление об этих веществах, как продуктах простого присоединения аммиака, должно быть отброшено, потому что содержание в них водорода относительно азота меньше, чем в аммиаке, стали принимать, что это — амидные соединения. Жерар принимал в них аммиак, в котором один или более водородов замещены Ртуть *; А. В. Гофманн развил это представление, приняв в них аммоний, подвергшийся замещению водородов одного, двух и т. д. Последний взгляд всего проще; все эти соединения, за исключением Hg3N2, таким образом, приводятся к одному типу.
Существует ряд солей, ведущих свое начало от так называемого основания Миллона (1846), которое можно себе представить как гипотетический едкий аммоний NH4OH, содержащий вместо двух водородов при азоте двухвалентную группу (— Hg—O—Hg—)», то есть это N(Hg2O)H2.OH — гидрат окиси оксидимеркуриаммония. Это соединение получается при взаимодействии окиси Ртуть * с водным раствором аммиака, оно буреет уже при высушивании над серной кислотой и имеет тогда указанный состав (изомерно с вышеупомянутым соединением Вейля NHg2. ОН+Н 2 O), а при 130° теряет еще воду и превращается в такую окись [N(Hg2O)H2]2O, без изменения окраски. Основание Миллона, хотя трудно растворимо в воде (при 17° одна часть в 13000, а при 80° в 1800 частях) и может быть выкристаллизовано из нее в виде микроскопических кристалликов светло-желтого цвета N(Hg 2O)H2.OH+H2 O. Соли соляной и серной кислот в воде нерастворимы, так что основанием Миллона можно вполне удалить Н 2 SО 4 и НСl, если будут примешаны Na2SO4 и NaCl, например, к раствору соды. Хлористый оксидимеркуриаммоний получается также при кипячении с водой обоих вышеупомянутых преципитатов:
он образует светло-желтый порошок, разлагающийся при постепенном нагревании на аммиак, азот, воду, каломель и металлическую Ртуть *; соль растворима в соляной и азотной кислотах. Йодистый оксидимеркуриаммоний лучше всего получать при действии «реактива Несслера» на аммиак; т. е. для этого нужно взять щелочной раствор двойной соли йодной Ртуть * и калия и прибавить к нему аммиаку:
получается бурый осадок указанного в уравнении состава; если аммиака взято очень мало, то возникает по крайней мере оранжевая окраска; это чувствительная реакция на присутствие аммиака (Несслер, 1856 г.). Существуют соли, в которых принимают вместо двух водородов аммония двухвалентную группу (— Hg—O—Hg—O—Hg —)», например азотнокислый окситримеркуриаммоний N2(Hg3O2).H2NO3.
Металлоорганические соединения Ртуть * Йодангидриды спиртов реагируют с металлической Ртуть * уже при обыкновенной температуре (Франкланд, 1852; Штрекер, 1854), причем получаются йодистые меркуриалкилы I.Hg.R’. При нагревании, затем, с цианистым калием получаются меркуридиалкилы, например:
или, что лучше, действуют цинкорганическими соединениями (Буктон, 1858):
Если, согласно последнему уравнению, подействовать цинкэтилом на йодистый меркуриметил, то не получается смешанного продукта H3C.Hg.C2H5, a возникает смесь меркуриметила и меркуриэтила:
Лучший способ получения меркуридиалкилов — действие амальгамы натрия на йодангидриды (Франкланд и Дуппа, 1863):
в присутствии малого количества уксусного эфира, роль которого до сих пор не разъяснена. Меркурифенил Hg (С 6 Н 5)2, получается при действии амальгамы натрия на бромбензол (Отто, Дреер, 1870) в ксилольном растворе в присутствии уксусного эфира и при кипячении. HgR’2, предельного ряда — бесцветные жидкости, в воде нерастворимые и на воздухе постоянные — не загораются подобно цинкэтилу; обладают слабым запахом и весьма ядовиты; отравление сказывается по истечении некоторого времени; особая осторожность требуется при обращении с легко летучим меркуриметилом. Температура кипения и удельный вес для Hg(CH3)2, 93,96° и 3,069; для Hg (С 3 Н 5)2 158—160° и 2,444. Кроме того, исследованы высшие гомологи, а именно пропилового, бутилового, амилового и октилового рядов. Hg(C6H5)2 кристалличен, температура плавления 120° и способен возгоняться. Меркуриалкиды способны к реакциям двойного разложения, к вымениванию спиртовых радикалов, но реагируют не так энергично, как цинкалкилы, а потому и употребляются вместо последних, где требуется медленное действие. Вода не действует на меркуриалкилы, разбавленные кислоты — очень мало, крепкие же растворяют, причем один радикал замещается остатком кислоты:
хлор действует иной раз с воспламенением, а бром и йод более спокойно:
Возникающие при этих реакциях соединения, кристаллизующиеся по большей части хорошо, могут быть рассматриваемы как соли сложных оснований R2Hg2O; гидраты подобных оснований легко растворимы в воде и получаются из галоидных солей при действии влажной окиси серебра; растворы R’.Hg.OH обладают сильной щелочной реакцией, скользки на ощупь и осаждают из соляных растворов окиси тяжелых металлов. Эти сложные щелочи можно получать еще при окислении HgR’2 хамелеоном, причем только один радикал окисляется и заменяется водным остатком. H3C.HgI — белые с перламутровым блеском листочки, в воде нерастворимы; H3C.Hg.NO3 легко растворим в воде, а Н 3 С.Нg.С 2 Н 3 О 2 — трудно. H5C6.Hg.OH кристалличен, малорастворим в холодной воде, но обладает точно так же щелочной реакцией, вытесняет аммиак из солей и притягивает угольный ангидрид из воздуха.
Извлечение ртути из ее руд. Главнейшим источником для получения ртути в технике служит киноварь HgS (см.) Существуют два главных способа для выделения из нее Ртуть *: 1) Киноварь накаливается с железом, известью и т. п. веществами, способными отнять серу от HgS, например HgS+Fe=Hg+FeS; выделившаяся Ртуть * улетучивается и собирается в конденсационных приборах. 2) Киноварь подвергается обжиганию на воздухе и сера выделяется из нее в виде сернистого газа: HgS+O2=Hg+SO2.
I. Первый способ наиболее простой и наиболее старый. В средние века он имел широкое распространение, в настоящее же время почти совершенно оставлен. Операция производится в железных или чугунных ретортах, величина которых изменяется в зависимости от размеров производства. Их обыкновенно по несколько штук вмазывают в одну общую печь. Реторты плотно соединены с холодильниками (обыкновенно металлическими), которым придается различное устройство: то они делаются в виде труб, то в виде вытянутых бутылей и т. д. (фиг. 1); в них обыкновенно наливается некоторое количество воды, причем или каждая реторта имеет свой холодильник, или один холодильник служит для нескольких реторт.
В некоторых местах (Missouri-Mine) холодильник устраивается из железного ящика, поставленного (дном вверх) в другой ящик более широкий, у которого дно идет наклонно; на дно налита вода, для спуска ртути служит сифон. Руда предварительно измельчается и после смешивания с известью или железом загружается в реторту. Гонка начинается довольно скоро и вся операция тянется несколько часов (смотря по емкости реторты). Конденсация ртутных паров идет очень хорошо, без особенных потерь. Наиболее неприятной операцией является выгрузка и нагрузка реторт, так как из нагретой реторты при этом выделяются ртутные пары, которые очень вредно действуют на здоровье рабочих. Чтобы уменьшить это, через реторты прогоняют иногда вентилятором воздух, а рабочие прикрывают себе нос и рот мокрой губкой и пр. Этот способ получения Ртуть * не требует больших расходов для первоначального обзаведения, но его нельзя сделать непрерывным (для загрузки и выгрузки реторт приходится ждать, когда они остынут), он требует большого расхода топлива и потому с выгодой может быть применяем только к очень богатым рудам. Если присоединить сюда вред, приносимый им здоровью рабочих, то становится понятным, почему он почти вышел из употребления.
II. Обжигание ртутных руд производится различным образом. Самый простой способ — обжигать руды в крытых кучах (Röststadeln); он, например, употребляется для получения ртути (попутно) из блеклой руды в Венгрии (Ober Ungarn Stephanshütte). Кучи делаются около 7 м в диаметре и 2 м высотой; в них находятся ходы, которые заполняются древесным углем; внизу проделываются отверстия для притока воздуха. Уголь разжигают; пары ртути конденсируются в верхних холодных слоях кучи; когда обжигание кончилось, на что требуется до 3-х недель, верхний слой кучи снимают, промывают и отмучивают выделившуюся Ртуть * Более сложным является обжигание руд в муфельных печах. В печь помещается чугунный муфель, снабженный у одного конца отверстиями для притока воздуха, а у другого — отверстием для выхода паров ртути. К отверстию для воздуха приделывают согнутую коленом трубку для охлаждения могущего выделиться ртутного пара. Для конденсации Ртуть * служат приемники из листового железа; из приемника для окончательного охлаждения и освобождения от Ртуть * воздух (служивший для обжига руд) поступает в систему глиняных труб и затем в вытяжную трубу. Неудобство этого способа — большой расход топлива. Наиболее совершенный способ добычи ртути из HgS — обжигание руды в шахтных печах. Он дает возможность разрабатывать руды, эксплуатация которых прежде вышеописанными приемами считалась неэкономичной. Шахтные печи бывают двух родов: одни, старой конструкции, действуют периодически, другие, новой, работают непрерывно; эти последние являются наиболее совершенными. В общих чертах операция здесь ведется следующим образом. Руда загружается сверху в высокую и сравнительно узкую печь — шахту, которая вверху закрывается, а внизу имеет отверстия, тоже закрывающиеся дверками, для выгрузки обожженной руды. Топки помещаются где-либо внизу. Топочные газы, смешанные с избытком воздуха, из топки идут в шахту, где происходит выгорание серы. Выделившаяся Ртуть * вместе с продуктами горения проходит через слой руды в верхнюю часть печи, откуда газы направляются в холодильник и затем в вытяжную трубу. Такая циркуляция газов иногда получается при помощи вентиляторов. Так как ртутные пары при обжигании смешиваются с большим количеством различных газообразных веществ, то представляется очень важным вопрос об устройстве надлежащих конденсационных аппаратов, иначе выходящие газы будут постоянно уносить с собой часть ртути. Охлаждение обыкновенно производится окружающим воздухом. В старых испанских печах для охлаждения Ртуть * служили особой формы глиняные сосуды (Aludel) около 0,5 м длины, вздутые посередине и вытянутые на одном конце (фиг. 1); они плотно соединялись друг с другом, образуя длинный канал, с большой охлаждающею поверхностью; они встречаются еще и ныне. Обыкновенно для конденсации Ртуть * устраивают кирпичные, деревянные, железные и др. камеры, разбитые перегородками таким образом, чтобы по возможности удлинить путь газов. Кирпичные камеры были бы наиболее удобны, если бы не имели одного крупного недостатка: кирпич проницаем для паров ртути и ртуть теряется. Против этого обстоятельства приходится принимать различные меры: кирпич берется плотный, покрывается асфальтом или защищается железом и пр. Железные конденсационные аппараты бывают трубчатые, в виде ящиков и пр. Благодаря большой теплопроводности железа, охлаждение идет быстро и величина холодильника сильно сокращается; но они тоже имеют свой недостаток: благодаря присутствию в газах кислых паров (серной, сернистой кислот и пр.) железо быстро разъедается. Дерево с успехом может быть употреблено для постройки конденсационных аппаратов на некотором отдалении от печей, где газы не обладают высокой температурой. Неудобство их — плохая теплопроводность дерева, вследствие чего охлаждение идет очень медленно, приходится сильно увеличивать длину пути газа; дерево иногда покрывают стеклом. В некоторых случаях, для более скорого охлаждения, в камеры вводят железные трубы, по которым течет холодная вода. Из конденсаторов ртуть стекает в соответственные приемники. Вместе с металлической ртутью в конденсаторах осаждаются различные вещества: сажа, ртутные соединения (окись Ртуть *, сернистая Ртуть * и др.), вода, продукты сухой перегонки топлива и пр.; получается налет (Stupp), который в ближайших к печи частях более или менее сухой, дальше же представляется в виде полужидкой массы, различной консистенции. Этот налет пропитан мелкими капельками ртути. Количество ртути в таком осадке бывает часто очень велико. Для извлечения ее, если осадок сухой или только немного влажный (в противном случае его подсушивают), его смешивают с известью в особых мешалках или просто лопатами. Капли металлической Ртуть * при этом собираются вместе; удаливши Ртуть *, массу подвергают перегонке в особых котлах или же ее присоединяют к руде и обжигают вместе с ней. Как на образец периодически действующих печей можно указать на печь Bustamente. Она появилась в середине XVII столетия и с различными видоизменениями встречается еще и до настоящего времени в Альмадене. Печь (фиг. 3) имеет вид цилиндра 8—10 м высотой, 2 м диаметром и заканчивается куполом. В середине в ней устроено несколько сводов, которые вместе образуют род решетки, разбивая канал печи на две половины. В нижней части печи помещается топливо (обыкновенно дерево); в верхней — руда, которая загружается через отверстие, сделанное в куполе (при работе печи оно замазывается); на высоте решетки находится входное отверстие (тоже запирающееся).
Фиг. 3. Печь Бустаменте в разрезе.
Продукты горения топлива с избытком воздуха частью уходят через боковое отверстие в вытяжную трубу, частью идут в печь. Из печи газы и пары Ртуть * поступают в 12 каналов (фиг. 2).
Фиг. 2. Печь Бустаменте в плане.
Каждый канал устроен из нескольких десятков грушеобразных глиняных сосудов (Aludel), герметически соединенных между собой; они лежат в желобах, устроенных на особой постройке. Последняя представляет две поверхности, пересекающиеся под известным углом (сначала идет, опускаясь к земле, а затем поднимается). Глиняные сосуды в восходящей ветви канала имеют в расширенной части небольшие отверстия, через которые выливается конденсирующаяся Ртуть *; она стекает вниз, попадает в желоб b и отсюда стекает в приемники. Пройдя через глиняные сосуды, газы поступают в конденсационную камеру; здесь они встречают перегородку, не доходящую до дна камеры, которая заставляет их спуститься вниз; там они проходят над поверхностью воды, поднимаются вверх и выходят через вытяжную трубу наружу. Когда печь пускается в ход, то на решетку кладут сначала некоторой толщины слой бедной руды, затем идет обыкновенная руда, затем наиболее богатая, Stupp, брикеты из рудной мелочи, обломки глиняных сосудов (Aludel) и пр., всего до 11,5 тонн. Топка производится около 10 часов; когда начинается дистилляция Ртуть *, топка прекращается и температура поддерживается сгоранием серы. Когда процесс кончится, ждут около суток, чтобы печь остыла и затем разгружают ее. Вся операция длится около 3 суток. Печи эти вредны для здоровья; глиняные сосуды легко бьются; потеря Ртуть * значительна. В Идрии действовали печи Леопольди, похожие на вышеописанные; разница заключалась в том, что в них устраивали 3 решетки, которые разбивали печь на 3 отделения для различной величины кусков руды; вместо ломких глиняных сосудов строили кирпичные камеры, разделенные перегородками, не доходящими попеременно до пола и до потолка, так что газы должны были проходить через них, постоянно меняя направление. Наибольший интерес представляют непрерывно действующие печи, появившиеся в середине этого столетия; здесь не нужно останавливать печь для загрузки и выгрузки руды: свежая руда постоянно поступает в печь сверху, а обожженная постоянно удаляется снизу. Вся задача заключается в том, чтобы руда, спускаясь сверху вниз, известное время пробыла в печи, достаточное для полного удаления Ртуть *; кроме того, нужно, чтобы она достаточно охладилась в печи, прежде чем ее будут окончательно выгребать (тогда из нее будет меньше выделяться ртутных паров). Систем непрерывно действующих печей множество. В Идрии и в Новом Альмадене в большом ходу печи Exeli (фиг. 4).
Печь внутри имеет вид цилиндра 11½ футов высоты и 5½ футов ширины, поставленного на опрокинутый конус около 8 футов высоты и 4 футов диаметром внизу. Внутри она выложена огнеупорным кирпичом, а дно чугунными клетками, так что получается углубление, куда собирается стекающая по стенкам Ртуть * Снаружи верхняя часть печи одета листовым железом, а нижняя выложена чугунными плитами, плотно связанными между собой. Все это делается для того, чтобы уменьшить потери Ртуть * через стенки печи. Печь имеет 3 топки, симметрично расположенные; под топками устроены камеры, в которые через особую дверку выгребают из печи обожженную руду. Через эти же камеры идет в топку воздух. Проходя около нагретой руды, он предварительно подогревается; руда же остается в камере до тех пор, пока не охладится достаточно, и тогда ее удаляют через особое отверстие. Для загрузки руды наверху печи находится воронка с конусом, поднимаемым при помощи рычага. Воронка прикрыта цилиндрической крышкой с водяным запором. Печь пускается в ход следующим образом. Сначала ее наполняют до топки обожженной рудой и уже затем свежей рудой, к которой прибавляют некоторое количество кокса для получения надлежащей температуры. Загрузивши печь, кладут порцию руды в воронку, чтобы прогреть ее перед употреблением; иначе, попавши в печь, она будет конденсировать на себе Ртуть * О том, какая температура в печи, судят через особые отверстия. Когда печь разгорится докрасна, выгребают часть руды, высыпают из воронки руду в печь, а в нее загружают новую порцию; затем выгрузка и нагрузка повторяются правильно через 2 часа. В сутки обжигают около 10 тонн; издержки около 0,96 доллара на тонну руды. Для конденсации служит система в несколько рядов зигзагообразно расположенных чугунных трубок. Для обжигания в печах Эксели и в др. печах подобного же устройства необходимо брать руду в сравнительно крупных кусках. Рудную мелочь нельзя непосредственно загружать в печь; из нее предварительно делают брикеты, что связано с большим расходом. Чтобы избежать этого, в последнее время предложено несколько систем печей. В Новом Альмадене, например, в ходу печи системы Гуттнера и Скотта (фиг. 5).
Фиг. 5. Печь Huttner’ а и Scott’ а.
Главная особенность их в том, что канал печи не вертикален, а идет зигзагообразно. Печи строятся парные, и каждая пара имеет одну общую воронку для загрузки руды и часто одно выгребное отверстие. Из стенки, отделяющей две смежные шахты, выдаются внутрь выступы из огнеупорного кирпича; выступы эти идут на известном расстоянии один над другим по обе стороны стенки под углом в 45° Подобные же выступы идут из противоположной стенки каждой шахты, направляясь перпендикулярно к первым и не доходя до них на известное расстояние; образуется таким образом узкая щель. Руда, передвигаясь в печи, должна как бы сваливаться с одной полки на другую, представляя очень большую поверхность для обжигания. С передней и с задней стороны печи находятся газовые камеры, которые сообщаются с внутренностью печи отверстиями, лежащими под выступами. Топочные газы, смешанные с воздухом (входящим через особые отверстия), входят через эти отверстия под выступами в печь, проходят над рудой, идут в заднюю камеру, меняя направление, поднимаясь выше — снова входят в печь, и так далее; они проходят над рудой, пока, окончательно охладившись, не уйдут из печи. Так как вообще переработка мелкой руды в вертикальных печах затруднительна, то еще в середине этого столетия предложены были для этой цели пламенные печи (Alberti). Они имеют горизонтальный под; в передней части пода находится топка, а в задней, над подом — воронка для загрузки руды: через дверку, находящуюся в передней части печи, рабочий может распределять руду по поду; под у топки имеет отверстие, в которое можно выгребать обожженную руду. Топочные газы с избытком воздуха проходят над рудой, входят в холодильник из чугунных труб, затем в кирпичные камеры, по трубам вновь возвращаются к печи и здесь через вытяжную трубу выходят вон.
При обработке ртутных руд в печах всеми вышеописанными способами потери Ртуть * очень значительны: часть Ртуть * (правда, незначительная) уносится газами в атмосферу, часть остается в обожженной руде, значительное количество ее проникает в каменные стенки, при этом часть ее улетучивается, часть скапливается в них или проникает в почву на значительную глубину. В Новом Альмадене из почвы одной печи извлечено было в 1863 г. 153000 кг Ртуть * Потери часто превышают 50% всего количества Ртуть *; при самой тщательной выработке потеря редко спускается ниже 6%; в Калифорнии в лучших печах обычная потеря 15—20%. Чтобы избежать этого, предлагались различные способы вести переработку ртутных руд мокрым путем. Сивекинг предлагал растирать руды с водой и затем смешивать во вращающихся бочках с раствором полухлористой меди Cu2Cl2 и поваренной соли в присутствии кусочков меди; тогда HgS+Cu2Cl2=Hg+CuS+CuCl2; выделившаяся Ртуть * образовала амальгаму с медью; ее затем отделяли и подвергали перегонке. Вагнер предлагал обрабатывать руды бромной водой или раствором брома в крепкой соляной кислоте и пр. Все эти способы не имели успеха на практике. Большую важность представляет электролитический способ. Руда подвергается электролизу в присутствии раствора поваренной соли или соляной кислоты. Полученную на заводах Ртуть * разливают обыкновенно в железные бутыли с винтовой пробкой; в бутыль помещают около 34,5—34,7 кг Ртуть * В Китае ее хранят в бамбуковых трубках. Следующая таблица дает понятие о выработке Ртуть * в различных странах за последние 50 лет. Вес Ртуть * выражен в тоннах:
Цена за 1 кг в марках, в Лондоне
В России добыто Ртуть * в 1887 г. — 64, в 1888 г. — 165, в 1889 г. — 167, в 1890 г. — 229 тонн. Наибольшее количество всей добываемой Ртуть * употребляется в технике для извлечения золота и серебра из их руд, часть идет для приготовления киновари, часть для производства зеркал, для золочения. Некоторое количество идет для приготовления гремучей Ртуть * и др. ртутных препаратов. При научных исследованиях в физических и химических лабораториях Ртуть * имеет большое применение (для устройства термометров, барометров, манометров, ртутных насосов, при газовом анализе для собирания и измерения газов, для калибровки сосудов и пр.). В этих случаях необходимо бывает иметь совершенно чистую Ртуть * Для очищения Ртуть * механическим путем берут стеклянную воронку, кладут в нее фильтр и делают в нем отверстие тонкой иглой. Влитая в воронку Ртуть * вытекает тонкой струей, а нечистота остается на фильтре. Вместо этого берут также широкую и длинную (до 1 м) стеклянную трубку и обвязывают один конец ее замшей. Если налить в нее Ртуть *, то она в виде дождя фильтруется через замшу. Для удаления из Ртуть * растворенных металлов, например Cu, Zn, Pb, самый простой способ — обработка азотной кислотой. Берут длинную широкую стеклянную трубку, согнутую на конце сифоном; наполняют ее слабой азотной кислотой и заставляют течь в нее ртуть тонкой струей; вытекающую из трубки Ртуть * тщательно промывают водой и сушат сначала бумагой, а затем вливая в склянку с крепкой серной кислотой с краном у дна; в такой склянке часто и хранится Ртуть *; при выливании Ртуть * смотрят, чтобы в кран не попадали капли серной кислоты. Брюль советует взбалтывать Ртуть * с 0,5% раствором двухромовокалиевой соли, к которому прибавлено некоторое количество Н 2 SО 4 (для разложения K2Cr2O7). Наиболее совершенный способ очистки Ртуть * — перегонка; ее иногда производят обычным способом в железных сосудах, но очистка лучше всего достигается при перегонке Ртуть * в пустоте. Из многих предложенных для этой цели приборов довольно удобен прибор Вейнгольда, имеющий различные видоизменения (фиг. 6).
Берется длинная (около 2 м) стеклянная трубка ab, согнутая на одном конце сифоном g; у нее имеется отросток e, сообщающийся с ртутным насосом и с баллоном D, где находится серная кислота. Трубка ab проходит через дно сосуда A; на нее надета более широкая трубка cd с шаром B из тугоплавкого стекла, трубка ab почти касается шара. x — кольцеобразная горелка, z — колпачок для защиты шара от охлаждения, E — приемник для Ртуть *, с хлоркальциевой трубкой для защиты Ртуть * от влаги воздуха. Ch — сосуд, наполненный перегоняемой Ртуть * Операция ведется следующим образом: наполняют ртутью A и C; C опрокидывают, погрузивши конец его, h, на известную глубину в A. Конец сифона r погружают в чашечку с Ртуть * (возможно, чистой) и начинают выкачивать из трубок воздух до полной пустоты. Давлением атмосферы Ртуть * в ab подымается до некоторой постоянной высоты q, а в cd в шаре B до высоты m; затем зажигают горелку x и начинают осторожно нагревать. Ртуть * обращается в пар, который входит в трубку ab; опускаясь по трубке ab, он охлаждается, благодаря тому, что трубка окружена Ртуть *, и капли ее стекают в q. В то же время будет выливаться Ртуть * из сифона в чашечку. Серная кислота в D служит для того, чтобы поглощать водяные пары, которые могут получаться при перегонке. Когда перегнанная Ртуть * заменит всю Ртуть *, которая раньше наполняла ab, чашечку у сифона убирают и конец сифона r вставляют на пробке в приемник E; в нем собирается сухая и чистая Ртуть * Убыль Ртуть * в шаре B пополняется Ртуть * из сосуда A под давлением атмосферы и уровень ее в A понижается. Когда при этом обнажится конец h сосуда C, в него ворвется воздух, часть Ртуть * вытечет из C и h вновь будет погружен в Ртуть * Прибор действует автоматически, но по временам смотрят, держится ли в нем пустота.
Ртуть (медико-санитарный очерк). — I. Ртуть * и ее препараты с точки зрения фармакологии. Применение Ртуть * и ее препаратов, с лечебными целями, теряется в глубокой древности. В Китае Ртуть * применялась более чем за 2600 лет до нашей эры; древние индусы также были знакомы с Ртуть * и так высоко ценили целебные свойства ее, что человек, «познавший силу Ртуть *», у них считался «богом». У арабов Ртуть * тоже находила обширное применение при лечении всякого рода кожных заболеваний, против вшивости, чесотки и т. д.; арабскому алхимику Геберу, жившему в VII в. после Ртуть * Х., приписывается открытие сулемы. Одним из главных показаний к назначению ртутного лечения уже в то отдаленнейшее время служил сифилис. Суберэн утверждает, что «китайцы пользовались Ртуть * для удаления сифилитического яда из организма за много веков до открытия Америки». Но широкое применение Ртуть * и ее препаратов против сифилиса началось лишь после эпидемии сифилиса, вспыхнувшей в конце XV в. С того времени Ртуть *, как говорит Фурнье, «никогда не сходила с медицинской сцены», хотя представители медицины в разные времена к ней относились различно. Так, в 1580 г. медицинский факультет гейдельбергского университета от всех докторов требовал клятвенного обещания в том, что они никогда не будут прибегать к назначению Ртуть * и ее препаратов. В 1655 г. гейдельбергский закон был отменен и, мало-помалу, вопрос о значении Ртуть * и ее препаратов для организма стал подвергаться научной разработке. Тем не менее, еще и в настоящее время наши представления о целебных действиях Ртуть * и ее препаратов далеко не полны. Некоторые представители медицины и теперь еще восстают против широкого применения Ртуть * и ее препаратов, но в общем Ртуть * приобрела право гражданства в современной медицине и большинством врачей считается пока незаменимым средством при лечении сифилиса (см. Сифилис); кроме того, ртутные препараты применяются и для умерщвления паразитов, для послабления на низ и как мочегонные при болезнях сердца (каломель).
Из наиболее употребительных препаратов Ртуть * укажем на следующие: a) Ртутная мазь (Unguentum Hydrargyri cinereum). Она представляет смесь металлической Ртуть * и жира. В старой мази содержатся, кроме того, ртутные соединения жирных кислот и свободные жирные кислоты. Ртутная мазь еще называется Unguentum Neapolitanum, потому что в Европе сифилис впервые появился в виде жестокой эпидемии в Неаполе (XV столетие) и там против него употребляли ртутную мазь. Изредка последняя применяется и как противовоспалительное средство. b) Окиси ртути (красная и желтая) применяются в форме мазей в глазной практике. c) Двухлористая ртуть (Hydrargyrum bichloratum corrosivum, HgCl2) — сулема — после серой мази наиболее известный препарат Ртуть * Сулема обладает чрезвычайно сильною способностью убивать низшие организмы и вследствие этого считается одним из наиболее распространенных дезинфицирующих и антисептических средств (см. ниже). При достаточной степени разведения, сулема способствует деятельности дрожжевых грибков (Шульц). Небольшие, но часто повторяемые дозы сулемы могут увеличивать вес тела у здоровых людей и животных (Льежуа, Кейс, Шлезингер и др.). d) Однохлористая ртуть (Hydrargyrum chloratum mite, Hg2Cl2 — каломель. Этот препарат Ртуть * раньше пользовался очень сильным распространением; в XVI и XVII столетиях на каломель смотрели как на «панацею» (Panacea dulcis) от всех болезней. В настоящее время каломель считают очень ценным средством при сифилисе, в начале брюшного тифа, при летних поносах детей и при некоторых болезнях сердца. При назначении каломели, однако, всегда следует быть крайне осторожным, ибо в организме он образует растворимое соединение с белковыми веществами (а не переходит в сулему, как это полагают некоторые авторы). Испражнения после приема каломели имеют темно-зеленый цвет и содержат неизмененный каломель, черную сернистую ртуть и неразложившуюся желчь. Каломель (в виде мельчайшего порошка — Hydrargyrum chloratum vapore paratum) употребляется в глазной практике; часть каломели, даже при этих условиях, переходит в раствор и выделяется мочой. В присутствии органических веществ (а также и света) каломель переходит в сулему. При лечении сифилиса подкожными впрыскиваниями пользуются e) так называемыми органическими препаратами Ртуть * (Hydrargyrum cyanatum, formamidatum, peptonatum, albuminatum, benzoicum oxydatum, aethylo-chloratum, phenylicum и т. д. и т. д.), которые не так сильно раздражают кожу, как обыкновенные препараты Ртуть * f) Металлическая Ртуть *, как таковая, в медицине в настоящее время применяется лишь в очень редких случаях: при острой непроходимости кишок, вследствие перегиба, внедрения, паралича и т. п. Давая сравнительно большие количества Ртуть * (до ½ фунта), рассчитывают на то, что Ртуть *, вследствие высокого удельного веса, опустится до места непроходимости и своим давлением расправит слившиеся стенки кишечника. Но, так как, с одной стороны, возможно прободение желудка и кишечника, а с другой — часть Ртуть * всегда может остаться в организме и даже переходит в растворимые соединения, то такой метод лечения клиницистами почти оставлен. В народной медицине, в особенности у нас, в России, металлическая Ртуть * (в виде таковой и в виде серой мази) часто применяется от всякого рода паразитов человеческой кожи (например, плащиц). Русские крестьяне также пользуются Ртуть * для вызывания выкидыша, причем растворяют Ртуть * в крепкой водке (азотной кислоте) и полученный раствор принимают вовнутрь. Очень большим распространением среди крестьян пользуется также раствор сулемы в спирте для излечения «нехорошей», «французской» болезни. С фармакологической точки зрения действие Ртуть * и ее препаратов изучено довольно подробно.
Все растворы ртути (кислые, щелочные или нейтральные) являются в высшей степени сильными ядами для протоплазмы и, при известных условиях, неминуемо ведут к гангренозному омертвению тканей. Всасывание препаратов Ртуть * происходит в виде растворимых двойных соединений с белками и другими азотсодержащими веществами, и даже нерастворимые соединения Ртуть * (как, например, каломель) всасываются таким путем; металлическая Ртуть * (серая мазь), а равно и нерастворимые в жидкостях организма ртутные соединения жирных кислот всасываются из волосных мешочков, сальных и потовых желез при помощи выделений этих желез (поваренной соли, белка, летучих жирных кислот; Бинц). При этом происходит или окисление, или, и это гораздо вероятнее — соединение Ртуть * с хлором и белками. Сделавшись, таким образом, растворимыми в лимфе и в крови, соединения Ртуть * попадают в систему кровообращения. Образование осадков при этом не может иметь места, ибо возникающий ртутный альбуминат растворим в избытке белка и поваренной соли, всегда содержащейся в жидкостях организма. Циркулируя в организме, Ртуть * энергично действует на пищеварительный канал, органы кровообращения и центральную нервную систему (см. ниже). Очень ясно выраженное действие Ртуть * обнаруживает на ткани и органы полости рта (сильное слюнотечение) и на толстую кишку (послабление). Пагубное действие Ртуть * на органы кровообращения сказывается в понижении кровяного давления, наступающего, по всей вероятности, вследствие паралича сердца и сосудов. Заболевания центральной нервной системы выражаются в своеобразном дрожании, в характерных болях и т. д. (см. ниже). Специфическое действие Ртуть * на сифилис далеко не выяснено удовлетворительно. Но есть основание допустить, что благотворное действие Ртуть * и ее препаратов при лечении сифилиса должно быть объяснено специфическим действием известных доз Ртуть * при известных же условиях на обмен веществ (Шмидеберг). В пользу этого предположения говорит и упомянутый уже факт, что при продолжительном употреблении малых доз Ртуть * наблюдается увеличение веса тела и числа красных кровяных шариков. Очевидно, что малые, но частые дозы Ртуть * действуют настолько же благотворно на «питание», как и малые дозы мышьяка при известных условиях.
III. Санитарное значение Ртуть * С санитарной точки зрения Ртуть * представляет выдающийся интерес в следующих отношениях: 1) хроническое отравление Ртуть * — в особенности, в виде так называемых «профессиональных» отравлений; 2) применение сулемы для дезинфекции; 3) нахождение препаратов Ртуть * в некоторых съестных припасах и предметах потребления; и 4) санитарный надзор за продажей Ртуть * и ее препаратов.
1) При продолжительном введении малых доз Ртуть * в организм получается хроническое отравление Ртуть *, известное также под названием «конституционального меркуриализма». Последний иногда возникает вследствие медикаментозного лечения, но в огромном большинстве случаев вызывается каким-нибудь ртутным препаратом, брызгами или парами металлической Ртуть *, пылью ртутных амальгам и т. п. При этом безразлично, проникает ли Ртуть * в организм через дыхательные пути, через пищеварительный канал или через кожу, — известно только, что пагубнее всего действует введение парообразной Ртуть * в организм. В смысле быстроты и интенсивности, хроническое отравление Ртуть * представляет в отдельных случаях большое разнообразие, но, в общем, оно сопровождается настолько характерными симптомами, что его едва ли можно смешать с каким-нибудь другим отравлением. Куссмауль, более 30 лет тому назад основательно изучивший хроническое отравление Ртуть * у наводчиков ртутной амальгамы в зеркальных заведениях, различает 3 стадии отравления. Первая стадия — эретизм (Erethismus mercurialis), вторая — тремор (Tremor mercurialis) и третья меркуриальная дискразия, ртутное худосочие (Cachexia mercurialis). Среди рабочих, выкапывающих ртутьсодержащие руды, встречается (даже при наилучших санитарных условиях) от 1—2% хронических отравлений Ртуть *, а рабочие, занимающиеся выплавкой Ртуть *, дают уже до 8% интоксикаций. Очень часто хронические отравления Ртуть * встречаются среди таких рабочих, которые применяют Ртуть * или соединения ее для тех или иных технических целей. Сюда относятся: скорняки, медники, позолотчики и шапочники, употребляющие азотнокислую Ртуть * при окрашивании заячьей шерсти. Но чаще всего и сильнее всего «профессиональным» меркуриализмом страдают лица, изготовляющие термометры и барометры и, в особенности, наводчики ртутных амальгам на зеркальные стекла. Эти рабочие часто подвергаются крайне тяжелым формам хронического меркуриализма. Так, по Коберту, в Фюрте до введения надлежащих санитарных мероприятий и технических усовершенствований (т. е. до замены Ртуть * серебром) обыкновенно заболевало хроническим меркуриализмом около 80% всех рабочих. Изредка хронические отравления Ртуть * могут возникать и у частных лиц: плохие зеркала, случайное присутствие Ртуть * под полом и т. п. При хроническом отравлении Ртуть * обыкновенно имеют место и все те характерные симптомы, которые наблюдаются при остром отравлении, за исключением разве разъедающего (прижигающего) действия Ртуть * Что же касается вышеприведенных специфических симптомов хронического меркуриализма, то они, в сущности, выражаются в следующем и проявляются один за другим в нижеописанном порядке. Сначала замечается общий упадок сил: рабочие худеют, выглядят бледными, чувствуют большую усталость и часто страдают сильными головными болями, даже головокружением, нередко доходящим до обморока. Далее, бывают: шум в ушах, летучие боли в суставах, подергивание лицевых мышц; потом сон становится плохим и часто прерывается страшными сновидениями. Наконец, замечается, с одной стороны, чрезмерная раздражительность, а с другой — почти совершенно утрачивается всякая уверенность в собственных силах. Аппетит падает, во рту ощущается неприятный металлический привкус, появляется сильное слюнотечение и все описанные выше симптомы меркуриального стоматита. Если в этой стадии подвоз Ртуть * к организму прекращается и больного переводят в хорошие гигиенические условия, то, в благоприятных случаях, по прошествии 4—6 недель, может наступать выздоровление; в противном случае все признаки отравления усиливаются в значительной степени и могут привести даже к смерти, хотя последняя, в стадии эретизма, наступает чаще всего вследствие заболевания туберкулезом. Для этой стадии характерны еще так называемые «Psellismus mercurialis» (заключающийся в парезе голосовых связок и обусловленной им своеобразной речи), а также и «Epilepsia mercurialis», которую констатируют тогда, когда страдающие хроническим меркуриализмом (вследствие частых и сильных головокружений) очень часто падают. В различных случаях преобладают то одни, то другие из описанных симптомов.
В стадии, известной под названием » Tremor mercurialis», главными симптомами являются разнообразные, более или менее сильные расстройства мускульной системы. Эта стадия лишь очень редко наблюдается в начале меркуриализма; обыкновенно она следует за стадией эретизма. Дрожание, которое сначала замечается лишь в мышцах, подчиненных воле, и то только в слабой степени, все более и более усиливается и распространяется на всю мышечную систему; больные не в состоянии ходить, кушать, одеваться. Бывают припадки, напоминающие пляску св. Витта. В тяжелых случаях конвульсии бывают настолько сильными, что больного выбрасывает из постели и он едва может быть удерживаем несколькими лицами. Расстройства психики ясно выражены и сказываются, прежде всего, в чрезвычайной подавленности и упадке духа (Hypochondria mercurialis). Страшный упадок сил и заболевания в легких сильно напоминают туберкулез. Выздоровление (даже при очень целесообразном пользовании и уходе) наступает лишь очень медленно и часто бывает неполным: некоторые симптомы остаются на многие годы, иногда на всю жизнь. Только в исключительных, очень тяжелых случаях, Tremor mercurialis прямо ведет к смерти. В таких случаях под конец появляется паралич мочевого пузыря и прямой кишки, а сильные ночные поты и частые поносы быстро ускоряют роковую развязку. У тех рабочих, которые переносили уже несколько раз сравнительно легкие формы вышеописанных стадий меркуриализма, со временем возникает очень характерная, своеобразная картина общего упадка сил, известная под названием «меркуриальной кахексии». Такие рабочие обыкновенно страдают стоматитом, ангиной, фарингитами. Слизистая оболочка рта утолщена, кое-где сморщена и отличается медно-красным цветом, замечается большее или меньшее слюнотечение, зубы шатаются и нередко во рту образуются язвы. При этой форме хронического меркуриализма дрожание почти всегда наблюдается, и оно очень усиливается во время аффекта. Чрезмерная раздражительность, пугливость, головные боли, плохой сон, ночные поты бывают очень часто. Если пищеварение идет сравнительно хорошо, то несчастные больные лишь очень медленно погибают, но в тех случаях, когда существует предрасположение к туберкулезу, роковая развязка наступает очень скоро, ибо только что описанная форма хронического меркуриализма замечательно легко переходит в скоротечную чахотку.
Общее состояние здоровья и форма, в которой Ртуть * поступает в организм, имеют очень важное значение при возникновении как острых, так и, в особенности, хронических отравлений Ртуть * Одинаковые приемы Ртуть * на разных лиц действуют далеко не одинаково. Сулема и большинство других препаратов Ртуть *, говоря вообще, дают картину отравления, в которой преобладают расстройства со стороны кишечника, при отравлениях же металлической Ртуть * (ее парами и т. п.) на первом плане стоят расстройства со стороны центральной нервной системы. Те крайне тяжелые картины хронического меркуриализма, которые были описаны выше, чаще всего возникают вследствие поступления в организм ртутных паров (или ртутной пыли). При этом пары Ртуть * в дыхательных путях сгущаются, а образовавшиеся мельчайшие капельки потом так или иначе окисляются, изменяются, растворяются. Как известно, Ртуть * уже при обыкновенной температуре испаряется. Нижеприведенная таблица, показывающая плотность ртутных паров при различных температурах и вычисленные по ней количества Ртуть *, содержащиеся в воздухе, насыщенном ртутными парами, дает некоторое представление о количестве Ртуть *, могущей находиться в воздухе. Таблица составлена по новейшим данным Гагена и Герца («Wiedemanns Annalen», 16 и 17).