Жидкость в матке что это такое после менопаузы
Патологии эндометрия, полости матки и цервикального канала
1. Паталогии эндометрия
Полость матки выстлана эндометрием – пронизанной кровеносными сосудами слизистой оболочкой (мукозный слой), ткань которой постоянно меняется и обновляется в зависимости от фазы менструального цикла.
Природное предназначение эндометрия – обеспечить надежное прикрепление и кровоснабжение (питание) оплодотворенной яйцеклетки. В эндометрии, как и в любом другом структурно сложном образовании живого организма, обнаруживаются многочисленные заболевания, функциональные расстройства и аномалии развития. К наиболее распространенным относятся следующие.
2. Гиперплазия и полипы
Гиперплазия
Увеличение, разрастание эндометрия, зачастую неравномерное, очаговое, полипообразное, железисто-кистовое и т.д. Согласно статистическим данным, гиперплазия эндометрия наблюдается примерно у 40% всех гинекологических пациенток, причем частота встречаемости не зависит от возраста. Основными этиопатогенетическими факторами считаются эндокринные нарушения, инфекционные заболевания, генетические сбои; однако, пусковые механизмы остаются неясными. Как правило, больные жалуются на патологически обильные менструации, выделения или маточные кровотечения, не связанные с циклом. Основными диагностическими методами являются УЗИ (трансвагинальный вариант наиболее информативен), гистероскопия (при необходимости отбирается материал для гистологического исследования). Терапия гиперплазии эндометрия включает гормональные препараты и/или малоинвазивное вмешательство: хирургическую гистероскопию, аблацию, гистерорезектоскопию.
Полипы
Очаговая доброкачественная пролиферация (разрастание) клеток эндометрия матки и/или цервикального канала (участка между маткой и влагалищем). Обнаруживаются более чем у половины пациенток после менопаузы; проявляются, в основном, кровянистыми выделениями. К главным причинам образования полипов относят неоднократные и неполные выскабливания. Различают несколько видов полипов (аденоматозные, железистые и пр.). Диагностика и лечение (удаление) полипов осуществляется, как правило, гистероскопическим методом.
3. Перегородка полости матки
4. Синехии и серозометра
Синехии
Внутриматочные синехии (спайки, сращения – синдром Ашермана) могут быть обусловлены рядом причин: травмы (в т.ч. хирургические), инфекции, нарушения нейровисцеральной регуляции. По охвату внутриматочного пространства выделяют три степени синехий. Основным клиническим симптомом является неспособность забеременеть либо выносить беременность. Диагностируется аппаратными методами. Единственным лечением является хирургическая коррекция (в настоящее время подавляющее большинство вмешательств производится малоинвазивными методами).
Серозометра
Скопление серозной жидкости (т.е. секрета слизистой оболочки) в полости матки. Серозометра не является самостоятельным диагнозом – это всегда симптом иного заболевания или состояния (в частности, послеродовое скопление носит название лохиометра, наличие жидкой крови – гематометра). Часто встречается в раннем климактерическом периоде на фоне гормональной перестройки. Провоцирующими факторами считают также вредные привычки и гиподинамический образ жизни. Проявляется ноющей болью, при большом объеме жидкости – видимым увеличением живота, водянистыми выделениями, при инфицировании – симптоматикой острого воспаления. Терапией выбора обычно является расширение цервикального канала с отводом жидкости; обязательно проводится гистологическое исследование, при необходимости – бактериальный посев и лечение инфекции.
Заболевания 
Жалобы и симптомы 
Диагностика 
Наши цены 
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.
Cерозометра: термин врача ультразвуковой диагностики или диагноз гинеколога?
Волгоградский государственный медицинский университет
В настоящее время одной из наиболее часто выполняемых внутриматочных операций является гистероскопия, с помощью, которой возможны не только визуализация различных видов внутриматочной патологии, но и осуществление хирургических вмешательств и контроля за эффективностью лечения [1]. Вместе с тем, это инвазивная манипуляция, имеющая определенный риск инфекционных осложнений, которые по данным разных авторов составляют от 0,7 до 12% (Баев О.Р., Стрижаков А.Н., Давыдов А.И. 2010) [2,3]. Вследствие возможности риска развития осложнений в послеоперационном периоде, необходимо иметь чёткие показания к выполнению данной операции [4]. Тем не менее, на современном этапе развития медицины неинвазивные методы диагностики внутриматочной патологии, такое как УЗИ органов малого таза, являются одним из начальных этапов постановки диагноза, а также определяющим фактором для определений показаний к выполнению гистероскопии [5,6]. Особенно важен метод УЗИ гениталий в период постменопаузы. Период постменопаузы является наиболее опасным в плане развития онкологических процессов гениталий, диагностика которых имеет большое практическое значение [7,8]. Негативные последствия имеют как несвоевременно проведенная диагностика, так и гипердиагностика, которая ведет к необоснованным внутриматочным вмешательствам.
Последние годы все чаще гинекологи встречаются с диагнозом «серозометра», на основании чего пациентка направляется в стационар для выполнения гистероскопии. Анализ литературы демонстрирует противоречивые мнения, как в отношении природы появления жидкости в полости матки, так и о прогностической значимости этого явления. Ряд авторов указывают на повышение риска злокачественных процессов в малом тазу при обнаружении жидкости в полости матки [9]. Некоторые исследователи, связывают скопление внутриматочной жидкости с доброкачественной внутриматочной патологией [10]. Другие исследователи расценивают появление жидкости в полости матки в период постменопаузы как вариант нормы, связывая ее с окклюзией цервикального канала [10].
Цель исследования: оценить прогностическую значимость определения при ультразвуковом исследовании жидкости в полости матки в постменопаузальном периоде.
Материалы и методы исследования. Для достижения поставленной цели были обследованы 27 пациенток, направленных для выполнения гистероскопии в плановом порядке с диагнозом «Серозометра» в гинекологические отделения ВОКБ №1 и КБСМП №7 г. Волгограда за период 2013-2015 гг. Оценивались факторы риска развития заболеваний гениталий с учетом длительности менопаузы, технические особенности гистероскопии в постменопаузальном возрасте, риск осложнений после манипуляции, фармакологическая нагрузка. Всем пациенткам после выполнения гистероскопий проводилось гистологическое исследование полученного материала.
Результаты исследования. Результаты исследования свидетельствуют, что возраст больных колебался от 53 до 73 лет и в среднем составил 62,8±1,8. Все пациентки человек были в периоде менопаузы. Причём длительность менопаузы составила от 2 до 19 лет в среднем 11,9±2,7. Таким образом, среди пациенток, которым выставлялся диагноз «серозометра» и выполнялась гистероскопия не было ни одной женщины репродуктивного или перименопаузального возраста. Минимальный срок менопаузы составил 2 года.
Подавляющее большинство обследованных (58,8%) были пенсионерами. В тоже время, обращает на себя внимание, что несмотря на средний возраст обследованных более шестидесяти лет более 40% из них продолжают работать.
Анализ менструальной функции обследованных пациенток в репродуктивном возрасте показал, что ее нарушения были выявлены у 52,9%. Возможно, одним из факторов нарушений менструального цикла была высокая частота прерываний беременности по желанию у пациенток исследуемой группы, 82,4% пациенток имели в анамнезе медицинские аборты. Причём у каждой третьей (30%) пациентки было более 2-х абортов. Среднее количество абортов на одну пациентку составило 2,1±0,3 (от 1 до 10). Количество родов в анамнезе у пациенток колебалось от 1 до 4 и в среднем составило 1,8±0,2.
Самопроизвольное прерывание беременности, в том числе замершие, имели в анамнезе 23,52% обследуемых женщин. Данные по соотношению родов, прервавшихся беременностей и медицинских абортов представлены на рис. 1.
Рис. 1. Соотношение доли родов, абортов и самопроизвольных выкидышей у пациенток исследуемой группы.
Всем пациенткам диагноз серозометра был поставлен на основании данных УЗИ малого таза, которое проводилось с профилактической целью. Данный диагноз был выявлен впервые, при этом какие-либо жалобы у пациенток отсутствовали. У большинства (81,8%) пациенток гистероскопия выполнялась впервые, повторное внутриматочное вмешательство в виде гистероскопии было у 18,2%.
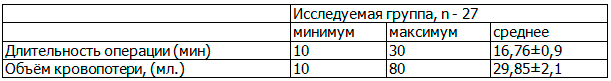
Данные по продолжительности операции и объеме кровопотери в исследуемой группе приведены в табл. 1.
Таблица 1. Продолжительность гистероскопии и объём кровопотери
Учитывая возраст и длительность менопаузы более 10 лет у большинства пациенток выполнение гистероскопии было сопряжено с определенными техническими трудностями в связи с инволютивными процессами в матке. Так, перфорация матки является крайне редким осложнением при выполнении гистероскопии в репродуктивном возрасте, однако у одной пациентки (3,70%) данной исследуемой группы операция была осложнена перфорацией матки.
По данным историй болезней у 88,2% пациенток послеоперационный период протекал без осложнений. Длительность пребывания в стационаре была от 2 до 7 дней, средний койко-день составил 4,18±0,1 койко-дня.
Результаты гистологических исследований представлены в табл. 2.
Таблица 2. Результаты гистологического исследования у пациенток с диагнозом «серозометра»
Данные гистологического исследования подтвердили диагноз полип, из двух пациенток с гиперплазией у 1 пациентки диагностирована атрофия эндометрия, а у второй пациентки с гиперплазией эндометрия выявлена аденокарцинома. Ни у одной из пациенток с изолированной серозометрой злокачественного процесса эндометрия не было выявлено.
Диагноза «Серозометры» по международной классификации болезней МКБ-10 не существует. Результаты проведенного исследования свидетельствуют,что большинство женщин с серозометрой не имеют никаких жалоб. Все они поступали в стационар для выполнения гистероскопии с раздельным диагностическим выскабливанием только на основании данных УЗИ малого таза (жидкость в полости матки). Данные гистологического исследования указывают на низкую диагностическую ценность ультразвуковых признаков серозометры для своевременного выявления патологии эндометрия в постменопаузальном периоде. Ни в одном случае изолированной серозометры заболеваний выявлено не было. В тоже время, выполнение внутриматочного вмешательства на фоне атрофичного эндометрия следует признать нецелесообразным, так как несет ряд негативных последствий для пациентки. Кроме того, это сопряжено с неоправданной госпитализацией и необоснованной фармакологической нагрузкой.
Диагностика патологии эндометрия в постменопаузе: применение 2D и 3D технологий
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Введение
Трехмерное УЗИ в последние годы чаще используется в работе как врачей ультразвуковой диагностики, так и врачей акушеров-гинекологов, несмотря на то, что остается ряд дискуссионных вопросов, роль которых в диагностике гинекологической патологии еще предстоит определить 1.
В большей мере освещены вопросы патологии эндометрия в постменопаузальном возрасте. Так, S. Kupesic и соавт. определили, что трехмерная энергетическая допплерография может использоваться для раннего выявления рака эндометрия, особенно у женщин в постменопаузальном возрасте без клинической симптоматики заболевания, а также для уточнения инвазии опухоли в миометрий [4].
При обследовании пациенток постменопаузального возраста с аденокарциномой, гиперплазией, атрофией эндометрия и субмукозной миомой матки, J.L. Alcazar и R. Galv n установили, что 3D энергетическая допплерография может быть полезна в диагностике рака эндометрия, так как у этих пациенток статистически значимо повышены индекс васкуляризации (ИВ) и васкуляризационно-потоковый индекс (ВПИ) эндометрия в сравнении с пациентками других групп [5].
В свою очередь R. Galv n и соавт. при изучении стадийности эндометриального рака у пациенток в постменопаузе определили, что ИВ в малигнизированном эндометрии коррелирует с некоторыми гистологическими характеристиками опухоли [6].
G. Opolskiene и соавт. определили, что у женщин с кровотечением в постменопаузальном возрасте ИВ и ВПИ не отличались как при доброкачественных, так и при злокачественных изменениях в эндометрии [7]. К противоположным выводам пришли A.K. Makled и соавт., которые в своих исследованиях доказали, что значение ИВ является достоверным диагностическим критерием рака эндометрия в постменопаузе [8].
Как видно из изложенного выше, в последние годы увеличивается интерес к проблемам постменопаузы, что связано в первую очередь с тенденцией населения развитых стран к старению. Поэтому так актуальны вопросы патологии эндометрия в постменопаузальном периоде [9].
Кроме того, заболеваемость раком эндометрия увеличилась во всех экономически развитых странах [10, 11].
В постменопаузальном возрасте у ряда пациенток происходит полная облитерация цервикального канала, и показанием для проведения раздельного диагностического выскабливания становится расширение полости матки за счет жидкости, выявленное при УЗИ в 2D режиме. Между тем у врачей ультразвуковой диагностики нет четких критериев, позволяющих исключить злокачественную трансформацию эндометрия у таких пациенток. Следовательно, поиск путей улучшения диагностики патологических состояний эндометрия у пациенток в постменопаузальном возрасте с использованием трехмерной эхографии с опцией энергетического допплера побудил нас к исследованиям в этой области.
Целью настоящего исследования стало проведение анализа совпадений результатов рутинного двухмерного трансвагинального УЗИ у пациенток постменопаузального возраста с окончательным патоморфологическим заключением исследования биоптата эндометрия, определение возможности использования трехмерной энергетической допплерографии у пациенток с облитерацией цервикального канала в постменопаузе.
Материал и методы
Для достижения поставленной цели нами ретроспективно оценено 50 историй болезни женщин постменопаузального возраста, госпитализированных в гинекологическое отделение для проведения раздельного диагностического выскабливания и гистероскопии в плановом порядке. Показанием для госпитализации явились данные рутинного трансвагинального УЗИ (ультразвуковое заключение: патология эндометрия). Данные ультразвуковых заключений, послужившие поводом для госпитализации в стационар, были оценены ретроспективно и сопоставлены с данными гистологических заключений после раздельного диагностического выскабливания.
Пациентке с атрезией цервикального канала и скоплением жидкости в полости матки проведено трансвагинальное сканирование с использованием объемного ректовагинального датчика 4-9 МГц на стационарном ультразвуковом сканере Accuvix-V10 компании Samsung Medison в режиме 3D реконструкции с опцией энергетического допплера по методике И.А. Озерской [12], с последующим автоматическим получением ИВ, индекса потока (кровотока) (ИП), ВПИ реконструированной матки в программе Virtual Organ Computeraided AnaLysis (VOCAL).
Статистическая обработка данных осуществлялась с применением прикладного программного пакета «Statistica 6.0», адаптированного для медико-биологических исследований. Производилось вычисление относительных частот признака (%) в группе.
Результаты и обсуждение
Анализ приведенных результатов побуждает к поиску дополнительных ультразвуковых методик, которые можно применить в постменопаузальном возрасте, особенно в ситуации с атрезией цервикального канала и последующим скоплением жидкости в полости матки. Именно это состояние занимает высокий удельный вес в постменопаузальном возрасте и, не представляя трудностей в диагностике при рутинном трансвагинальном УЗИ, ведет к проведению раздельного диагностического выскабливания.
Мы попытались применить у такой категории пациенток 3D энергетическую допплерографию и приводим клинический пример.
Пациентка К., 60 лет, поступила в гинекологическое отделение для проведения раздельного диагностического выскабливания под контролем гистероскопии с диагнозом: подозрение на рак тела матки. Данные трансвагинального УЗИ, проведенного амбулаторно: тело матки нормальных размеров, контур матки ровный, миометрий однородный, полость матки расширена до 6 мм, заполнена анэхогенным содержимым. Яичники обычных размеров и эхоструктуры, свободная жидкость в позадиматочном пространстве не визуализируется. Ультразвуковое заключение: серозометра.
Анамнестические данные: постменопауз 5 лет, из гинекологических заболеваний в анамнезе пациентка отмечает эктопию шейки матки, по поводу чего была произведена диатермоэлектрокоагуляция шейки матки. В анамнезе 2 родов, в срок, без осложнений и один медицинский аборт в срок 8-9 нед, без осложнений.
До проведения раздельного диагностического выскабливания, на стационарном ультразвуковом сканере Accuvix-V10 компании Samsung Medison после опорожнения мочевого пузыря мы провели трансвагинальное сканирование с использованием объемного ректовагинального датчика 4-9 МГц в режиме 3D реконструкции с опцией энергетического допплера и получили объемное изображение (рис. 1).
Рис. 1. Объемное изображение в режиме энергетического допплера.
Влагалище и шейка матки в постменопаузе. Возможности терапии.
Проф. д.м.н. В.Н. Прилепская, руководитель научно-поликлинического отдела.
Научный центр акушерства, гинекологии и перинатологии РАМН
Проблема постменопаузы приобрела в последние годы особое значение в связи со значительным увеличением продолжительности жизни женщин, что особенно четко прослеживается в развитых странах. Однако тот период жизни, за счет которого увеличивается эта продолжительность, характеризуется возрастными инволютивными изменениями, нередко выходящими за рамки физиологических процессов старения, развитием ряда патологических симптомов, синдромов и заболеваний.
На фоне дефицита половых гормонов, преимущественно эстрогенов, у каждой второй женщины возникают климактерические нарушения, которые по времени их возникновения и клиническим особенностям условно принято разделять на 3 группы.
Симптомы урогенитальных нарушений возникают приблизительно через 5 лет и более после прекращения менструаций и в дальнейшем прогрессируют, приводя к функциональным и анатомическим изменениям не только влагалища, уретры, мочевого пузыря, мочеточников, но и патологическим процессам шейки матки.
Дефицит эстрогенов закономерно вызывает нарушение пролиферативных процессов влагалищного эпителия, подавление митотической активности клеток, в первую очередь базального и парабазального слоев, изменение чувствительности рецепторного аппарата. Как известно, специфическая регуляция влагалища определяется рецепторами к эстрогенам, протеинами, альтернативными гормонами, клеточными элементами иммунокомпетентных клеток. По мере прогрессирования эстрогенного дефицита на фоне общих инволютивных изменений в организме происходит значительное изменение микроциноза влагалища.
Известно, что у женщин репродуктивного возраста в микроцинозе влагалища преобладают пероксин-продуцирующие лактобациллы, которые обеспечивают защитные свойства влагалища, конкурируя с патогенными микроорганизмами.
Путем расщепления гликогена, образующегося в эпителии влагалища благодаря наличию достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду в пределах колебания рН от 3, 8 до 4, 4.
Это в свою очередь приводит к подавлению роста патогенных и условно-патогенных бактерий. Наряду с присущими ей защитными свойствами влагалищная флора у женщин репродуктивного возраста обладает достаточно выраженной ферментативной, витаминообразующей, иммуностимулирующей и другими функциями, необходимыми для нормального функционирования экосистемы и ее защитного действия.
В период постменопаузы эти защитные свойства утрачиваются, слизистая оболочка влагалища истончается, легко изъязвляется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами. По мере прогрессирования дефицита эстрогенов, нарастают и атрофические изменения во влагалище, которые характеризуются:
— снижением кровотока и кровоснабжения;
— фрагментацией элластических и гиалинозом коллагеновых волокон;
— уменьшением содержания гликогена в клетках эпителия влагалища;
— снижением колонизации лактобацилл;
— значительным снижением количества молочной кислоты;
С увеличением продолжительности постменопаузы происходит резкое ощелачивание влагалищной среды, развитие дисбиотических и атрофических процессов.
Атрофические процессы, особенно выраженные в слизитой влагалища, захватывают и соединительнотканные и мышечные структуры влагалища, мышцы тазового дна, уретры, мочевого пузыря, что закономерно приводит как к анатомическим, так и функциональным нарушениям мочеполовой системы.
Многослойный плоский эпителий, покрывающий наружную поверхность влагалищной части шейки матки (экзоцервикс), претерпевает аналогичные изменения с прогрессирующими явлениями атрофии.
В виду этого наиболее частыми клиническими формами возрастной патологии влагалища и шейки матки в постменопаузе являются атрофические вагиниты (кольпиты) и цервициты.
Наиболее тяжелые формы атрофических изменений нижних отделов половых путей связаны с нарушением контроля мочеиспускания, требуют обследования не только гинеколога, но и уролога и подробно изложены в диссертации В. Е. Балан (1998) [1].
Клиническими проявлениями атрофических вагинитов и цервицитов являются весьма характерные жалобы на сухость, зуд, выделения из влагалища, носящие длительный, рецидивирующий и упорный характер, кровянистые выделения при физической нагрузке и половых контактах, при попытке произвести исследование в зеркалах; различные сексуальные нарушения, вплоть до невозможности половой близости.
Схематично динамику сексуальных нарушений можно представить следующим образом: вначале появляется сухость влагалища, снижение коитальной, а затем и сексуальной активности, снижение оргазма и возбуждения, диспареуния и впоследствии невозможность половых контактов.
Диагностика и дифференцированная диагностика возрастных изменений нижних отделов половых путей в первую очередь должна быть направлена на исключение онкологической, инфекционной и других патологий, которые могут как бы маскироваться возрастными изменениями.
Основными методами исследования, которые безусловно не исчерпывают весь арсенал методов и могут быть необходимы для обследования конкретной больной, являются:
— кольпоцитология (с определением КПИ или ИС мазков) ;
— Pap-smear-test (мазки-отпечатки с шейки матки);
— определение рН влагалищного содержимого.
Клиническому методу исследования должно отводится первостепенное значение, несмотря на наличие комплекса перечисленных дополнительных методик.
Важное значение имеют связь с возрастом больных, характерные клинические признаки в виде вульвитов, вагинитов, экзо- и эндоцервицитов, дистрофических процессов вульвы и влагалища. При этом необходимо помнить, что характерными особенностями клинического течения возрастных изменений нижнего отдела половых путей у женщин в постменопаузе является их длительное, рецидивирующее течение, сочетание с урологическими симптомами, отсутствие эффекта от антибактериальной и других видов терапии, не включающих применение эстрогенов в том или ином виде.
Особенностью клинического течения возрастной патологии является нередкое инфицирование истонченных и атрофических тканей.
В таком случае на первый план выступают симптомы того или иного инфекционного процесса (кандидоз, хламидиоз и т. д. ).
Однако, учитывая то, что беспорядочные половые связи у женщин в постменопаузе очень редки, редка и частота специфических процессов в половых органах.
Следует отметить, что основная ошибка в ведении этого контингента больных состоит в назначении длительной, немотивированной, бесконтрольной антибиотикотерапии, противовирусного и других видов лечения, приводящих к усугублению выраженности и извращенному характеру инволютивных изменений.
Клинические ошибки связаны также с необходимостью больных обращаться к врачам различных специальностей: акушеру-гинекологу, урологу, терапевту, дерматологу и, наконец, к психиатру.
В своей клинической практике мы встречали больных, которые в течение нескольких лет получали массивные дозы антибактериальной терапии по поводу атрофических вагинитов и цервицитов с неоднократной биопсией шейки матки, так как очаговые атрофические экзоцервициты трактовались как подозрение на предраковые процессы.
Трудно переоценить значимость кольпоскопии при оценке состояния шейки матки в постменопаузе.
Как правило, кольпоскопическая картина шейки матки в постменопаузе является достаточно характерной: многослойный плоский эпителий истончен, субэпителиальные сосуды стромы легко кровоточат при контакте и могут не сокращаться на пробу с раствором уксусной кислоты; стык многослойного плоского и цилиндрического эпителия находится на уровне наружного зева, определяется картина синильного диффузного или очагового экзоцервицита, проба Шиллера слабоположительная.
При кольпоцитологии в постменопаузальном периоде выявляются 5 основных типов влагалищных мазков:
Пролиферативный и промежуточные типы мазков могут редко встречаться в менопаузе или в начале постменопаузы, смешанный, атрофический или цитолитический тип наиболее часто встречающиеся типы мазков.
Чрезвычайно важным в отношении онкологической настороженности применительно к патологии шейки матки является Pap-smear-test, позволяющий с точностью до 95% выявить предраковые процессы шейки матки, не выявляемые с помощью других неинвазивных методик. Мазки-отпечатки с шейки матки по Папаникалау подразделяются на 5 основных классов.
При получении ответа цитолога о выявлении IV или V класса мазков следует тщательно обследовать больную для исключения признаков цервикальной неоплазии. Нередко это подозрение при повторной кольпоскопии исчезает после проведения противовоспалительного лечения. Если нет-показана прицельная биопсия шейки матки с последующим цитологическим исследованием биоптата.
Бактериоскопический и бактериологический методы позволяют выявить состояние микрофлоры влагалища, специфических и неспецифических возбудителей сопутствующей инфекции, дисбиотические процессы влагалища.
По данным А.С. Анкирской (1995) [2], у женщин в постменопаузе атрофические процессы нередко осложняются бактериальным вагинозом, одним из признаков которого является наличие «ключевых» клеток во влагалищном мазке.
Дополнительным методом диагностики состояния микробиоценоза является определение рН влагалищного содержимого с помощью бумажных индикаторов или биохимических методов.
Установлено, что не только уровень КПИ, но и уровень рН могут быть использованы для косвенного суждения о степени эстрогенной недостаточности. Если у здоровых женщин рН колеблется от 3,5 до 5,5, то в период постменопаузы от 5,5 до 7, при этом рН > 6 соответствует значительной выраженности атрофических процессов (Муравеева В.В., 1997) [3].
Безусловно, одним из первых методов обследования пациенток является УЗИ гениталий, позволяющее исключить органическую патологию половых органов.
Таким образом, только комплексное исследование позволяет оценить состояние нижнего отдела половых путей и принять решение об использовании заместительной гормонотерапии (ЗГТ).
Начатая в этот период своевременная терапия ранневременных климактерических расстройств позволяет значительно уменьшить выраженность и отсрочить появление средневременных атрофических нарушений.
Основными задачами ЗГТ у данного контингента женщин являются :
1) ликвидация атрофических изменений, восстановление нормальной микрофлоры влагалища, кровообращения, тонуса влагалища и мочевыводящих путей;
2) предотвращение инфицирования влагалища и шейки матки, что осуществляется с помощью эстрогенов, входящих в состав различных препаратов как системного, так и местного действия.
Принципы выбора того или иного метода ЗГТ у женщин с атрофическими процессами в постменопаузе, особенно при нарушении контроля мочеиспускания детально сформулированы В.Е. Балан, В.П. Сметник в ряде статей [4].
При изолированных, не сочетающихся с другими симптомами менопаузы, урогенитальных расстройствах и наличии противопоказаний к системной ЗГТ у женщин старше 65 лет предпочтение следует отдавать местной терапии препаратами, содержащими эстриол, не вызывающими каких-либо осложнений в отличие от системной ЗГТ (климен, прогинова, циклопрогинова, ливиал, дивина, дивитрен и многие другие), практически безопасными и не имеющими абсолютных противопоказаний.
Применительно к инволютивной патологии вульвы, влагалища и шейки матки местную терапию мы считаем методом выбора.
В нашей стране, так же как и за рубежом, предпочтение отдается препаратам эстриола, входящего в состав таблеток, кремов, мазей, свечей под названием «Овестин».
Менструальноподобная реакция при его применении в отличие от других препаратов возникает чрезвычайно редко.
Вместе с тем под влиянием уже небольших доз препарата активизируются пролиферативные процессы влагалищного и шеечного эпителия, нормализуется микрофлора влагалища, повышается тонус сосудов, мышц, улучшается кровообращение нижних отделов половых путей, в связи с чем повышается резистентность влагалища и шейки матки к инфекционным воздействиям.
Мы имеем опыт применения овестина у 283 больных в различных лекарственных формах на протяжении от 1 года до 5 лет [5]. Ретроспективный анализ показал его высокую клиническую эффективность также и в качестве реабилитирующего средства после лечения специфических инфекционных процессов у женщин в постменопаузе. Существуют различные схемы применения препарата, мы использовали одну из следующих:
После контрольного микробиологического исследования, исключающего наличие патогенной микрофлоры, показано использование овестина по той же схеме с клиническим и лабораторным контролем с применением перечисленных ранее дополнительных методов исследования, позволяющих судить о степени восполнения эстрогенного дефицита.
В настоящем сообщении мы хотели коротко остановиться на клинике, диагностике некоторых форм возрастных изменений в репродуктивной системе женщины и возможностях их коррекции с помощью методов щадящей терапии, чрезвычайно удобной для применения.
Однако изложенный кратко материал безусловно не охватывает все аспекты этой сложной и многогранной проблемы.
Другие публикации по материалам семинара дополнят и расширят настоящее сообщение.
Опубликовано с разрешения администрации Русского Медицинского Журнала.