Даи при бронхиальной астме что это
Даи при бронхиальной астме что это
ГБОУ ДПО Российская медицинская академия последипломного образования, кафедра клинической аллергологии, Москва
Ингаляционная терапия (аэрозольтерапия) – метод лечения, заключающийся во введении аэрозолей лекарственных средств в дыхательные пути.
Согласно клиническим рекомендациям, основной путь введения лекарственных средств (ЛС) при бронхиальной астме (БА) и хронической обструктивной болезни легких (ХОБЛ) – ингаляционный [1, 2]. Ингаляционный путь введения лекарственных препаратов является основным при БА и ХОБЛ, поскольку создает высокие концентрации препарата в нижних дыхательных путях и позволяет сводить к минимуму системные побочные эффекты. Но при этом ингаляционный путь доставки является одним из самых сложных, т.к. неправильная техника ингаляции не только не обеспечит поступления адекватных доз препарата в легкие, но и может вызвать местные побочные эффекты за счет депозиции препарата в ротоглотке и трахее. Поэтому трудно не согласиться с утверждением J.B. Fink [3], что эффективность ингаляционной терапии больных хроническими заболеваниями легких на 10% определяется самим лекарственным препаратом, а на 90% – правильной техникой ингаляции.
Залогом успешной ингаляционной терапии служит не только правильный выбор препарата, но и такие факторы, как обучение пациента ингаляционной технике, выбор оптимальной системы доставки ЛС [4]. Идеальное устройство доставки предполагает достаточно высокую депозицию препарата в легких, надежность и простоту в использовании, возможность применения в любом возрасте и при тяжелых стадиях заболевания [5].
Преимущества и недостатки ингаляционной терапии
Преимущества ингаляционной терапии:
Наряду с преимуществами имеются и определенные недостатки:
Правовой контроль применения ингаляционных устройств
В Европе ингаляционные устройства для аэрозольной терапии контролируются Европейским лекарственным агентством (ЕМА – European Medicines Agency,). В США контролирующим органом является Агентство по контролю пищевых продуктов и лекарственных препаратов (FDA – Food and Drug Administration).
Рекомендации Европейского респираторного общества (ERS – European Respiratory Society) и Международного общества по использованию аэрозолей в медицине (ISAM – International Society for Aerosols in Medicine) ERS/ISAM [6]
Врач, назначающий лечение, обязан:
Что должен знать специалист, назначающий аэрозольную терапию
Для ингаляций используют ЛС, разрешенные для применения в этих целях регуляторными органами.
Листок-вкладыш к препарату должен допускать или рекомендовать ингаляционный путь введения.
Независимо от личного опыта врача и рекомендаций т.н. старой школы в настоящее время для ингаляций не рекомендованы водорастворимые глюкокортикостероиды (преднизолон, гидрокортизон), аминофиллин, антигистаминные препараты, многие антибактериальные препараты.
Создание произвольных смесей препаратов для ингаляций, не оговоренных в листке-вкладыше или стандартах оказания медицинской помощи, недопустимо.
Для ингаляционной терапии используют следующие группы ЛС [6]:
Традиционные препараты для аэрозольной доставки:
Классификация ингаляционных устройств
Ингаляционные устройства можно разделить на пять групп [6]. Все типы ингаляционных устройств приведены в табл. 1.
Дозированные аэрозольные ингаляторы
ДАИ были введены в практику в 1956 г. как первые портативные многодозовые устройства для ингаляции бронходилататоров, и по сей день они остаются наиболее распространенными и часто назначаемыми [7]. При использовании ДАИ около 30–40% всех частиц аэрозоля, генерируемого ДАИ, находятся в пределах респирабельных размеров (
Современные ингаляционные устройства, применяемые в лечении бронхиальной астмы
Адекватное лечение бронхиальной астмы (БА) – одна из наиболее острых проблем здравоохранения в мире. Несмотря на появление новых препаратов и постоянное совершенствование лечебных стратегий и профилактических мероприятий, ряд вопросов остается нерешенным. Всемирная организация здравоохранения приводит неутешительные данные:
В последние годы представления о том, какой должна быть терапия БА, существенно изменились. Сегодня ее целью является не облегчение симптомов, а эффективный контроль над заболеванием и улучшение качества жизни пациентов [2, 3]. Контроль БА – это непрерывный цикл, который включает в себя оценку тяжести заболевания при постановке диагноза, назначение терапии, направленной на достижение контроля, и ее постоянную коррекцию в соответствии с критериями контроля [3–5].
Согласно клиническим рекомендациям, основной путь введения лекарственных средств (ЛС) при БА – ингаляционный [2, 3]. Главное преимущество ингаляционной терапии заключается в возможности доставки ЛС непосредственно в дыхательные пути. При этом быстро достигается положительный эффект, а также высокая местная концентрация препарата и низкая системная концентрация, что и определяет высокий терапевтический индекс (отношение желаемых и нежелательных эффектов) и безопасность ЛС [6].
Залогом успешной ингаляционной терапии служит не только правильный выбор препарата, но и такие факторы, как обучение пациента ингаляционной технике, выбор оптимальной системы доставки ЛС [7]. Идеальное устройство доставки предполагает достаточно высокую депозицию (оседание) препарата в легких, надежность и простоту в использовании, возможность применения в любом возрасте и при тяжелых стадиях заболевания [8].
Краткий экскурс в историю
Ингаляционная терапия (аэрозольтерапия) – метод лечения, заключающийся во введении аэрозолей ЛС в дыхательные пути.
В древней Индии, Египте, Греции, Риме, Китае применялись пары горячих минеральных вод, ароматических веществ, курение лекарственных трав (например, Atropa belladonna).
В 1859 г. J. Sales-Girons создал первый аэрозоль-генератор (вода под давлением проходила через мелкую сетку) и первый портативный ингалятор для паров смолы и антисептиков.
В 1876 г. система ингаляционной доставки была предложена для больных туберкулезом. W. Seegers разработал небулайзер (от лат. nebula – туман или облако), основанный на испарении лекарств при нагревании.
В 1935 г. в США появился небулайзер, который по конструкции близок к современному. Его использовали для лечения больных с хронической обструктивной болезнью легких (ХОБЛ).
Важной вехой в истории ингаляционных средств доставки стал день, когда 13-летняя девочка, страдавшая БА, сказала отцу – президенту фармацевтической компании River Laboratories, что лекарства для лечения БА надо заправлять в такие же баллончики, которые используются для лака для волос. В 1956 г. группа под руководством Charles Thiel предложила первый дозированный аэрозольный ингалятор (ДАИ), без которого сегодня представить терапию БА невозможно [9]. После этого фармацевтическими компаниями было разработано множество ингаляторов, поскольку стало очевидным, что совершенное устройство – ключевой фактор успеха лечения.
Преимущества и недостатки ингаляционной терапии
Преимуществами ингаляционной терапии являются:
Наряду с преимуществами имеются и определенные недостатки:
Задачи рабочей группы ERS/ISAM
Европейским респираторным обществом (European Respiratory Society, ERS) и Международным обществом по использованию аэрозолей в медицине (International Society for Aerosols in Medicine, ISAM) была создана объединенная рабочая группа экспертов разных специальностей, занимающихся фармакологическими аэрозолями. Эксперты должны были подготовить четкие клинические рекомендации, позволяющие врачу-пульмонологу выбрать тип устройства для аэрозольной терапии, наиболее подходящий конкретному пациенту для применения амбулаторно и в стационаре, а также описать технику ингаляции при применении каждого вида устройства.
Была сформирована рабочая группа из 11 участников с опытом применения аэрозольной терапии в пульмонологии. Весь объем информации был разделен на темы. Каждая тема освещалась как минимум двумя экспертами. Все участники подбирали литературу по собственной методике. Отбор литературы заканчивался в декабре 2009 г. Предварительную версию каждого раздела рассылали участникам рабочей группы на совещаниях в рамках конгресса ISAM 2009 г. и конгресса ERS 2009 г., а также на совещании рабочей группы в рамках Школы ERS по аэрозольной медицине в 2009 г. Во время встреч участники рабочей группы обсуждали предлагаемые рекомендации. Каждая рекомендация принималась по соглашению большинства участников. Если мнения расходились, рекомендации пересматривали до достижения консенсуса. Рабочая группа пыталась создать согласительный документ, который можно было бы использовать во всех странах независимо от вида лекарственных препаратов и ингаляционных устройств [10].
Правовой контроль применения ингаляционных устройств
В Европе ингаляционные устройства для аэрозольной терапии контролируются Европейским лекарственным агентством (European Medicines Agency, ЕМА). В США контролирующим органом является Управление по контролю качества пищевых продуктов и лекарственных препаратов (US Food and Drug Administration, FDA).
Врач, назначающий лечение,
обязан:
1. Знать типы устройств, которые доступны для доставки конкретных препаратов и классов препаратов.
2. Оценить преимущества и недостатки каждого устройства.
3. Выбрать устройства, которые пациент будет эффективно использовать.
4. Выбрать устройства, одобренные законодательными органами.
5. Научить пациентов правильному маневру вдоха, соответствующему назначенному устройству.
6. Регулярно проверять технику ингаляций, применяемую пациентом.
7. Во время каждого визита опрашивать пациента о соблюдении режима назначенной терапии.
8. Не переводить больного на другое устройство без согласования с пациентом и без последовательного обучения технике использования нового устройства доставки [10].
Что должен знать специалист, назначающий аэрозольную терапию
Для ингаляций используют ЛС, которые разрешены для применения в этих целях регуляторными органами.
Листок-вкладыш к препарату должен допускать или рекомендовать ингаляционный путь введения.
Независимо от личного опыта врача и рекомендаций так называемой старой школы в настоящее время для ингаляций не рекомендованы водорастворимые глюкокортикостероиды (преднизолон, гидрокортизон), Эуфиллин, антигистаминные препараты, многие антибактериальные препараты.
Создание произвольных смесей препаратов для ингаляций, не оговоренное в листке-вкладыше или стандартах оказания медицинской помощи, недопустимо.
Для ингаляционной терапии используют следующие группы ЛС [10].
В программе «Глобальная инициатива по лечению и профилактике бронхиальной астмы» (Global Initiative for Asthma, GINA) и в рекомендациях Британского торакального общества (British Thoracic Society, BTS) содержится требование: при назначении ингаляционной терапии следует оценить умение пациента пользоваться ингаляционной техникой и соблюдение им режима дозировки [11].
В действительности 76% больных, использующих ДАИ, и 49–54% пациентов, применяющих ДАИ, активируемые вдохом (ДАИ-АВ), допускают во время процедуры как минимум одну ошибку [12]. Порошковые ингаляторы (ПИ) применяют неправильно от 4 до 94% больных, а 25% никогда не обучались их корректному использованию. Распространенные ошибки при применении ПИ – недостаточно глубокий выдох перед ингаляцией (не достигающий функциональной остаточной емкости) и недостаточно мощный и глубокий вдох [13]. При использовании ДАИ обычно возникают проблемы, связанные с неполной координацией вдоха и активацией ингалятора [14].
Перечислим параметры, характеризующие возможности систем доставки:
Один из главных параметров эффективности ингаляционного устройства – степень депонирования ЛС в дыхательных путях, которая зависит от системы ингаляционной доставки и колеблется от 4 до 60% отмеренной дозы [15].
На депонирование аэрозоля в дыхательных путях влияют следующие факторы:
Частицы размером более 5 мкм c максимальной долей вероятности будут скапливаться в ротоглотке и проглатываться [16]. В какой-то степени это результат инерции, связанной с массой частицы: способность частиц перемещаться со струей воздуха уменьшается, когда последняя меняет направление от ротоглотки к нижним дыхательным путям. Важно минимизировать депонирование ИГКС в ротоглотке, чтобы снизить риск местных побочных эффектов, таких как охриплость голоса и кандидоз ротовой полости.
Частицы размером 4–5 мкм депонируются в первую очередь в бронхах, а более мелкие остаются в воздушной струе и достигают периферических отделов дыхательных путей и альвеол. На периферии легких скорость воздушного потока меньше, и частицы депонируются преимущественно за счет осаждения (седиментации), когда «выпадают» под воздействием гравитации. Большинство частиц размером 0,1–1 мкм перемещаются по принципу броуновского движения и депонируются после столкновения со стенкой дыхательных путей. Чем больше время пребывания аэрозоля в мелких периферических дыхательных путях, тем активнее депонирование за счет седиментации и броуновского движения. Задержка дыхания после ингаляции аэрозоля увеличивает время его нахождения в дыхательных путях и усиливает депонирование в периферических отделах. Частицы аэрозоля, которые не осели в дыхательных путях, выводятся с выдыхаемым воздухом [16]. Для оценки аэродинамических характеристик исследуемых препаратов используют импакторы. С их помощью моделируется in vitro вдох пациента и производится количественный анализ частиц препарата, собранных на ступенях импактора.
Скорость перемещения ингалируемых частиц обычно определяется скоростью инспираторного потока, что влияет на вероятность оседания аэрозоля в ротоглотке и гортани [17]. Чтобы минимизировать депонирование в верхних дыхательных путях и усилить доставку ЛС в легкие при использовании ДАИ со спейсером или без него либо ДАИ-АВ, пациент должен делать вдох медленно. После глубокого выдоха ребенок должен сделать полный вдох за 2–3 с, а взрослый – за 4–5 с. Это обеспечивает скорость потока
30 л/мин, которая считается идеальной при использовании ДАИ. В случае применения ПИ пациент должен сделать глубокий и мощный вдох, чтобы преодолеть внутреннее сопротивление ингалятора и генерировать аэрозоль. ПИ также требуют турбулентной энергии для дезагрегации ЛС во время маневра вдоха и создания мелкодисперсной дозы. Чем выше скорость инспираторного потока, тем эффективнее дезагрегация частиц аэрозоля.
Ингаляционные устройства можно разделить на пять групп [10].
1. ДАИ – ингалятор под давлением, отмеряющий дозу (применяется самостоятельно, со спейсерами, с аэрокамерами, оснащенными клапаном).
2. ДАИ-АВ (ингалятор «Легкое Дыхание», Аутохалер).
3. ПИ – ингаляторы сухого порошка или дозирующие порошковые ингаляторы (капсульные, резервуарные, блистерные).
4. «Мягкие» аэрозоли (soft-mist) (Респимат).
5. Небулайзеры (струйные, ультразвуковые, электронно-сетчатые).
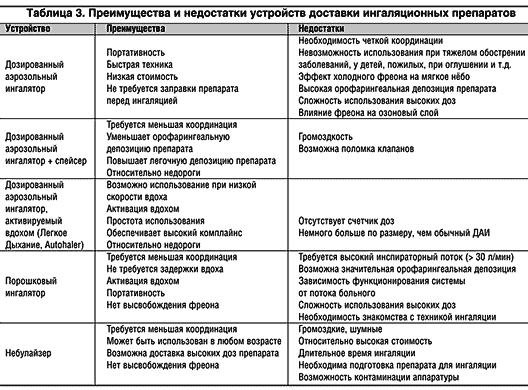
Преимущества и недостатки разных типов ингаляционных устройств приведены в табл. 1 [10].
Дозирующие аэрозольные ингаляторы
ДАИ были введены в практику в 1956 г. как первые портативные многодозовые устройства для ингаляции бронходилататоров и по сей день остаются наиболее распространенными и часто назначаемыми [18].
До недавнего времени ЛС, ингалируемые с помощью ДАИ, содержали хлорфторуглеродный пропеллент (ХФУ). Однако, несмотря на давно известные отрицательные свойства фреона, на дальнейшую судьбу фреонсодержащих ДАИ (ДАИ-ХФУ) повлияли не медицинские, а экологические проблемы.
Образование «озоновой дыры» в стратосфере, приводящей к увеличению частоты таких заболеваний, как катаракта, рак кожи, ХОБЛ, связали с широким использованием фреона во многих областях деятельности человека, в том числе в медицине. В 1987 г. был подписан Монреальский протокол «Субстанции, вызывающие истощение озонового слоя». В протоколе жестко регламентировано ограничение производства различных озоноистощающих химических веществ, в частности фреона. При подписании Монреальского протокола был оговорен ряд жизненно важных областей, в которых не представлялось возможным немедленно прекратить использование фреона, не заменив его новым пропеллентом (это касалось и медицинских аэрозолей для лечения БА).
Почти 10 лет 1400 исследователей (90 лабораторий из 10 стран) вели работу по поиску нового пропеллента. Был проведен анализ 15 000 субстанций, прежде чем эксперты пришли к выводу, что единственно приемлемая альтернатива ХФУ в медицинской практике – гидрофторалканы (ГФА) – ГФУ-134а и ГФА-227.
В связи с заменой ХФУ на ГФА потребовалось изменить конструкцию ингалятора, чтобы сохранить характеристики генерируемого аэрозоля, и заменить материалы, из которых были выполнены отдельные детали ингалятора. Значительные изменения претерпела и формула ЛС. Неизменной осталась только сама субстанция. В ходе многочисленных исследований была подтверждена пригодность обоих пропеллентов – ГФА-134а и ГФА-227 – для медицинских целей. Доказано, что они являются инертными веществами, не взаимодействующими с компонентами аэрозольных лекарственных форм и имеющими нулевой озоноразрушающий потенциал. Введение новых пропеллентов не влияло на стабильность ЛС.
В результате изучения токсичности ГФА-134а (норфлуран) было установлено, что по профилю безопасности он аналогичен пропеллентам на основе ХФУ.
В конце 1995 г. Комитет ЕС по патентованным медицинским продуктам (СРМР) заключил, что ГФА-134а и ГФА-227 представляют собой «приемлемую альтернативу ХФУ, используемым в настоящее время в медицинских целях, включая дозированные аэрозольные ингаляторы для лечения астмы».
В ходе клинических испытаний ДАИ-ГФА было установлено, что:
Кроме того, доклинические и клинические испытания бесфреоновых препаратов выявили положительные свойства ГФА. Наиболее интересное из них – увеличение дисперсности аэрозоля и соответственно респирабельной фракции ингалируемых ЛС [19]. Например, некоторым ИГКС свойственно увеличение доли мелких частиц, которые не оседают в ротоглотке, а проникают глубоко в дыхательные пути. В результате перераспределения крупно- и мелкодисперсных фракций в аэрозоле может меняться эквипотентная доза ИГКС, его системная активность. В результате снижается риск побочных эффектов [20].
В большинстве европейских стран ДАИ-ХФУ полностью заменены на ингаляторы с другим пропеллентом. После 2013 г. ДАИ-ХФУ не будут использоваться в США.
При использовании ДАИ около 30–40% всех частиц аэрозоля, генерируемого ДАИ, находятся в пределах респирабельных размеров ( 60 л/мин. В исследованиях показано, что дети дошкольного возраста с БА иногда испытывают затруднения при использовании некоторых ПИ, поскольку не могут создать инспираторный поток необходимой мощности. К тому же инспираторный поток снижается при обострениях БА [10].
Среди ПИ, используемых для лечения БА, представляет интерес новый для России порошковый ингалятор Изихейлер, который является оригинальной разработкой компании «Орион Фарма» (Финляндия). В России в 2011 г. зарегистрированы, а с 2012 г. доступны Формотерол Изихейлер 12 мкг/120 доз и Будесонид Изихейлер 200 мкг/200 доз.
В других странах более 15 лет помимо названных применяются изихейлеры, содержащие сальбутамол и беклометазон.
Изихейлер – это дозирующий порошковый ингалятор с относительно высоким внутренним сопротивлением. Испытания in vitro показали, что доставка дозы происходит единообразно и точно, начиная с минимального потока при вдохе через ингалятор 28 л/мин [30, 31].
При ингаляции препарата из дозирующего порошкового ингалятора Изихейлера генерируются частицы размером более 5 мкм. Считается, что предпочтительный размер частиц ингаляционного препарата, обеспечивающий его равномерное распределение в крупных и дистальных бронхах, для взрослых 1–5 мкм [32], для детей 1,1–3 мкм [33, 34]. Чем больше таких частиц генерируется при ингаляции, тем эффективнее распределение препарата в легких. Использование Изихейлера обеспечивает лучшее распределение ЛС по сравнению с аэрозольными ингаляторами (рис. 1) [30].
В условиях in vitro определяли депозицию препаратов при использовании пяти моделей ПИ: Спирива ХандиХалер, Реленза Дискхалер, Сальбутамол Изихейлер, Пульмикорт Турбухалер и Форадил Аэролайзер. Эту депозицию сравнивали с величиной регионарной депозиции, полученной в ходе исследований in vivo со сцинтиграфией.
Как показали результаты исследования, в условиях in vitro средний процент общей легочной депозиции препарата при использовании ингалятора Спирива ХандиХалер составил 17,3 ± 1,2, Реленза Дискхалер – 22,6 ± 1,1, Сальбутамол Изихейлер – 29,0 ± 1,1, Пульмикорт Турбухалер – 28,0 ± 3,0, Форадил Аэролайзер – 21,7 ± 1,2. Установлена корреляция между величиной депозиции, полученной в условиях in vitro, и величиной регионарной депозиции, полученной в ходе исследований in vivo. Данное исследование продемонстрировало высокую (29%) легочную депозицию препарата с использованием изихейлеров, что выгодно отличает их от других ПИ [35].
Кроме того, проводилось сравнение депонирования в легких ЛС при ингаляции с помощью ПИ Изихейлер и ДАИ + спейсер у 12 здоровых добровольцев. Отмечено преимущество формы доставки Изихейлер (рис. 2) [36].
Техника использования ингалятора
Порядок применения ПИ Изихейлера, равно как и любого аэрозольного ингалятора, следующий:
1. Снять защитный колпачок ингалятора.
2. Встряхнуть устройство, удерживая его в вертикальном положении.
3. Нажать на устройство, медленно сдавливая его между большим и указательным пальцами до появления характерного щелчка, чтобы отмерить дозу лекарственного средства. Затем вернуть устройство в исходную позицию.
4. Сделать медленный выдох до комфортного уровня для опорожнения легких. Не делать выдох в ингалятор!
5. Вдох должен быть мощным с самого начала. Не следует постепенно наращивать скорость вдоха. Вдох необходимо продолжать до полного заполнения легких.
6. В конце вдоха вынуть ингалятор изо рта и сомкнуть губы. Задержать дыхание насколько возможно, но не менее 10 с, затем сделать выдох.
8. Если необходимо проингалировать еще 1 дозу препарата будесонид, повторить шаги 2–7.
9. Закрыть мундштук Изихейлера защитным колпачком.
Применение ингалятора Изихейлер: результаты клинических исследований
Основным преимуществом устройства Изихейлер является стабильная доставка одинаковой дозы ЛС, независимо от возраста пациента, тяжести течения БА или от того, как используется устройство. При постоянно стабильной дозе, доставляемой пациентом с помощью ингалятора Изихейлер, любые изменения в течении БА обусловлены самим заболеванием, а не дефектами дозирования. Это важно как для пациента, так и для врача-специалиста, назначающего ему противоастматические средства, поскольку позволяет достичь лучшего результата лечения заболевания [37].
Для оценки приверженности терапии был проведен метаанализ приемлемости устройства Изихейлер при лечении БА в сравнении с другими ингалирующими устройствами [38]. Были собраны данные по 9 клиническим исследованиям с участием 802 пациентов, применявших ЛС с помощью Изихейлера, ДАИ (со спейсерным устройством или без него) и ПИ Турбухалер и Дискхалер.
Предметом изучения стали пять аспектов:
Терапевтическая эквивалентность Изихейлера с устройствами сравнения была подтверждена во всех исследованиях. Кроме того, результаты метаанализа показали, что устройству Изихейлер отдают предпочтение по всем анализируемым аспектам. Наиболее четко выраженным преимуществом устройства Изихейлер названо удобство использования (p
Устройства доставки ингаляционных препаратов, используемые при терапии заболеваний дыхательных путей
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
НИИ пульмонологии МЗ РФ, Москва
НИИ пульмонологии МЗ РФ, Москва
П ри заболеваниях дыхательных путей (бронхиальная астма, хроническая обструктивная болезнь легких и др.) основной способ введения лекарственных препаратов – ингаляция медицинских аэрозолей ( b 2–агонисты, антихолинергические препараты, глюкокортикостероиды, кромоны). Ингаляционные устройства представляются наиболее логичными и эффективными, так как лекарственный препарат непосредственно направляется к тому месту, где он должен действовать – в дыхательные пути. Можно выделить следующие преимущества ингаляционного способа введения лекарств: более быстрое начало действия лекарственного средства, требуется меньшая доза препарата, снижается риск развития побочных эффектов.
Любая ингаляционная техника предназначена для доставки лекарственного препарата в дыхательные пути. Одним из главных параметров эффективности ингаляционного устройства является такая величина, как депозиция (т.е. отложение) препарата в дыхательных путях. Легочная депозиция препаратов при использовании различных систем доставки колеблется в пределах от 4 до 60% от отмеренной дозы.
Основные механизмы депозиции – инерционное столкновение, седиментация (оседание) и диффузия (Swift, 1985). Депозиция аэрозоля путем инерционного столкновения происходит, когда инерция частицы не в состоянии обеспечить ее дальнейшее движение с потоком воздуха при изменении направления потока. Такой механизм имеет место в верхних дыхательных путях, в глотке, гортани и в местах бифуркации дыхательных путей. Седиментация (оседание) ответственна за депозицию частиц аэрозоля, не подвергнувшихся столкновению при вхождении в легкие. Седиментация увеличивается при задержке дыхания и при медленном, спокойном дыхании. Броуновская диффузия является важнейшим механизмом, ответственным за депозицию в легких частиц размерами менее 0,5 мкм. Такая депозиция имеет место в дистальных, газообменных отделах легких и составляет очень малую долю общей легочной депозиции терапевтического аэрозоля.
Основным фактором, определяющим депозицию частиц в дыхательных путях, является размер частиц аэрозоля. В аэрозольной медицине принято использовать следующие понятия:
Дозированные аэрозольные ингаляторы (ДАИ) являются наиболее известными и распространенными в мире системами доставки лекарственных аэрозолей. Первый ДАИ Medihaler™ был изготовлен в 1956 г., сначала в стеклянном, а с 1963 г. – в алюминиевом корпусе (Huchon, 1997).
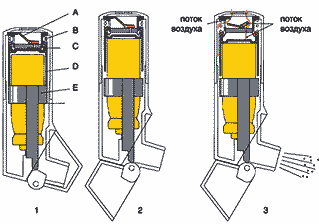
В классическом ДАИ под давлением содержатся микронизированный препарат в виде суспензии и пропеллент фреон (Ф), представляющий собой хлорфторуглерод (chlorofluorocarbon – CFC). Кроме того, для смазывания клапана и сохранения лекарственного вещества в виде суспензии в состав ДАИ входит также и сурфактант (рис. 1). Обычно лишь около 30–40% всех частиц аэрозоля, генерируемого ДАИ, находятся в пределах респирабельных размеров (менее 5 мкм).
Достоинствами ДАИ является их удобство, портативность, быстрота выполнения процедуры, низкая стоимость. Высвобождаемая из ДАИ доза препарата хорошо воспроизводима. Однако несмотря на относительную простоту, ДАИ имеют серьезные недостатки. Главные проблемы связаны с использованием фреона, который создает высокоскоростное «облако» аэрозоля (скорость более 30 м/с) в течение короткого отрезка времени. Высокая скорость аэрозоля приводит к массивной депозиции препарата на задней стенке глотки (около 80%), в то время как легочная депозиция обычно не превышает 10% от отмеренной дозы; еще около 10% дозы остается в ингаляторе (Newman et al., 1984). Другим недостатком, связанным с фреоном, является его низкая температура (до –30°С), что при его контакте с мягким небом может приводить к рефлекторному прерыванию вдоха – так называемый эффект холодного фреона.
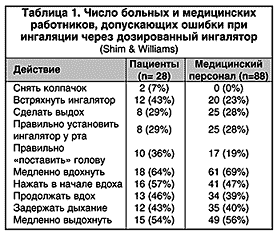
Еще одно последствие высокой скорости аэрозоля – сложность координации вдоха с высвобождением препарата из ингалятора. Неправильно используют ДАИ от 8 до 54% всех больных бронхиальной астмой (БА) (мета–анализ Cochrane et al., 2000). Правильная ингаляционная техника позволяет добиться значительного эффекта при доставке препарата в легкие. У больных с хорошей координацией вдоха и высвобождения аэрозоля легочная депозиция препарата (18,6%) почти втрое больше, чем у пациентов с неадекватной техникой использования ДАИ (7,2%) (Newman et al., 1991). Обучение больных правилам ингаляции значительно снижает остроту проблемы координации, хотя до 20% всех пациентов все же не способны правильно пользоваться ДАИ. Озабоченность вызывает то, что даже медицинский персонал при демонстрации ингаляционной техники допускает порой не меньше ошибок, чем больные (табл. 1).
Оптимальная техника ингаляции – медленный вдох (инспираторный поток около 30 л/мин) с последующей задержкой дыхания до 10 сек (Pedersen, 1996). При этом требуется встряхивать ДАИ перед каждой ингаляцией: лекарственный препарат в резервуаре ингалятора находится в виде суспензии, а по тому необходимо равномерно распределять его перед ингаляцией.
К недостаткам ДАИ относятся также постепенное снижение эффективности препарата по мере его хранения и непредсказуемые колебания его дозы после использования заданного количества доз – «феномен остатка». Данный феномен означает, что после высвобождения номинальных 200 доз препарата в камере ДАИ может оставаться еще до 20 доз, однако содержание в них лекарственного вещества очень сильно варьирует (June, 1997), что негативно влияет на результативность терапии в целом.
Наконец, существенный недостаток классических ДАИ – наличие в них фреонов, участвующих в повреждении озонового слоя атмосферы, что ведет к глобальному потеплению климата («парниковый эффект»).
Для замены фреонов были предложены другие пропелленты – гидрофторалканы (HFA–134a) (June, 1997). В отличие от фреона, HFA не содержит атома хлора, не вызывает разрушения озонового слоя, имеет очень низкую химическую реактоспособность; период сохранения в стратосфере составляет около 15 лет, и к тому же он обладает меньшим (примерно в 6 раз) потенциалом создания «парникового эффекта» (Tashkin, 1998). Новый пропеллент HFA абсолютно не токсичен, имеет очень низкую растворимость в воде и липидах (Leach, 1997). Создание новых ДАИ с пропеллентом HFA привело не просто к замене наполнителя, а к полному изменению технологии ДАИ. В бесфреоновых ДАИ лекарственный препарат содержится не в виде суспензии, а в виде раствора (для его стабилизации используется этанол, олеиновая кислота или цитраты). Новшество сделало ненужным предварительное взбалтывание содержимого ингалятора, однако больной может ощущать появившийся привкус алкоголя.
Достоинством бесфреоновых ДАИ является создание низкоскоростного «облака» аэрозоля, что приводит к значительно меньшей депозиции препарата в ротоглотке и меньшему риску развития эффекта холодного фреона (температура «облака» около 3°С) (Lipworth, 2000). Бесфреоновые ДАИ лишены таких недостатков классических ДАИ, как потеря дозы, «феномен остатка»; они могут функционировать даже при низких температурах окружающей среды (June, 1997).
Создание новых ДАИ с наполнителем HFA позволило также уменьшить и размер частиц аэрозоля. Например, MMAD частиц, образуемых ДАИ с беклометазоном–HFA, значительно меньше, чем у обычного ДАИ с беклометазоном–Ф – 1,1 мкм против 3,5 мкм (Lipworth, 2000). Изменение размера частиц аэрозоля влияет на величину легочной депозиции препарата. Так, при использовании ДАИ беклометазона–HFA депозиция у больных БА достигает 56% по сравнению с 4% при применении ДАИ беклометазона–Ф (Leach, 1998). Очевидно, такое различие требует пересмотра доз ингаляционных глюкокортикостероидов – для обеспечения контроля симптомов БА с помощью ДАИ беклометазона–HFA достаточно дозы в 2,6–3,2 раза меньше обычной (Lipworth, 2000).
ДАИ, активируемые вдохом
ДАИ, активируемые вдохом, были созданы для преодоления проблемы координации вдоха и активации ингалятора. К таким ингаляторам относятся Autohaler (3M Pharmaceutical), Easy–Breath (зарегистрирован в России под названием «Легкое Дыхание», Baker Norton) и Breath–Operated Inhaler (Baker Norton). Их главным отличием является пружинный механизм, который взводится либо открытием колпачка (Легкое Дыхание, рис. 2), либо поднятием специального рычажка (Autohaler). В ответ на вдох (средний инспираторный поток 20 и 30 л/мин) в течение 0,2 с происходит высвобождение дозы препарата. Легочная депозиция препаратов достигает значений в 2 раза больших по сравнению с обычными ДАИ (18–21%) (Newman, 1991).
Клинические исследования показали, что больные очень быстро обучаются ингаляционной технике с использованием ДАИ, активируемых вдохом (Crompton & Duncan, 1989). В исследовании Lenney et al. (2000) хорошая техника ингаляции с помощью ДАИ «Легкое Дыхание» и Autohaler была продемонстрирована у 91% больных. Кроме того, активируемые вдохом ДАИ являются устройствами, которым больные чаще всего отдают предпочтение по сравнению со всеми другими системами для ингаляций.
Комбинация ДАИ со спейсерами
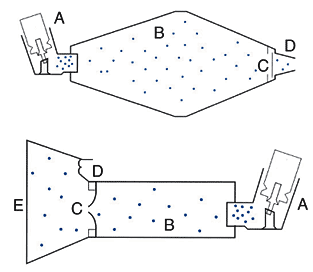
Спейсер представляет собой объемную камеру, которая соединяет дозированный ингалятор и дыхательные пути больного. Спейсеры позволяют решать проблемы координации вдоха пациента и высвобождения лекарственного препарата, а также уменьшить орофарингеальную депозицию препарата и связанные с ней местные побочные эффекты. Выполняя роль аэрозольного резервуара, спейсеры замедляют скорость струи аэрозоля и увеличивают время и дистанцию пути аэрозоля от ДАИ до рта пациента, в результате чего в дыхательные пути больного проникают частицы малого размера, а более крупные оседают на стенках камеры (рис. 3).
Спейсеры снижают риск эффекта «холодного фреона» и преждевременного прекращения вдоха. Техника использования спейсеров намного проще по сравнению с ДАИ, что делает возможным их применение у пациентов практически всех возрастных категорий, включая и детей.
Оптимальной техникой ингаляции аэрозоля через спейсер является глубокий медленный вдох (инспираторный поток около 30 л/мин) или два спокойных глубоких вдоха (до 4–5 вдохов для детей) после высвобождения одной дозы в камеру небулайзера, или даже обычное спокойное дыхание – для детей. Достоинством спейсера является возможность отсрочки выполнения ингаляции после высвобождения препарата до нескольких секунд без снижения клинического эффекта аэрозольной терапии. Однако очень длительная пауза (более 5–10 секунд) снижает количество респирабельных частиц, поэтому следует стремиться к максимально быстрому выполнению вдоха после активации ингалятора, особенно при использовании спейсеров малого объема. Необходимо также помнить: ингаляция аэрозоля из спейсера должна производиться после каждого высвобождения препарата в камеру спейсера (одна доза – один вдох).
Все спейсеры значительно снижают орофарингеальную депозицию лекарственных препаратов – до 17% (Newman SP et al., 1984), что ведет к уменьшению местных побочных эффектов при использовании глюкокортикостероидов (кандидоз и дисфония) и системных эффектов при применении b 2–агонистов вследствие уменьшения абсорбции препарата со слизистых желудочно–кишечного тракта.
Спейсеры приводят к значительному увеличению депозиции препарата в легких по сравнению с ДАИ (в 2–4 раза). По данным исследований с использованием радиоактивной метки, легочная депозиция препаратов при ингаляции через систему спейсер–ДАИ составляла 21–45% (Newman SP et al., 1984; Pierart et al., 1999).
Объем спейсера является важной характеристикой. Считается, что спейсеры большого объема (750 мл: Volumatic, Nebuhaler) более эффективны по сравнению со спейсерами меньших объемов. Однако Agerhort и Pedersen (1994) показали сходную клиническую эффективность ингаляционного будесонида при сравнении ингаляций через Babyspacer (200 мл, 23 см) и Nebuhaler (750 см, 23 см), а в исследовании Bisgaard et al. (1995) поликарбоновые спейсеры по степени эффективности были расположены в следующем порядке: Babyhaler (350 мл, 23 см), Nebuhaler и Aerochamber (145 мл, 11 см). Эти данные говорят в пользу того, что эффективность спейсера определяется не столько объемом, сколько его длиной.
Металлические спейсеры (Nebuchamber), по сравнению с пластиковыми (поликарбоновыми) системами, обладают антистатическими свойствами, т.е. не имеют электростатического заряда на своей поверхности и не вызывают повышенного осаждения частиц аэрозоля (Barry & O’Callaghan, 1999). Электростатический заряд является значимым фактором, влияющим на выход аэрозоля при использовании пластиковых спейсеров. Для решения данной проблемы предлагается создание антистатического покрытия на поверхности спейсера, что может быть достигнуто либо «примированием» устройства лекарственным препаратом, либо обработкой спейсера ионными детергентами. «Примирование» нового или вымытого спейсера создается впрыскиванием в него нескольких доз из ДАИ (обычно около 15 доз), вследствие чего образуется тонкий антистатический слой (Pedersen, 1996). Обработка спейсера ионными детергентами является очень эффективным методом: она обеспечивает повышение легочной депозиции препаратов от 11,5 до 45,6% – в 4 раза (Pierart et al., 1999).
Оборудование спейсеров лицевыми масками позволяет использовать данный тип доставки аэрозоля у детей до 3 лет (O’Callaghan & Barry, 1995).
Основным недостатком спейсеров является их относительная громоздкость, что затрудняет их использование больными вне дома.
Первым порошковым ингалятором (ПИ) явился ингалятор Spinhaler, созданный для доставки в легкие высоких доз кромогликата натрия (Bell et al., 1971). Новый тип ингалятора сразу привлек к себе внимание, так как в основу работы устройства был положен принцип высвобождения лекарственного препарата в ответ на инспираторное усилие больного (активация вдохом). Тем самым решалась проблема координации.
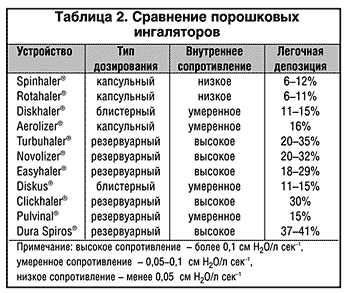
ПИ используют лекарственное вещество в сухом виде (порошок), которое при помощи энергии вдоха пациента доставляется в его дыхательные пути. В ПИ препарат находится в виде больших агрегатов (около 60 мкм) либо в чистом виде – Turbuhaler (AstraZeneca), либо, в большинстве случаев, в соединении с носителем – лактозой или бензоатом натрия – Циклохалер (Пульмомед). Во время вдоха больного в ингаляторе создаются турбулентные потоки и часть лекарственного вещества, проходя через устройство, «разбивается» до частиц респирабельных размеров. Эти респирабельные частицы сухого вещества аэродинамически более стабильны, нежели частицы ДАИ, так как транспортируются в легкие со скоростью потока воздуха, а не со скоростью струи пропеллента, не меняют своего размера и формы после высвобождения из устройства, а по тому обеспечивают большую депозицию препарата в легких – до 40% (табл. 2). Частицы, которые не подверглись микронизации, в т.ч. и с носителем, оседают в ротоглотке, причем для ПИ орофарингеальная депозиция по–прежнему остается довольно значимой проблемой (50–80%) (Pedersen, 1996).
Достоинствами ПИ являются (как и у ДАИ) их портативность, компактность, удобство и относительная простота использования (не у всех моделей!). В отличие от ДАИ порошковые ингаляторы не используют фреоны. Нельзя не отметить, что переход на бесфреоновые формы ингаляционных устройств в течение последнего десятилетия значительно стимулировал появление новых моделей ПИ.
Зависимость функционирования ПИ от инспираторного потока больного может быть не только достоинством (хорошая координация), но и недостатком, поскольку доставка препарата в дыхательные пути может находиться в прямой связи с величиной инспираторного потока. Некоторые ПИ для преодоления сопротивления ингалятора требуют относительно высокого инспираторного потока (60 л/мин), что иногда становится проблемой при их использовании у детей и в случаях тяжелого бронхоспазма. Например, Newman et al. (1991) показали, что при использовании Turbuhaler (AstraZeneca) легочная депозиция тербуталина составляла 35% при инспираторном потоке 60 л/мин и 8,9% – при потоке 15 л/мин. Другой проблемой ПИ, связанной с инспираторным усилием больного, является более высокая вариабельность высвобождаемой дозы препарата по сравнению с ДАИ. Ингалятор Aerolizer (Novartis), ранее называвшийся Ciclohaler, имеет умеренное сопротивление, что позволяет применять его при более низких инспираторных потоках (30 л/мин) (Chew et al., 2001). Однако эффективность Aerolizer также зависит от величины потока. В исследовании in vitro показано снижение фракции респирабельных частиц с уменьшением инспираторного потока: MMAD аэрозольных частиц составлял 7,2 и 5,3 мкм при потоках 40 л/мин и 80 л/мин, соответственно (Zanen et al., 1992).
Новые ПИ, такие как HandiНaler (Boehringer Ingelheim) и Clickhaler (ML Laboratories PLC), не меняют свой профиль функционирования и при таких низких потоках, как 15–30 л/мин (Chodosh et al., 2001; Newhouse et al., 1999).
Эффективность работы практически всех ПИ зависит от инспираторного потока. В свою очередь, инспираторный поток через ингаляционную систему зависит от двух факторов – внутреннего сопротивления устройства и инспираторного усилия пациента. По уровню внутреннего сопротивления потоку ПИ можно расположить в следующем порядке: Inhaler M (Boehringer Ingelheim) > Easyhaler (Orion) > Turbuhaler (AstraZeneca) > Novolizer (Sofotec) > Diskus (GlaxoSmithKline) > Aerolizer (Novartis) > Diskhaler (GlaxoSmithKline) > Rotahaler (GlaxoSmithKline) (Fyrnys et al., 2001). Низкое сопротивление устройства, безусловно, дает возможность достичь высокого инспираторного потока при менее интенсивном усилии больного и позволяет использовать ПИ с низким сопротивлением даже при тяжелом бронхоспазме.
С другой стороны, при ингаляции через ПИ с низким сопротивлением инспираторный поток может достичь очень высоких значений, вследствие чего депозиция респирабельных частиц в ротоглотке значительно увеличивается, а в периферических дыхательных путях – снижается. Поэтому, например, оптимальные значения легочной депозиции достигаются при использовании ПИ с высокими-средними внутренними сопротивлениями потоку: Turbuhaler (20–35%), Novolizer (20–32%), Easyhaler (18– 29%), а худшие показатели – при использовании ПИ с низкими сопротивлениями: Rotahaler (6–11%), Spinhaler (6–12%), Diskhaler (11–15%).
При использовании ПИ больным рекомендовано вдыхать через устройство с максимальным усилием – такой прием позволяет обеспечить максимальный инспираторный поток, что ведет к повышению респирабельной фракции аэрозоля. Однако, с другой стороны, очень быстрая ингаляция снижает депозицию в периферических отделах бронхиального дерева, что особенно актуально для ПИ с низким сопротивлением. Задержка дыхания после ингаляции, наклон головы и вдох от уровня более низких легочных объемов не влияют на эффективность ПИ (Pedersen, 1996). Необходимо помнить, что при использовании ПИ пациент не должен выдыхать в ингалятор перед ингаляцией, чтобы не «выдуть» дозу из ингалятора.
По типу дозирования лекарственного препарата все ПИ можно разделить на несколько классов (Цой, 1997; Огородова, 1999):
Самые ранние модели ПИ (Rotahaler и Spinhaler) и более современные (Aerolizer и Handihaler) используют желатиновую капсулу с лекарственным препаратом. Достоинством капсульных моделей ПИ является точность дозирования препарата, компактный размер устройств, защита лекарственной субстанции от влажности, возможность назначения большой дозы препарата (до 20–30 мг) и низкая стоимость ингалятора. К недостаткам можно отнести неудобство, связанное с частой заправкой ингалятора, и технические проблемы: неадекватное вскрытие капсулы, застревание капсулы в камере ингалятора и возможность ингаляции частиц капсулы (Nielsen et al., 1997). Необходимость заправки ПИ перед каждой ингаляцией не становится большой проблемой при ингаляции бронхолитиков пролонгированного действия – формотерола (Foradil Aerolizer) или тиотропиума бромида (Spiriva HandiНaler), когда требуется использование ингалятора не чаще 1–2 раз в сутки, однако это может вызвать достаточные неудобства при использовании ПИ с другими препаратами, требующими ингаляции чаще 3 раз в сутки.
Более удобны с этой точки зрения мультидозовые резервуарные ПИ (Turbuhaler, Easyhaler, Novolizer, Clickhaler, Airmax, Pulvinal, Циклохалер, Twisthaler), которые по концепции дозирования приближаются к ДАИ. Недостатки резервуарных ПИ – вариабельность дозы, ограничение дозы размером резервуара, сложность устройства и более высокая стоимость. Кроме того, проблемой данного класса ПИ является их влагочувствительность. Абсорбция влаги из окружающей среды или во время использования ингалятора пациентом может повлиять на взаимодействие между частицами препарата или носителя, значительно уменьшив образование респирабельного аэрозоля.
Компромиссом между капсульными и резервуарными ПИ являются мультидозовые блистерные ПИ, в которых используется несколько запакованных в блистеры доз, в виде диска (4 и 8 доз) – Diskhaler или полоски (60 доз) – Diskus. Блистерные ингаляторы успешно решают проблему защиты лекарственного вещества от влаги и обеспечивают довольно высокую точность дозирования.
Немаловажный аспект использования ПИ – их простота и удобство. Наиболее сложной системой является Diskhaler, использование которого требует выполнения особого 5–ступенчатого алгоритма. Достаточно просты Easyhaler, Clickhaler и Airmax™, которые по своей форме напоминают ДАИ. Впрочем, и сама процедура ингаляции через них требует таких же навыков, как при использовании ДАИ: встряхивание и нажатие на дно устройства (или просто открывание мундштука – при использовании Airmax) с последующим вдохом. Такой фактор, как наличие цифрового счетчика доз (Turbuhaler, Easyhaler, Clickhaler, Novolizer, Diskus), также значительно облегчает использование ПИ и улучшает комплайнс к ингаляционной терапии.
Самую длительную историю использования имеют небулайзеры – они применяются уже почти 150 лет. Слово «небулайзер» происходит от латинского «nebula» (туман, облачко), впервые было употреблено в 1874 г. для обозначения «инструмента, превращающего жидкое вещество в аэрозоль для медицинских целей» (Muers, 1997). Один из первых портативных «аэрозольных аппаратов» был создан J.Sales–Girons в Париже в 1859 г. Небулайзеры тогда использовали в качестве источника энергии струю пара, и применялись они для ингаляции паров смол и антисептиков у больных туберкулезом.
В настоящее время в зависимости от вида энергии, превращающей жидкость в аэрозоль, различают два основных типа небулайзеров: 1) струйные или компрессорные, пневматические – использующие струю газа (воздух или кислород); 2) ультразвуковые – использующие энергию колебаний пьезокристалла.
Продукция аэрозоля в ультразвуковом небулайзере практически бесшумная и более быстрая по сравнению со струйными. К числу недостатков относятся: неэффективность образования аэрозоля из суспензий и вязких растворов; как правило, больший остаточный объем; повышение температуры лекарственного раствора во время небулизации и вероятность разрушения структуры лекарственного препарата (Nikander, 1994).
Преимущества небулайзеров: легкая техника ингаляция (спокойное дыхание), отсутствие потребности в форсированном маневре, возможность использования системы даже при самых тяжелых состояниях (астматический статус), у пожилых и у детей, при двигательных расстройствах, при нарушениях уровня сознания.
Достоинством небулайзеров является возможность доставки большой дозы препарата (в случае необходимости во время ингаляции допускается использование кислорода).
Задачей ингаляционной терапии при помощи небулайзера является продукция аэрозоля с высокой пропорцией (> 50%) респирабельных частиц (менее 5 мкм) в течение довольно короткого временного интервала, обычно не более 10–15 минут (Muers, 1997).
Эффективность продукции аэрозоля, свойства аэрозоля и его доставка в дыхательные пути зависят от типа небулайзера, его конструкционных особенностей, объема наполнения и остаточного объема, величины потока рабочего газа, «старения» небулайзера, сочетания системы компрессор–небулайзер и др. (Авдеев, 2001).
Несмотря на сходный дизайн и конструкцию, небулайзеры разных моделей могут существенно отличаться по своим показателям. В исследовании Loffert et al. (1994) при сравнении 17 типов струйных небулайзеров in vitro было установлено, что различия в выходе аэрозоля достигали 2 раз, в величине респирабельной фракции аэрозоля – 3,5 раз, а в скорости доставки частиц респирабельной фракции препаратов – 9 раз. В другом исследовании при сравнении эффективности доставки аэрозоля (8 небулайзеров) было показано, что средняя депозиция препарата в легких различалась в 5 раз, а средняя орофарингеальная депозиция – в 17 раз (Thomas et al., 1991).
Типы струйных небулайзеров. Различают три основных типа струйных небулайзеров (Knoch & Sommer E. 2000).
Конвекционный (обычный) небулайзер является наиболее распространенным типом систем доставки. Такой небулайзер производит аэрозоль с постоянной скоростью, во время вдоха происходит вовлечение воздуха через Т–трубку и разведение аэрозоля. Аэрозоль поступает в дыхательные пути только во время вдоха, а во время выдоха аэрозоль попадает во внешнюю среду, т.е. происходит потеря большей его части (около 55–70%) (Jackson W.F., 1998). Легочная депозиция препаратов при использовании таких небулайзеров относительно невелика – до 10%.
Небулайзеры, активируемые вдохом (известные также, как небулайзеры Вентури): продуцируют аэрозоль постоянно на протяжении всего дыхательного цикла, однако высвобождение аэрозоля усиливается во время вдоха. Такой эффект достигается благодаря поступлению дополнительного потока воздуха во время вдоха через специальный клапан в область продукции аэрозоля, общий поток увеличивается, что ведет и к увеличению образования аэрозоля. Таким образом, соотношение выхода аэрозоля во время вдоха и выдоха увеличивается (до 70:30), повышается количество вдыхаемого препарата, снижается потеря препарата, а время небулизации сокращается (Jackson W.F, 1998). Небулайзеры Вентури позволяют добиться вдвое большей депозиции препарата в дыхательных путях по сравнению с обычным небулайзером (до 19%) (Devadason SG, 1997).
Небулайзеры, синхронизованные с дыханием (дозиметрические небулайзеры), производят аэрозоль только во время фазы вдоха. Генерация аэрозоля во время вдоха обеспечивается при помощи электронных сенсоров потока либо давления, и теоретически выход аэрозоля во время вдоха достигает 100%. Основным достоинством дозиметрического небулайзера является снижение потери препарата во время выдоха (Nicander, 1997).
Новые виды ингаляционных систем
Ингалятор Respimat (Boehringer Ingelheim) является представителем нового класса ингаляционных систем – жидкостных дозированных ингаляторов (Ganderton, 1999). Устройство имеет съемные картриджи, поворот корпуса взводит пружину. При активации ингалятора раствор проходит через сопло с двумя сходящимися каналами. На выходе из них образуются две жидкостных струи, их столкновение друг с другом формирует медленнодвижущееся «облако» аэрозоля (10 м/с). Устройство имеет компактный дизайн и снабжено цифровым счетчиком доз. Легочная депозиция аэрозоля при использовании достигает 45%, а орофарингеальная депозиция колеблется от 26 до 54% (Dolovich, 1999).
На сегодняшний день практически все рассмотренные выше системы доставки аэрозолей имеют не только достоинства, но и недостатки (табл. 3). Аэрозольные технологии – бурно развивающееся направление медицины. Практически каждый год на мировом рынке появляется несколько новых ингаляционных устройств, приближающих нас к заветной цели – созданию «идеального ингалятора». Идеальный ингалятор характеризуют свойства аэрозольного «облака», удобство устройства для больного и общие фармакологические аспекты (Ganderton, 1999).
Условно требования к идеальному ингалятору можно представить следующим образом.
1. Свойства аэрозольного «облака».
2. Удобство использования ингалятора пациентом.
3. Общие фармакологические аспекты.
1. Swift DL. Aerosol characteristics and generation. In: Moren F, Dolovich MB, Newhouse MT, et al., eds. Aerosols in medicine; principles, diagnosis and therapy. Elsevier Science (Biomedical Division), New York, 1985; 53–76
2. Task Group on Lung Dynamics. Deposition and retention models for internal dosimetry of the human respiratory flow; tract. Health Physics 1966;12:173–208.
3. Goldberg J, Freund E, Beckers B, Hinzmann R. Improved delivery of fenoterol plus ipratropium bromide using Respimat( compared with conventional metered dose inhaler. Eur Respir J 2001; 17: 225– 232.
4. Huchon G. Metered dose inhalers part and present: advantages and limitations. Eur Respir Rev 1997; 7: 41, 26– 28.
5. Newman SP, Millar AB, Lennard–Jones TR, et al. Improvement of pressurised aerosol deposition with Nebuhaler spacer device. Thorax 1984; 39:935–941
6. Cochrane MG, Bala MV, Downs KE, Mauskopf J, Ben–Joseph RH. Inhaled corticosteroids for asthma therapy. Patient compliance, devices, and inhalation technique. Chest 2000; 117: 542– 550.
7. Newman SP, Weisz AWB, Talaee N, et al. Improvement of drug delivery with a breath actuated pressurised aerosol for patients with poor inhaler technique. Thorax 1991; 46:712–716
8. Pedersen S. Inhalers and nebulizers: which to choose and why. Respi Med 1996; 90: 69– 77.
9. June D. Achieving to change: challenges and successes in the formulation of CFC–free MDIs. Eur Respir Rev 1997; 7, 41: 32– 34.
10. Tashkin DP. New devices for asthma. J Allerg Clin Immunol 1998; 101: S409– S416.
11. Leach CL. Safety asessment of the HFA propellant and the new inhaler. Eur Respir Rev 1997; 7: 41, 35– 36.
12. Lipworth BJ. Targets for inhaled treatment. Respir Med 2000; 94(suppl D): S13– S16.
13. Leach CL. Safety asessment of the HFA propellant and the new inhaler. Improved delivery of inhaled steroids to the large and small airways. Respir.Med. 1998; 92(Suppl.A): 3– 8.
14. Lenney J, Innes JA, Crompton GK. Inappropriate inhaler use: assessment of use and patient preference of seven inhalation devices. EDICI. Respir Med 2000; 94: 496– 500.
15. Crompton G, Duncan J. Clinical assessment of a new breath–actuated inhaler. Practitioner 1989;233:268–9.
16. Newman SP, Millar AB, Lennard–Jones TR, et al. Improvement of pressurised aerosol deposition with Nebuhaler spacer device. Thorax 1984; 39:935–941
17. Pierart F, Wildhaber JH, Vrancken I, Devadason SG, Le Souel PN. Washing plastic spacers in household detergent reduces electrostatic charge and greatly improves delivery. Eur Respir J 1999; 13: 673– 678.
18. Agertoft L, Pedersen S. Influence of spacer device on drug delivery to young children with asthma. Arch Dis Child 1994;71:217–20.
19. Bisgaard H, Anhoj J, Klug B, Berg E. A non–electrostatic spacer for aerosol delivery. Arch Dis Child 1995;73:226–30.
20. Barry PW, O’Callaghan C. The output of budesonide from spacer devices assessed under simulated breathing conditions. J Allergy Clin Immunol 1999; 104: 1205– 1210.
21. Barry PW, O’Callaghan C. The optimum size and shape of spacer devices for inhalational therapy. J Aerosols Med 1995;8:303–5.
22. Bell JH, Hartley PS, Cox JSG. Dry powder aerosols. I. A new powder inhalation device. J Pharm Sci 1971; 78: 176– 180.
23. Newman SP, Moren F, Trofast E, Talaee N, Clarke SW. Terbutaline sulphate Turbuhaler effect of inhaled flow rate on drug deposition and efficacy. Int J Pharmaceutics 1991;74:209–13
24. Chew NY, Chan HK. In vitro aerosol performance and dose uniformity between the Foradile Aerolizer and the Oxis Turbuhaler. J Aerosol Med 2001 Winter; 14: 495–501
25. Zanen P, van Spiegel PI, van der Kolk H, Tushuizen E, Enthoven R. The effect of the inhalation flow on the performance of a dry powder inhalation systems. Int J Pharmaceut 1992; 81: 199– 203.
26. Chodosh S, Flanders JS, Kesten S, Serby CW, Hochrainer D, Witek TJ Jr. Effective delivery of particles with the HandiHaler dry powder inhalation system over a range of chronic obstructive pulmonary disease severity. J Aerosol Med 2001 Fall; 14: 309– 315.
27. Newhouse MT, Nantel NP, Chambers CB, Pratt B, Parry–Billings RN, Parry–Billings M. Clickhaler (a novel dry powder inhaler) provides similar bronchodilation to pressurized metered–dose inhaler, even at low flow rates. Chest. 1999; 115: 952– 956.
28. Fyrnys B, Stang N, Wolf–Heuss E. Stability and performance characteristics of a budesonide powder for inhalation with a novel dry powder inhaler device. Curr Opin Pulm Med 2001; 7(suppl 1): S7– S11.
29. Огородова ЛМ. Системы ингаляционной доставки препаратов в дыхательные пути. Пульмонология 1999; № 1: 84– 87.
30. Цой АН. Преимущества и недостатки приспособлений для индивидуальной ингаляционной терапии. Пульмонология 1997; № 3: 71– 74.
31. Nielsen KG, Auk IL, Bojsen K, Ifversen M, Klug B, Bisgaard H. Clinical effect of Diskus dry–powder inhaler at low and high inspiratory flow–rates in asthmatic children. Eur Respir J 1998; 11: 350– 354.
32. Muers M.F. Overview of nebulizer treatment. Thorax 1997; 52 (Suppl.2): S25– S30.
33. Sales–Girons J. Traitement de la phtisie pulmonaire par l’inhalation des liquides pulverises et apr les fumigation de gudron. Paris, F. Savy, 1859; p. 528.
34. Nikander K. Drug delivery systems. J Aerosol Med 1994; 7(Suppl 1): S19– 24
35. Muers M.F. The rational use of nebulizers in clinical practice. Eur. Respir. Rev. 1997; 7: 189– 197.
36. Авдеев С.Н. Использование небулайзеров в клинической практике. Русский Медицинский Журнал 2001; 9, № 5(124): 189– 196.
37. Loffert D.T., Ikle D., Nelson H.S. A comparison of commercial jet nebulisers. Chest 1994; 106: 1788– 1793.
38. Thomas S.H., O’Doherty M..J., Page C.J., Nunan T.O., Bateman N.T. Which apparatus for inhaled pentamidine? A comparison of pulmonary deposition via eight nebulisers. Eur.Respir.J. 1991; 4: 616– 622.
39. Knoch M., Sommer E. Jet nebulizer design and function. Eur.Respir.Rev. 2000; 10: 183– 186.
40. Jackson W.F., Nebulised Pulmocort therapy. A scientific and practical review. Clinical visison Ltd, Oxford 1998: p. 83.
41. Devadason S.G., Everald M.L., Linto J.M., Le Souef P.N. Comparison of drug delivery from conventional versus «Venturi» ulizers. Eur.Respir.J. 1997; 10: 2479– 2483.
42. Nicander K. Adaptive aerosol delivery: the principles. Eur.Respir.Rev. 1997; 7: 385– 387
43. Ganderton D. Targeted delivery of inhaled drugs: current challenges and future goal. J Aerosol Med 1999(Suppl 1) 12: S3– S8.
44. Dolovich MB. New propellant–free technologies under investigation. J Aerosol Med 1999; 12(Suppl 1):S9–S17.