Денервационно реиннервационный процесс что это
Денервационно реиннервационный процесс что это
Изменения суммарной электромиограммы при заболеваниях периферического нейромоторного аппарата зависят от изменений ПД ДЕ и характера вовлечения их в процесс произвольного максимального усилия. При всех формах заболеваний, сопровождающихся уменьшением длительности ПД ДЕ (I и II типы изменений структуры ПД ДЕ), при максимальном изометрическом напряжении мышцы отмечается интерференционная электромиограмма, отличающаяся от нормальной снижением амплитуды ПД, но значительно большей их насыщенностью.
Это связано с тем, что сила каждой ДЕ, утратившей часть мышечных волокон, уменьшена и требуется большая частота работы каждой ДЕ для выполнения двигательного акта той же силы. При наличии меньшего числа ДЕ, особенно увеличенной длительности (IV и V типы изменения структуры ПД ДЕ), наблюдается уреженная суммарная электромиограмма типа частокола, отражающая синхронное включение небольшого числа сохранившихся ДЕ.
Спонтанная активность — ПД, регистрируемая в мышце с помощью игольчатых электродов при отсутствии произвольной активности или искусственной стимуляции мышцы, в том числе активности, вызываемой введением электродов.
К формам спонтанной активности, имеющим диагностическое значение, относятся потенциалы фибрилляций (ПФ), положительные острые волны (ПОВ) и потенциалы фасцикуляций.
ПФ — это ПД одного, в редких случаях нескольких мышечных волокон. Обычно выявляются в виде повторяющихся разрядов частотой от 0,1 до 150 в секунду. Длительность ПФ до 5 мс, амплитуда до 500 мкВ.
ПОВ — медленные крлебания потенциала характерной формы — быстрое положительное отклонение потенциала, за которым следует медленное возвращение потенциала в отрицательную сторону, которое может заканчиваться длительной отрицательной фазой низкой амплитуды. Длительность ПОВ варьирует от 2 до 100 мс, их амплитуда также различна — от 20 до 4000 мкВ. ПОВ обычно регистрируется в виде разрядов частотой от 0,1 до 200 в секунду.
К формам спонтанной активности мышечных волокон, имеющих диагностическое значение, следует отнести миотонические и псевдомиотонические разряды. Миотонический разряд — высокочастотный разряд двухфазных (положительно-отрицательных) ПД или ПОВ, вызываемый произвольным движением или шевелением иглы.
Амплитуда и частота разряда нарастает и убывает, что отражается в появлении при прослушивании разряда характерного звука пикирующего бомбардировщика. Псевдомиотонические разряды — аналогичные высокочастотные разряды, не сопровождающиеся изменением амплитуды ПД, прекращающиеся внезапно. Появление миотонических разрядов почти патогномонично для миотонии.
Псевдомиотонические разряды выявляются при полимиозитах, некоторых видах обменной миопатии и в зонах реиннервации (V тип изменений ПД ДЕ) при нейрональных расстройствах.
Методом ЭМГ с помощью накожных электродов можно выявить ряд характерных типов нарушения электрогенеза мышц, свойственных центральным и периферическим поражениям двигательного пути, заболеваниям экстрапирамидной системы, ряду нейромоторных нарушений при миастении, миотонии, а также при других мышечных заболеваниях.
На ЭМГ выделяют ряд параметров, в основном исходя из оценки амплитуды колебаний, их частоты и некоторых временных характеристик. Для количественного анализа электромиограмм применяются различные методы визуальной и аппаратной характеристики патологических изменений.
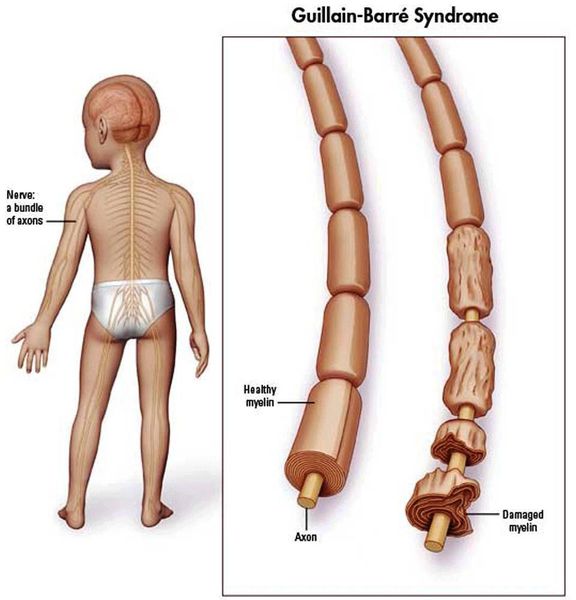
Что такое синдром Гийена — Барре? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуйков А. В., невролога со стажем в 20 лет.
Определение болезни. Причины заболевания
Синдром Гийена-Барре (ГБС) — острое аутоиммунное заболевание, которое охватывает группу острых нарушений периферической нервной системы. Характеризуется мышечной слабостью, а также болью и ползанием мурашек в начале болезни из-за поражения чувствительных волокон. Каждый вариант нарушений характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.
У 70% пациентов с ГБС наблюдалось предшествующее инфекционное заболевание перед появлением неврологических симптомов.
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев. [1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
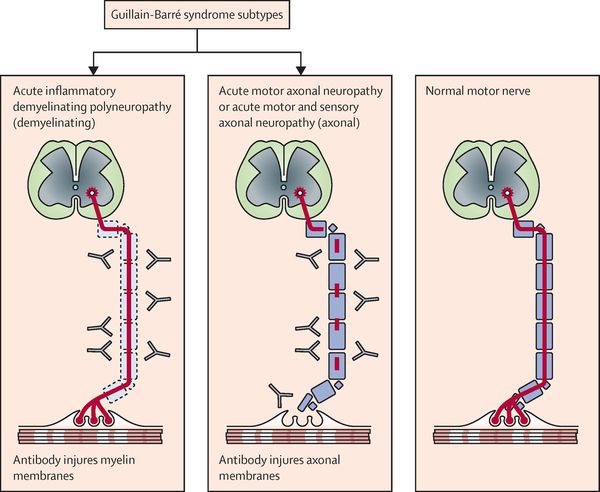
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
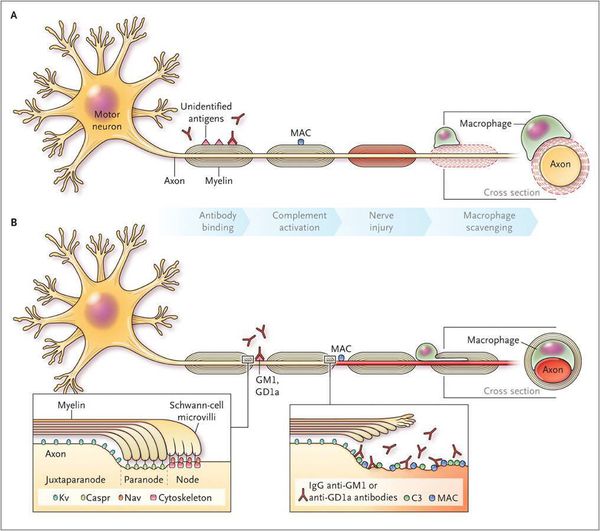
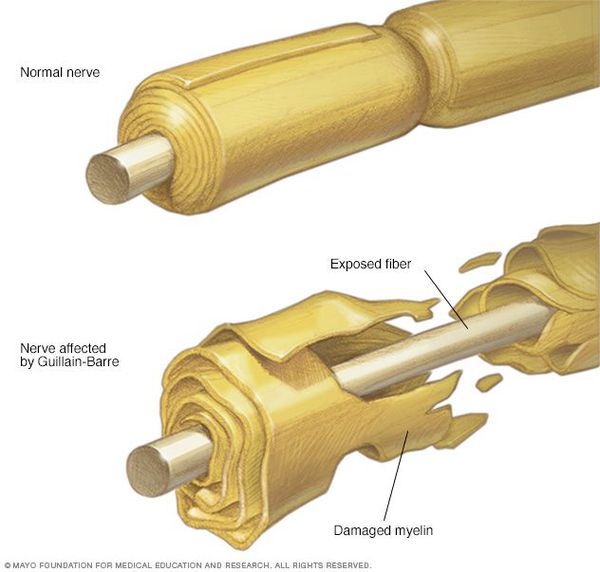
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.
Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.
Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких. [2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких: [4]
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов. [3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Инструментальная диагностика
Люмбальная пункция
При люмбальной пункции результаты СМЖ обычно показывают повышенный уровень белка (> 45 мг/дл), без плеоцитоза ( Электронейромиография) — единственный инструментальный метод диагностики, позволяющий подтвердить диагноз ГБС и уточнить характер патологических изменений (демиелинизирующий или аксональный) и их распространенность. [3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
Оценка основных ЭНМГ- параметров:
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Лечение синдрома Гийена — Барре
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника.
При боли применяют парацетамол. Катадолон и трамадол применяют при выраженном болевом синдроме. При нейропатической боли эффективны карбамазепин и габапентин.
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии. [1] [2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом.
Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Кортикостероиды не должны использоваться при лечении ГБС, т. к. не ускоряют выздоровление, не уменьшают вероятность ИВЛ и не влияют на долгосрочный результат. [2]
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита. [4]
Электромиографические стадии денервационно-реиннервационного процесса при нервно-мышечных болезнях: необходимость ревизии
Полный текст:
Аннотация
Анализ параметров потенциалов двигательных единиц (ПДЕ), регистрируемых игольчатыми электродами, является ключом к пониманию изменений двигательных единиц при разных нервно-мышечных болезнях. Отечественная классификация изменений ПДЕ по стадиям денервационно-реиннервационного процесса (ЭМГС-ДРП) основана на анализе результатов обследования пациентов с миогенными, синаптическими, нейрогенными и нейрональными уровнями поражения. В статье обсуждаются причины появления типичных и атипичных ПДЕ малой длительности, сниженной и повышенной амплитуды, рассматриваются взаимно дополняемые результаты оценки мышечных биоптатов и данные нейрофизиологического анализа плотности мышечных волокон и макро-ЭМГ при первично-мышечных поражениях и патологии нервно-мышечной передачи. Отсутствие первично нейрогенных изменений, подтвержденное результатами анализа плотности мышечных волокон и макро-ЭМГ, при воспалительных и невос палительных болезнях мышц, патологии нервно-мышечной передачи делает невозможным использование ЭМГС-ДРП для оценки данных уровней поражения. Концепция ЭМГС-ДРП может быть использована лишь при невритическом и нейрональном уровнях поражения, позволяя оценивать изменение объема компенсаторной иннервации, но при этом не отражает эффективности реиннервации.
Ключевые слова
Об авторе
Список литературы
1. Fuglsang-Frederiksen A. The role of different EMG methods in evaluating myopathy. Clin Neurophysilol 2006;117: 1173–89.
2. Kimura J. Electrodiagnosis in diseases of nerve and muscle: principles and practice (3rd edition). 2001, 1024 p.
3. Федотов В.П., Курбатов С.А., Иванова Е.А. и др. Клинико-электромиографические критерии диагностики наследственных миотонических синдромов. Нервно-мышечные болезни 2012;(3):55–66. [Fedotov V.P., Kurbatov S.A., Ivanova Е.А. et al. Clinical and electromyographic criteria of inherited myotonical syndromes diagnosis. Nervno-mishechnie bolezni = Neuromuscular Diseases 2012;(3):55–66. (In Russ.)].
4. Stеlberg E., Daube J. Elecromyographic methods. In: Handbook of Clinical Neurophysiology 2003;2:147–85.
5. Nandedkar S., Sanders D., Stеlberg E., Andreassen S. Simulation of concentric needle EMG motor unit action potentials. Muscle Nerve 1988;11:151–9.
6. Stеlberg E., Karlsson L. Simulation of EMG in pathological situations. Clin Neurophysiol 2001a;112:869–78.
7. Stеlberg E., Karlsson L. Simulation of the normal concentric needle electromyogram by using a muscle model. Clin Neurophysiol 2001b;112:464–71.
8. Никитин С.С. ЭМГ-анализ развития денервационно-реиннервационного процесса при заболеваниях нейромоторного аппарата у человека. Автореф. дис. … канд. мед. наук. М., 1983. 22 с.[Nikitin S.S. EMG analysis during denervation-reinnervation process development at neuromotor apparatus diseases in man. Abstract of a thesis of … Ph.D. in Medicine. M., 1983. 22 p. (In Russ.)].
9. Bischoff C., Stеlberg E., Falk B. Edebol Eeg-Olofsson K. Reference values of motor unit action potentials obtained with multi-MUP analysis. Muscle Nerve 1994;17:842–51.
10. Гехт Б.М., Касаткина Л.Ф., Кевиш А.В. Электромиография с использованием игольчатых электродов в анализе структуры и функционального состояния двигательных единиц при нервно-мышечных болезнях. Журн неврол и психиатр 1980;80(6):822–9. [Gekht B.M., Kasatkina L.F., Kevish A.V. Electromyography using needle electrodes in analysis of structure and functional status of motor units at neuromuscular diseases. Journal nevrologii i psychiatrii = Journal of Neurology and Psychiatry 1980;80(6):822–9. (In Russ.)].
11. Гехт Б.М., Касаткина Л.Ф., Самойлов М.И., Санадзе А.Г. Электромиография в диагностике нервно-мышечных болезней. Таганрог: ТРТУ, 1997. 370 с. [Gekht B.M., Kasatkina L.F., Samoylov M.I., Sanadze A.G. Electromyography in diagnosis of neuromuscular diseases. Taganrog: Taganrog State Radio Engineering University, 1997. 370 p. (In Russ.)].
12. Касаткина Л.Ф., Гильванова О.В. Электромиографические методы исследования в диагностике нервно-мышечных заболеваний. Игольчатая электромиография. М.: Медика, 2010. 416 с. [Kasatkina L.F., Gilvanova O.V. Electromyography test methods in diagnosis of neuromuscular diseases. Needle Electromyography. M.: Medika, 2010. 416 p. (In Russ.)].
13. Николаев С.Г. Атлас по электромиографии. Иваново. ИПК «ПресСто», 2010. 468 с. [Nikolaev S.G. Atlas of Electro myography. Ivanovo. IPK “PresSto”, 2010. 468 p. (In Russ.)].
14. Stеlberg E., Trontelj J.V., Sanders D. Single fiber electromyography. Edshagen Publishing House, 2010. 400 p.
15. Bertorini T., Stеlberg E., Yuson C., Engel K. Single-fiber electromyography in neuromuscular disorders: correlation of muscle histochemistry, single-fiber electromyography, and clinical findings. Muscle Nerve 1994;17:345–53.
16. Swash M., Schwartz S. Implications of longitudinal muscle fibre splitting in neurogenic and myopathic disorders. J Neurol Neurosurg Psychiatri 1977;40:1152–9.
17. Ciciliot S., Schiaffino S. Regeneration of mammalian skeletal muscle. Basic mechanisms and clinical implications. Curr Pharm Des. 2010;16(8):906–14.
18. Engel W.K. Integrative histochemical approach to the defect of Duchenne muscular dystrophy. In: Rowland L.P. (Ed): Pathogenesis of the muscular dystrophies. NY: American Elsivier, Excerpta Medica, 1977, p. 277–309.
19. Uncini A., Lange D.J., Lovence R.E., et al. Long-duration polyphasic motor unit potentials in myopathies: a quantitative study with pathological correlation. Muscle Nerve 1990;13:263–7.
20. Liguori R., Fuglsang-Frederiksen A., Nix W. et al. Electromyography in myopathy. Neurophysiol Clin 1997;27:200–3.
21. Trojaborg W. Motor unit disorder and myopathies. In: Hallyday A.M., Butler S., Paul R., eds: A Textbook of Clinical Neurophysiology. New York, John Wiley & Sons, 1987, p. 417–438.
22. Trojaborg W. Quantitative electromyography in polymyositis: a reappraisal. Muscle Nerve 1990;13(10):964–71.
23. Zalewska E. Hausmanowa-Petrusewicz I. Effectiveness of motor unit potentials classification using various parameters and indexes. Clinical Neurophysiology 2000;111:1380–7.
24. Rowiñska-Marciñska K. SzmidtSaĺkowska E., Fidziaĺska A. et al. Atypical motor unit potentials in Emery-Dreifuss muscular dystrophy (EDMD). Сlin Neurophysiol 2005;116(11):2520–7.
25. Rowiñska-Marciñska K., Szmidt-Saĺkowska E., Kopeć A. et al. Motor unit changes in inflammatory myopathy and progressive muscular dystrophy. Electromyogr Clin Neurophysiol 2000;40(7):431–9.
26. Pascuzzi R.M., Campa J.F. Lymphorrhage localized to the muscle end-plate on myasthenia gravis. Arch Pathol Lab Med 1988;112:934–7.
27. Maselli R.A., Richman D.P., Willaman R.I. Inflammation at the neuromuscular junction in myasthenia gravis. Neurology 1991;41:1497–504.
28. Cruz Martinez A., Ferrer M.T., Diez Tejedor E. et al. Diagnostic yield of single fiber electromyography and other electrophysiological technique in myasthenia gravis. I. Electromyography, automatic analysis of the voluntary pattern, and repetive nerve stimulation. EMG Clin Neurophysiol 1982;22:377–93.
29. Cruz Martinez A., Ferrer M.T., Peres Conde M.C. et al. Diagnostic yield of single fiber electromyography and other electrophysiological technique in myasthenia gravis. II. Jitter and motor unit fiber density studies. Clinical remission and thymectomy. EMG Clin Neurophysiol 1982;22:395–417.
30. Engel A.G. Molecular biology of end-plate disease. In Salpeter M.M. (ed): The vertebrate neuromuscular junction. New York, Alan R. Liss, 1987; p. 361–424.
31. Engel A.G., Tsujihata M., Lindstrom J.M., Lennon V.A. The motor endplate in myasthenia gravis and in experimental autoimmune myasthenia gravis; a quantative ultrastructural study. Ann Acad Sci 1976;274:60–79.
32. Roberts D.V., Thesleff S. Acetylcholine release from motor nerve endings in rat treated with neostigmine. Eur J Pharmacol 1969;6:281–5.
33. Engel A.G., Lambert E.H., Santa T. Study of anticholinesterase therapy. Effects on neuromuscular transmission and motor endplate structure. Neurology 1973;23:1273–81.
34. Komatsu T., Bokuda K., Shimutzu T. et al. Pseudomyopathic changes in needle electromyography in Lambert-Eaton myasthenic syndrome. Case Rep Neurol Med 2013;2013, AID 3692278: p. 2.
35. Oh S.J. Electromyography: neuromuscular transmission. Baltimore: Williams & Wilkins, 1988.
36. Emeryk-Szajewska B., Kopec J., Karwamska A. The reorganisation of motor units in different motor neuron disease. Muscle Nerve 1997;20(3):306–15.
37. Emeryk-Szajewska B., Kopec J., Karwamska A. The reorganisation of motor units in motor neuron disease. EMG Clin Neurophysiol 2003;43(1):23–31.
38. Emeryk-Szajewska B., Kopec J. Electromyographic pattern in Duchenne and Becker muscular dystrophy. Part I: electromyographic pattern in subsequent stages of muscle lesions in Duchenne muscular dystrophy. EMG Clin Neurophysiol 2008;48(6–7):265–77.
Для цитирования:
Никитин С.С. Электромиографические стадии денервационно-реиннервационного процесса при нервно-мышечных болезнях: необходимость ревизии. Нервно-мышечные болезни. 2015;5(2):16-24. https://doi.org/10.17650/2222-8721-2015-5-2-16-24
For citation:
Nikitin S.S. Electromyographic stages of denervation/reinnervation process in neuromuscular diseases: need for revision. Neuromuscular Diseases. 2015;5(2):16-24. (In Russ.) https://doi.org/10.17650/2222-8721-2015-5-2-16-24
Функциональное состояние двигательных единиц скелетных мышц при хронических заболеваниях мотонейронов и их аксонов
Полный текст
Аннотация
Электромиографическое исследование потенциалов двигательных единиц у 498 больных с различными формами патологии периферического двигательного нейрона позволило выделить ЭМГ кри терии оценки стадий денервационно-реиннервационно- го процесса. Определение стадии полной, частичной компенсации и стадии декомпенсации может быть использовано для изучения патогенеза нервно мышечных заболеваний, их диагностики и оценки течения.
Ключевые слова
Полный текст
Процесс восстановления двигательной функции при любой форме денервации мышцы всегда связан с восстановлением нервного контроля за функционированием мышечных волокон путем формирования компенсаторной иннервации, осуществляемой ветвлением (спрутингом) сохранившихся аксонов [2, 6, 17]. Формирование компенсаторной иннервации прослеживается с помощью различных гистологических (морфогистохимических) и нейрофизиологических методов исследования функциональной организации мышц.
Нейрофизиологические методы, включающие изучение двигательных единиц (ДЕ) скелетных мышц посредством анализа их потенциалов, отражающих любые изменения ДЕ в процессе компенсаторной иннервации, выявили прогрессирующее увеличение длительности и амплитуды потенциалов ДЕ (ПДЕ), причем это увеличение пропорционально степени нарастания числа сгруппированных мышечных волокон одного гисто- химического типа [3, 4, 9].
Многократное исследование ПДЕ в различной степени пораженных мышцах больных с нервно-мышечными заболеваниями, в основе которых лежит процесс развития и компенсации денервационно-реиннерва ционного синдрома, позволило нам ранее выделить несколько последовательно развивающихся электромиографических (ЭМГ) стадий этого процесса, отличающихся от таковых в нормальной ЭМГ картине ПДЕ в мышцах здоровых людей наличием разного количества ПДЕ нормальной, сниженной либо увеличенной длительности в каждой конкретной мышце и являющихся отражением происходящих в ней изменений [5].
Вместе с тем многие вопросы последовательности реорганизации ДЕ в процессе развития патологических процессов, обусловленных поражением мотонейронов и их аксонов, продолжают оставаться недостаточно изученными. Их решение связано с расширением диагностических возможностей электромиографии и пониманием происходящих при различных заболеваниях изменений ДЕ.
В этой связи в настоящем исследовании проводился детальный анализ ПДЕ в мышцах здоровых людей и их изменений в процессе развития денервационно-реиннерва ционного процесса при заболеваниях мотонейронов и их аксонов.
Состояние и размер ДЕ скелетных мышц человека изучены в 2 950 мышцах 498 больных с заболеванием мотонейронов и их аксонов и 126 мышцах 98 здоровых людей в возрасте от 6 до 73 лет. Проведен анализ 61 717 ПДЕ в мышцах верхних и нижних конечностей. У здоровых людей и всех боль ных в динамике, кроме наиболее пораженных, обязательно исследовались мышцы: дельтовидная, общий разгибатель пальцев, четырехглавая, передняя большеберцовая и мышца, приводящая первый палец кисти.
МакроПДЕ (МПДЕ) изучались в 271 передней большеберцовой мышце 102 больных в возрасте от 17 до 50 лет. Полученные при этом данные сравнивали с результатами исследования той же мышцы у 10 здоровых лиц того же возраста.
В каждой мышце регистрировали не менее 20 ПДЕ с применением концентрических игольчатых электродов и 20 МИДЕ, зарегистрированных с помощью макро электрода с большой отводящей поверхностью. Сравнивали потенциалы и гистограммы их распределения, анализировали пара метры ПДЕ и амплитуду МИДЕ.
Исследование проводилось на электро миографе фирмы «Дантек Электроник” (Дания) согласно общепринятым методикам изучения ДЕ в мышцах человека [7, 16]. Помимо определения длительности и амплитуды ПДЕ, числа фаз и типов определялось время нарастания основного пика (ВНП) ПДЕ. ВНП измерялось (в мс) от максимальной позитивной части до максимума негативного отклонения.
Результаты исследования сопоставляли с итогами детального анализа клинического состояния мышцы.
1. Потенциалы двигательных единиц в скелетных мышцах здоровых людей
В настоящее время широко известны и используются в электромиографических лабораториях мира таблицы средних величин длительности ПДЕ в скелетных мышцах здоровых людей в зависимости от возраста, являющиеся результатом исследований раз личных авторов [7, 8, 11, 12, 15].
Значительно менее изучен вопрос о том, какие по длительности ПДЕ можно считать нормальными, а какие — необходимо выносить за рамки нормальных величин. По мнению большинства, для суждения о состоянии мышцы наиболее информативным параметром ПДЕ является величина средней длительности не менее 20 ПДЕ, зарегистрированных в различных участках мышцы в области двигательной точки.
В серии исследований мы изучали распределение по длительности 2 717 ПДЕ в 126 мышцах здоровых людей в возрасте от 6 до 73 лет, используя сравнительную оценку нормированных величин в процен тах. За 100% бралась величина средней длительности потенциалов для данной мышцы в норме из общепринятых таблиц, величины которых практически совпали с результатами наших исследований, и в про центах высчитывалась длительность каждого из 20 зарегистрированных в мышце потенциалов по отношению к этой нормаль ной величине. Это позволило нам сравнивать величины длительности ПДЕ в разных мышцах здоровых людей различного воз раста (табл. 1).
Как видно из табл. 1, в мышцах здоровых людей регистрировались ПДЕ, длительность которых не выходила за границы 60—140%. Обращает на себя внимание, что величина основного количества потенций лов (72.9%) отличалась от величины средней длительности всего на ±10%, т.е. укладывалась в границы 90—110%. Самую малую длительность, составляющую 60% от сред ней величины, имели 19 ПДЕ (0,7%), а самую большую длительность, равную 140%, имели всего 7 из 2 717 ПДЕ (0,3%), т.е. лишь величина 1,0% ПДЕ отличалась от величин нормы на ±40%. Других величин длительности ПДЕ в мышцах здоровых людей зарегистрировано не было.
Таким образом, 99,0% всех ПДЕ имели длительность, составляющую 70—130% от средней величины длительности ПДЕ для данной мышцы лиц соответствующего воз раста. Это позволило нам считать нормальными потенциалы, находящиеся в границах ±30% от средней величины при условии сохранения формы гистограммы нормального распределения.
2. Изменение параметров ПДЕ при развитии денервационно-реиннервационного процесса
Для исследования изменений ПДЕ, про исходящих в процессе развития заболева ния, были изучены данные анализа ПДЕ больных с различными нервно мышечными заболеваниями, в основе которых лежит денервационно-реиннервационный процесс: нейрональные заболевания (боковой амиотрофический склероз, спинальные амиотрофии), аксональные и демиелинизирующие полиневропатии. У каждого больного исследовалось не менее 5 мышц, в различной степени вовлеченных в патологический процесс.
Таблица 1. Представленность потенциалов различной длительности в мышцах здоровых людей
Длительность ПДЕ (в % по отношению к средней величине)
Количество и % мышц с ПДЕ данной длительности (п=126)
Количество ПДЕ данной длительности (М±@) (в %)
Разброс ПДЕ данной длительности (в %)
Количество ПДЕ данной длительности
Принято считать, что при первично мы щечных заболеваниях длительность и амплитуда ПДЕ снижаются вследствие гибели части мышечных волокон в ДЕ. При неврогенных заболеваниях гибель некоторого числа мотонейронов или их аксонов при водит к возникновению компенсаторной иннервации, когда сохранившиеся мотопейроны иннервируют лишенные нервного контроля мышечные волокна, тем самым увеличивая амплитуду и длительность потенциалов.
Полученные нами результаты [5] показали, что при развитии компенсаторной иннервации не происходит одновременного увеличения пара метров всех ПДЕ данной мышцы. Как правило, в мышце, особенно на ранних стадиях ее вовлечения в процесс, регистрируются ПДЕ сниженной, нормаль ной и в различной степени увеличенной длительности.
На основании анализа изменений длительности ПДЕ в ходе заболевания по отношению к нормальным величинам мы выделили 5 ЭМГ стадий денервационно-реиннервационного процесса [1, 5], которые получи ли широкое признание при ЭМГ диагностике различных нервно мышечных заболеваний не только у нас в стране, по и за рубежом [10].
В соответствии с предложенной классификацией на 1-й стадии средняя длительность ПДЕ снижена на 15—20%, увеличено количество ПД малой длительности, гистограмма несколько смещена влево от сред ней линии. Эта стадия отражает начальные изменения в ДЕ. Па 2-й стадии средняя длительность снижена более чем на 20%, гистограмма резко смещена влево. Эта стадия отражает выраженные изменения в ДЕ, обусловленные уменьшением числа функционирующих мышечных волокон. На 3-й стадии средняя длительность находится в пределах ±20%, но гистограмма растяну та, появляются отдельные ПДЕ увеличенной длительности. Эта стадия отражает начальный процесс реиннервации. На 4-й стадии средняя длительность ПДЕ увеличена на 21—40%, гистограмма растянута и смещена в сторону больших величин, число ПДЕ нормальной и увеличенной длительности примерно одинаково. На 5-й стадии средняя длительность увеличена более чем на 40%, гистограмма смещена вправо и, как правило, разомкнута, преобладают укрупненные ПДЕ.
Правомочность выделения 1-й и 2-й стадий перестройки ДЕ при текущем денервационно-реиннервационном процессе. Наши наблюдения показали, что у больных с несомненным поражением периферических мотонейронов и их аксонов в 16,6% мышц наблюдается (фаза снижения длительности ПДЕ (1 я и 2 я стадии) при нормальной и несколько повышенной их амплитуде.
Для выявления количества ПДЕ снижен нои длительности при данном процессе мы отобрали в случайном порядке по 100 мышц по каждой ЭМГ стадии среди 235 больных с различными заболеваниями, в основе которых лежит денервационный синдром, проанализировали 12 164 ПДЕ (табл. 2) и проследили количество ПДЕ различной длительности на каждой из стадий.
Таблица 2. Количество ПДЕ различной длительности (в %), зарегистрированных в мышцах на разных стадиях денервационно-реиннервационного процесса (ДРП)
Длительность ПДЕ (в %)
Всего из общего количества ПДЕ
Примечание. Пунктиром выделены границы «нормальных» значений длительности ПДЕ.
Как следует из приведенных результатов, 9,45% ПДЕ в мышцах больных с нейрональными заболеваниями и невронагиями имели снижение длительности, вы ходящее за пределы минимальных значений, выявляемых в мышцах здоровых лю дей. Из всех ПДЕ сниженной длительности 353 были зарегистрированы на 1 й и 2-й стадиях, т.е. на стадиях снижения средней длительности ПДЕ в мышце.
1 я и 2 я стадии наблюдались в 12% обследованных мышц с быстро прогрессирующими и хронически протекающими нейрональными заболеваниями, в 22,8% мышц с острыми и в 18,2% мышц с хроническими заболеваниями периферических нервов. Однако амплитуда этих укорочен пых по длительности ПДЕ была повышена, чего не наблюдается в мышцах здоровых людей. Подобные ПДЕ не выявляются и при миопатиях, прогрессирующих мышечных дистрофиях, синаптических заболеваниях, связанных с нарушением функции постсинаптических структур (миастения).
Поскольку амплитуда и в меньшей степени длительность ПДЕ находятся в об ратной зависимости от расстояния отводя щей поверхности электрода до зоны генерации потенциала, естественным является вопрос, не обусловлена ли регистрация дан ной группы ПДЕ техническими причинами, т.е. изменениями свойств мышцы либо отдаленностью электрода от зоны ДЕ, генерирующей потенциал.
В этой связи наряду с анализом амплитуды и длительности ПДЕ мы изучили время нарастания потенциала (ВНП) каждого из ПДЕ. Как известно, при максимальном приближении электрода к источнику генерации потенциала ВНП в норме равно 100—300 мкс и не должно превышать 500 мкс [11, 13, 14].
Было проанализировано 120 ПДЕ в мышцах 6 здоровых людей, 659 ПДЕ (табл. 3) в 88 мышцах больных: с боковым амиотрофическим склерозом (БАС: 24 мышцы, 138 ПДЕ), аксональными (АПН: 24 мышцы, 167 ПДЕ) и демиелинизирующими (ДПН: 30 мышц, 179 ПДЕ) полиневропатиями, поли миозитом (10 мышц, 175 ПДЕ).
Таблица 3. Средние величины (M±SD мкс) времени нарастания потенциала в мышцах больных с заболеваниями мотонейронов и их аксонов
Длительность отдельных ПДЕ (в %)
Как следует из полученных результатов, средние величины ВНП в ПДЕ различной длительности меняются однонаправленно при различных патологических процессах, причем во всех группах больных ВНП в ПДЕ укороченной длительности имеет минимальные величины. Следовательно, выявление укороченных по длительности ПДЕ не может быть обусловлено техническими причинами и отражает реальные стадии реорганизации ДЕ при ДРП. На основании экспериментов с моделированием ПДЕ развитие ПДЕ такого типа может отражать утрату мотонейроном самых дистальных ветвлений аксонов, элиминацию наиболее отдаленных от центра ДЕ мышечных волокон и увеличение плотности мышечных волокон данной ДЕ в ее центральной части.
Из вышесказанного следует, что механизм укорочения ПДЕ при денервационных синдромах не идентичен механизму изменения ПДЕ при первично мышечных заболеваниях, когда выпадение МВ происходит в случайном, хаотичном порядке. Регистрируемые в последнем случае укороченные, часто полифазные ПДЕ имеют амплитуду, сниженную пропорционально длительности.
Целесообразность коррекции критериев определения ЭМГ-стадий денервакционно-реиннереакционного процесса в зависимости от представленности ПДЕ различной длительности. В основе приведенной выше классификации ДРП, находящегося на 1—2-й и 4—5-й стадиях — величины средней длительности ПДЕ. Так, 1 я (снижение средней длительности до 20%) и 2 я (снижение средней длительности более чем на 20%) стадии характеризуются ПДЕ уменьшенной длительности, а 4 я (увеличение средней длительности на 21—40%) и 5 я (увеличение средней длительности более 40%) стадии — ПДЕ увеличенной длительности.
Дальнейший анализ выявил недостатки и условность такого способа определения стадий, так как наличие даже одного «гигантского» но длительности потенциала мо жет существенно изменить величину сред ней длительности и исказить представление о реальной стадии процесса. Поэтому мы видоизменили процедуру определения ЭМГ стадий процесса, считая более удобным учет количества ПДЕ, по своей длительности находящихся в границах укороченных, нормальных и увеличенных величин.
1 я стадия характеризуется появлением нескольких укороченных ПДЕ, длительность которых выходит за границы нормальных величин, отражая начальную стадию денервации.
Па 2-й стадии количество таких ПДЕ на растает, и число ПДЕ сниженной длительности превышает число «нормальных» ПДЕ. Однако на данной стадии не выявляется укрупненных ПДЕ.
3-я стадия отражает начало реиннервации. В мышцах на данной стадии наряду с укороченными ПДЕ появляются ПДЕ увеличенной длительности, выходящей за границы нормальных величин.
На 4-й стадии укороченные ПДЕ не вы являются, количество ПДЕ увеличенной длительности нарастает, но имеется определен ное число ПДЕ нормальной длительности.
На 5-й стадии «нормальных» ПДЕ практически нет, все ПДЕ значительно увели чены по длительности, степень ее увеличения зависит от степени реиннервации.
Предельные величины потенциалов ДЕ в процессе развития болезни. Представляет интерес определение максимальных вели чин нарастания длительности и амплитуды ПДЕ при различных поражениях мотонейронов спинного мозга, отражающих их пре дельные возможности по формированию пол поденной компенсаторной иннервации.
Параллельное изучение параметров ПДЕ и амплитуды МПДЕ, отражающих размеры ДЕ, позволило установить закономерности изменения структурно функциональной организации ДЕ скелетных мышц при полно ценной компенсаторной иннервации и формировании частичной и недостаточной ком пенса горной иннервации.
При исследовании 61 мышцы у больных с болезнями мотонейронов выявлены значительные колебания средних величин МПДЕ и ПДЕ и их максимальных значений, обнаруженных в отдельных мышцах (табл. 4).
Таблица 4. Средние величины параметров ПДЕ и МПДЕ у больных с нейрональными заболеваниями по нозологическим группам
Средние параметры потенциалов
Средние (стандартное отклонение)
1. Нейрональная форма болезни Шарко—Мари—Туста (п= 14)
2. Резидуальная стадия полиомиелита (n=12)
3. Боковой амиотрофический склероз (n=19)
Как следует из представленных данных, наиболее значительные величины потенциалов, отражающие суммарный объем реин нервации, выявлены при более длительно протекающих заболеваниях — нейрональных формах болезни Шарко—Мари—Туста (ШМТ) и резидуальной стадии полиомиелита (РСП). Причем эти величины являются наиболее высокими и при сопоставлении величин МПДЕ и ПДЕ. Несколько меньшие величины выявлены в мышцах больных с боковым амиотрофическим склерозом (БАС) и спинальной амиотрофией (СА).
Самые низкие значения выявлены при обследовании больных с хронически протекающими аксональными невропатиями.
Индивидуальные максимальные величины МИДЕ также выявлены у больных с РСП и болезнью ШМТ (4210% и 4894% соответственно), у них зарегистрированы “рекордные» по амплитуде МПДЕ, более чем в 40 раз превышающие нормальные величины.
Следует, однако, отметить, что различие средних величин амплитуд МПДЕ определяется не наличием в популяции отдельных ДЕ с огромным объемом реиннервированных мышечных волокон, а числом ДЕ, генерирующих столь мощные потенциалы.
Наличие спонтанной активности — потенциалов фибрилляций и положительных острых волн — является обязательным компонентом денервации и может служить удобным критерием для определения степени благополучия трофического обеспечения иннервируемых данным мотонейроном мышечных волокон.
Показано, что средние величины амплитуд МПДЕ в мышцах с наличием и отсутствием спонтанной активности различаются не столь существенно (р > 0,5). Вместе с тем значительно различаются средние величины амплитуд при патологических процессах, развивающихся с различной интенсивностью. Данное наблюдение дает основание обсудить несколько вариантов объяснения. Одно из них связано с различной злокачественностью процессов при относительно быстром и медленном развитии изученных заболеваний, второе — с возрастающей адаптивностью мотонейронов при медленном увеличении объема иннервации.
Дальнейшее изменение ПДЕ после достижения максимального объема реиннервации. Многолетние наблюдения за состоянием ДЕ в мышцах больных с ДРП показали, что 5 я стадия не всегда является последней в развитии ЭМГ изменений при хронических прогрессирующих заболеваниях мотонейронов спинного мозга или их аксонов. При прогрессировании заболевания после 5-й стадии начинали выявляться отдельные ПДЕ, форма которых изменена, не было острой спайки, в несколько раз было увеличено ВНП, исчезала полифазность. Длительность такого ПДЕ могла быть нормальной или несколько сниженной, амплитуда была снижена и не соответствовала длительности. Количество таких ПДЕ нарастало, а число укрупненных ПДЕ падало, и наконец они исчезали совсем, превращаясь в мелкие низкоамплитудные потенциалы с закругленными пиками.
Этот процесс сопровождался нарастанием интенсивности спонтанной активности и снижением силы мышцы. Быстрота такого процесса зависела от его злокачественности либо от дополнительного влияния какого то патогенного фактора, запускающего весь механизм развития заболевания.
Накопление информации о реорганизации двигательных единиц в процессе раз вития денервационно-реиннервациоиного синдрома при болезнях мотонейронов и поражении моторных аксонов, полученной с помощью различных методов нейрофизиологического исследования, поставило вопрос о функциональном состоянии ДЕ па разных этапах развития компенсаторной иннервации. Систематизация этих результатов позволила сформулировать положение о различной степени компенсации утраченной функции в зависимости от достаточности иннервационно-трофических возможностей сохранившихся мотонейронов в условиях принятой ими на себя нагрузки но обеспечению определенного объема ин нервируемых ими мышечных волокон.
Нами в этой связи были выделены следующие этапы развития компенсаторной иннервации.
Таким образом, наблюдения свидельствуют о значительных вариациях функционирования различных структур ДЕ в процессе развития компенсаторной иннернации, связанной с прогрессирующей гибе лью мотонейронов и (или) их аксонов.