Десмопластическая реакция стромы что это
Десмопластическая реакция стромы что это
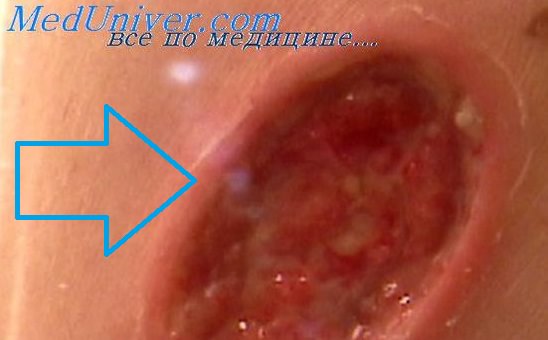
Десмопластическая меланома является одним из вариантов узловой меланомы или меланомы стадии вертикального роста. Состоит из веретенообразных клеток и отличается выраженной десмопластической реакцией стромы. Если присутствует стадия радиального роста, то это обычно один из лентигинозных типов меланомы. Это необычный вариант меланомы, который выглядит как непигментированное образование на коже, подобное шраму или рубцу, но без предшествующего травматического повреждения в анамнезе Если биопсия взята поверхностно, образование можно принять за келоид или дерматофиброму. Так как нет четких клинических проявлений, характерных для мела-номы, очень большое значение имеет анамнез. В вертикальной стадии роста десмопластическая меланома принимает вид твердого узла, также беспигментного или слабопигментированного.
Микроскопически десмопластическая меланома состоит из веретенообразных клеток, расположенных между тонкими прослойками коллагена. Ядра клеток вытянутые, S-образные, подобно клеткам в нейрофибромах или шванномах. Часто клетки сгруппированы в пучки. В более поверхностных отделах могут встречаться эпи-телиоидные клетки, единичные или сгруппированные в гнезда. Если в опухоли есть пигмент, то скорее он будет в эпителиоидных клетках. Описаны поля миксоматоза и многоядерные клетки, подобные клеткам злокачественной гистиоцитомы.
Десмопластическая меланома обладает выраженным инфильтрирующим ростом с характерным нейротропизмом, но ее все-таки следует отличать от нейротропной меланомы.
Иммуногистохимически клетки десмопластической меланомы дают положительную реакцию на белок S-100 и отрицательную на НМВ-45.
Дифференциальный диагноз беспигментных вариантов десмопластической меланомы проводят со злокачественной эпителиоидной шванномой, а при наличии пигмента — со злокачественной меланоцитарной шванномой. Если опухоль связана с эпидермисом и распространяется на сосочковый слой дермы, то скорее всего это десмопластическая меланома или нейротропная десмопластическая меланома. Если же опухоль расположена глубоко в дерме или в мягких тканях, то более вероятно, что она шванновского происхождения. Если в опухоли отсутствуют митозы и нет ядерной атипии. то это десмопластический доброкачественный Spitz невус.
В некоторых десмопластических меланомах можно встретить один или два митоза в нескольких срезах, такие низкозлокачественные опухоли могут быть расценены как один из вариантов минимально отклоненной меланомы.
В Гистологической классификации опухолей кожи (ВОЗ, 1996г.) нейротропная меланома и минимально отклоненная меланома выделены как самостоятельные формы.
Десмопластическая реакция стромы что это
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Цель исследования – определить гистогенез анапластических участков опухоли и окружающей стромы при протоковом раке поджелудочной железы. Установлено, что эпителиально-стромальные взаимодействия при протоковом раке поджелудочной железы обуславливают его агрессивное биологическое поведение, резистентность к химиотерапевтическому лечению и различную выживаемость в зависимости от степени дифференцировки опухоли. Гетерогенность протокового рака проявляется в появлении анапластического (саркомоподобного) компонента, в котором прослеживается способность эпителиальных опухолевых клеток приобретать свойство мезенхимальных клеток, не требующих наличия стромы для своего развития и обладающих агрессивным злокачественным потенциалом, влияющим на выживаемость больных.
Цель исследования – определить гистогенез анапластических участков опухоли и окружающей стромы при протоковом раке поджелудочной железы.
Материал и методы
Выполнен анализ операционного материала от 118 больных протоковой аденокарциномой поджелудочной железы (ПАК ПЖ), находившихся на лечении в медицинских учреждениях г. Москвы в период с 2005 по 2013 гг. Среди больных ПАК ПЖ преобладали мужчины (1,3:1). Возраст больных колебался от 40 до 80 лет. Средний возраст мужчин – 61 год, средний возраст женщин – 52 года.
Материал фиксировали в 10% забуференном растворе формалина, затем заливали в парафин по обычной методике. Серийные парафиновые срезы толщиной 3 мкм депарафинировали по стандартной схеме, окрашивали гематоксилином и эозином. Иммуногистохимическое исследование проводили на серийных парафиновых срезах толщиной 2 мкм по стандартой методике с применением следующей панели поликлональных антител: р63, кальпонин, гладкомышечный актин (ГМА), общий цитокератин, цитокератин 7, виментин, Е-кадгерин (Dako, LabVisionFlex, Дания). Интенсивность пероксидазной метки оценивали полуколичественным методом с учетом интенсивности окрашивания и количества антиген-позитивных клеток. Иммуногистохимическая реакция оценивалась как негативная («−» – нет реакции), слабопозитивная («+» – 10% клеток средней интенсивности окраски) и выраженная («+++» – >50% клеток высокой интенсивности окраски). Для проведения ИГХ-реакции применялась техника tissuemicroarrays (TMA), сконструированная в формате multitumorarrays. Данная модель состояла из 24 образцов первичной опухоли от разных больных, при этом от одного больного использовались образцы с разной степенью дифференцировки опухолевых клеток. Таким образом, это позволило осуществить скрининг определенного молекулярного повреждения во всем разнообразии представленных опухолей с наименьшей затратой реактивов и времени. Для получения цветного изображения использовали сканер Miraxdesk (Zeiss, Германия).
Результаты
Протоковая аденокарцинома поджелудочной железы имеет вид узла неправильной формы без четких границ, размерами от 2 до 10 см, на разрезе матового белесовато-серого или беловатожелтого цвета, каменистой плотности. Нередко в центре опухоли можно обнаружить очаги распада с формированием полостей различной формы. В большинстве случаев 78,8% (93 из 118) опухоль представлена железистыми структурами неправильной формы, состоящими из опухолевых клеток с различным содержанием муцина, выраженной десмопластической реакцией стромы, как правило, занимающей большую долю опухолевой массы (от 50–80%).
Однако в 21,2% (25 из 118) случаев в классическом гистологическом варианте ПАК ПЖ в опухоли наряду с железистыми структурами обнаружен анапластический (саркомо-подобный) компонент, представленный крупными полиморфными или веретенообразными клетками с гиперхромными ядрами, иногда многоядерными, с минимальным стромальным компонентом (рис. 1). Объем анапластического компонента разнился и составил от 5 до 20% общей массы опухоли, но во всех случаях не являлся преобладающим.
При проведении ИГХ-реакции обнаружены различия в экспрессии маркеров в железистом и анапластическом компонентах ПАК ПЖ. Так, выраженная экспрессия гладкомышечного актина (+++) отмечена только в десмопластической строме, окружающей железистые структуры. В опухолях с анапластическим компонентом также отмечена выраженная положительная реакция с ГМА, выявленная как в гладкомышечных волокнах, так и в единичных крупных анапластических опухолевых клетках. Помимо этого, как в строме, так и в эпителиальном анапластическом компоненте отмечена выраженная диффузная реакция с виментином (+++) (рис. 2), отсутствующая в железистых структурах (рис. 3). Одновременно в отдельных анапластических клетках отмечалась потеря экспрессии общего цитокератина и цитокератина 7 при сохраненной экспрессии эпителиального-мембранного антигена. Также, в ядрах анапластических клеток отмечена положительная реакция с р63, который может рассматриваться как маркер базальных стволовых клеток (рис. 4).
В опухолях без анапластического компонента, доля окрашенных ядер с антителами к р63 была ниже и представлена единично окрашенными ядрами по периферии железистых структур. Также при раке поджелудочной железы происходила редукция экспрессии белка Е-кадгерина и изменение полярности его экспрессии, а именно исчезновение мембранного окрашивания и появление цитоплазматического с разной степенью интенсивности. В опухолевых клетках железистых структур ПАК в 66,7% (62 из 93 случаев) наблюдалась умеренно-выраженная (++) цитоплазматическая экспрессия данного белка; в 30,1% (28 из 93) – выраженная цитоплазматическая (+++). Мембранная реакция наблюдалась только в 3,2% (3 из 93) случаев. В анапластическом компоненте во всех случаях отмечена отрицательная как мембранная, так и цитоплазматическая экспрессия белка Е-кадгерина.
Заключение
Классический вариант протоковой аденокарциномы поджелудочной железы по своей гистологической структуре, как правило, неоднородная опухоль, которая представлена полями ткани различной дифференцировки от высокой до низкой, включая анапластический компонент. В исследуемой серии анапластический компонент присутствовал в 21,2% (25 из 118) случаев. По нашему убеждению, его необходимо выделять даже при минимальном его объеме от общей массы опухоли, поскольку опухоли с анапластическим компонентом имеют не только различия в гистологическом строении, но и в злокачественном потенциале, а также по экспрессии эпителиальных, миоэпителиальных и мезенхимальных иммуногистохимических маркеров. Гистологически десмоплазия стромы, которая характерна для протокового рака поджелудочной железы, полностью отсутствует в анапластических участках. Опухолевые клетки, плотно располагаясь друг к другу, как бы создают «стромальный каркас» из самих себя (рис. 5).
Таким образом, возрастающий интерес исследователей к эпителиально-стромальным взаимодействиям в протоковом раке поджелудочной железы обусловлен его агрессивным биологическим поведением, резистентностью к химиотерапевтическому лечению и различной выживаемостью в зависимости от дифференцировки опухоли. Гетерогенность протокового рака проявляется в появлении анапластического (саркомоподобного) компонента, в котором прослеживается способность эпителиальных опухолевых клеток приобретать свойство мезенхимальных клеток, не требующих стромы и обладающих агрессивным злокачественным потенциалом, влияющим на выживаемость больных.
Десмопластическая реакция стромы что это
Опухолевые клетки отличаются от нормальных нарушениями прочной сопряженности между процессами роста и дифференцировки [9]. Увеличение темпа воспроизводства озлокачествленных клеток обеспечивается не столько через укорочение митотического цикла, сколько за счет возрастания количества тех элементов, которые вместо достижения терминальной степени дифференцировки остаются во фракции роста [6, 11, 13]. В качестве еще одного механизма немалую роль играет «карикатурная» сигнальная связь, то есть нарушенная интеграция между малигнизированными клетками, проходящими через этапы дифференцировки, и микроокружением [2, 4]. Достигнут значительный прогресс в области изучения морфофункциональных особенностей слизистой оболочки желудка при предраке и раке, отчасти связанный с развитием высокочувствительных способов выявления в гистологических срезах отдельных тканевых и клеточных компонентов [1, 3]. Однако многие аспекты структурно-метаболической перестройки слизистой оболочки желудка при ее малигнизации остаются предметом дискуссий, и поиск изменений, предшествующих возникновению опухоли, по-прежнему актуален [5, 10].
Материал и методы исследования
Срезы окрашивали гематоксилином и эозином в комбинации с реакцией Перлса, по ван Гизону с окраской эластических волокон резорцин-фуксином Вейгерта, ставили ШИК-реакцию. Полутонкие срезы окрашивали реактивом Шиффа и азуром II. Исследования проводили в универсальном микроскопе Leica DM 4000B (Германия). Ультратонкие срезы, контрастированные уранилацетатом и цитратом свинца, исследовали в электронном микроскопе JEM 1010 при ускоряющем напряжении 80 кВт.
Результаты исследования и их обсуждение
Светооптическое исследование первичных опухолей пациентов 1-й группы выявило превалирование зрелых форм аденокарцином, характеризующихся формированием папиллярных и тубулярных железистых структур, умеренно выраженной тканевой и клеточной атипией, появлением патологических митозов, в разной степени выраженными фиброзными изменениями стромы. В низкодифференцированной аденокарциноме среди обширных скоплений опухолевых клеток или фиброзных полей с трудом обнаруживались мелкие железы, степень анаплазии опухолевых клеток возрастала. Перстневидно-клеточный рак отличался диффузным распределением клеток типичной перстневидной формы и, как правило, отсутствием десмопластической реакции стромы.
Особый интерес представляло изучение состояния слизистой оболочки желудка в отдаленных от опухоли участках. При кишечном типе рака светооптическое исследование фрагментов пилорического отдела желудка во всех наблюдениях выявило наличие распространенной неполной кишечной метаплазии. Обращала на себя внимание атрофия слизистой оболочки, иногда выраженная, с заметным истончением собственной пластинки, дистрофическими изменениями покровно-ямочного эпителия и уменьшением количества желез [7]. Диспластические изменения эпителия от слабой до тяжелой степени (увеличение ядерно-цитоплазматического соотношения, снижение секреции мукоида, псевдомногорядность, повышение митотической активности) обнаружены в большинстве исследованных фрагментов. Характерна многофокусность диспластических изменений, нарастающих по направлению к опухолевому очагу.
В фундальном отделе желудка очаговая кишечная метаплазия эпителиоцитов отмечена у 25% пациентов. Диспластические изменения энтеролизованного и интактного эпителия выявлены в половине наблюдений. Мононуклеарная инфильтрация отличалась слабой интенсивностью и поверхностной локализацией. В целом, патологические изменения в фундальном отделе желудка носили менее выраженный характер по сравнению с пилорическим отделом.
При изучении регионарных лимфатических узлов обращали внимание на наличие, размер и множественность метастазов. У пациентов с аденокарциномами метастазы в лимфатических узлах обнаружили у 37% больных.
Таким образом, светооптическое исследование первичных опухолей желудка пациентов 1-й группы выявило преобладание зрелых форм аденокарцином, характеризующихся формированием капиллярных и тубулярных железистых структур, умеренно выраженной тканевой и клеточной атипией. В большинстве случаев зрелых аденокарцином опухолевый очаг хорошо отграничен от окружающих тканей стенки желудка. Перстневидно-клеточный рак отличался диффузным распределением изолированных округлой формы клеток, содержащих в цитоплазме большое количество слизи. Опухоль характеризовалась инфильтративным ростом и была плохо отграничена от окружающих тканей [8, 12].
Новообразования у пациентов 2-й группы состояли из полиморфных либо мономорфных по составу анапластических клеток, располагающихся в виде тяжей, комплексов, или изолированно друг от друга. Клеточные ядра различались по основным светооптическим характеристикам: форме, размерам, окраске. Наиболее часто в клетках недифференцированного рака желудка встречались крупные гиперхромные угловатой формы ядра, а также небольшие светлые пузырьковые ядра. Цитоплазма была, как правило, скудная и плохо различима. Анализ частоты и выраженности патологических изменений нетрансформированной слизистой оболочки обнаружил их сходство с перифокальными процессами при диффузном типе карцином в первой группе наблюдений, что свидетельствует об определенном гистогенетическом единстве этих вариантов рака желудка. Ведущим патологическим изменением являлась дисплазия генеративных зон желудочного эпителия на фоне атрофически-склеротических процессов. Метастазы в регионарных лимфатических узлах обнаружены у 38% пациентов, что соответствует аналогичному показателю в первой группе.
Таким образом, светооптическое исследование опухолей желудка пациентов 2-й группы выявило наличие недифференцированного рака с солидным или скиррозным характером роста. Опухолевый очаг был плохо отграничен от окружающих тканей стенки желудка, отличался инфильтративным ростом и латеральным распространением опухоли по подслизистому слою.
Смешанные формы (3-я группа) сочетали в одном опухолевом очаге участки аденокарцином с различной степенью дифференцировки (часто с перстневидными клетками) либо разные патогистологические варианты рака желудка. Морфологическая картина отражала направление «дедифференцировки» клеточных популяций от центра к периферии опухоли. Практически во всех исследованных случаях карцинома распространялась в глубь желудочной стенки, инвазируя подслизистый, мышечный, иногда серозный слои, в ряде наблюдений комплексы раковых клеток выявлялись в большом сальнике или брыжейке поперечной ободочной кишки.
В слизистой оболочке вне опухолевого очага у 60% пациентов имелась кишечная метаплазия, ограниченная пилорическим отделом желудка; с такой же частотой встречались атрофия, склероз и густая полиморфно-клеточная инфильтрация. Наличие метастазов в регионарных лимфатических узлах выявлено у 60% оперированных больных этой группы, что значительно превышало данные первых двух анализируемых групп.
Таким образом, светооптический анализ перифокальных процессов в слизистой оболочке при различных патогистологических формах рака желудка показал, что при высоко- и умереннодифференцированных аденокарциномах наиболее типичными изменениями являются распространенная неполная кишечная метаплазия и ассоциированная с этими участками дисплазия на фоне диффузной атрофии эпителия. При низкодифференцированной и перстневидно-клеточной аденокарциномах, а также при недифференцированном раке желудка на первый план выходят атрофические изменения слизистой оболочки и дисплазия генеративных зон эпителия [14].
Электронно-микроскопический анализ аденокарциномы желудка выявил множественные патологические изменения ультраструктуры малигнизированных клеток: большие, неправильной формы ядра с изрезанными контурами и неравномерным распределением крупноглыбчатого гетерохроматина в кариоплазме, увеличенным количеством ядрышек, иногда атипичными митозами.
При перстневидно-клеточном раке желудка преобладали опухолевые клетки с переполненной секреторными гранулами цитоплазмой и эксцентрически расположенным ядром аномальной формы. Слизистая оболочка желудка вне опухолевого очага отличалась мозаичностью ультраструктурной картины. В очагах кишечной метаплазии, кроме типичных покровно-ямочных эпителиоцитов, обнаружены также каемчатые и бокаловидные клетки, цитоплазма которых была переполнена крупными электронно-прозрачными глобулами слизи, а уплощенные ядра оттеснены к базальному полюсу клеток. На апикальной поверхности каемчатых эпителиоцитов выявлялись высокие, нерегулярно расположенные микроворсинки. В цитоплазматическом матриксе большое число митохондрий и развитая гранулярная цитоплазматическая сеть. Отражением атрофических процессов в слизистой оболочке желудка было наличие большого числа эпителиоцитов, почти лишенных микроворсинок, имеющих электронно-плотную цитоплазму с едва различимыми органеллами. В дистрофически измененных клетках покровно-ямочного эпителия наблюдалось уменьшение количества секреторных мукоидных гранул, среди которых преобладали незрелые, с плотным содержимым и неровными контурами. Диспластические изменения эпителиоцитов выражались в увеличении размеров ядер, появлении крупных ядрышек, значительном снижении содержания внутриклеточного муцина.
При недифференцированном раке желудка преобладали атипичные клетки с гладкими, лишенными микроворсинок контурами. Клеточные ядра отличались большими размерами, с глубокими инвагинациями в нуклеолемме, придающими ядру причудливую двухлопастную или трехлопастную форму. Изучение желудка при недифференцированном раке на отдалении от первичной опухоли показало высокую степень развития атрофически-склеротических процессов слизистой оболочки и наличие диспластических изменений эпителия, ассоциированных с генеративными зонами (желудочные ямки, верхние отделы шеек желез). Неполная кишечная метаплазия носила очаговый характер и была ограничена, как правило, пилорическим отделом желудка. Анализ частоты и выраженности патологических изменений нетрансформированной слизистой оболочки при недифференцированном раке выявил их сходство с перифокальными процессами при диффузном типе карцином в первой группе наблюдений, что свидетельствует об определенном гистогенетическом единстве этих вариантов рака желудка.
Ультраструктурный анализ карцином желудка со смешанным типом строения подтвердил полиморфизм тканей и клеточную атипию, обнаруженные при светооптическом исследовании. В участках опухоли обнаружили злокачественные клетки с признаками секреции слизи в виде различных по размеру гранул, содержащих муцин. При снижении уровня дифференцировки по направлению к периферии опухоли наблюдалось прогрессирующее изменение ядерно-цитоплазматического соотношения в сторону увеличения размеров ядер. В слизистой оболочке желудка на отдалении от опухолевого очага в ряде случаев отсутствовали патологические изменения покровно-ямочного эпителия. По мере приближения к опухолевому очагу нарастала выраженность и гетерогенность изменений эпителиальных структур слизистой оболочки желудка. Анализ перифокальных процессов в окружающей слизистой оболочке желудка выявил меньшую распространенность и частоту предраковых изменений (дисплазии, неполные кишечные метаплазии и атрофии эпителия), чем в других исследованных группах пациентов. В целом, это свидетельствует о более высоких темпах опухолевой прогрессии смешанных форм карцином желудка.
Проведен комплексный морфологический анализ, включающий световую и электронную микроскопию опухолевых очагов, нетрансформированной слизистой оболочки, и регионарных лимфатических узлов при раке желудка. По результатам микроскопического исследования слизистой оболочки желудка на отдалении от опухолевого очага у пациентов с высоко- и умереннодифференцированными карциномами желудка установлено, что наиболее типичными изменениями являются распространенная неполная кишечная метаплазия и ассоциированная с этими участками дисплазия. В прилежащих к опухоли участках слизистой оболочки нередко обнаруживалась неравномерная гиперплазия эпителия. При низкодифференцированной и перстневидно-клеточной карциномах, а также при недифференцированном раке желудка на первый план выходит дисплазия генеративных зон эпителия; неполная кишечная метаплазия носит очаговый характер.
Биологическая роль фибробластов в развитии опухолей
Аннотация
Среди всех клеток человеческого организма только фибробласты можно сравнить с тараканами по их способности к выживанию. Они в состоянии пережить тяжелый стресс, который обычно летален для других клеток, и только они могут быть культивированы из ткани после смерти организма или в процессе умирания ткани. Их устойчивость может быть обусловлена внутренними программами выживания и их пластичностью. Развитие злокачественной опухоли связано с фибробластами на всех стадиях, включая метастазирование. Они являются ключевым компонентом ответа организма на повреждение, вызванными опухолевыми клетками. Фибробласты, ассоциированные с опухолью (ФАО), становятся синтетическими машинами, которые продуцируют различные компоненты опухолей. ФАО играют роль в создании внеклеточного матрикса (ВКМ) и перепрограммировании метаболизма и иммунитета в микроокружении опухоли и ее адаптации к химиотерапии. Плейотропное действие ФАО на опухолевые клетки обусловлено их неоднородностью и пластичностью с разносторонним влиянием, зависящим от факторов среды.
Развитие злокачественных клеток запускает патологические процессы в организме, приводящие к формированию опухолевой ткани, которая содержит компоненты нормальных органов 4. Эти процессы, определяющие сложные гетерогенные взаимоотношения злокачественных клеток с нормальными клетками организма, известны как десмопластическая реакция, опухолевая строма или опухолевое микроокружение (ОМО). Опухолевая строма состоит из клеток иммунной системы, капилляров, базальной мембраны, активированных фибробластов и внеклеточного матрикса (ВКМ), окружающего злокачественные клетки [2]. На сегодняшний день стало совершенно очевидно, что развитие злокачественной опухоли и метастазирование опосредовано эффектами ОМО и зависит не только от автономных нарушений клетки [4, 8, 9]. Клетки иммунной системы, ангиогенез, напряжение кислорода, интерстициальное давление, ремоделирование ВКМ и метаболитов опухолевых клеток из ОМО заслужили особого внимания как важные детерминанты поведения клеток опухоли и прогрессии заболевания [1, 5, 10]. Основной компонент опухолевой стромы – фибробласты. Многие исследования за последнее время были направлены на изучение роли фибробластов в процессе развития злокачественной опухоли и метастазировании [11, 12]. Фибробласты, ассоциированные с опухолью были названы опухоль-ассоциированными фибробластами (ФАО), активированными фибробластами или активированными миофибробластами. Они могут включать также и мезенхимальные стволовые клетки (МСК). За прошедшее десятилетие ФАО прочно закрепили за собой роль ключевых компонентов в развитии злокачественной опухоли и новые исследования говорят об их участии во многих стромальных программах различных опухолевых процессов [13, 14]. Фибробласты обычно неподвижны и становятся активными только в ответ на повреждение ткани. Точный механизм их активации до сих пор остается невыясненным. Однако считается, что есть два типа активации фибробластов: “обратимый” и “необратимый”, частично определяющийся эпигенетическими факторами [15, 16] (РИС. 1). Активированные фибробласты были впервые описаны в механизме заживления ран и выявлены главным образом благодаря экспрессии α-гладкомышечного актина (α-ГMA; также известный как ACTA2) – белка цитоскелета, ассоциированного с клетками гладких мышц [17]. Из-за экспресии α-ГMA фибробласты называют миофибробластами 21. Активированные фибробласты являются также главным компонентом рубцов и важнейшим участником ответа на хронический процесс заживления ран, также известный как тканевой или органный фиброз [15, 22-25]. Постоянно продолжающийся (хронический) процесс заживления ран наблюдается при фиброзе органов и опухолевом росте [26], и он сильно отличается от соответствующего острого процесса [27, 28]. Несомненно, фибробласты являются самыми изменчивыми и наиболее изучаемыми клетками in vitro благодаря простоте их изолирования и культивирования. Они способны выживать при сильном стрессе и могут быть культивированы из тканей человека после его смерти [29]. В условиях беспощадного, высокодинамичного и опасного тканевого микроокружения, включая повреждение, вызванное химиотерапией или лучевой терапией, ФАО могут представлять постоянный вид стромальных клеток, который участвует в рецидиве опухоли. Несмотря на то, что они являются наиболее изучаемыми клетками в биологии, фибробласты остаются самыми мистическими и загадочными клетками. В последние годы всё больше информации появляется об их разнообразии и двойственной функции в развитии злокачественной опухоли.
Несмотря на схожесть, обусловленную очевидными идентичными чертами на клеточном уровне, нам всё ещё предстоит выяснить функциональные отличия между ФАО и фибробластами, ассоциированными с фиброзом (ФАФ) на молекулярном уровне. Более того, наши знания о пластичности фибробластов продолжают расти, формируя понимание того, какую роль она играет в функциональной вариабельности и сложности строения ОМО. В этом обзоре происхождение и функции фибробластов в физиологическом и патологическом перерождении паренхимы взрослого человека собраны воедино с особым акцентом на их функциональной гетерогенности в здоровом состоянии и при болезни.
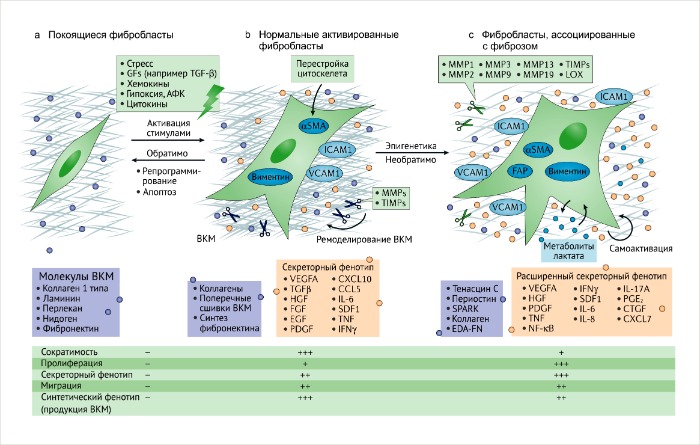
а. Покоящиеся или неактивные фибробласты – это инертные интерстициальные веретенообразные клетки, погруженные в физиологический внеклеточный матрикс (ВКМ).
b. В ответ на тканевое повреждение или ассоциированный с ним стимул, покоящиеся фибробласты обратимо активируются для обеспечения заживления и регенерации. Нормальные активированные фибробласты (НАФ) начинают экспрессировать актин гладких мышц (αSMA) и виментин, приобретая звездчатую форму.
Вместе с повышенной продукцией ВКМ, ремоделированием и перестройкой цитоскелета, фибробласты приобретают сократительные свойства. Полученные функции синтеза связаны с секрецией и миграцией, обуславливающими их активацию, вовлечение в клеточные процессы и пролиферацию. Обратимость такой активации может регулироваться репрограммированием или апоптозом активированных фибробластов, ассоциированных с процессом заживления, когда регенеративный процесс окончен.
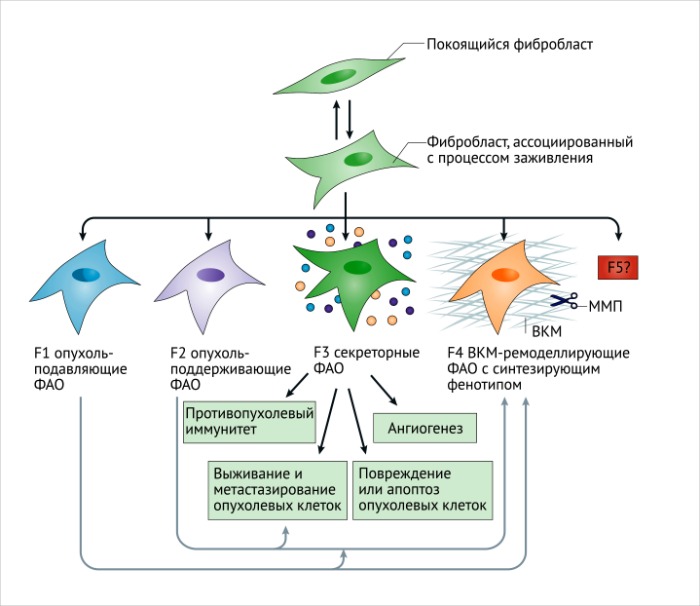
с. Активированные фибробласты могут приобретать секреторный фенотип, специализируясь на ремоделировании ВКМ, аутокринной активации и динамическом иммуномодуляторном сигналинге. Этот процесс связан с постоянными и неутихающими повреждающими стимулами, такими как появление и развитие злокачественных очагов. Эпигенетическая регуляция может ограничивать регрессию таких активированных состояний. Фибробласты, ассоциированные с фиброзом (ФАФ) и опухолью (ФАО), могут приобретать повышенную пролиферативную активность и различный фенотип, тем самым увеличивая гетерогенность среды фиброзного и опухолевого микроокружения.
Определение и происхождение фибробластов
Первоначально Вирхов [30] (ок. 1858) и чуть позже Дюваль [31] использовали классические анатомические приемы и микроскопию, чтобы описать клетки, находящиеся в соединительной ткани. Фибробласты были первыми обнаруженными клетками соединительной ткани, которые продуцировали коллаген. В нормальных тканях они обычно являются одиночными клетками, которые находятся в интерстиции и иногда рядом с капиллярами, без каких-либо связей с базальной мембраной, но внедренные в фибриллярные структуры межклеточного матрикса. Фибробласты являются неэпителиальными, неиммунными клетками с вероятным мезенхимальным происхождением и составляют значительную часть разнородных компонентов соединительной ткани [32] (БОКС 1).
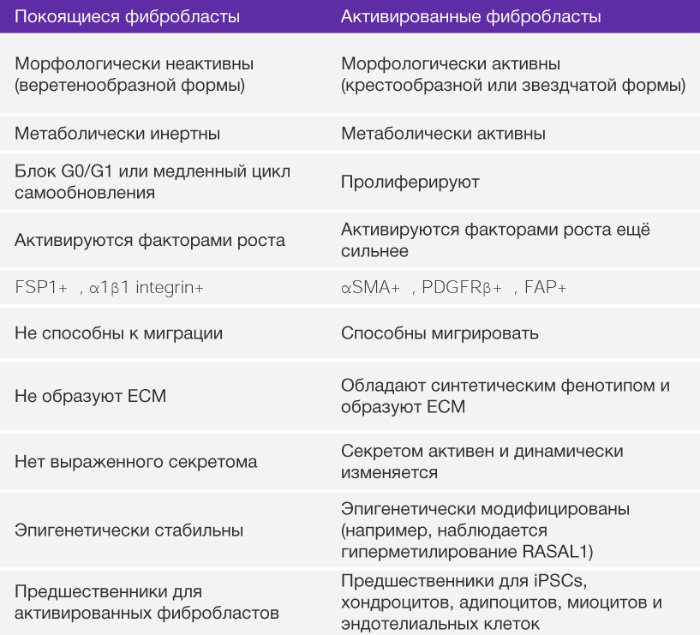
Фибробласты представляют собой классические веретенообразные клетки с потенцией к планарной полярности (РИС. 1). Фибробласты в нормальной ткани обычно рассматривают как медленнорастущие клетки с незначительной метаболической и транскрипционной активностью. При этом они находятся в спящем, бездействующем режиме. Покоящиеся фибробласты могут иметь много общих черт с предшественниками МСК (БОКС 2). Способность покоящихся фибробластов к активации и превращению в синтезирующие клетки (миофибробластами) было впервые выявлено при исследовании заживления ран [33] и позже при остром и хроническом воспалении и фиброзе тканей [17, 24, 34]. Нет никаких прямых доказательств того, что неактивные тканевые фибробласты у взрослых людей являются синтетически активными, кроме тех, что находятся в интерстициальном ВКМ.
Активированные фибробласты являются гетерогенной клеточной популяцией с различной экспрессией, зависящей от ткани, из которой они изолированы [235]. Количество клеточных пассажей и неидентичные условия культивирования могут также объяснить такую разнородность. Экспрессия гомеобоксных генов (HOX-генов) в фибробластах ограничена при культивировании [235], что подтверждает тот факт, что гетерогенность фибробластов отражает различные направления местной дифференцировки. Тщательное изучение собранных фактов говорит о том, что эмбриональные и развивающиеся ткани не имеют фибробластов, а, вероятно, наполнены мезенхимальными клетками. Как только развитие ткани завершено, большинство активных мезенхимальных клеток подвергается апоптозу, но некоторые (в любой ткани) превращаются в бездействующие фибробласты. Такие клетки наблюдал Вирхов [30] и позже назвал их фибробластами. В таких тканях, как взрослая сердечная мышца наблюдается большое количество бездействующих фибробластов. Таким образом, на сегодняшний день все свойства, приписываемые фибробластам, связаны с активированным фенотипом, а именно с их подтипом – миофибробластами. Одна из возможных функций бездействующих фибробластов – это их способность дифференцироваться в активную форму и, таким образом, основываясь на соответствующем стимуле, давать начало росту мезенхимальным линиям, включая хондроциты, адипоциты и эндотелиоциты. В этом отношении бездействующие фибробласты могут быть рассмотрены как взрослая форма тканевых мезенхимальных стволовых клеток. (rMSCs). Очевидно, что такие стволовые клетки отличаются от мезенхимальных стволовых клеток костного мозга (классических BM-MCS). Каким образом два типа мезенхимных стволовых клеток различаются по своим функциям, еще предстоит узнать.
αSMA, α‑гладкомышечный актин; ECM, внеклеточный матрикс; iPSCs, индуцированные плюрипотентные стволовые клетки; PDGFRβ, тромбоцитарного фактора роста рецептор-β; RASAL1, активатор RAS-белка 1.
На самом деле, более точное определение фибробластов – покоящиеся мезенхимальные клетки, обладающие потенциальной возможностью активации соответствующим стимулом и превращением в МСК (БОКС 2). Такие покоящиеся мезенхимальные клетки являются довольно редкими клетками интерстиция, способные к пролиферации при стимуляции факторами роста, такими как трансформирующий фактор роста бета (TФР-β), тромбоцитарный фактор роста (ТрФР) и интерлейкин-6 (ИЛ-6), и другие [11, 12] (БОКС 3). Исходя из этого нового определения можно предположить, что большинство свойств, приписываемых фибробластам, на самом деле являются свойствами “активированных” фибробластов, миофибробластов и МСК. Фибробласты, полученные из места заживления раны или из фибринозной ткани, секретируют повышенные количества элементов ВКМ и пролиферируют чаще, чем их товарищи, изолированные из здоровых органов [35, 36]. Такая повышенная активность связана с их активацией [35] (РИС. 1). После активации они начинают синтезировать ВКМ, цитокины и хемокины, мобилизуют иммунные клетки и прилагают физические силы для модификации архитектуры тканей [37, 38]. Хотя обнаружение фибробластов во многих тканях и не представляет сложности в наше время, их идентификация в эмбриональных тканях неоднозначна. В целом, покоящиеся фибробласты не встречаются в ходе эмбрионального развития и впервые отмечаются в дифференцированных тканях и органах. У взрослых людей остается неизвестным, вносят ли вклад в популяцию активированных фибробластов МСК или мезенхимальные предшественники моноцитов (фиброциты).
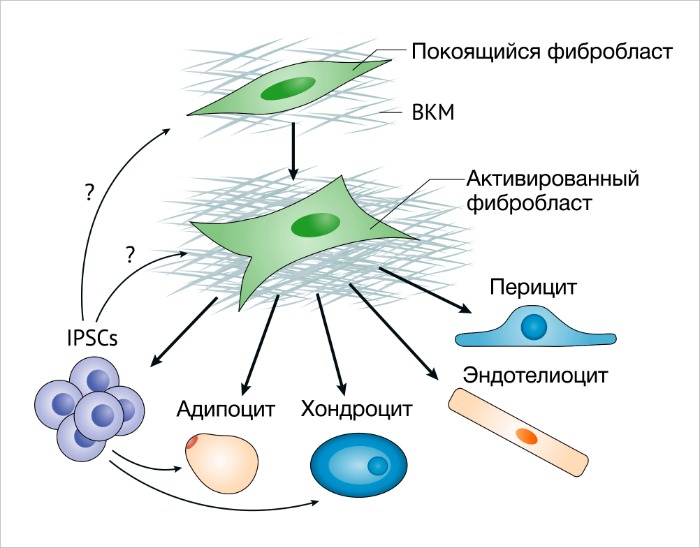
Некоторые факты говорят о том, что МСК из костного мозга (КМ-MСК) могут усиливать метастатическую активность клеток рака молочной желез [39]. Например, КМ-МСК составляют значительную часть ФАО с протуморогенными функциями при раке желудка, индуцированном воспалением [40]. Фиброциты, или клетки костномозгового происхождения CD45+ (CD45 также известен как PTPRC), продуцирующие коллаген I типа, могут способствовать образованию в рубце фиброзной ткани благодаря накоплению коллагена и продукции провоспалительного секретома [41]. Остается одна гипотеза – МСК могут быть просто бездействующими фибробластами, которые могут стать активированными, или МСК с мультилинейным потенциалом. Доподлинно известно, что активированные фибробласты при культивировании могут стать адипоцитами, эндотелиоцитами или хондроцит-подобными клетками и при индукции становятся индуцированными плюрипотентными стволовыми клетками (ИПСК) 44 (РИС. 2). Важно помнить, что бездействующие фибробласты не используются для таких экспериментов по индукции пластичности.
Заживление ран, фиброз и опухоль
Острый период заживления ран
Любое повреждение функциональной паренхимы приводит к какому-либо ответу организма. К повреждающим стимулам относят механическую травму, ущерб от радиации, экстремальной температуры, токсинов, патогенов и метаболических нарушений. Ответ организма начинается незамедлительно после нанесения повреждения функциональной паренхиме и заключается в регенерации поврежденных участков клетки и восстановлении тканевого гомеостаза [21, 34, 37, 46, 47]. Такое заживление ран запускается в ответ на различные типы острых повреждений. Классический процесс заживления включает воспаление, активацию ангиогенеза иммунными клетками и фибробластами и отложение ВКМ [12, 26, 34]. Многие составляющие ВКМ и базальных мембран – такие как коллагены I, III, IV и V типов, различные ламинины и фибронектины – продуцируются активированными фибробластами или миофибробластами [37, 48]. Миофибробласты также являются главным источником протеаз, которые отвечают за деградацию ВКМ, включая матричные металлопротеазы (ММП), что подчеркивает их ключевую роль в сохранении гомеостаза ВКМ благодаря контролю за его обновлением [49]. Миофибробласты были впервые выделены при заживлении кожной раны. Именно их активность была связана с процессом стягивания кожи [32, 37]. Миофибробласты, индуцированные ТФР-β–опосредованным сигнальным путем, пролиферируют и экспрессируют виментин и α-ГМА [17, 18]. Кроме этого, активированные фибробласты играют важную роль в сохранении гомеостаза прилегающего эпителия с помощью секреции факторов роста и прямых взаимодействий между эпителиальными и мезенхимальными клетками [50] (БОКС 1). После заживления количество активированных фибробластов значительно уменьшается благодаря апоптозу, и изначальный фенотип покоящихся фибробластов, вероятно, восстанавливается [37] (РИС. 1). Такая обратимость является важным признаком восстановления ткани, связанного с заживлением.
Тканевой фиброз
Если повреждающий фактор действует постоянно, как при воздействии хронических физических, токсических, метаболических и аутоиммунных факторов, регенеративный ответ идет безостановочно и приводит к хроническому процессу заживления, также известному как фиброз. Таким образом, тканевой фиброз можно рассматривать как повреждение, которое тормозит процесс заживления из-за постоянной активации механизмов регенерации. Частично это регулируется эпигенетическими механизмами в активированных фибробластах, что усиливает активность антиапоптотических сигнальных путей и пролиферацию клеток, приводящую к генерации гиперактивированных фибробластов. Патологическое ремоделирование и фиброз в тканях могут повышать активность ФАФ с различным происхождением, маркерами активации и функциями 53.
Опухолевый фиброз
Хронический процесс регенерации ткани также осуществляется при генетическом повреждении функциональной паренхимы при злокачественной опухоли. В этом отношении опухоли можно рассматривать как «язвы, которые никогда не заживают» (ССЫЛКА 26). Постоянное возникновение и наращивание массы опухолевых клеток отражает прогрессирующее повреждение ткани, которое вызывает хронический процесс заживления по отношению к опухолевым клеткам. Это приводит к хронической ответной реакции организма, известной как опухолевый фиброз или стромообразование. Термин “опухолевый фиброз” аналогичен термину “десмопластическая реакция”, “опухолевое стромообразование” или ОМО. Роль миофибробластов в заживлении раны хорошо изучена, но их функциональное значение в прогрессии злокачественной опухоли и метастазировании представляется сложным и неоднозначным, одновременно и стимулирующим злокачественную опухоль, и тормозящим [12, 55, 56]. В 1970-х были выполнены новаторские исследования, которые позволили установить, что злокачественные клетки могут мобилизовать активированные фибробласты, сходные с фибробластами, ассоциированными с процессом заживления ран 61. Вовлечение стромальных фибробластов в опухоль значительно регулируется факторами роста, синтезируемыми злокачественными клетками и инфильтрированными иммунными клетками. ТФР-β, ТрФР и фактор роста фибробластов типа 2 (ФРФ-2) являются ключевыми медиаторами в активации фибробластов при остром и хроническом процессах повреждения ткани [62]. Мобилизация активированных фибробластов при многих видах злокачественных опухолей зависит от ТФР-β [63, 64]. Локальная пролиферация и инвазия ФАО стимулируется ТФР-β, представленными в опухолевом микроокружении. Существует еще одно предположение, что активация фибробластов является ответом организма на противодействие злокачественному роста и попыткой элиминации опухоли [11, 56, 62, 65]. ТрФР, секретируемый злокачественными и стромальными клетками (включая фибробласты), может активировать и индуцировать пролиферацию фибробластов и коррелировать с прогрессией злокачественной опухоли [66]. Точный механизм разрастания опухолевой стромы и опухолевого фиброза остается неизученным. На ранних стадиях образования солидных опухолей, злокачественные клетки формируют неопластические очаги, которые возникают в микроокружении эпителия [10, 67]. Многие исследования показали, что карцинома in situ уже включает в себя “реактивный” опухолевый фиброз [2, 68]. Ведутся оживленные дебаты по поводу значения реактивной опухолевой стромы в прогрессии злокачественной опухоли, где спорным является вопрос о ее роли в защите от инвазивных и злокачественных изменений в карциноме in situ [69].
В целом, действие опухолевой стромы рассматривается как стимулирующее возникновение злокачественной опухоли и ее развитие. Точный клеточный и молекулярный механизмы, которые осуществляют превращение карциномы in situ в инвазивный рак, неизвестны, но большинство ученых сходится во мнении, что опухолевая строма, скорее всего, является индуктором этого процесса. В этом отношении миоэпителиальные клетки, которые имеют некоторые общие черты с миофибробластами протоков молочных желез, содержащих злокачественные клетки, могут играть регуляторную роль в прогрессии опухоли [70].
На ранних этапах неоплазии воспалительные сигналы, появившиеся, возможно, в результате патологического преобразования ткани, могут стимулировать провоспалительные и опухоль-стимулирующие функции фибробластов. Секреция ИЛ-1β иммунными клетками в ранних опухолевых очагах ведет к активации в фибробластах сигнального пути транскрипцио́нного фактора NF-κB, результатом которого является образование проопухолевого секретома [71].
Создание ран у предрасположенных к злокачественным новообразованиям куриц, инфицированных вирусом саркомы Рауса, приводит к появлению инвазивной карциномы в толще поврежденной ткани [72]. В генномодифицированных мышах с экспрессией jun-онкогена также отмечается связь между нанесением наружного повреждения и появлением злокачественной опухоли [73]. Хотя эта связь остается неизученной у млекопитающих, во многих эпидемиологических и клинических исследованиях выдвинута гипотеза, что тканевой фиброз в таких органах, как печень, легкие и поджелудочная железа, может повысить риск появления карцином 74. Развитие гепатоцеллюлярной карциномы безусловно связано с предшествующим фиброзом печени [77, 78]. Нормальная строма в большинстве органов содержит небольшое число покоящихся фибробластов, погруженных в физиологический ВКМ [2], в то время как реактивная опухолевая строма или фиброзная ткань обычно наполнены большим количеством активированных фибробластов, которые обычно экспрессируют α-ГМА или белок-активатор фибробластов (БАФ) и демонстрируют повышенное отложение коллагена, фибрина и других составляющих ВКМ по сравнению с бездействующими фибробластами [6, 11, 13]. Привлечение новых капилляров и аккумуляция иммунных клеток в ОМО регулируется многими факторами роста, такими как фактор роста эндотелия сосудов А (ФРЭС-A), ТрФР, эпидермальный фактор роста (ЭФР), ИЛ-6 и ИЛ-8, наряду с некоторыми другими. Вдобавок к продукции ФРЭС-A злокачественными клетками, ее также осуществляют активированные фибробласты [79]. ФРЭС-A, также известный благодаря своей способности увеличивать проницаемость сосудов, играет центральную роль в транссудации жидкости из сосудов, приводя к повышенной реактивности периваскулярной области, содержащей фибрин и тромбоциты. Они, в свою очередь, стимулируют аккумуляцию иммунных клеток, пролиферацию эндотелиоцитов и активированных фибробластов [80]. Опухолевая строма насыщается белками ВКМ, такими как коллаген I типа и фибронектин, которые инициируют ангиогенез 80. С ростом опухоли и приобретением инвазивности, стромальный компонент также увеличивается. Опухолевая строма на поздних стадиях злокачественной опухоли содержит повышенное количество различных типов коллагена, ламининов, фибронектинов, протеогликанов, периостинов и тенасцина-С, наряду с другими веществами [5, 83]. Периостин и тенасцин-С, частично продуцируемые активированными фибробластами, обычно отсутствуют в нормальных тканях молочной железы у взрослых, но они экспрессируются при раке груди [2, 84-87]. Многие недавние исследования продолжают указывать на то, что активированные фибробласты регулируют развитие злокачественной опухоли благодаря активному действию их секретома, который включает факторы роста и ВКМ.
Функция фибробластов и их гетерогенность
На сегодняшний день совершенно ясно, что многие различные маркеры позволяют идентифицировать активированные фибробласты. К ним относятся: специфический белок фибробластов (СБФ-1, также известный как S100A4), виментин, α-ГMA, БАФ, ТрФР-α, ТрФР-β, десминовые и дискоидиновые домен-содержащие рецепторы типа 2. Также важно заметить, что рецепторы ТрФР (ТрФР-α and ТрФР-β) и связанный с ними сигнальный путь могут служить мишенями для фармакологических средств 88. СБФ-1 является надежным маркером для определения покоящихся непролиферирующих (Ki67-негативных) фибробластов в интерстиции [91]. Важно отметить, что ни один из этих маркеров не является строго специфичным для покоящихся или активированных фибробластов. Например, СБФ-1 также идентифицирует макрофаги и, возможно, другие иммунные клетки; кроме того, экспрессируется некоторыми злокачественными клетками [92, 93]. БАФ также присутствует в подгруппе иммунных клеток CD45+ [94]. Десмин и ТрФР-β экспрессируются периваскулярными клетками [95]. Таким образом, при использовании этих маркеров содержание, морфология и пространственное распределение клеток должны приниматься во внимание для идентификации покоящихся и активированных фибробластов. Также вероятно, что многие активированные фибробласты не экспрессируют все эти общепризнанные маркеры в одно и то же время [96, 97], что повышает степень их неоднородности (РИС. 4). Остается неизвестным, выполняет ли какие-либо уникальные функции каждая из подгрупп активированных фибробластов, идентифицированных несколькими перекрывающимися или неперекрывающимися маркерами. Маркеры ФАО могут также быть связаны с клетками, обладающими разнообразными и, возможно, противоречащими функциями даже в одном специфическом опухолевом микроокружении. Потеря экспрессии кавеолина-1 при раке молочной железы может определять развитие метаболически измененных фибробластов с про-опухолевыми функциями [98, 99], в то время как высокая экспрессия кавеолина-1 у ФАО может обеспечить опухолевую инвазию посредством ремоделирования ВКМ [100]. Покоящиеся фибробласты, предположительно, также как и Т-лимфоциты, способны дифференцироваться в разнообразные подгруппы активированных фибробластов, которые, скорее всего, будут иметь различную активность (РИС. 5).
Чтобы идентифицировать такие подгруппы, следует использовать набор различных маркеров клеточной мембраны для детекции. Таким образом, необходимо проводить соответствующие исследования в целях определения их специфической активности. Гетерогенность фибробластов, в частности активированных, может также зависеть от происхождения предшественников фибробластов. Активированные фибробласты имеют костномозговое происхождение; их предшественниками в целом могут являться МСК, эндотелиоциты, звездчатые клетки печени и поджелудочной железы, покоящиеся тканевые фибробласты, и, возможно, некоторые эпителиальные клетки [4, 11, 22, 40]. В зависимости от их происхождения, функции таких активированных фибробластов могут быть различными и уникальными. Возможно, будущие исследования смогут ответить на эти интригующие вопросы.
Фибробласты являются выоскопластичными клетками и обладают мультипотентностью. Активированные фибробласты быстро трансдифференцируются в хондроциты, миоциты и адипоциты, эндотелиоциты и другие клетки 45. Активированные фибробласты могут приобретать периваскулярные и васкулярные функции. Индуцированные плюрипотентные стволовые клетки были первыми клетками, полученными при помощи активированных фибробластов, которые до сих пор являются их самым насыщенным источником [42]. Пластичность фибробластов также может определять их гетерогенные функции.
ECM – внеклеточный матрикс.
Эпигенетическая регуляция фибробластов
В большинстве карцином активированные фибробласты считаются главными регуляторами многих различных стромальных программ и сигнальных путей в опухолевых клетках [20]. Сигналы, которые регулируют превращение покоящихся фибробластов в ФАО в опухолях, вероятно, сложны, но в культуре некоторые фенотипические черты, характерные для ФАО, могут быть индуцированы под действием ТФР-β [18]. Несмотря на это, новые научные данные говорят о том, что необратимая активация фибробластов может быть вызвана эпигенетическими альтерациями [15, 16, 101, 102]. При развитии опухоли — процессе, отличающемся от процесса заживления ран, но имеющем сходство с фиброзом, фибробласты остаются постоянно активными. В последние годы было сделано предположение, что при острых ситуациях эффект факторов роста на активацию фибробластов имеет обратимый характер. Но при хронизации тканевого фиброза и опухолевого стромообразования активированные фибробласты получают уникальные свойства, которые не наблюдаются у фибробластов, ассоциированных с заживлением ран или при остром повреждении (РИС. 1). Исследования опухолей молочной железы у человека показывают, что стромальные клетки (преимущественно фибробласты) имеют уникальные эпигенетические изменения, которые не наблюдаются в фибробластах нормальной ткани молочной железы [103].
Долгое время считалось, что ФАФ и ФАО могут быть легко культивированы из опухолевой ткани и что они пролиферируют намного быстрее, чем активированные фибробласты, полученные из нормальной ткани, или из ткани с острым повреждением, или из заживающей раны. При обработке ФАФ с помощью деметилируюшего агента 5-азацитидина их пролиферативная активность падала, синтез коллагена I типа и экспрессия α-ГMA снижались. Гиперметилирование RAS-подобных белков-активаторов (RASAL1), наряду с частичной инактивацией RASAL1, приводит к реактивации RAS в почечных ФАФ, но не в тех фибробластах, что изолируются из нормальной ткани или ассоциированы с острым повреждением почек [104]. Это исследование предоставляет первое доказательство роли эпигенетических альтераций в необратимой активации ФАФ. При фиброзе легкого эпигенетические модификации могут определить резистентность ФАФ к FAS (также известному как TNFRSF6)-опосредованному апоптозу [105] и дифференцировке миофибробластов [106, 107]. Стромальные клетки простаты с гиперэкспрессией эпигенетических регуляторов высокомобильной группы AТ-петли 2 (HMGA2) играли важную роль в индукции интраэпителиальной неоплазии [108]. Эпигенетический переключатель, ответственный за регуляцию ингибиторного фактора лейкемии (ИФЛ), может привести к активизации проинвазивных функций ФАО благодаря повышенной активности сигнального трансдуктора Янус-киназы 1 (JAK1) и активатора транскрипции 3 (STAT3). Двойное ингибирование ДНК-метилтрансферазы и активности Янус киназы поддерживает неинвазивный фенотип ФАО [109]. Будущие исследования, возможно, раскроют гораздо больше таких эпигенетических контрольных узлов в генерации ФАО.
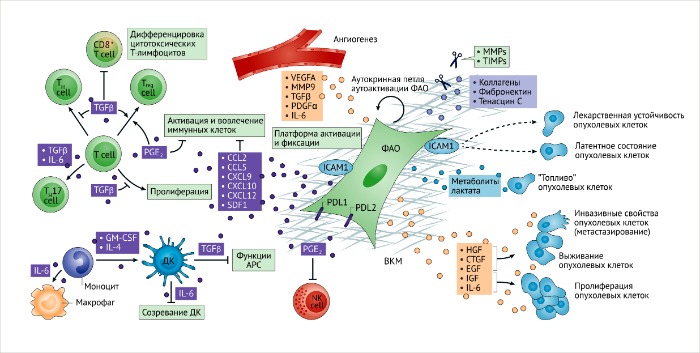
ФАО и их секретом участвуют в ремоделировании опухолевой стромы. Внеклеточный матрикс (ВКМ) вместе с клеточными компонентами опухолевого микроокружения сильно изменяются и репрограммируются фибробластами, ассоциированными с опухолью (ФАО). Секреторные функции регулируют иммунную перестройку (слева), самоактивацию (посередине) и связывают опухолевые клетки (справа), инициируя или ограничивая их рост, выживание или сопротивляемость к терапии. Метаболическая перестройка в ФАО может также поддерживать опухолевое микроокружение и стимулировать адаптацию опухолевых клеток к опухолевому росту. ФАО также могут сильно влиять на опухолевый ангиогенез, который косвенно влияет на вовлечение иммунных клеток и их активацию, миграцию опухолевых клеток и их инвазивные свойства. Внутриклеточная молекула адгезии (ICAM1), которая экспрессируется ФАО, может служить в качестве депо для активации и репрессии иммунных клеток и лиганда 1 белка программируемой клеточной смерти (PDL1), а экспрессия PDL2 на ФАО может влиять на иммуносупрессивные функции. Секретом ФАО имеет потенциальный ремоделирующий эффект на противоопухолевый иммунитет, затрагивая врожденные механизмы активации иммунных клеток, и поляризуя адаптивный иммунный ответ.
APC, антигенпрезентирующие клетки; CCL, хемокины с C-C мотивом; CTGF, фактор роста соединительной ткани; СXCL, хемокины с C-X-C мотивами; DC, дендритные клетки, EGF, эпидермальный фактор роста; GM-CSF, колониестимулирующий фактор роста гранулоцитов и макрофагов; HGF, гепатоцитарный фактор роста; IGF, инсулиноподобный фактор роста; IL, интерлейкин; MMP, матриксные металлопротеазы; NK, натуральные киллеры; PDGFα, фактор роста тромбоцитов; PGE2, простагландин E2; SDF1, фактор роста стромальных клеток; TGFβ, трансформирующий фактор роста; TH, Т-хелперы; TIMPs, тканевые ингибиторы металлопротеиназ; Treg cells, регуляторные Т-клетки; VEGFA, фактор роста эндотелия сосудов А.
Фибробласты, ассоциированные с опухолью: положительные регуляторы развития злокачественной опухоли
ФАО и канцерогенез
Активированные фибробласты, изолированные из опухолей организма человека, проявляют различные свойства по сравнению с фибробластами, полученными из нормальных органов [32] (РИС. 1). Важно помнить, что программы активации фибробластов могут быть индуцированы искусственно, с помощью изменений условии среды. Несмотря на это, существуют некоторые фундаментальные различия между культурированными нормальными фибробластами и аналогичными клетками, полученными из органов с тканевым фиброзом или из опухолевой ткани. ФАФ и ФАО пролиферируют гораздо быстрее, чем нормальные активированные фибробласты (НАФ). ФАО и ФАФ проявляют повышенную миграционную способность, обладают активным сигналингом фактор-индуцируемого аутокринного роста и высоким уровнем молекулярной секреции, что включает в себя выделение факторов роста и хемокинов (РИС. 1). Такое различие может быть обусловлено обнаруженными эпигенетическими изменениями, вероятно, как следствие влияния способствующей их активации внешней среды: в ФАФ и ФАО, но не в НАФ. Во многих экспериментах с совместным культивироваванием ФАО усиливали развитие опухоли, в отличие от НАФ [111]. Первоначально было продемонстрировано, что когда трансформированные симианским вирусом 40 (SV40) эпителиальные клетки простаты были смешаны с НАФ и ФАО, и эти смеси были привиты мышам, то именно ФАО (в отличие от НАФ) приводили к образованию неоплазий, похожих на интраэпителиальную опухоль [112]. ФАО также были способны индуцировать инвазию неинвазивных опухолевых клеток [113]. Подобные исследования были проведены и с другими видами опухолей [111]. Способность ФАО влиять на процесс развития опухоли зависит от их способности индуцировать ангиогенез, опосредованно через фактор стромальных клеток 1 (ФСК-1; также известен как CXCL12) или вовлечение эндотелиоцитов костномозгового происхождения [111]. Некоторые секретируемые ФАО молекулы-регуляторы имеют проонкогенный эффект (БОКС 3). Повышение экспрессии фактора теплового шока 1 (ФТШ-1) в ФАО может содействовать ФТШ-1-опосредованной программе в злокачественных клетках, поддерживая проопухолевое влияние ОМО [114]; а активация Yes-ассоциированного белка в ФАО усиливает уплотнение ВКМ и инвазивность злокачественных клеток [115]. Деактивация сигнальный путей, опосредованных Notch и p53 в ФАО, в дальнейшем усиливает пролиферацию этих клеток [116]. Для понимания того, как эти пути деактивируются в ФАО, необходимы дальнейшие исследования. Активированные фибробласты продуцируют протеазы, деградирующие ВКМ — такие как ММП 118. Подвижность и инвазивность злокачественных клеток регулируются ММП. Стромелизин-1 (также известный как MMП-3) синтезируется активированными фибробластами в больших количествах и расщепляет Е-кадгерин, стимулируя в прилегающих злокачественных клетках эпителиально-мезенхимальный переход (ЭМП) и инвазионную способность [120]. Кроме того, активированные фибробласты синтезируют MMП-1, который также индуцирует инвазивность [117]. Далее, делеция рецептора TФР-β типа II в фибробластах, экспрессирующих СБФ-1, приводит к развитию инвазивной плоскоклеточной карциномы кардиального отдела желудка или к интраэпителиальной неоплазии, зависимой от гепатоцитарного фактора роста (ГФР), продуцируемого фибробластами [8]. Продуцируемые фибробластами экзосомы также являются положительными регуляторами развития опухоли и стромального перерождения, за счет регуляции активности фибробластов и химиорезистентности 121. Фибробласты, у которых отсутствуют четыре компонента тканевого ингибитора семейства металлопротеинкиназ, образуют экзосомы с повышенной экспрессией MMП и активностью дизинтегрина и белка с доменом металлопротеиназной (ADAM10), связанные с большей подвижностью злокачественных клеток, метаболическим перепрограммированием и индукцией свойств опухолевых стволовых клеток [125].
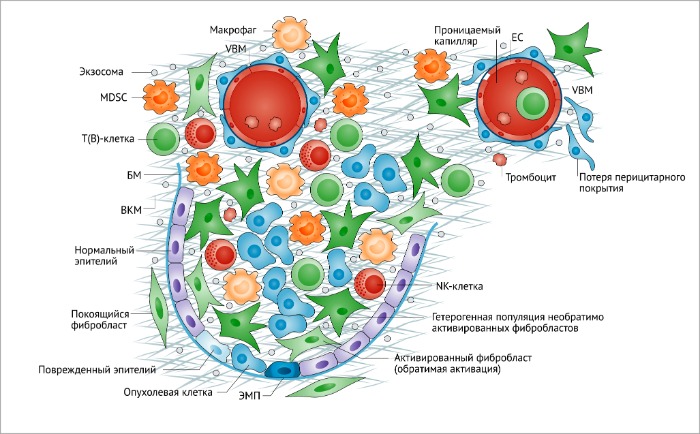
Фибробласты – гетерогенная популяция опухолевого микроокружения. Фибробласты, составляющие доминирующий клеточный компонент опухолевого микроокружения, которое, в свою очередь, состоит из инфильтрата иммунных клеток, нормального и поврежденного эпителия, неопластических эпителиальных клеток, перицитов и сосудистой базальной мембраны. Фибробласты, ассоциированные с опухолями (ФАО) являются гетерогенной популяцией необратимо активированных фибробластов с различными функциями.
BM, базальная мембрана; ЕС, эндотелиальные клетки; ЕМТ, эпителиально-мезенхимальный переход; MDSC, клетки-супрессоры миелодного происхождения; NK, натуральные киллеры.
Преобразование ВКМ фибробластами также может играть роль в создании и поддержании ниши опухолевых стволовых клеток. Фибробласты могут быть использованы опухолевыми стволовыми клетками для индукции среды по поддержанию своей популяции клеток. Экспрессия периостина (POSTN) фибробластами, вероятно, носит лимитирующий характер для стромального преобразования, мобилизации WNT-лигандов и поддержания ниши опухолевых стволовых клеток, регулируемой сигнальным путем WNT [126].
Повышение активности WNT-пути обнаружено во многих стволовых опухолевых клетках кишки, близко расположенных к ФАО, что, вероятно, вовлекает ГФР, синтезируемый такими фибробластами, в регуляцию создания ниши опухолевых стволовых клеток [127]. В случае раке легкого опухолевые стволовые клетки и клетки-инициаторы злокачественного роста являются сильными активаторами фибробластов благодаря экспрессии тромбоспондина-2, усиливающего процесс метастазирования [128]. Паракринная сигнализация между опухолевыми клетками и фибробластами задействует инсулиноподобный фактор роста II (ИФР-2), который также является производным фибробластов, и сигнальный путь, связанный с рецептором ИФР-1 в стволовых опухолевых клетках, усиливающий экспрессию Nanog и формирующий стволово-подобный фенотип опухолевых клеток [129].
Роль ФАО в метастазировании
Активированные фибробласты являются важными медиаторами вторичного роста опухоли в процессе метастазирования. В сайте первичной локализации опухоли ФАО способны усиливать интенсивность метастазирования благодаря высвобождению факторов роста и цитокинов в кровоток для стимуляции (косвенной или прямой) роста и инвазивных способностей злокачественных клеток в отдаленные структуры [114, 130, 131]. ФАО могут также влиять на уплотнение ВКМ в первичных опухолях, увеличивая инвазивность злокачественных клеток; кроме этого, они способны участвовать в образовании каналов ВКМ с целью перемещения по ним неопластически измененных клеток [133]. Фибробласты, ассоциированные с метастазированием (ФАМ), экспрессирующие тенасцин С и ФРЭС-А, являются ключевыми медиаторами в процессе роста метастазов рака груди в легкие [134]. Прорастание метастазов меланомы в печень основывается на активации звездчатых клеток (резидентных печеночных фибробластов), участвующих в поддержании ангиогенеза [135]. При колоректальном раке ФАО, стимулированные TФР-β1, секретируют ИЛ-11 с целью повышения выживаемости колоректальных опухолевых клеток и успешности колонизации органа [136]. ФАО, стимулированные ТрФР, также усиливают интравазацию клеток колоректального рака и формирование отдаленных метастазов благодаря секреции станниокальцина-1 [137]. Фибронектин, ассоциированный с микроокружением легких, и клетки костного мозга, экспрессирующие рецепторы к ФРЭС-1, также поддерживают метастазирование клеток меланомы [138]. Утрата функции Fsp1 у мышей (мыши с нокаутом гена Fsp1) приводит к снижению подвижности фибробластов и ассоциировано с торможением темпов метастазирования [139]. ФАМ могут быть активированы в месте метастазирования в результате распространения злокачественных клеток или воспалительного ответа. Они могут появиться из других частей опухоли или из костного мозга и сразу вовлекаться в метастатический процесс; также они могут происходить из резидентных тканевых фибробластов. Их различное происхождение может также объяснять их функциональную гетерогенность.
ФАО и опухолевый метаболизм
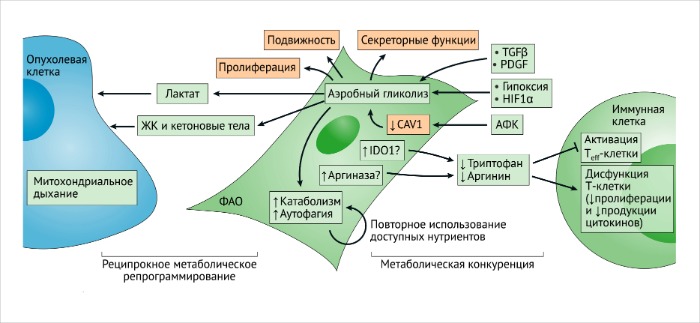
Клеточный метаболизм ФАО схож с метаболизмом быстро пролиферирующих клеток, который основывается на аэробном гликолизе [140]. Виновниками метаболических сдвигов при активации фибробластов являются TФР-β, ТрФР, гипоксия, индуцируемый гипоксией фактор 1α (HIF1α) и супрессия кавеолина-1 активными формами кислорода (АФК) [ССЫЛКИ 98, 141, 142].
Метаболическая адаптация может отображать ответ ФАО на внутриопухолевую гипоксию, вероятнее всего, обусловленную попыткой поддержания пролиферативной программы (РИС. 6).
Усиленный эффект Варбурга в ФАО связан с повышенной катаболической активностью и аутофагией [98, 141, 143].
Такие метаболические адаптации играют важнейшую роль в перенаправлении нутриентов на нужды других клеток ОМО и злокачественных клеток. В частности, повышенная продукция лактата в фибробластах с нокаутированным геном кавеолина-1, так же как и увеличенный уровень кетоновых тел, жирных кислот и глутамина наблюдаются в связи с их возможным участием в роли “топлива” для митохондриального дыхания в анаболических злокачественных клетках [141, 144]. ФАО могут принимать участие в анаболическом и катаболическом балансе опухолевых клеток в ОМО, представленном местами в достаточно разнородном виде. Повышенная активность анаболических процессов и митохондриального дыхания у злокачественных клеток может привести к усилению резистентности к терапевтическим средствам и началу метастазирования 146.
Метаболическое перепрограммирование ФАО зависит не только от паракринных влияний злокачественных клеток, но и от внутриклеточных контактов между ними, которые способны стимулировать взаимное метаболическое репрограммирование [148]. Исследования по установлению полного профиля экспрессируемых белков у ФАО выявило подавление изоцитратдегидрогеназы 3А (ИДГ-3А), стабилизацию HIF1α и индукцию генов гликолиза в условиях нормального содержания кислорода [142]. Активация р62 в ФАО ведет к ослаблению клеточного окислительно-восстановительного потенциала и повышению уровня ИЛ-6, обусловленного АФК [149]. Несмотря на то что специфические механизмы, инициирующие репрограммирование метаболизма в ФАО, требуют дальнейших исследований, уже становится очевидным, что метаболические изменения, однажды возникнув, получают способность к самоподдержанию – в частности, вероятно, благодаря эпигенетическим перестройкам. Однако метаболический симбиоз ФАО и злокачественных клеток может динамически развиваться лишь в ответ на активность кислорода, доступность внеклеточных метаболитов и сигнальные пути хемокинов и цитокинов. Гаплонедостаточность “датчика” кислорода и регулятора HIF1α пролилгидроксилазы 2 (PHD2; также известного как EGLN1) в MMTV-PyMT (средний Т-антиген полиомавируса мышиной опухоли молочной железы) у мышей снижает активацию ФАО in vivo и ассоциирована со снижением интенсивности метастазирования в легкие, вероятно, благодаря уменьшению продукции ТФР-β1 и репрограммированию ФАО [150]. Гипоксия также может играть прямую роль в активации ФАО [150]. Эти наблюдения говорят о том, что рецепция кислорода и метаболическое репрограммирование ФАО может влиять на их функцию (или функции) в растущих опухолях. Наконец, метаболизм ФАО может адаптироваться в ответ на курсы осуществляемой противоопухолевой терапии (о чем подробнее обсуждается ниже). Вклад изменений в метаболических программах ФАО, в основном, был изучен в контексте их влияния на рост злокачественных клеток, пролиферацию и инвазивность. В ходе метаболизма ФАО из-за нарушений в доступности метаболитов могут также индуцироваться проопухолевые биохимические циклы. Недостаточное поступление триптофана и аргинина в организм играет ключевую роль в активации Т-клеток и лимфоцитов, а метаболическая адаптация ФАО может регулировать биодоступность этих воспалительных метаболитов 153. Цитотоксические CD8-экспрессирующие Т-клетки имеют гиперактивированный гликолитический метаболизм, а роль ФАО в обеспечении биодоступности нутриентов для иммуных клеток также подтверждает их иммуномодуляторную функцию. В этом отношении, метаболическая конкуренция между стромальными клетками может привести к снижению реактивности Т-клеток в опухолях [152]. Эпителиальный канцерогенез может запускать метаболическое перепрограммирование ФАО, а также их гликолитическую и катаболическую адаптации в целях обеспечения реципрокного метаболического симбиоза между ФАО и злокачественными клетками [156]. Произвольные или специфически обусловленные симбиотические отношения между ФАО и опухолевыми клетками могут быть потенциальной мишенью для противоопухолевой терапии. Однако являются ли такие симбиотические отношения причиной развития метастазов – в целом, остается неизвестным.
ФАО и противоопухолевый иммунный ответ
Плейотропное иммуномодуляторное влияние ФАО может быть прямым и непрямым. ФАО могут приобретать секреторный фенотип, осуществляя синтез белков ВКМ, экспрессию ВКМ-преобразующих ферментов и синтез множества цитокинов и хемокинов. Секретом ФАО не только постоянно поддерживает их в активированном состоянии в период опухолевой прогрессии, но также может динамически изменяться по мере развития опухоли, таким образом, по-разному влияя на противоопухолевый иммунитет на разных стадиях злокачественного роста. Секретом этих клеток также способен действовать на регуляцию противоопухолевого иммунного ответа напрямую (РИС. 3). Несмотря на то что недавние исследования секретома подтвердили гипотезу о положительном влиянии ФАО-специфического секретома на активацию опухолевых иммунных клеток, подобные кинетические исследования имеют ограничения в отношении клеток, развивающихся in vitro 159, и поэтому, в целях достоверного изучения роли секретома ФАО в обеспечении иммуномодуляторного ответа, проводятся in vivo. Тем не менее, данные работы указывают на гетерогенность секретома фибробластов [157, 159] и его избирательное влияние на биологию опухоли с применением химиотерапии или без нее [160]. Дальнейшие исследования с использованием специфических методов удаления из фибробластов цитокинов и хемокинов в доклинических моделях опухолей раскроют более точный список иммуномодуляторных цитокинов и хемокинов, синтезируемых ФАО. В целом, ФАО рассматривают как активаторов иммуносупрессивного влияния ОМО [161, 162]. Однако, возможно, это больше зависит от условий, нежели является специфической особенностью ФАО. В условиях гипоксии в опухолевом микроокружении ФАО, злокачественные клетки, эндотелиоциты и иммунные клетки динамично взаимодействуют, что значительно усложняет систему их паракринного влияния друг на друга.
Более того, большинство исследований, направленных на изучение иммуномодуляторного влияния секретома ФАО и иммунного ответа основывается на данных, полученных in vitro или на исследованиях in vivo, при которых ФАО, размноженные до инъекции in vitro, физически взаимодействовали со злокачественными клетками in vivo. Секреция ФАО в определенных опухолях цитокинов, хемокинов и про-ангиогенных факторов, включая, например, ИЛ-6, ИЛ-4, ИЛ-8, ИЛ-10, фактор некроза опухолей (ФНО), TФР-β, CCL2, CCL5 (также известный как RANTES), CXCL9, CXCL10, SDF1, простагландин E2 (ПГ-E2), оксид азота (NO), ГФР и человеческий лейкоцитарный антиген G (HLAG), может иметь прямой и/или непрямой эффекты на противоопухолевый иммунитет 163. Хотя сигнальный путь ИЛ-6 и так связан с ограничением созревания дендритных клеток (ДК), что обуславливает снижение активации Т-клеток и индуцирует Т-клеточную толерантность, секретируемые фибробластами ИЛ-6, помимо прочего, перенаправляют моноциты на дифференцировку в макрофаги, блокируя их путь дифференцировки в ДК [167], и активирует тучные клетки [168]. До сих пор остается неизвестным, является ли ИЛ-6, продуцируемый ФАО, скорость-лимитирующим фактором для иммунных реакций, или же другие источники ИЛ-6 в ОМО и другие факторы, такие как TФР-β, также задействованы. TФР-β регулирует бесчисленное множество иммуносупрессивных реакций [169], и недавние исследования показали, что TФР-β участвует в дифференцировке Т-хелперов линии 17 [170], что делает иммуномодуляторные функции продуцируемых ФАО молекул ТФР-β еще сложнее [171]. На основе анализа данных, полученных in vitro, продукция ИЛ-4, ИЛ-6 и ИЛ-8 может индуцировать дифференцировку иммуносупрессивных миелоидных клеток [19, 172]. Секретируемые ФАО факторы CXCL14 также влияют на противоопухолевый иммунитет, в частности, индуцируя мобилизацию макрофагов в опухоли [173]. Эти исследования подчеркивают роль паракринной сигнализации между ФАО и иммунными клетками, которая контролирует процесс неоплазии и злокачественного роста [174, 175]. CCL2 также играет роль в прогрессии рака груди на доклинических моделях [176], но изучение его эффектов ограничено исследованиями in vitro [176, 177]. CCL2 продуцируется также макрофагами и ДК, а секретом ФАО может активировать его синтез в других стромальных клетках. Он может усиливать влияние ФАО на ОМО. Также было обнаружено, что в активации Т-клеток участвуют такие цитокины, как CXCL9, CXCL10 и SDF1, входящие в секретом ФАО (ССЫЛКА 178).
Было установлено, что культивированные фибробласты из здорового кишечника человека экспрессируют негативные регуляторные иммунные сигналы (например, лиганды программируемой клеточной смерти 1 и 2 – соответственно, PDL1 и PDL2) c потенциальным тормозным воздействием на активацию Т-клеток [179]. В группе ФАО, полученных от пациентов с раком легкого, экспрессия PDL1 и PDL2 может иметь иммуносупрессивный эффект на активацию Т-клеток ex vivo [180]. Остается неизвестным, участвуют ли ФАО в иммуносупрессивном адаптивном ответе на солидную опухоль благодаря экспрессии ко-регуляторных сигналов in vivo. ФАО также могут усиливать противоопухолевый иммунитет косвенно, благодаря воздействию на опухолевый ангиогенез (регулируя трансэндотелиальную миграцию иммунных клеток), а также благодаря синтезу молекул адгезии (например, внутриклеточной молекулы адгезии 1 – ICAM1), что обеспечивает иммунные клетки платформой для специфических реакций, приводящих к их активации, репрессии или поляризации [21]. Иммунные клетки также влияют на ФАО посредством паракринных сигналов, хотя вся динамическая система отношений между ФАО и клетками иммунной системы остается, по большей мере, неизученной. Поляризация фенотипа ФАО [181] в процессе опухолевого развития может обеспечивать более динамичное и гетерогенное влияние на противоопухолевый иммунитет (РИС. 5). ФАО и злокачественные клетки создают сеть белков ВКМ, которые ограничивают доступ иммунных клеток к опухолевым благодаря образованию физического барьера.
С другой стороны, преобразование ВКМ, отчасти регулируемое ФАО, может обеспечить контакт Т-клеток с опухолевыми [182]. Ремоделирование ВКМ высвобождает провоспалительные факторы роста и цитокины и открывает скрытые связывающие сайты, которые могут обеспечивать адгезию иммунных клеток [5, 183]. В генетически модифицированных животных моделях и исследованиях ортотопических трансплантаций опухолей в иммунокомпетентных мышах, таргетируя БАФ-экспрессирующие ФАО, был продемонстрирован противоопухолевый эффект посредством активации CD8-позитивных T-клеток и опосредуемого ими киллинга [184, 185]. Воздействие на БАФ-экспрессирующие ФАО с помощью ДНК-вакцины или терапия мышей траниластом для подавления синтеза коллагена (несмотря на его неспецифическое связывание с ФАО) приводили к мобилизации и активации CD8-позитивных T-клеток и иммунному контролю опухолевого роста [186, 187]. Общая картина протуморогенной роли ФАО еще остается под вопросом и некоторые данные свидетельствуют о том, что ФАО могут ограничивать развитие злокачественной опухоли [96, 188]. Специфическое снижение числа α-ГMA-позитивных ФАО у трансгенных мышей, экспрессирующих вирусную тимидинкиназу под контролем промотера Acta2 (кодирующего α-ГMA) и обладающих ганцикловир-регулируемой пролиферацией α-ГMA-позитивных клеток, приводило к развитию инвазивных опухолей, связанных с иммуносупрессивным адаптивным ответом и увеличенной инфильтрацией регуляторных Т-клеток [96]. Несмотря на то, что общая картина роли ФАО в активации роста опухоли основывается на экспериментах с ко-культивированием клеток, настоящие и будущие исследования позволят определить функциональную роль ФАО в прогрессии опухолей и модуляции противоопухолевого иммунитета.
ФАО и лекарственная резистентность
Трудноразрешимой клинической задачей в терапии злокачественных опухолей является развитие резистентности, которая возобновляет развитие опухоли и метастазов, несмотря на лечение. Резистентность опухоли к терапии определяется прогрессией опухолевых очагов, сопутствующей первичному ответу на терапевтическое вмешательство или развившейся по отношению к нему вторично. Ранние исследования указывали на роль органоспецифического микроокружения в появлении резистентности [189], и ФАО считались ключевыми участниками прогрессии злокачественной опухоли при противоопухолевой терапии. Профиль генной экспрессии компонентов стромы ассоциирован с химиорезистентностью ( к 5-фторурацилу, эпирубицину и циклофосфамиду) при раке груди, что легко может позволить спрогнозировать ответ на химиотерапию при неоадьювантной терапии [190]. Несмотря на всю интригу, такие исследования, устанавливая связь между реактивной стромой и слабым ответом на химиотерапию, указывают, что ФАО не несут всей вины за появление резистентности к терапии, играя в этом лишь вспомогательную роль. Продолжающиеся попытки установить такие механические связи предпринимаются и являются предметом большого интереса для лучшего понимания противоопухолевой терапии. Механизмы развития резистентности, связанные со стромой, включают модуляцию путей, осуществляющих взаимодействие злокачественных клеток с клетками ВКМ, их адгезию и сигнальных путей цитокинов и хемокинов [191, 192]. ФАО также могут участвовать в повышенном внутриопухолевом давлении в интерстиции, таким образом косвенно ослабляя действие антибластомных препаратов [193]. Другие исследования предположили, что иммунная модуляция, проангиогенные процессы и метаболическое перепрограммирование ОМО, опосредованные ФАО, могут помочь в выживании злокачественных клеток и способствовать их уходу из-под контроля организма [112, 194, 195]. Хотя многие исследования на эту тему основываются на данных анализов, полученных in vitro и на моделях ксенотрансплантатов прогрессии опухоли, исследования ГМ-мышей и клинических образцов могут пролить свет на неизвестные функции ФАО в качестве ингибиторов противоопухолевой терапии. Повышенная адгезия злокачественных клеток к ВКМ может обеспечивать образование сигнальной платформы, которая усиливает механизмы выживания опухоли 197. Такие механизмы могут задействовать “спящий фенотип”, формирующийся благодаря остановке клеточного цикла при участии β1-интегрина [198, 199].
ФАО в меланомах с мутацией BRAF могут принимать участие в сопротивлении ингбированию BRAF путем образования богатого фибронектином ВКМ, усиливающего активацию ERK, опосредованную β1-интегрин-индуцированной киназой фокальных контактов (КФК) и SRC [200].
Наиболее важно то, что такие регулируемые ФАО программы не всегда повышают резистентность, но вместо этого могут создавать новые механизмы развития злокачественной опухоли, как, например, при разрастании резистентных клонов. Также важно заметить, что адгезия опухолевых клеток прямо к ФАО может также увеличивать лекарственную резистентность, вероятно, через N-кадгериновое гомотипичное связывание и усиление AKТ- сигналинга, направленного на выживание опухолевых клеток [201, 202]. Интересно, что приобретение адгезивных свойств опухолевыми клетками и их присоединение к ремоделированному ФАО внеклеточному матриксу может индуцировать ЭМП в опухолевых клетках, приводящий к терапевтической резистентности 203. Программа эпителиально-мезенхимального перехода может обеспечивать приобретение свойств химиорезистентности у опухолевых клеток благодаря индукции остановки клеточного цикла [96, 145] или изменению экспрессии клеточных транспортеров, обеспечивающих угнетение эффектов химиотерапии [206]. ФАО также могут обеспечивать резистентность к противоопухолевой лекарственной терапии с помощью растворимых факторов [191]. В этом отношении TФР-β, ИЛ-6 и ГФР, продуцируемые ФАО, являются потенциальными регуляторами лекарственной резистентности. TФР-β способен индуцировать мезенхимальные программы в опухолевых клетках, обеспечивая их адгезию к ВКМ, а ИЛ-6 индуцирует хорошо изученные сигнальные каскады, обеспечивающие выживание клеток [207]. ГФР также является ключевым модулятором ФАО-опосредованной резистентности, взаимодействуя с ингибиторами рецептора тирозинкиназы [208]. Было установлено, что ГФР, полученный из ФАО, усиливает резистентность у доклинических моделей опухолей при их лечении BRAF-V600E [209] или ингибиторами рецепторов к эпидермальному фактору роста (ЭФР) [210]. Злокачественные клетки, демонстрирующие высокую степень выживаемости после таргетной терапии, могут проявиться в ОМО благодаря ФАО-опосредованному аутокринному и паракринному сигнальным путям. Эти наблюдения доказывают рациональность применения лекарственных средств одновременно против ФАО и злокачественных клеток, в ходе чего, вероятно, активируются индуцируемые стромой синтетические пути, приводящие к гибели клеток [211].
Тем не менее, предполагаемое воздействие на Hedhehog-сигналинг для подавления проопухолевой активности ФАО аденокарциноме протоков поджелудочной железы (АПЖ) [212] привело к провалу второй фазы клинических испытаний [213]. Последующие исследования с долговременной оценкой доклинических моделей и специфическими стратегиями модификации генома подтвердили противоопухолевую активность ФАО и Hedhehog-сигналинга у ГМ-мышей с АПЖ [96, 188]. Тщательная проверка функции секретома ФАО в развитии лекарственной резистентности служит необходимым условием для лучшего прогноза значимости таргетирования ФАО в клинике. Некоторые комбинаторные стратегии на данный момент апробируются в клинике для преодоления ФАО-опосредованной лекарственной резистентности [191]. Тщательный анализ стромального ответа и адаптаций к терапии позволит понять конвергентную роль сигналинга между ФАО и злокачественными клетками во время терапии. Одна из стратегий включает ферментативную дезактивацию ВКМ, образованного ФАО. Деградация гиалуроновой кислоты [213, 215] или антиангиогенная терапия [216, 217] способны повлиять на перестройку и нормализацию опухолевых сосудов, что может обеспечить более эффективную доставку химиотерапевтических средств к злокачественным клеткам в солидных опухолях или усилить иммунорегулируемый противоопухолевый ответ. Несмотря на перспективность этих подходов, все они исходят из того, что ФАО стимулируют развитие опухоли. Эта концепция остается под вопросом и нуждается в дальнейших, более точных исследованиях.
ФАО – негативные регуляторы злокачественного роста
На сегодняшний день существует масса литературы, которая поддерживает идею о положительном влиянии ФАО на рост опухоли. Наиболее вероятно, что роль фибробластов в развитии опухоли носит непреднамеренный и побочный характер, обусловленный их участием в стромальном ответе организма на повреждение ткани.
В этом отношении, НАФ могут угнетать опухолевый рост благодаря обратимости эффектов TФР-β и ГФР, продуцируемых ФАО [218]. Потеря контроля за сигналингом, запускаемым TФР-β, в НАФ может индуцировать внутриэпителиальную неоплазию простаты, что указывает на супрессивную функцию НАФ в возникновении опухоли [8]. То, каким образом НАФ предотвращают опухолевый рост, остается практически неизвестным. Некоторые исследования также указывают, что элиминация стареющих фибробластов дермы вследствие дермабразии приводит к повышению экспрессии ИФР-1 и корригирует неадекватный ответ на облучение ультрафиолетом-В и опухолеобразование, обнаруженное в стареющей коже [220]. Такие процессы направлены на защиту стареющих кератиноцитов от канцерогенного влияния ультрафиолетового излучения и перерождения в плоскоклеточный рак [220]. Вероятно, что НАФ сдерживают опухолевый рост, в сравнении с активированными фибробластами. Недавние исследования показали, что ФАО способны сдерживать развитие аденокарциномы поджелудочной железы (АПЖ) благодаря редукции фиброза и гипоксии [188]. Другие исследования демонстрируют, что прямая инактивация α-ГMA-позитивных ФАО уменьшает выраженность фиброза и выживание мышей с АПЖ [96]. Активированные фибробласты могут влиять на защиту организма благодаря стимуляции врожденного и адаптивного противоопухолевого иммунитета. Многие исследования показали, что ФАО продуцируют такие иммуномодуляторные цитокины, как ИЛ-10, ТФР-β, ФНО, γ-интерферон и ИЛ-6, и помогают в активации и поляризационном распределении макрофагов, Т-лимфоцитов и естественных киллеров [162-165, 171, 175, 181]. Исследования с использованием мышиных моделей, которые позволяют извлекать активированные фибробласты, преследуют цель определить специфическую роль ФАО в модуляции противоопухолевого иммунитета. В связи с этим, клинические исследования, в ходе которых определяют экспрессию коллагена 1 типа и маркеры ФАО, включая α-ГMA и БАФ, при анализе исхода заболеваний демонстрируют, что пациенты с десмоплазией могут иметь хороший прогноз и полную выживаемость при АПЖ, раке молочной железы и раке легкого [221, 222]. При раке груди профиль экспрессии генов стромы может представлять ценную прогностическую информацию [223]. Структура десмопластичских стромальных клеток может также быть специфически ассоциирована с корреляциями, установленными при анализе клинической картины. Например, образуемые ФАО кавеолин-1 и β-рецептор ТрФР независимо ассоциированы с неблагоприятным прогнозом развития злокачественной опухоли молочной железы. Такие исследования необходимы в будущем для дальнейшего понимания потенциальной роли в ограничении роста опухолевой стромы и ФАО в прогрессии злокачественной опухоли.
Собранные данные свидетельствуют о возможности воздействия на ФАО с целью ингибирования роста злокачественных клеток. Однако еще предстоит, к примеру, найти такой агент, который специфически связывался бы с ФАО и воздействовал на него таргетно. Терапия против ФАО, направленная либо на их полное уничтожение, либо на их репрограммирование обратно в сторону нормального, покоящегося фенотипа, таким образом, вселяет некоторые надежды. Недавние исследования показали, что кальцитриол способен репрограммировать звездчатые клетки поджелудочной железы, дающих начало ФАО при АПЖ, по-видимому, возвращая их к нормальному фенотипу, подразумевающим, в числе прочего, отложение ретиноевой кислоты [225].
Такие доклинические попытки могут быть легко апробированы в клинике. Недавнее одобрение использования пирфенидона для лечения идиопатического фиброза легкого направлено на активацию ФАФ и усиление их секреторных функций [226]. Это дает возможность применять данный препарат при стандартной химиотерапии для вовлечения в терапию ФАО и злокачественных клеток. ФАО также могут быть таргетированы антителами, которые инактивируют БАФ (например, сибротузумаб) [227]; исследования по этому вопросу уже проводятся. Направленная терапия против активно пролиферирующих злокачественных клеток может также влиять на ФАО; таким образом, и химио-, и лучевая терапия способны индуцировать протуморогенные или противоопухолевые эффекты ФАО. Несмотря на то что воздействие на ФАО может послужить мощным противопухолевым терапевтическим средством, их функциональная гетерогенность и динамическая поляризация могут потребовать избирательного воздействия и более глубокого понимания ответных механизмов организма на терапию против ФАО.
Выводы и будущие перспективы
Становится очевидным, что покоящиеся фибробласты, вероятно, дают начало гетерогенной популяции активированных фибробластов. Различия в происхождении данных клеток и миофибробластов могут также быть основой для формирования гетерогенных популяций в опухолях. Мы считаем, что активированные фибробласты могут иметь подтипы, такие как F1 и F2 и так далее, похожие на подтипы макрофагов и других иммунных клеток (РИС, 5) [225]. Исследования по биологии развития, направленные на изучение различных подтипов мезенхимных клеток с различными функциями в различных тканях [51, 229, 230], могут выявить причины функциональной гетерогенности при патологиях, включая злокачественный рост. Уже на протяжении нескольких десятилетий активированные фибробласты рассматривались как соучастники злокачественных клеток в развитии опухоли. Однако эти клетки, вероятнее всего, непреднамеренно участвуют в канцерогенезе и могут служить как позитивными, так и негативными регуляторами опухолевого роста. Обладают ли различные подтипы фибробластов специфическими свойствами, или же популяции фибробластов функционируют вместе в зависимости от факторов среды на различных стадиях развития опухоли, остается неизвестным. Несмотря на это, изначальная функция фибробластов — это ответ на тканевое повреждение и индукция регенеративных процессов. В ответ на стимул, вырабатываемый поврежденными органами, и воспаление покоящиеся фибробласты активизируются, синтезируют факторы роста и регулируют увеличение ВКМ, а также влияют на воспаление и иммунитет.
Спорным является утверждение, что злокачественные клетки в среде, наполненной этими факторами, начинают заметно расти, мигрировать и вырабатывать механизмы выживания. Таким образом, фибробласты могут косвенно влиять на опухолевый рост. Первоначальный ответ нашего организма на злокачественный рост – это не противоборство, а контроль за тканевым повреждением.
Следующие 10 лет обещают подарить открытия многих скрытых тайн фибробластов.