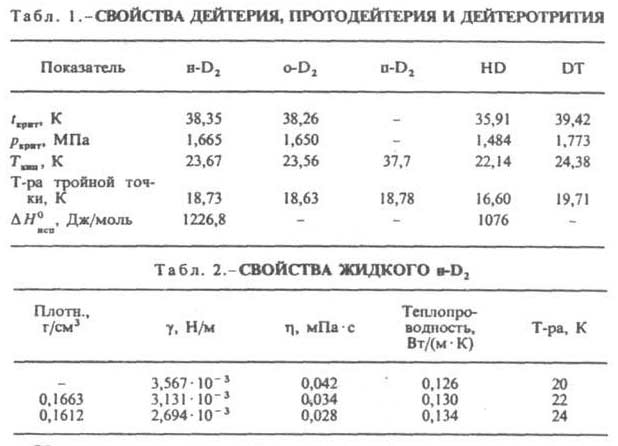
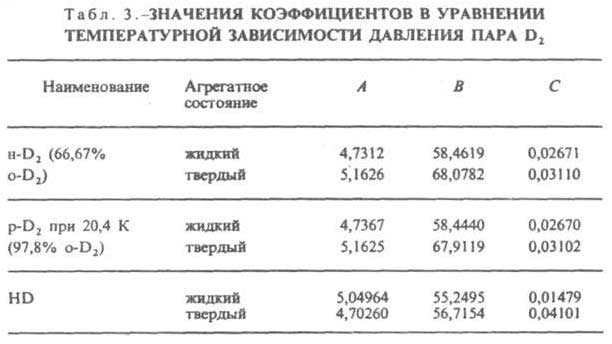
Дейтерий что это такое
Дейтерий
Открыт в 1932 г. американским физико-химиком Г. Юри. Природное содержание — 0,0115 ± 0,0070 [2] %.
Содержание
Изотопные модификации соединений водорода
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Получение
Применение
Дейтерий широко используется в атомной энергетике как замедлитель нейтронов в атомных реакторах; в смеси с тритием или в соединении с литием-6 применяют для термоядерной реакции в водородных бомбах, применяется в качестве меченого стабильного индикатора в лабораторных исследованиях и технике. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER).
Примечания
Литература
Стабильные: 1 H: Протий, D, 2 H: Дейтерий
Полезное
Смотреть что такое «Дейтерий» в других словарях:
ДЕЙТЕРИЙ — (тяжелый водород), D, стабильный изотоп водорода, атомная масса 2,01416, газ. Ядро атома дейтерия называется дейтрон. Дейтерий замедлитель нейтронов (в виде тяжелой воды) в ядерных реакторах, изотопный индикатор. Дейтерий открыт американским… … Современная энциклопедия
ДЕЙТЕРИЙ — ДЕЙТЕРИЙ, изотоп (D, или 2Н) водорода, ядра которого (ДЕЙТРОНЫ) помимо протона содержат также нейтрон. На каждый миллион атомов водорода, существующего в природе, приходится около 156 атомов дейтерия. Дейтерий находится также в воде (D2O, или… … Научно-технический энциклопедический словарь
дейтерий — изотоп, водород Словарь русских синонимов. дейтерий сущ., кол во синонимов: 2 • водород (10) • изотоп … Словарь синонимов
ДЕЙТЕРИЙ — (лат. deuterium от греч. deuteros второй), D, 2Н, тяжелый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома (дейтрон) состоит из протона и нейтрона. С кислородом образует тяжелую воду. Открыт Г. Юри в 1932 … Большой Энциклопедический словарь
ДЕЙТЕРИЙ — [дэ, тэ ], я, муж. Тяжёлый водород, стабильный изотоп водорода. | прил. дейтериевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ДЕЙТЕРИЙ — (от греч. deuteros второй; лат. Deuterium), D или 2H, тяжёлый стабильный изотоп водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе). Масса 2,0141018 а. е. м. Ядро Д. дейтрон состоит из 1 протона и 1 нейтрона. Д.… … Физическая энциклопедия
ДЕЙТЕРИЙ — тяжелый изотоп водорода с массовым числом 2. Отношение Н1/Н2 в космосе равно 1017, на Земле 6,41∙103; причины такого расхождения, вероятно, вызваны гравитационной дифференциацией и преимущественной потерей Землей более легкого изотопа.… … Геологическая энциклопедия
Дейтерий — Deuterium «тяжелый» изотоп водорода с атомной массой 2. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
дейтерий — дейтерий. Произносится [дэйтэрий] … Словарь трудностей произношения и ударения в современном русском языке
ДЕЙТЕРИЙ И ТЯЖЕЛАЯ ВОДА
ДЕЙТЕРИЙ И ТЯЖЕЛАЯ ВОДА. Дейтерий (тяжелый водород) – один из двух стабильных изотопов водорода, ядро которого состоит из одного протона и одного нейтрона. Молекула D2 – двухатомна. Содержание в природном водороде – 0,012–0,016%. Температура плавления – 254,5° С, температура кипения – 249,5° С. Тяжелая вода D2O (оксид дейтерия) – изотопная разновидность воды; плотность 1,1, температура плавления – 3,8° С, температура кипения – 101,4° С.
В 1932 одно за другим следовали выдающиеся открытия в области физики: были открыты нейтрон и позитрон, разработана протоно-нейтронная теория строения ядер и релятивистская квантовая механика, построен первый циклотрон и изобретен электронный микроскоп, проведена первая реакция ядерного синтеза, экспериментально измерена скорость движения молекул. Недаром физики назвали этот год anno mirabilis – год чудес. В этом же году был открыт и второй изотоп водорода, названный дейтерием (от греческого deuteros – второй, символ D).
Открытие дейтерия может служить прекрасной иллюстрацией к парадоксальному на первый взгляд высказыванию французского физикохимика Анри Ле Шателье, обращенному к ученикам: «Ошибкой не только начинающих исследователей, но многих немолодых, весьма опытных и зачастую талантливых ученых является то, что они устремляют свое внимание на разрешение очень сложных проблем, для чего еще недостаточно подготовлена почва. Если вы хотите сделать нечто действительно большое в науке, если вы хотите создать нечто фундаментальное, беритесь за детальное обследование самых, казалось бы, до конца обследованных вопросов. Эти-то на первый взгляд простые и не таящие в себе ничего нового объекты и являются тем источником, откуда вы при умении сможете почерпнуть наиболее ценные и порой неожиданные данные».
Действительно, что можно было ожидать от исследования физических свойств обыкновенной чистой воды – они были изучены, как говорится, вдоль и поперек еще в 19 в. Вспомним однако, что проведенные в 1893 рутинные определения плотности газообразного азота, полученного разными методами (литр азота из воздуха весил 1,257 г, а полученного химическим путем – 1,251 г), привели к выдающемуся открытию – сначала аргона, а за ним и других благородных газов.
Можно ли было надеяться обнаружить нечто новое в обычной воде? В начале 19 в. лондонский врач и химик Уильям Праут опубликовал гипотезу, согласно которой из самого легкого элемента – водорода могли возникнуть все остальные элементы путем конденсации. В этом случае атомные массы всех элементов должны быть кратны массе атома водорода. Определения атомных масс, которые оказались дробными, эту гипотезу не подтвердили, и химики 19 в. часто осмеивали ее как лишенную научного содержания (см. ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА).
В 1917 немецкий ученый К.Шерингер предположил, что атомы разных элементов построены не только из протия (от греческого protos – первый), т.е. «легкого» водорода с атомной массой 1, а из разных изотопов водорода. К тому времени уже было известно, что один и тот же элемент может иметь изотопы с разной массой. Впечатляющих успехов в открытии большого числа изотопов нерадиоактивных элементов достиг английский физик Фрэнсис Уильям Астон с помощью сконструированного им масс-спектрографа. В этом приборе изучаемые атомы или молекулы бомбардируются пучком электронов и превращаются в положительно заряженные ионы. Пучок этих ионов далее подвергается действию электрического и магнитного поля, и их траектории отклоняются от прямой. Это отклонение тем сильнее, чем больше заряд иона и чем меньше его масса. Из значений отклоняющих напряжений непосредственно получают относительные массы ионов. А из интенсивности пучка ионов с данной массой можно судить об относительном содержании в образце этих ионов.
Гипотеза Шерингера предполагала, что и у самого легкого элемента – водорода тоже могут быть изотопы. Однако попытки обнаружить «второй», тяжелый водород, предпринятые в 1919 Отто Штерном и Максом Фольмером, оказались безуспешными. Не удалось обнаружить его и Астону. Это означало одно из двух: либо у водорода тяжелого изотопа вовсе нет, либо его содержание в природном водороде слишком мало и чувствительности имевшегося в распоряжении Астона прибора недостаточно для его обнаружения. Правильным оказалось второе предположение, однако тяжелый водород прятался от исследователей в течение еще многих лет, маскируясь под ошибки эксперимента.
В 1927 Астон очень точно для того времени измерил отношение масс атомов водорода и кислорода-16; у него получилось 1,00778:16,0000, что, казалось, находится в прекрасном соответствии с результатами самых точных измерений атомной массы водорода химическим путем: у химиков это отношение получалось равным 1,00777:16,0000. Однако такое единодушие физиков и химиков было недолгим: оказалось, что природный кислород, с которым работали химики, – плохой эталон для измерения атомных масс, поскольку кислород представляет собой смесь изотопов, причем их относительное содержание в разных источниках не вполне постоянно. Точные измерения в начале 30-х соотношения 18 O: 16 O = 1:630 существенным образом изменили все прежние расчеты и данные об атомных массах. Пришлось в срочном порядке отказываться от «химической» шкалы атомных масс и переходить на «физическую» шкалу, основанную на кислороде-16. Такой пересчет данных химических анализов дал отношение масс Н: 16 О = 1,00799:16,0000, что уже заметно отличалось от измерений Астона. Кто же ошибся – физики или химики, выполнившие определения атомных масс? И те и другие ручались за точность своих определений, расхождение в результатах далеко выходило за пределы экспериментальных ошибок.
В 1931 было высказано предположение о том, что причина небольшого расхождения – наличие в обычном водороде более тяжелого изотопа. Расчеты показали, что расхождение устраняется в том случае, если на 5000 атомов обычного водорода 1 H приходится всего один атом его вдвое более тяжелой разновидности 2 Н. Дело оставалось за малым – обнаружить этот изотоп экспериментально. Но как это сделать, если его действительно так мало? С учетом чувствительности имевшейся в то время аппаратуры выход был один: сконцентрировать тяжелый водород, увеличив тем самым его содержание в обычном водороде, – примерно так же, как концентрируют спирт, перегоняя его смесь с водой. Если перегонять смесь обычного и тяжелого водорода, остаток должен обогащаться более тяжелым изотопом. После этого можно было снова попытаться обнаружить тяжелый изотоп водорода аналитически.
В конце 1931 группа американских физиков – Гарольд Юри со своими учениками, Фердинандом Брикведде и Джорджем Мерфи, взяли 4 л жидкого водорода и подвергли его фракционной перегонке, получив в остатке всего 1 мл, т.е. уменьшив объем в 4 тысячи раз. Этот последний миллилитр жидкости после ее испарения и был исследован спектроскопическим методом. Талантливый спектроскопист Гарольд Клейтон Юри заметил на спектрограмме обогащенного водорода новые очень слабые линии, отсутствующие у обычного водорода. При этом положение линий в спектре точно соответствовало проведенному им квантово-механическому расчету предполагаемого атома 2 H. Соотношение интенсивностей линий нового изотопа (Юри назвал его дейтерием) и обычного водорода показало, что в исследованном обогащенном образце нового изотопа в 800 раз меньше, чем обычного водорода. Значит, в исходном водороде тяжелого изотопа еще меньше. Но насколько?
Пытаясь оценить так называемый коэффициент обогащения при испарении жидкого водорода, исследователи поняли, что в своих опытах использовали самый неподходящий источник водорода. Дело в том, что он был получен, как обычно, путем электролиза воды. А ведь при электролизе легкий водород должен выделяться быстрее, чем тяжелый. Получается, что образец был сначала обеднен тяжелым водородом, а затем снова обогащался им!
После того, как дейтерий был обнаружен спектроскопически, Эдвард Уошберн предложил разделять изотопы водорода электролизом. Эксперименты показали, что при электролизе воды легкий водород действительно выделяется быстрее, чем тяжелый. Именно это открытие стало ключевым для получения тяжелого водорода. Статья, в которой сообщалось об открытии дейтерия, была напечатана весной 1932, а уже в июле были опубликованы результаты по электролитическому разделению изотопов. В 1934 за открытие тяжелого водорода Юри была присуждена Нобелевская премия по химии. (Уошберн тоже был представлен к премии, но скончался в том же году, а по положению о Нобелевских премиях они вручаются только прижизненно.)
Когда был открыт нейтрон, стало ясно, что в ядре дейтерия, в отличие от протия, помимо протона находится также нейтрон. Поэтому ядро дейтерия – дейтрон вдвое тяжелее протона; его масса в углеродных единицах равна 2,0141018. В среднем в природном водороде содержится 0,0156% дейтерия. В прибрежной морской воде его немного больше, в поверхностных водах суши – меньше, в природном газе – еще меньше (0,011–0,013%). По химическим свойствам дейтерий схож с протием, но огромное различие в их массах приводит к заметному замедлению реакций с участием атомов дейтерия. Так, реакция дейтерированного углеводорода R–D с хлором или кислородом замедляется, в зависимости от температуры, в 5–10 раз по сравнению с реакцией R–Н. С помощью дейтерия можно «пометить» водородсодержащие молекулы и изучить механизмы их реакций. Так, в частности, были изучены реакции синтеза аммиака, окисления углеводородов, ряд других важных процессов.
Тяжелая вода.
После фундаментальных работ Уошберна и Юри исследования нового изотопа стали развиваться быстрыми темпами. Уже вскоре после открытия дейтерия в природной воде была обнаружена ее тяжелая разновидность. Обычная вода состоит в основном из молекул 1 Н2О. Но если в природном водороде есть примесь дейтерия, то и в обычной воде должны быть примеси НDO и D2O. И если при электролизе воды Н2 выделяется с большей скоростью, чем НD и D2, то со временем в электролизере должна накапливаться тяжелая вода. В 1933 Гилберт Льюис и американский физикохимик Роналд Макдональд сообщили, что в результате длительного электролиза обычной воды им удалось получить не виданную никем до этого новую разновидность воды – тяжелую воду.
Открытие и выделение весовых количеств новой разновидности воды – D2O произвело большое впечатление на современников. Всего за два года после открытия было опубликовано более сотни работ, посвященных исключительно тяжелой воде. О ней читались популярные лекции, печатались статьи в массовых изданиях. Практически сразу же после открытия тяжелую воду стали использовать в химических и биологических исследованиях. Так, было обнаружено, что рыбы, микробы и черви не могут существовать в ней, а животные погибают от жажды, если их поить тяжелой водой. Не прорастают в тяжелой воде и семена растений.
Однако технически получение значительных количеств D2О представляло собой трудную задачу. Для обогащения воды дейтерием на 99% необходимо уменьшить объем воды при электролизе в 100 тысяч раз. Льюис и Макдональд взяли для своих опытов 10 л воды из проработавшей несколько лет большой электролитической ванны, в которой содержание дейтерия было повышенным. Пропуская через эту воду ток большой силы – 250 ампер (для увеличения электропроводности вода содержала щелочь), они за неделю уменьшили ее объем в 10 раз. Чтобы жидкость при электролизе таким огромным током не закипела, ее приходилось непрерывно охлаждать холодной водой, пропускаемой по металлическим трубкам внутри электролизера. Остаток объемом 1 л перенесли в электролизер поменьше и снова путем электролиза снизили объем в 10 раз. Затем в третьей ячейке объем был уменьшен до 10 мл, и, наконец, в четвертой он был доведен до 0,5 мл. Отогнав этот остаток в вакууме в небольшую колбочку, они получили воду, содержащую 31,5% D2O. Ее плотность (1,035) уже заметно отличалась от плотности обычной воды.
В следующей серии опытов из 20 л воды, также в несколько этапов, получили 0,5 мл воды с плотностью 1,075, содержащей уже 65,7% D2O. Продолжая такие опыты, удалось, наконец, получить 0,3 мл воды, плотность которой (1,1059 при 25° С) уже больше не увеличивалась при уменьшении объема при электролизе до 0,12 мл. Эти несколько капель и были первые за всю историю Земли капли почти чистой тяжелой воды. Соответствующие расчеты показали, что прежние оценки соотношения обычного и тяжелого водорода в природе были слишком оптимистическими: оказалось, что в обычной воде содержится всего 0,017% (по массе) дейтерия, что дает соотношение D:Н = 1:6800.
Чтобы получать заметные количества тяжелой воды, необходимой ученым для исследований, необходимо было подвергать электролизу уже огромные по тем временам объемы обычной воды. Так, в 1933 группе американских исследователей для получения всего 83 мл D2O 99%-ой чистоты пришлось взять уже 2,3 тонны воды, которую разлагали в 7 стадий. Было ясно, что такими методами ученые не смогут обеспечить всех желающих тяжелой водой. А тут выяснилось, что тяжелая вода является прекрасным замедлителем нейтронов и потому может быть использована в ядерных исследованиях, в том числе для построения ядерных реакторов. Спрос на тяжелую воду вырос настолько, что стала ясна необходимость налаживания ее промышленного производства. Трудность состояла в том, что для получения 1 тонны D2O необходимо переработать около 40 тысяч тонн воды, израсходовав при этом 60 млн кВт-ч электроэнергии – столько уходит на выплавку 3000 т алюминия!
Первые полупромышленные установки были маломощными. В 1935 на установке в Беркли еженедельно получали 4 г почти чистой D2O, стоимость которой составляла 80 долларов за грамм – это очень дорого, если учесть, что за прошедшие годы доллар «подешевел» в десятки раз. Более эффективной была установка в химической лаборатории Принстонского университета – она давала ежедневно 3 г D2O ценой по 5 долларов за грамм (через 40 лет стоимость тяжелой воды снизилась до 14 центов за грамм). Наиболее трудоемким оказался самый первый этап электролиза, в котором концентрация тяжелой воды повышалась до 5–10%, поскольку именно на этом этапе приходилось перерабатывать огромные объемы обычной воды. Дальнейшее концентрирование можно было уже без особых проблем провести в лабораторных условиях. Поэтому преимущества получали те промышленные установки, которые могли подвергать электролизу большие объемы воды.
Теоретически можно вместо электролиза использовать простую перегонку, поскольку обычная вода испаряется легче, чем тяжелая (ее температура кипения 101,4° С). Однако этот способ еще более трудоемкий. Если при электролизе коэффициент разделения изотопов водорода (т.е. степень обогащения в одной стадии) теоретически может достигать 10, то при перегонке он составляет всего 1,03–1,05. Это означает, что разделение путем перегонки исключительно малоэффективно. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация D2О всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1O 30 тонн воды, что в 300 млн. раз превышает массу Земли!
В настоящее время разработан ряд эффективных методов получения тяжелой воды: электролизом, изотопным обменом, сжиганием обогащенного дейтерием водорода. В настоящее время тяжелую воду получают ежегодно тысячами тонн. Ее используют в качестве замедлителя нейтронов и теплоносителя в ядерных реакторах (для заполнения одного современного крупного ядерного реактора требуется 100–200 тонн тяжелой воды чистотой не менее 99,8%); для получения дейтронов D + в ускорителях частиц; как растворитель в спектроскопии протонного магнитного резонанса (обычная вода своими протонами смазывает картину). Не исключено, что роль тяжелой воды значительно возрастет, если будет осуществлен промышленный термоядерный синтез.
«Битва за воду».
Загадочный дейтерий и его свойства
ДЕЙТЕРИЙ (от греческого deuteros-второй) (тяжелый водород) D, стабильный изотоп водорода с нуклеарной массой 2 ат. ед.
Свойства. Коэффициент сжимаемости дейтерия (pV/RT)при 273,15 К: 1,0121 (2,0266 МПа), 1,0624(10,133 МПа), 1,130(20,266 МПа). С° [в Дж/(моль.К)]: 20,81 (20 К), 30,11 (100 К), 29,30 (298 К); теплопроводность 0,135 Вт/(м.К) (25 К); 1,23.102 мПа.с (293,15 К).
Дейтерий растворяется в жидкостях (например, в бензоле, толуоле, октане, гептане, ССl4, CS2) лучше, чем газообразный водород, причем это различие возрастает с понижением температуры.
Дейтерий применяется также как изотопный индикатор в научных исследованиях в химии, биологии, физиологии, агрохимии и др. (в т.ч. в опытах с живыми организмами и при диагностич. исследованиях человека).
Соединения дейтерия используются также при спектроскопических исследованиях. Изделия из монокристаллов на основе KD2PO4 применяются для создания систем управления и преобразования лазерного излучения.
Литература.: Выделение дейтерия из водорода методом глубокого охлаждения, М., 1961; Тупицын И. Ф., Тяжелые изотопы водорода, дейтерий и тритий, М., 1961; Андреев Б. М., Зельвенский Я. Д., Катальников С. Г., Тяжелые изотопы водорода в ядерной технике, М., 1987 Я. Д. Зельвенский.
ДЕЙТЕРИЙ
Полезное
Смотреть что такое «ДЕЙТЕРИЙ» в других словарях:
Дейтерий — Таблица нуклидов … Википедия
ДЕЙТЕРИЙ — (тяжелый водород), D, стабильный изотоп водорода, атомная масса 2,01416, газ. Ядро атома дейтерия называется дейтрон. Дейтерий замедлитель нейтронов (в виде тяжелой воды) в ядерных реакторах, изотопный индикатор. Дейтерий открыт американским… … Современная энциклопедия
ДЕЙТЕРИЙ — ДЕЙТЕРИЙ, изотоп (D, или 2Н) водорода, ядра которого (ДЕЙТРОНЫ) помимо протона содержат также нейтрон. На каждый миллион атомов водорода, существующего в природе, приходится около 156 атомов дейтерия. Дейтерий находится также в воде (D2O, или… … Научно-технический энциклопедический словарь
дейтерий — изотоп, водород Словарь русских синонимов. дейтерий сущ., кол во синонимов: 2 • водород (10) • изотоп … Словарь синонимов
ДЕЙТЕРИЙ — (лат. deuterium от греч. deuteros второй), D, 2Н, тяжелый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома (дейтрон) состоит из протона и нейтрона. С кислородом образует тяжелую воду. Открыт Г. Юри в 1932 … Большой Энциклопедический словарь
ДЕЙТЕРИЙ — [дэ, тэ ], я, муж. Тяжёлый водород, стабильный изотоп водорода. | прил. дейтериевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ДЕЙТЕРИЙ — (от греч. deuteros второй; лат. Deuterium), D или 2H, тяжёлый стабильный изотоп водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе). Масса 2,0141018 а. е. м. Ядро Д. дейтрон состоит из 1 протона и 1 нейтрона. Д.… … Физическая энциклопедия
ДЕЙТЕРИЙ — тяжелый изотоп водорода с массовым числом 2. Отношение Н1/Н2 в космосе равно 1017, на Земле 6,41∙103; причины такого расхождения, вероятно, вызваны гравитационной дифференциацией и преимущественной потерей Землей более легкого изотопа.… … Геологическая энциклопедия
Дейтерий — Deuterium «тяжелый» изотоп водорода с атомной массой 2. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
дейтерий — дейтерий. Произносится [дэйтэрий] … Словарь трудностей произношения и ударения в современном русском языке
Дейтерий и тритий: водород, да не тот
Кандидат химических наук Александр Семёнов, главный эксперт АО «ВНИИНМ»
В 1931—1932 годах американский физикохимик Гарольд Юри и его коллеги сумели выделить из обыкновенного, всем известного водорода необычную фракцию. Водород из этой фракции имел большие атомный вес и плотность, давал в эмиссионном спектре ранее незнакомые линии, напоминающие классические линии спектра водорода, но в то же время немного смещённые. Это означало, что в природном водороде присутствуют атомы нескольких сортов, отличные по своим свойствам. Так был открыт первый из тяжёлых изотопов водорода — дейтерий. Вскоре в чистом виде была получена «тяжёлая вода» — оксид дейтерия. Она имела на 10% бóльшую плотность, более высокие температуры плавления и кипения, чем вода обычная, сложнее разлагалась электрическим током, что вскоре легло в основу одного из первых способов её получения. Длительный, многоступенчатый электролиз воды позволял сконцентрировать дейтерий и очистить его от лёгкого изотопа водорода.
Другой тяжёлый изотоп, тритий, открыли двумя годами позже в Кембриджском университете физики Эрнест Резерфорд, Марк Олифант и физикохимик Пауль Хартек при бомбардировке ядрами дейтерия мишеней из дейтерийсодержащих соединений. При этом исследователи впервые столкнулись с ядерным синтезом — искусственным превращением одних ядер в другие. Как оказалось, третий изотоп водорода сильно радиоактивен (период полураспада 12,32 года) и поэтому не может накапливаться в природе в сколько-нибудь значимых количествах.
За открытие дейтерия Г. Юри в 1934 году был награждён Нобелевской премией по химии.
Сколько же тяжёлых изотопов водорода в природе? Дейтерия в природе не так уж и мало. Его концентрация относительно протия составляет около 0,016% ат., но, учитывая широкую распространённость самого водорода, запасы дейтерия можно считать неисчерпаемыми. Наибольшие его количества находятся в Мировом океане; концентрация дейтерия в океанической воде также заметно выше, чем в водах рек, вследствие фракционирования изотопов воды в атмосферном водяном цикле (см. «Наука и жизнь» № 5, 2011 г., статья «Изотопная «дактилоскопия» для Шерлока Холмса»). Дейтерия в водах Мирового океана содержится даже больше, чем таких химических элементов, как фтор и йод. Природные вариации соотношения изотопов дейтерия и протия изменяются в диапазоне от 5500 до 11 000 атомов лёгкого водорода на один атом тяжёлого — это своеобразный рекорд среди природных вариаций всех стабильных изотопов. Наименьшие концентрации дейтерия наблюдаются в ледниках Антарктики, а наибольшие — в закрытых водоёмах пустыни Сахара.
Трития в природе в десятки и сотни триллионов раз меньше, чем дейтерия. Из-за радиоактивного распада тритий практически отсутствует в объектах, изолированных от атмосферы, например в углеводородах нефти и природного газа. Естественная наработка трития на Земле постоянно происходит при воздействии космических лучей на ядра азота и кислорода в верхних слоях атмосферы, поэтому наиболее богаты природным тритием осадки: дождь и снег. Такая естественная наработка трития находится в равновесии с его распадом и составляет не более 7 кг на весь земной шар.
Как разделить изотопы водорода? Известный учёный и публицист академик И. В. Петрянов-Соколов в конце 1960-х годов, проведя несложные математические выкладки, показал, насколько утопичен миф о «накоплении тяжёлой воды» в чайнике при длительном кипячении. Чтобы получить хотя бы литр воды с обогащением по дейтерию всего в 10 раз больше природного, пришлось бы испарить такое её количество, масса которого во много раз превышает массу всей Солнечной системы. Причина — близость физико-химических свойств обычной и дейтериевой воды, малая величина коэффициента разделения этих изотопов при дистилляции. Эффективность разделения может быть значительно повышена, если использовать многоступенчатые противоточные процессы. Наиболее освоены и промышленно реализованы такие методы получения дейтерия, как ректификация жидкого водорода, двухтемпературный сероводородный метод, и метод, основанный на химическом обмене в системе «вода—водород». При получении концентрированного трития приходится считаться с его радиоактивностью. В этом случае могут быть применены лишь те методы, в которых водород присутствует в молекулярном виде, так как и вода и сероводород, содержащие тритий, сильно разлагаются вследствие авторадиолиза. При получении дейтерия в качестве исходного сырья используют природную воду. Тритий может быть получен только в реакторах, при облучении нейтронами одного из изотопов лития.
Приятно отметить, что наше предприятие, АО «ВНИИНМ» им. академика А. А. Бочвара, которое ранее называлось НИИ-9, стоит у истоков создания всех отечественных тритиевых технологий. И реакторная наработка трития, и его очистка от сопутствующих примесей, и проблемы безопасности обращения с ним — все эти вопросы были в своё время успешно решены.
С самого начала Атомного проекта СССР проблема получения трития была по значимости на втором месте после изготовления ядерного заряда. Тритий предстояло нарабатывать реакторным путём из лёгкого изотопа лития — 6Li. Решение этой задачи было поручено коллективу НИИ-9, состоявшему из специалистов разных направлений. С их помощью в Советском Союзе создали тритиевое производство и ныне действующее на ФГУП «ПО «Маяк» (г. Озёрск).
Процессы разделения изотопов водорода в нашей стране большей частью разработаны в МХТИ (ныне — РХТУ им. Д. И. Менделеева). Там же в 1934 году А. И. Бродский получил первую советскую тяжёлую воду на специально разработанной лабораторной установке. Ежегодно кафедра технологии изотопов РХТУ даёт образование десяткам специалистов в этой области.
Наибольшее количество дейтерия в нашей стране, по-видимому, наработано методом низкотемпературной ректификации*, хотя на первом этапе для этого активно использовали очень энергозатратный способ получения тяжёлой воды электролизом. Производства дейтерия были распределены по всей стране, при этом ориентировались на наличие свободной электроэнергии и на возможность использования отходящего водорода, в частности на азотно-туковых заводах**. Одно из наиболее крупных производств дейтерия существовало в городе Чирчик; тяжёлую воду производили также в Днепродзержинске, Сталиногорске, Ленинграде, Норильске, Каменке, Березниках, Горловке и во многих других городах СССР. Меньшее распространение у нас получил двухтемпературный сероводородный метод производства тяжёлой воды, реализованный в городе Алексине, в то время как в мировом масштабе это один из основных методов её получения.
В нашей стране тяжёлую воду и дейтерий в настоящее время производит единственное предприятие — ПИЯФ им. Б. П. Константинова в Гатчине. В качестве исходного сырья используют запасы, накопленные в СССР. Из природного сырья дейтерий у нас в стране сейчас не выделяют.
Говоря об отечественных тритиевых технологиях, нельзя не упомянуть РФЯЦ-ВНИИЭФ (г. Саров), специалисты которого многие годы занимаются этим вопросом как в рамках оборонных задач, так и для нужд фундаментальной науки. В частности, они разработали тритиевую криомишень для получения сверхтяжёлых изотопов лёгких элементов, используемую в ОИЯИ (г. Дубна) на установке АКУЛИНА***, позволившую получить пятый изотоп водорода и до сих пор востребованную в фундаментальных исследованиях.
Где же применяют тритий и дейтерий? Так уж получилось, что открытые человеком колоссальные источники энергии деления и слияния ядер изначально предполагалось использовать для разрушения, и лишь потом было освоено их мирное использование. Кроме того, есть немало сфер применения этих изотопов, вообще не связанных с реакцией термоядерного синтеза.
Один из основных отечественных потребителей трития и производителей тритиевой продукции — ФГУП «ВНИИА им. Н. Л. Духова». На этом предприятии разрабатывают и производят нейтронные генераторы — ускорительные устройства, в которых ядра дейтерия, ударяясь в мишень, вступают в ядерную реакцию с содержащимся в ней тритием. При этом выделяющиеся нейтроны имеют постоянную энергию 14,1 МэВ, а само устройство очень удобно в эксплуатации. При отсутствии ускоряющего напряжения нейтроны не излучаются (в отличие от радиоизотопных нейтронных источников), а радиоактивный тритий находится внутри нейтронной трубки и в таком виде практически безопасен (его мягкое бета-излучение не способно пробить даже лист бумаги).
Нейтронные генераторы используются везде, где требуются компактные автономные источники нейтронов. Очень востребованы они у геологов, которые используют их при гео-физическом исследовании скважин методом нейтронного каротажа. (Слово «каротаж» происходит от французского слова «carotte» — морковь, что объясняется сходством формы керна, извлекаемого из земли, с морковью.) Метод нейтронной активации при этом позволяет оперативно получить полную информацию о химическом составе всех горных пород по глубине скважины, просто опустив в неё нейтронный зонд с детектором. Нейтронный генератор, изготовленный во ВНИИА, есть даже на марсоходе «Curiosity» («Кьюриосити»; в переводе с английского означает «любопытство»), в составе прибора ДАН (Детектора альбедных нейтронов), созданного в ИКИ РАН. Главная задача этого прибора — поиск воды на Марсе под толщей грунта, и уже имеются первые положительные результаты. ВНИИНМ внёс свой вклад в этот международный проект, поставив для ВНИИА мишени, насыщенные тритием.
То, что тритий является мягким бета-излучателем с высокой радиоактивностью, обусловливает его использование в радиоизотопных источниках света и электроэнергии. Во многих часах и приборах со светящимися стрелками применяют люминофоры, активированные тритием. Тритиевая подсветка на оружейных прицелах существенно повышает точность стрельбы в ночное время.
Сейчас АО «ВНИИНМ» по заказу Роскосмоса и под руководством ООО «Солар-Си» принимает участие в разработке отечественного бета-вольтаического источника питания на основе трития — «тритиевой батарейки». Этот источник питания нужен в тех ответственных узлах, где требуется стабильное бесперебойное электроснабжение в течение многих лет. Его создание решит актуальный вопрос импортозамещения, поскольку аналогичных источников электропитания Россия в настоящее время не производит.
Наибольшие количества дейтерия потребляются атомной энергетикой. Содержащая его тяжёлая вода — один из наилучших замедлителей нейтронов, настолько эффективный, что позволяет «зажечь» реакцию деления ядер даже в уране с природным обогащением по изотопу U-235, тогда как все остальные типы ядерных реакторов требуют обогащённого урана. Использование тяжёлой воды в качестве замедлителя позволяет повысить и степень выгорания ядерного топлива. По этому пути пошла атомная энергетика Канады, которая производит для себя и строит по всему миру на заказ тяжеловодные реакторы CANDU.
И дейтерий и тритий активно применяют при производстве меченых соединений. В этой продукции заинтересованы в первую очередь биологи и медики, которые с помощью изотопной метки определяют механизмы биохимических реакций. У нас меченные тритием соединения традиционно производят в Институте молекулярной генетики РАН.
Самая заманчивая перспектива использования дейтерия и трития — создание управляемой термоядерной реакции. Если это удастся, человечество будет иметь в своём распоряжении неисчерпаемый источник энергии. К сожалению, эта задача оказалась чрезвычайно сложной. Более полувека в мире ведутся разработки в этой области, но всё равно мы очень далеки от создания такого термоядерного реактора, который производил бы энергии больше, чем потреблял. В настоящее время весь мир с надеждой смотрит на международный термоядерный реактор ИТЭР, создаваемый в городе Кадараш на юге Франции. С его помощью физики надеются приблизиться к созданию энергетики, использующей энергию слияния ядер трития и дейтерия, а в перспективе перейти к использованию одного дейтерия, чьи ядра могут взаимодействовать между собой.
В своё время на нашем предприятии пересказывали забавную историю, как один из вновь назначенных чиновников, проходя по территории ВНИИНМ, потребовал, чтобы ему «показали тритий», и был очень возмущён тем, что этого не сделали. Ему объясняли, что тритий — это газ, который прозрачен и потому невидим, тем не менее новый босс сурово резюмировал: «Что-то у вас здесь нечисто!». Давайте попытаемся понять, можно ли изотопы водорода «увидеть»?
Что касается трития, то, несомненно, да — можно, и без всяких дополнительных устройств. В концентрированном виде этот изотоп водорода даёт голубое свечение вследствие самоионизации. Поток бета-излучения трития способен при длительном контакте изменить цвет стекла, он вызывает потемнение эмульсии фотопластинок, на чём основан классический метод авторадиографического анализа, в котором по интенсивности потемнения фотоэмульсии определяют концентрацию радиоактивного изотопа. В последнее время приобретает популярность новый метод анализа трития, позволяющий визуализировать его распределение по поверхности образцов, — радиолюминография. Метод основан на образовании скрытого изображения в некоторых люминофорах под воздействием радиации. Это изображение считывается специальным лазерным сканером, причём интенсивность люминесценции пропорциональна активности образца. Концентрация трития с помощью радиолюминографии может быть представлена довольно наглядно и красочно. Радиоактивность трития даёт возможность определять даже ничтожные его количества методом жидкостной сцинтилляции, в котором определяют интенсивность свечения некоторых жидкостей, пропорциональную содержанию в них радиоактивного изотопа, и газовыми ионизационными методами, использующими свойство газовых смесей менять свои вольт-амперные характеристики при воздействии на них ионизирующего излучения. Кроме того, и дейтерий и тритий, так же как самый лёгкий из изотопов водорода протий, можно без труда «увидеть», используя современные методы атомно-эмиссионной, ИК- и масс-спектрометрии.
Не стоит забывать и об опасности, которую несут тяжёлые изотопы водорода. Самая грозная и зловещая из них скрыта в термоядерном оружии, произведённом за десятилетия «холодной войны». В своё время в прессе звучали сообщения, что мощности накопленного вооружения достаточно, чтобы неоднократно уничтожить всё живое на нашей планете. Даже малая его часть в случае использования способна вызвать глобальную экологическую катастрофу, известную под названием «ядерная зима». Несомненно, важнейшая задача всего человечества — не допустить развития такого сценария в мировой истории.
Но даже тот тритий, который не используется в вооружении, представляет для человека существенную опасность, так как является высокотоксичным радиоактивным изотопом. Риск облучения персонала, контактирующего с тритием, очень высок в связи с тем, что этот изотоп не удерживается современными фильтрующими системами защиты органов дыхания и способен проникать через кожу. При этом в форме тритированной воды тритий в 10 000 раз токсичнее, чем в виде молекулярного водорода, так как пары тритированной воды уже при комнатной температуре практически мгновенно обменивают изотопы водорода, моментально попадая за счёт этого в организм человека. Значительная часть трития при переработке радиоактивных отходов сбрасывается в атмосферу или попадает в Мировой океан. И обращение с отходами, содержащими тритий (особенно с низкоактивными, которых очень много), до сих пор представляет собой серьёзную проблему, ожидающую своего решения.
Кто бы мог предугадать 100 лет назад, что самый первый и самый простой из химических элементов — водород преподнесёт нам столько сюрпризов, столько радости и страхов, надежд и разочарований? Сегодня хочется верить, что все знания, полученные человечеством, будут направлены только на созидание, а не на разрушение, а изотопы водорода со своими удивительными свой-ствами помогут нам ещё не раз заглянуть в сокровенные тайники Природы и сделать немало интересных и полезных открытий.
Автор выражает благодарность Г. М. Тер-Акопьяну (ОИЯИ), А. А. Юхимчуку (РФЯЦ-ВНИИЭФ), Л. А. Ривкису, М. И. Белякову, А. Н. Букину, А. С. Аникину, Н. Е. Забировой, А. В. Лизунову и всему тритиевому отделу АО «ВНИИНМ» им. академика А. А. Бочвара, а также специалистам кафедры технологии изотопов РХТУ им. Д. И. Менделеева, особенно М. Б. Розенкевичу и Ю. С. Паку, которые оказали помощь при подготовке материала.
Не только тяжёлые изотопы водорода имеют собственные красивые имена. Привычный нам самый лёгкий и распространённый изотоп водорода тоже имеет специальное обозначение — протий. Все три названия этих изотопов появились ещё до открытия трития, когда Г. Юри, Д. Мерфи и Ф. Брикведде 5 июня 1933 года предложили их в письме редактору научного журнала «The Journal of Chemical Physics». Названия изотопов водорода происходят от греческих слов «protos» (первый), «deuteros» (второй) и «tritos» (третий). Интересно отметить, что название «протий» менее известно широкой общественности, чем имена тяжёлых и намного более редких его «собратьев». В последнее время в интернете появились такие названия, как «квадий», «пентий», «гексий» и «септий», отнесённые к чрезвычайно короткоживущим изотопам водорода массой от 4 до 7 и с периодами полураспада 10 –22 — 10 –23 с. Однако, по-видимому, эти названия не имеют под собой основы и являются одним из «фейков» интернета. В частности, профессор Г. М. Тер-Акопьян, который с коллективом ОИЯИ (г. Дубна) впервые получил в 2001 году ядра пятого изотопа водорода, названия «пентий» ему не давал и никогда не слышал упоминания такого термина в научных публикациях и на конференциях.
Комментарии к статье
* Ректификация — разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путём многократных испарений жидкости и конденсации паров. Разделение сжиженных газовых смесей ректификацией проводят при очень низких температурах под избыточным давлением.
** На азотно-туковых заводах из природного газа получают дешёвые азотные удобрения.
*** Название АКУЛИНА происходит от английского «accurate line» — аккуратная (прецизионная) линия.