Диабет моди что это
MODY-диабет
MODY-диабет – это группа клинически схожих форм сахарного диабета с аутосомно-доминантным путем наследования. Болезнь проявляется в детстве и юности. Основные симптомы – частые позывы к мочеиспусканию и увеличение объема мочи, усиление жажды и аппетита, потеря веса, покраснение кожных покровов, повышение температуры тела. Диагностика сложная, включает клиническое обследование, комплекс лабораторных тестов: глюкоза натощак и после еды, гормональный и генетический анализ крови. Программа лечения предполагает прием гипогликемических препаратов, коррекцию питания и систематические занятия спортом.
МКБ-10
Общие сведения
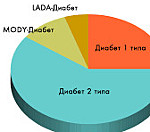
MODY-диабет называют сахарным диабетом взрослого типа у молодых. Впервые данный термин был использован в 1974-75 годах. Им обозначали формы болезни, которые обнаруживаются в детстве или в молодости, но протекают относительно легко, подобно СД 2 типа, характерному для людей старше 45 лет, и без снижения чувствительности клеток к воздействию инсулина. Показатели распространенности заболевания не определены, но среди разных видов СД у молодежи и пациентов детского возраста он встречается в 2-5% случаев. Эпидемиология и симптомы наиболее полно описаны для популяций Европы и Северной Америки, данные по странам Азии остаются весьма ограниченными.
Причины
Данная форма эндокринной патологии обусловлена мутационными изменениями генов, которые отвечают за активность работы островковых клеток поджелудочной железы (ПЖ). Причины структурных изменений участков хромосом остаются невыясненными, но исследования эпидемиологии заболевания позволяют выявить группы пациентов, находящихся в зоне повышенного риска. Предположительно развитие MODY-диабета связано со следующими факторами:
Патогенез
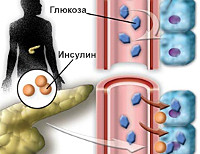
Патология формируется на основе мутации генов, влияющих на функциональность клеток островков Лангерганса, передается по аутосомно-доминантному типу, что обуславливает не сцепленное с полом наследование и выявление близких родственников, страдающих той или иной формой гипергликемии. В основе MODY лежит мутация только одного гена. Диабет проявляется снижением активности клеток ПЖ – недостатком производства инсулина.
В результате глюкоза, поступающая в кровь из желудка, не усваивается клетками организма. Развивается состояние гипергликемии. Избыточный сахар выводится почками, формируется глюкозурия (глюкоза в моче) и полиурия (увеличенный объем мочи). Из-за возникающей дегидратации усиливается чувство жажды. Источником энергии для тканей вместо глюкозы становятся кетоновые тела. Их избыток в плазме провоцирует развитие кетоацидоза – нарушения метаболизма со смещением pH крови в кислую сторону.
Классификация
MODY-диабет представлен несколькими формами, обладающими генетической, метаболической и клинической разнородностью. Классификация основана на различении типов болезни с учетом участка мутировавшего гена. Выделено 13 генов, изменения которых провоцируют диабет:
Симптомы MODY-диабета
Среди всех разновидностей диабетов МОДИ 50-70% клинических случаев приходится на МОДИ 3. На втором месте по распространенности – МОДИ 2, на третьем – МОДИ 1 (1%). Другие варианты заболевания встречаются реже, недостаточно изучены, не представляют клинической значимости. Второй тип болезни часто манифестирует в детском возрасте. Протекает бессимптомно или со слабовыраженными проявлениями, крайне редко сопровождается осложнениями, поэтому диагностируется при скрининговых обследованиях и во время беременности, когда развивается гестационная форма диабета.
Третий тип имеет прогрессивное течение, у большинства пациентов начинается в возрасте от 20 до 40 лет. Проявления схожи с симптомами классического диабета 1 типа: увеличивается количество мочи, усиливается жажда, повышается аппетит, вес тела снижается, по ночам возможна бессонница, судороги, днем – приливы жара, возбужденность, повышение кровяного давления и температуры.
Без лечения симптомы прогрессивно нарастают, сохраняется высокий риск микро- и макрососудистых осложнений. Характерен продолжительный «медовый месяц» – 3 года и более. Этим словосочетанием обозначают период после начала инсулинотерапии, когда первично подобранные врачом дозы препарата понижают уровень сахара крови сильнее ожидаемого, и требуется корректировка лечения вплоть до полной отмены инсулина.
Первый тип диабета МОДИ по клинической картине схож с третьим, но манифестирует чаще у новорожденных и детей младшего возраста. Определяется макросомия и неонатальная гипогликемия.
Осложнения
При MODY-диабете третьего типа наблюдается постепенное прогрессивное нарастание симптомов. Терапия инсулином и гипогликемическими препаратами дает хороший результат, но у пациентов сохраняется риск развития ангиопатии. Поражение капиллярных сетей в сетчатке глаза приводит к диабетической ретинопатии (снижению зрения), в почечных клубочках – к нефропатии (нарушению фильтрации мочи).
Атеросклероз крупных сосудов проявляется нейропатиями – онемением, болью, покалыванием в ногах, нарушением питания нижних конечностей («диабетической стопой»), сбоями в работе внутренних органов. У будущих мам заболевание второго и первого типа способно спровоцировать макросомию плода.
Диагностика
Из-за схожести симптомов различных форм диабета и редкости MODY диагностика достаточно сложна, объемна и продолжительна. С момента первого обращения пациента до подтверждения диагноза проходит не менее месяца. Обследованием руководит врач-эндокринолог, дополнительно назначаются консультации генетика, офтальмолога, невролога. Основные этапы – выявление гипергликемии, дифференциация MODY-диабета с обычным диабетом 1 и 2 типов. Комплекс диагностических процедур включает следующие методы:
Лечение MODY-диабета
Принципы терапии при диабете МОДИ такие же, как при лечении распространенных вариантов болезни. Они направлены на устранение гипергликемии, нормализацию метаболических процессов в организме. Методы зависят от типа заболевания и от наличия беременности – при вынашивании ребенка гипергликемия может негативно повлиять на только на женщину, но и на плод, поэтому применяется инсулинотерапия. Общая схема терапевтического воздействия включает:
Прогноз и профилактика
Течение MODY-диабета считается более благоприятным, чем других разновидностей диабета – симптоматика менее выраженная, заболевание хорошо поддается коррекции с помощью диеты, физических упражнений и приема гипогликемических лекарств. При строгом соблюдении назначений и рекомендаций врача прогноз положительный. Поскольку снижение выработки инсулина вызвано генетическими факторами, профилактика оказывается малоэффективной. Пациентам из групп риска следует периодически сдавать анализы крови для раннего выявления гипергликемии и предупреждения осложнений.
Наследственные формы сахарного диабета (сахарный диабет тип MODY)
Что такое MODY диабет?
MODY диабет чаще носит семейный характер, когда аналогичные нарушения углеводного обмена отмечаются также у одного из родителей и родственников 2 и 3 степени родства (бабушки, дедушки и т.д.).
К настоящему моменту известно 14 типов MODY, наиболее частыми из которых являются типа MODY 1 (HNF4A/MODY), MODY 2 (GCK/MODY) и MODY 3 (HNF1A/MODY). MODY диагностируется в 2- 5% случаев от общего количества людей с разными типами диабета. Диагностика различных типов MODY на основании только клинической картины невозможна!
Как заподозрить MODY?
ВАЖНО: при некоторых подтипах MODY ожирение является провоцирующим фактором, на фоне которого может повыситься сахар в крови.
Какие анализы нужно сделать в случае нестандартного (для СД 1 типа) течения сахарного диабета?
Что необходимо уточнить у родственников?
Как диагностировать MODY диабет?
Молекулярно-генетическое исследование методом NGS позволяет осуществлять поиск мутаций сразу в 28 генах-кандидатах (из них 13 генов MODY)
Как лечить и наблюдать MODY диабет?
ВАЖНО понимать!
MODY-диабет является РЕДКИМ заболеванием! Решение о целесообразности проведения генетического исследования и тактике лечения ребенка должно быть принято эндокринологом.
Описание клинических случаев семейной формы сахарного диабета HNF1A-MODY

Резюме. Сахарный диабет взрослого типа у молодых (MODY) представляет собой группу заболеваний, связанных с мутацией генов, приводящих к дисфункции β-клеток поджелудочной железы. Известно 14 вариантов MODY, наиболее изученными являются MODY 1-5. В статье приводится описание клинических случаев MODY3, в основе которых лежит мутация гена HNF1A. Мы наблюдали две семьи, в которых пробандом были молодые девушки 26 и 25 лет соответственно. Сахарный диабет (СД) у них впервые был диагностирован в подростковом возрасте 16 лет. В дебюте заболевания у пациентки из первой семьи наблюдались жалобы неспецифического характера, глюкозурия, гипергликемия до 9 ммоль/л, НвА1с – 8%. У пациентки из второй семьи гипергликемия до 14 ммоль/л была выявлена случайно, отсутствовали жалобы. При обследовании через 10 лет после диагностики СД у обеих пациенток уровень С-пептида был в пределах референсных значений, что свидетельствует о сохранности секреторной функции поджелудочной железы. Антитела у пациентки из первой семьи были отрицательными, по сравнению с пациенткой из второй семьи (выявлено наличие антител к GAD), уровень НвА1с – 7,8% и 5,9% соответственно. Из сопутствующих заболеваний у 2 пробандов выявлен аутоиммунный тиреоидит. Из осложнений СД у обеих пациенток – диабетическая периферическая полинейропатия. Отягощенный семейный анамнез по нарушениям углеводного обмена наблюдался в двух семьях, прослеживался в трех поколениях по материнской линии. На основании возраста диагностирования СД, сохраненной секреции β-клеток поджелудочной железы, отсутствия антител, определения СД у родственников в трех поколениях высказано предположение о наличии у пациенток HNF1A-MODY. После проведения молекулярно-генетического исследования диагноз подтвержден у наблюдаемой пациентки и ее матери (семья 1) и у пациентки из семьи 2. Данные клинические случаи демонстрируют варианты течения моногенной формы СД.
Cахарный диабет взрослого типа у молодых лиц (Maturity-Onset Diabetes of the Young, MODY) – редкая форма сахарного диабета (СД), на долю которой приходится от 2% до 5% всех случаев СД [1, 2]. Показатели распространенности MODY неточны и недооцениваются в глобальном масштабе, поскольку он часто не диагностируется или неправильно классифицируется как диабет типа 1 (СД 1 типа) или диабет 2 типа (СД 2 типа) из-за сходных клинических признаков [3].
MODY – это гетерогенная группа заболеваний с аутосомно-доминантным типом наследования, обусловленная мутациями генов, приводящими к дисфункции β-клеток поджелудочной железы и дебюту в молодом возрасте (до 35 лет) [4]. В настоящее время известно 14 типов MODY, 80% из которых обусловлены мутациями в генах ядерного фактора гепатоцитов 1-α (HNF1A), ядерного фактора гепатоцитов 4-α (HNF4A) и глюкокиназы (GCK) [3,5]. Одной из наиболее распространенных форм является HNF1A-MODY (MODY3), в основе патогенеза которой лежит нарушение секреции инсулина, снижение почечного порога для глюкозы. В некоторых странах Европы HNF1A-MODY превалирует, например, в Великобритании он составляет 62% от всех диагностированных случаев MODY [6]. Для сопоставления, распространенность HNF1A-MODY в Хорватии и Великобритании составляет 0,0066% и 3,6% случаев соответственно [7].
Каждый тип MODY требует различных стратегий ведения. Генетическая диагностика является ключом к адекватному лечению наследственных типов СД, обеспечивает правильную интерпретацию и оценку известных и новых вариантов в ассоциированных генах [3]. В данной статье мы приводим клиническое наблюдение HNF1A-MODY у пациенток с отягощенным семейным анамнезом и мутацией в гене HNF1A.
Описание клинических случаев
Семья 1
Пациентка А., 26 лет (пробанд). Обратилась на консультацию к врачу-эндокринологу с жалобами на сухость во рту. Из анамнеза заболевания известно, что в возрасте 15 лет у пациентки впервые выявлены нарушения углеводного обмена (нарушение толерантности к глюкозе), были даны рекомендации по ограничению легкоусвояемых углеводов, которые пациентка строго не соблюдала. В возрасте 16 лет она обратилась к врачу в связи с появлением неспецифических жалоб: слабость, повышенная утомляемость. При обследовании было выявлено значительное повышение уровня глюкозы плазмы крови натощак (до 9,1 ммоль/л), глюкозурия (до 3 г/л в утренней порции мочи), НвА1c составлял 8,0, при отсутствии антител к глутаматдекарбоксилазе. Был диагностирован СД 2 типа, рекомендован прием метформина в дозе 1000 мг/сут. В дальнейшем пациентка не наблюдалась регулярно, практически не проводила самоконтроль, рекомендации по питанию и медикаментозной терапии строго не выполняла.
Из анамнеза жизни известно, что пациентка родилась доношенной, с массой тела при рождении – 4600 г и длиной 57 см, в дальнейшем росла и развивалась соответственно возрасту. В детстве перенесла краснуху, ветряную оспу.
Наследственный анамнез отягощен по СД. Так, у матери пробанда был выявлен СД 2 типа в возрасте 39 лет (в настоящий момент возраст 53 года, индекс массы тела 38,3 кг/м 2 ). Поводом для обследования матери были жалобы на сухость во рту, жажду, повышенную утомляемость, прибавку массы тела на 6 кг в течение 2 месяцев. При обследовании впервые была выявлена гипергликемия натощак и постпрандиальная гипергликемия (6,8 и 10,4 ммоль/л соответственно), глюкозурия. Длительное время она принимала метформин и глибенкламид, текущая терапия – метформин 2000 мг/сут, гликлазид МВ – 90 мг/сут, эмпаглифлозин – 25 мг/сут. За время наблюдения развилась диабетическая дистальная полинейропатия, других осложнений СД не выявлено. Кроме СД мать пациентки имеет ожирение 2-й степени, артериальную гипертензию, неалкогольную жировую болезнь печени. Ее акушерско-гинекологический анамнез включал 2 беременности, осложнившихся гестозом и завершившихся рождением двух девочек с весом при рождении 3800 г (старшая сестра пробанда) и 4600 г (пробанд). У единоутробной старшей сестры пробанда (возраст 34 года) в настоящее время нарушений углеводного обмена нет. Однако во время беременности был выявлен гестационный СД (гликемия натощак – 6,5 ммоль/л на раннем сроке беременности), разрешившийся после родов.
У бабушки пробанда по линии матери СД впервые выявлен в возрасте 58 лет, в лечении был использован метформин с достаточным контролем гликемии. Бабушка пробанда умерла в возрасте 74 лет. У дедушки по материнской линии была нормогликемия, определялось ожирение 2-й степени, в анамнезе два инфаркта миокарда, умер в возрасте 45 лет. Отец пробанда (55 лет) не имеет СД, но имеет отягощенную наследственность: у его отца в возрасте 60 лет диагностирован СД 2 типа. Таким образом, среди ближайших родственников пробанда непрерывное наследование СД прослеживается в трех поколениях по линии матери (рис. 1).
Учитывая наличие СД с дебютом в подростковом возрасте, сохранение нормального уровня С-пептида за 10-летний период длительности диабета, отсутствие высоких значений гликемии при нерегулярном применении сахароснижающих препаратов (метформин), выявление дислипидемии в молодом возрасте, отягощенного наследственного анамнеза по СД, был проведен молекулярно-генетический анализ гена HNF1A. Принимая во внимание особенности течения диабета у пробанда и ее матери, исследование было выполнено обеим пациенткам в НИИТПМ – филиал ИЦиГ СО РАН (г. Новосибирск).
В результате у пробанда и ее матери был обнаружен ранее описанный гетерозиготный вариант rs137853240 (G319S), локализованный в 319-м кодоне гена HNF1A. Родной сестре пробанда планируется идентичное обследование. После верификации типа СД у пациентки А. терапия скорректирована на назначение препарата сульфонилмочевины (СМ) (гликлазид МВ 60 мг) с положительным эффектом (купировалась глюкозурия, были достигнуты целевые показатели гликемии и HbA1c).
Семья 2
Пациентка И., 25 лет (пробанд). Впервые при обследовании по поводу умеренной гипергликемии натощак и проведении перорального теста толерантности к глюкозе в 14 лет было выявлено нарушение толерантности к глюкозе, даны рекомендации по диете, режиму физических нагрузок. Пациентка рекомендаций не соблюдала. Отсутствовали жалобы как специфического, так и неспецифического характера. По данным амбулаторной карты в возрасте 16 лет на основе клинических данных был диагностирован СД 1 типа, при обследовании – гипергликемия до 14 ммоль/л, рекомендован прием метформина в дозе 1000 мг/сут. Дебют заболевания пациентка И. долгое время связывала с перенесенным психоэмоциональным стрессом (выпускные и вступительные экзамены). В 18 лет подтвержден диагноз СД 1 типа на основании получения повышенного титра антител к глутаматдекарбоксилазе (титр антител составил 56,0 МЕ), был отменен метформин, назначен НовоРапид по 4 ЕД перед основными приемами пищи. На фоне данной терапии при самоконтроле отмечались эпизоды гипогликемии до 1,3 ммоль/л 1-2 раза в неделю, сопровождавшиеся ощущением беспокойства и повышенной потливости. В 2018 г. к терапии добавлен инсулин длительного действия в дозе 2 Ед/сут. В 2019 г. пациентка находилась на лечении в ФГБУ НМИЦ им. В. А. Алмазова (Санкт-Петербург), уровень НвА1c – 5,3%, предположительно ввиду частых эпизодов гипогликемии, в том числе и в ночное время, было принято решение об отмене инсулина длительного действия. Пациентка старается соблюдать диету, выполняет рекомендации по питанию и медикаментозной терапии, но самоконтроль глюкозы проводит нерегулярно.
Из анамнеза жизни известно, что пациентка родилась недоношенной, в 36 недель беременности, масса тела при рождении – 2850 г, длина – 48 см, в дальнейшем росла и развивалась соответственно возрасту. В детстве перенесла ветряную оспу. Отмечает нарушения менструального цикла: менструации с 14 лет, установились не сразу, в течение около 1 года, в течение последних лет менструальный цикл регулярный на фоне приема комбинированного гормонального контрацептивного препарата (дроспиренон + этинилэстрадиол), беременностей не было.
Старшему брату мамы пробанда диагностировали СД в 39 лет, его текущая терапия представлена инсулинотерапией в режиме базис-болюс, течение заболевания осложнилось развитием в молодом возрасте (до 45 лет) инфаркта миокарда. У дедушки по материнской линии СД впервые выявлен в 40 лет, был осложнен развитием диабетической ретинопатии и нефропатии. В лечении использовался глибенкламид. В анамнезе пять инфарктов миокарда, умер в возрасте 70 лет. У брата дедушки был выявлен СД в 39 лет, протекал с развитием хронических осложнений СД (ретинопатия, нефропатия, полинейропатия, макроангиопатия, синдром диабетической стопы). Родная сестра дедушки также страдала СД с дебютом в 40 лет. Отец пробанда (55 лет) не имеет СД, но есть отягощенная наследственность: у его отца в возрасте 65 лет диагностировано ожирение и СД 2 типа, успешно контролируемый приемом метформина 1 г/сут. Таким образом, среди прямых родственников пробанда непрерывное наследование СД прослеживается в трех поколениях по линии матери (рис. 2).
Учитывая наличие СД с дебютом в подростковом возрасте, сохранение нормального уровня С-пептида за весь период течения СД, отсутствие избыточного веса и явных клинических признаков инсулинорезистентности, отсутствие положительного эффекта от применения препаратов инсулина, склонность к гипогликемическим состояниям, отягощенный наследственный анамнез по СД, был проведен молекулярно-генетический анализ гена HNF1A (в ФГБУ НМИЦ эндокринологии Минздрава России, г. Москва). В результате у пробанда был обнаружен ранее неописанный гетерозиготный вариант c.682delG p.E228SfsX5, патогенный. Матери и дяде пробанда по материнской линии планируется идентичное обследование.
После верификации типа СД пациентка была переведена на препараты СМ (гликлазид МВ 30 мг) с положительным эффектом (устранены эпизоды гипогликемии, достигнуты целевые показатели гликемии и HbA1c).
Обсуждение
В нашем наблюдении как в 1-й, так и во 2-й семье при оценке семейного анамнеза прослеживались случаи выявления СД у родственников 1-й и 2-й степени родства. Наличие родственников с СД в нескольких поколениях типично для HNF1A-MODY [6]. Сведения о других родственниках были недоступны. Безусловно, обращает на себя внимание выявление гестационного СД у родной сестры пробанда А. (семья 1), что, безусловно, подтверждает необходимость проведения молекулярно-генетического скрининга MODY. Матери и дяде пробанда И. по материнской линии (семья 2) планируется идентичное обследование.
Клиническая картина HNF1A-MODY вариабельна. Дебют обычно приходится на возраст до 25 лет с пиком диагностики заболевания в пубертатный период. Так и у наших пациенток за 1-2 года до клинически явной манифестации СД определялись нарушения углеводного обмена (нарушение толерантности к глюкозе), а СД был диагностирован в 16 лет. Диабет HNF1A часто развивается внезапно с классическими гипергликемическими симптомами, такими как полиурия и полидипсия, поэтому его неправильно классифицируют как диабет 1 типа. Тем не менее нередко HNF1A-MODY является случайной диагностической находкой, выявляемой при обследовании по поводу умеренной гипергликемии или глюкозурии (как у пациентки А. из 1-й семьи). В обоих описанных случаях длительное время у пациенток отсутствовали специ-фические для СД жалобы, такие как полиурия, полидипсия, полифагия, изменения массы тела.
Пациенты с HNF1A-MODY имеют такой же риск развития диабетических микро- и макрососудистых осложнений, как и пациенты с СД 2 типа, и строгий гликемический контроль в сочетании с надлежащим лечением осложнений имеет решающее значение для хорошего прогноза. По данным проспективных наблюдений у пациентов с HNF1A-MODY могут развиться классические диабетические осложнения с достаточно высокой частотой: ретинопатия – у 47% пациентов, нефропатия – у 19% и полинейропатия – у 4%, реже – макрососудистые, при нерегулярном лечении – острые гипергликемические осложнения [16]. Так и на примере наших пациенток мы видим спустя 10 лет от момента дебюта заболевания развитие диабетической полинейропатии. Зачастую у пациентов с HNF1A-MODY отмечается склонность к развитию гипогликемических состояний, особенно в начале терапии [17]. Так, у пациентки из 2-й семьи были выявлены эпизоды гипогликемии до 1,3 ммоль/л, в том числе и в ночное время, которые развивались в ответ на небольшие дозы препаратов инсулина как длительного, так и короткого действия. По современным представлениям пациенты с HNF1A-MODY нуждаются в постоянном соблюдении диеты и низких дозах сахароснижающих препаратов из группы препаратов сульфонилмочевины [18]. Отчетливая положительная динамика на фоне минимальных доз препаратов СМ в режиме монотерапии была отмечена у обеих пациенток и матери пробанда И.: устранены эпизоды гипогликемии, глюкозурия, достигнуты целевые показатели гликемии и HbA1c.
Окончательный диагноз HNF1A-MODY устанавливается на основании молекулярно-генетического обследования при обнаружении клинически значимых мутаций в гене HNF1A. Молекулярно-генетическое исследование позволяет верифицировать тип MODY, что обеспечивает адекватное ведение пациентов и позволяет провести генетическое консультирование семей 20.
Лечение пациентов с HNF1A-MODY включает диету с ограничением легкоусвояемых углеводов, умеренную физическую активность и при недостаточной компенсации – применение препаратов СМ в индивидуально подобранной, как правило, невысокой, дозе или инсулинотерапию, зачастую ограничивающуюся суточной потребностью в инсулине менее 0,5 ед/кг/сут [21]. Пациенты с HNF1A-MODY-диабетом имеют высокую чувствительность к препаратам СМ, превышающую соответствующий параметр пациентов с СД 2 типа в четыре раза [18]. Препараты СМ связываются с мембранным белком, тесно связанным с АТФ-зависимым калиевым каналом в β-клетке, тем самым закрывая канал. Развивающаяся вследствие этого деполяризацию мембраны приводит к открытию кальциевого канала и увеличению внутриклеточной концентрации кальция, что и вызывает секрецию инсулина. Следовательно, применение СМ у пациентов с HNF1A-MODY позволяет стимулировать секрецию инсулина, несмотря на сниженную концентрацию АТФ в β-клетках. Препараты СМ рекомендуются в качестве терапии первой линии у пациентов с СД HNF1A. Однако лечение СМ имеет ограничения: СМ не обеспечивает устойчивого гликемического контроля у всех пациентов, часто требуется комбинированная сахароснижающая терапия; СМ значительно повышает риск развития гипогликемии и может привести к увеличению массы тела. Следует отменить, что вследствие высокой чувствительности к СМ в сочетании с нормальной или даже повышенной чувствительностью к инсулину терапия СМ эффективна для снижения гликемии, однако из-за глюкозонезависимого механизма действия СМ часто ассоциируется с гипогликемией даже при использовании относительно низких доз. Безусловно, существует необходимость в исследованиях, изучающих эффективные сахароснижающие средства в качестве дополнения к лечению СМ, когда пациенты не имеют достаточного гликемического контроля, или исследующих альтернативные подходы к лечению, когда пациенты не достигают гликемических целей из-за рецидивирующей гипогликемии на фоне СМ. Недавние исследования показали эффективность в лечении пациентов с HNF1A-MODY агонистов рецепторов глюкагоноподобного пептида 1-го типа (АрГПП-1) [22]. В рандомизированном двойном слепом перекрестном исследовании S. H. Østoft с соавт. в небольшой группе пациентов с MODY (n = 16, возраст 39 лет) было продемонстрировано, что терапия лираглютидом в течение 6 недель эффективно снижает уровень глюкозы крови натощак и постпрандиально с достоверно меньшей частотой легкой гипогликемии в сравнении с глимепиридом. При этом не было выявлено статистически значимых различий между лираглютидом и глимепиридом по уровню инсулина, был отмечен сопоставимый прирост уровня С-пептида в сравнении с исходным при обоих вариантах терапии. Глимепирид более значимо влиял на уровень глюкозы крови, что сопровождалось 10-кратным в сравнении с лираглютидом увеличением риска гипогликемии [22]. Также перспективным представляется подход комбинированной терапии СМ и препаратами группы АрГПП-1. Так, продемонстрировано, что низкие дозы СМ в сочетании с введением глюкагоноподобного пептида 1-го типа и глюкозозависимого инсулинотропного пептида у носителей мутации HNF1А демонстрируют аддитивный эффект на секрецию инсулина [23].
Katra и соавт. описали успешное добавление глиптинов (вилдаглиптина и ситаглиптина) к терапии пациентов с HNF1А-MODY, которые получали комбинации инсулина с гликлазидом или инсулина с метформином [24]. Эта терапия была связана не только с улучшением гликемического контроля, но также с улучшением функции β-клеток. В недавнем рандомизированном двойном слепом перекрестном исследовании пациентов с HNF1А-MODY (n = 19, возраст 43 ± 14 лет) была продемонстрирована эффективность добавления линаглиптина к терапии глимепиридом, не сопровождавшаяся ростом риска гипогликемии [25]. С осторожностью назначаются ингибиторы натрий-глюкозного котранспортера-2, так как при мутации в гене HNF1A снижен почечный порог для глюкозы и назначение данного класса препаратов может вызвать дегидратацию и урогенитальную инфекцию [26].
Заключение
Данное наблюдение показывает особенности течения СД, ассоциированного с гетерозиготной заменой в экзоне 4 гена HNF1A, а также с ранее неописанной мутацией c.682delG. Клинические случаи расширяют наши представления об одном из наиболее частых типов MODY, демонстрируют необходимость персонализированного подхода при проведении дифференциальной диагностики типа СД у лиц молодого возраста.
Литература/References
* ФГБОУ ВО ОмГМУ Минздрава России, Омск, Россия
** НИИТПМ – филиал ФИЦ ИЦиГ СО РАН, Новосибирск, Россия
Описание клинических случаев семейной формы сахарного диабета HNF1A-MODY/ А. А. Баранова, И. В. Друк, А. К. Овсянникова 35
Для цитирования: Баранова А. А., Друк И. В., Овсянникова А. К. Описание клинических случаев семейной формы сахарного диабета HNF1A-MODY // Лечащий Врач. 2020; 12 (23): 35-40. DOI: 10.26295/OS.2020.13.48.008
Теги: гипергликемия, молодые пациенты, семейный анамнез
.gif)
.gif)
.gif)
.gif)