Диагноз 109 при беременности что это такое
Перечень контингентов, рекомендуемых для обследования на ВИЧ – инфекцию и кратность их обследования.
Понедельник, 22 Июнь 2015
Согласно приложению №3 к приказу департамента здравоохранения и социальной защиты населения Белгородской области от «11» января 2009 г. № 1 «Об оптимизации обследования населения Белгородской области на ВИЧ-инфекцию», приказа №1317 от 26.05.15 г. основными кодами при обследовании детей являются следующие:
4. КОД 113 – обследование по клиническим показаниям, в т. ч. больные с подозрением или подтвержденным диагнозом:
· мононуклеоза (через 3 месяца после начала заболевания);
· токсоплазмоза (центральной нервной системы);
· кандидоза пищевода, бронхов, трахеи или легких;
· прогрессирующей многоочаговой лейкоэнцефалопатии;
· анемии различного генеза
-и другие СПИД-ассоциированные инфекции.
Больные по клиническим показаниям:
· Длительно лихорадящие больные, не исключающие диагноз «ВИЧ-инфекция»;
· имеющие увеличение лимфоузлов двух или более групп свыше 1 месяца;
· с диареей, длящейся более месяца;
· с неясной потерей массы тела на 10 и более процентов;
· с затяжными и рецидивирующими пневмониями или пневмониями, не поддающимися обычной терапии;
· с затяжными и рецидивирующими гнойно-бактериальными, паразитарными заболеваниями, сепсисом;
· с подострым энцефалитом и слабоумием у ранее здоровых лиц;
· с волосатой лейкоплакией языка;
· с рецидивирующей пиодермией;
· женщины с хр. воспалительными заболеваниями женской репродуктивной системы неясной этиологии.
6. Код 118 – прочий контингент (по пр. №1317):
— код 118с – лица по социальным показаниям (страдающие алкоголизмом, БОМЖИ);
— код 118м- медицинские работники в стационарах (отделениях) хирургического профиля;
— код 118о – биологические отцы будущих детей;
— код 118х-лица от 18 до 55 лет идущие на инвазивные вмешательства.
9. Код 200 – прибывшие дети, для получения гражданства, вида на жительство (платно).
10. Код 200/у – граждане, временно покинувшие Украину – по прибытию
В направлениях на обследование указывать код материала и причину обследования (диагноз).
По всем вопросом Вы можете проконсультироваться у специалистов кабинета анонимного обследования ВИЧ – инфекции тел. 42-85-86.
Примечание: В соответствии с Федеральным законом «О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ- инфекции)» принудительное обследование на ВИЧ запрещается.
Вагиниты, вызванные условно-патогенной микрофлорой: рекомендации для практикующих врачей
Сведения об авторе:
Пустотина Ольга Анатольевна, доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН Адрес: 117198 Москва, ул. Миклухо-Маклая д. 6, телефон 8 (495) 787-38-27, email: rudn@rudn.ru Pustotina Olga Anatolievna, Doctor of Medicine, Professor of The department of Obstetrics, Gynecology and Reproductive Health, Peoples’ Friendship University of Russia. Address: 117198 Moscow, Mikluho-Maklaya str, 6. Phone 8(495)7873827
Нормальная микрофлора женских половых органов
Таким образом, во влагалище здоровых женщин репродуктивного возраста общая численность бактерий составляет 105-106 КОЕ/мл выделений, 95% которых представлены лактобактериями и только 5% формируется представителями других видов аэробных и анаэробных УПМ.
Вагиниты, вызванные УПМ
Вагиниты бывают воспалительного и невоспалительного характера. Воспалительные вагиниты в зависимости от вида возбудителя разделяют на неспецифические и специфические. К специфическим относятся трихомонадный, хламидийный, гонококковый и грибковый вагинит (вагинальный кандидоз), при обнаружении любых других УПМ вагинит является неспецифическим. Невоспалительный вагинит называется бактериальным вагинозом. Бактериальный ваги- ноз, неспецифический вагинит и вагинальный кандидоз объединяют вагиниты, вызванные УПМ.
Бактериальный вагиноз не относится к инфекциям, передаваемым половым путем (ИППП), но связан с сексуальной активностью женщины и может вызывать симптомы уретрита у мужчин. Происходящие во влагалищном биотопе изменения облегчают восходящее инфицирование ИППП: гонококками, хламидиями, трихо- монадами, ВИЧ-инфекцией и др. Кроме того, накапливаясь в большом количестве, УПМ проникают в полость матки, вызывая хроническую воспалительную реакцию, приводя к бесплодию, невынашиванию беременности и снижению эффективности программ ЭКО [7, 8].
Вагинальный кандидоз-это воспаление слизистой оболочки влагалища, вызванное дрожжевыми грибами рода СапсНс1а, которое встречается у 5-10% женщин репродуктивного периода. Развитие кандидоза в основном расценивают как вторичную эндогенную инфекцию, резервуаром которой является желудочно-кишечный тракт. Основными причинами, способствующими проникновению грибов из аногенитальной области во влагалище и их интенсивному размножению, является прием антибиотиков, глюкокортикоидов, потребление пищи с большим количеством углеводов. Предрасполагающими к заболеванию факторами служат ожирение, сахарный диабет и нарушение правил личной гигиены 9.
Факторы риска вагинитов, вызванных УПМ
Устойчивость экосистемы влагалища определяется факторами эндогенного и экзогенного происхождения. К развитию дисбиотических процессов в вагинальном микроценозе наиболее часто приводят: стресс, лечение антибиотиками, гормональная терапия, эндокринные и аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекция мочевых путей. Уменьшение доли лактобацилл и повышение рН в содержимом влагалища происходит при повреждениях эпителиального покрова в результате полового акта, трещин, расчесов, при чрезмерной гигиене наружных половых органов. Нередко женщины при появлении неприятного запаха из половых путей прибегают к спринцеванию. Спринцевание не имеет ни гигиенического, ни профилактического, ни лечебного эффекта, а усугубляет дис- биоз и является фактором риска воспалительных заболеваний органов малого таза. Нарушение экосистемы влагалища может возникать после полового акта вследствие действия спермы с высоким уровнем рН, при частой смене половых партнеров, во время аногенитальных контактов, при использовании некоторых спермицидов. Длительное маточное кровотечение, инородные тела во влагалище (тампоны, пессарии, швы при истмико-цервикальной недостаточности) нередко также сопровождаются патологическими выделениями из половых путей [4, 6, 7, 9].
Клиника и диагностика вагинитов, вызванных УПМ
В основе вагинитов, вызванных УПМ, лежит уменьшение колоний лактобактерий, в результате которого изменяется рН вагинальной среды с кислой на щелочную и создаются условия для разрастания УПМ и их адгезии на освобождающийся эпителий слизистой оболочки влагалища.
Все происходящие изменения вагинального биотопа объединяются диагностическими критериями Амселя: появление специфических белей из половых путей, увеличение рН вагинального отделяемого, «рыбный» запах и наличие «ключевых клеток», представляющих собой эпителиальные клетки, порытые сплошным слоем различных микроорганизмов. По последним данным, даже наличие двух критериев из четырех позволяет установить нарушение вагинального микробиоценоза [5].
Кроме того, возбудители ИППП, такие как хламидии, трихомонады, гонококк и Мусор1а5та депйаПит, также могут колонизировать генитальный тракт, не нарушая нормальный рост лактобактерий и не изменяя рН влагалищного содержимого, в следствие чего до 90% случаев инфицирования ИППП протекают бессимптомно. Поэтому международные и отечественные эксперты 15 рекомендуют дополнительно к микроскопическому исследованию, обладающему низкими диагностическими возможностями в отношении облигатных патогенов, использовать метод полимеразной цепной реакции (ПЦР) для выявления антигенов хламидий, трихо- монад, гонококка и Мусор1а5та депИаИит в отделяемом половых путей.
Таким образом, окончательный диагноз вагинитов, вызванных УПМ, устанавливается при наличии у женщины жалоб на патологические вагинальных выделения и данных микроскопического исследования, и только после исключения ИППП методом ПЦР.
Лечение вагинитов, вызванных УПМ
Первый этап: Противомикробная терапия.
Препаратами выбора для лечения бактериального вагиноза являются производные нитроимидазола и линкозамиды, которые наиболее активно подавляют размножение анаэробной микрофлоры:
Исследования показали, что ни у одной из схем нет преимуществ в эффективности терапии [7], однако при местном использовании значительно реже возникают побочные эффекты [16].
Для лечения неспецифического вагинита рекомендуется использовать клин- дамицин (300 мг 2 р/сут 7 дней, вагинальный крем 2% 5г 7 дней, свечи 100 мг вагинально 3 дня). В сравнении с производными нитроимидазола (метронидазол, тинидазол, орнидазол), он имеет более широкий спектр действия, включающий не только анаэробные, но и аэробные грамположительные и грамотрицательные бактерии [3, 12, 13, 17, 18].
В последние годы опубликованы результаты крупных рандомизированных контролируемых исследований, показавших высокую эффективность лечения нарушений вагинального микробиоценоза еще двумя антибиотиками широкого спектра действия: рифаксимина (250 мг вагинально 5 сут) [19] и нифуратела (250 мг вагинально 10 сут) [20].
Следует отметить, что все выше представленные антибактериальные средства, обладая выраженной подавляющей активностью в отношении УПМ, не влияют на жизнедеятельность полезных молочно-кислых бактерий [15, 19, 20].
Терапия вагинального кандидоза проводится антимикотиками, среди которых препаратами первой линии являются азолы для интравагинального применения (имидазолы):
и азолы для приема внутрь (триазолы):
При остром неосложненном вагинальном кандидозе, вызванном СапсМс1а а1Ысап5, все препараты местного и системного действия одинаково эффективны.
В случаях рецидивирования процесса длительность и количество курсов увеличивается, при этом необходимо идентифицировать вид кандидозной инфекции и исключить возможные факторы риска [10,12-14].
Антисептики:
В настоящее время получено множество доказательств эффективности терапии вагинитов, вызванных УПМ, различными антисептическими средствами, такими как:
Все антисептики обладают широким неспецифическим спектром действия и подавляют рост аэробных и анаэробных микроорганизмов, а также грибов рода СапсМс1а, при этом не влияя на жизнедеятельность колонии лактобактерий [15].
Наибольшая доказательная база (уровень доказательности 1А) продемонстрирована для деквалиния хлорида (флуомизина). В крупномасштабных многоцентровых рандомизированных зарубежных [21 ] и отечественных исследованиях (БИОС-1/М) [18, 22, 24] с участием 321 и 640 пациенток, соответственно, деквалиния хлорид показал сопоставимую эффективность с действием клиндамицина при лечении вагинитов, вызванный УПМ, при значительно лучшей переносимости и меньшей частоте развития кандидоза. Кроме того, вагинальные таблетки деквалиния хлорида обладают хорошей всасываемостью и меньшей текучестью в сравнении с хлоргексидином, поэтому назначаются один раз в сутки, не вызывая аллергических и других побочных эффектов, характерных для повидон-йода, при этом более эффективно уменьшая количество «ключевых клеток» и ПЯЛ в вагинальном мазке [18, 22].
Второй этап: восстановление микробиоценоза
Одной из причин хронизации процесса являются бактериальные пленки, формирующие невосприимчивость микроорганизмов к действию антибактериальных и антисептических средств [23]. В результате уровень излеченности через 3 мес составляет 60-70% и еще ниже через 6 мес [6]. Значительное повышение эффективности терапии вагинитов происходит после проведения второго этапа, направленного на восстановление нормального микробиоценоза [22, 23, 25].
Наилучшие результаты продемонстрировало применение пробиотиков, содержащих живые лактобактерии. Они не только подавляют рост УПМ, ассоциированных с бактериальным вагинозом и неспецифическим вагинитом, за счет образования молочной кислоты, перекиси водорода и бактериоцинов, но и способны разрушать образованные ими биопленки, а также модулируют иммунный ответ и способствуют размножению колоний эндогенных лактобактерий [4, 12, 19, 24, 26, 27].
В качестве дополнительного фактора, улучшающего состояние вагинального микробиоценоза после антимикробной терапии, является применение вагинальных таблеток аскорбиновой кислоты. [28]. В то же время, применение исключительно пробиотиков и/или закисления вагинальной среды без предшествующей антимикробной терапии для лечения вагинитов, вызванных УПМ, недостаточно [7].
Лечение вагинитов, вызванных УПМ, у беременных
Нарушение вагинального микробиоценоза у беременных достоверно сопряжено с повышенным риском преждевременных родов, восходящего инфицирования плода и послеродовых гнойно-септических осложнений [1,8, 29-31 ].
Согласно зарубежным рекомендациям [12, 13] терапия бактериального вагино- за и неспецифического вагинита у беременных женщин не отличается от таковой у небеременных. Препаратом первой линии считается метронидазол для системного и местного применения. При осложненном течении беременности и высоком риске преждевременных родов более эффективным считается назначение клиндамицина, обладающего более широким спектром активности 33. При этом терапию нарушений биоценоза влагалища необходимо проводить с самых ранних сроков беременности [36].
В отечественных рекомендациях [14] антибиотики из группы нитроимидазола и линкозамидов противопоказаны в первом триместре, их применение возможно только местно после 12 нед беременности. Поэтому препаратами выбора для беременных являются вагинальные антисептики широкого спектра действия. Среди антисептических средств только у деквалиния хлорида безопасность применения на любом сроке беременности и в период грудного вскармливания подтверждена в масштабных многоцентровых исследованиях [18, 21, 22, 24]. Беременным с вагинальным кандидозом показано местное применение азолов (клотримазол, миконазол, терканозол и др.) 13. В случаях неэффективности терапии предусмотрено интравагинальное назначение полиенов (натамицин, нистатин) 13. В дальнейшем для профилактики рецидивов вагинальных выделений беременным назначаются пробиотики и средства, подкисляющие вагинальную среду [28, 36].
В заключение хочется отметить, что вагинальный микробиоценоз напрямую связан с состоянием здоровья женщины. Любые нарушения гомеостаза могут сопровождаться патологическими выделениями из половых путей, которые нередко бывают кратковременными, и после нормализации общего состояния самостоятельно проходят. В случаях рецидивирования процесса основной задачей врача является не поиск и идентификация возможных возбудителей, которых при вагинитах, вызванных УПМ, как правило множество, а выяснение причин, приведших к длительному течению заболевания. Для постановки правильного диагноза достаточно простой микроскопии вагинального мазка и метода ПЦР для исключения строгих патогенов. При рецидивирующих патологических вагинальных выделениях необходим также тщательный сбор анамнеза для выявления всех возможных факторов риска, только после устранения которых достигается полноценное восстановление вагинального микробиоценоза.
Список использованной литературы
1. Гуртовой Б.Л., Кулаков В.И., Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии. – М.: Триада-Х, 2004. – 176с.
2. Sweet RL, Gibbs RS. Infectious diseases of the female genital tract. – 5th ed. Lippincott Williams Wilkins, 2009. 469p.
4. Радзинский В.Е. Бактериальный вагиноз. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Издат журнала StatusPraesens, 2014. – С.249-280.
5. Mittal V, Jain A, Pradeep Y. Development of modified diagnostic criteria for bacterial vaginosis at peripheral health centres in developing countries/ J Infect Dev Ctries. 2012; 6(5): 373-377.
6. Verstraelen H, Verhelst R. Bacterial vaginosis: an update on diagnosis and treatment/ Expert Rev Anti Infect Ther. 2009;7:1109–1124.
7. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss/ Expert Opin Pharmacother. 2014;15(5): 645-657.
8. Leitich H, Bodner-Adler B, Brunbauer M. et al. Bacterial vaginosis as a risk factor for preterm delivery: a meta-analysis/ Am J Obstet Gynecol. 2003;189: 139–147.
9. Filler SG. Insights from human studies into the host defense against candidiasis/ Cytokine. 2012; 58(1): 129-132.
10. Байрамова Г.Р. Рецидивирующий вульвовагинальный кандидоз: автореф. дис. докт.мед.наук.– М., 2013.
11. Роговская С.И., Липова Е.В., Яковлева А.Б. Вульвовагинальные микозы. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Изд-во журнала StatusPraesens, 2014. – С.281-308.
12. CDC. Sexually Transmitted Diseases Treatment Guidelines 2010. http://www.cdc.gov/std/treatment/2010/pid.htm
13. Sherrard J, Donders G, White D. European (IUSTI/WHO) Guideline on the management of vaginal discharge in women reproductive age. 2011.
14. Клинические рекомендации РОАГ. Акушерство и гинекология. – 4-е изд./ под ред. В.Н. Серова, Г.Т. Сухих. – М.: ГЭОТАР-Медиа, 2014. – 1024с.
15. Профилактика, диагностика и лечение инфекций, передаваемых половым путем: рук-во для дерматовенерологов, акушеров-гинекологов, урологов и семейных врачей. – М.:Институт здоровья семьи, 2008.
16. Mikamo H, Kawazoe K, Izumi K, et al. Comparative study on vaginal or oral treatment of bacterial vaginosis / Chemotherapy. 1997; 43:60-68.
17. Практическое руководство по антиинфекционной химиотерапии// Под ред. Л.С. Страчунского, Ю.А. Белоусова, С.Н. Козлова. – М., 2007. – 462с.
18. Подзолкова Н.М., Никитина Т.И. Сравнительная оценка различных схем лечения больных с бактериальным вагинозом и неспецифическим вульвовагинитом // Рос вестник акуш гинекол, 2012.- №4. – С.75-81.
19. Donders GG, Guaschino S, Peters K, et al. A multicenter, double-blind, randomized, placebocontroled study of rifaximin for the treatment of bacterial vaginosis/ Int J Gynaecol Obstet. 2013; 120:131-136.
21. Weissenbacher ER, Donders G, Unzeitig V. et al. Fluomizin Study Group. A comparison of dequalinium chloride vaginal tablets (Fluomizin®) and clindamycin vaginal cream in the treatment of bacterial vaginosis: a single-blind, randomized clinical trial of efficacy and safety. Gynecol Obstet Invest.
2012; 73: 8–15.
23. Swidsinski A, Verstraelen H, Loening-Baucke V. et al. Presence of a polymicrobial endometrial biofilm in patients with bacterial vaginosis/ PLoS One. 2013;8:e53997.
25. McMillan A, et al. Disruption of urogenital biofilms by lactobacilli / Colloids Surf B Biointerfase,2011; 86(1): 58-64.
26. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study./ BMC Women Health, 2008;15(8):3.
27. Ya W, Reifer C, Miller L E. Efficacy of vaginal probiotic capsules for recurrent bacterial vaginosis: a double blind, randomized, placebo-controlled study. Am J Obstet Gynecol. 2010; 203:1200–1208.
28. Zodzika J, Rezerberga D, Donders G. et al. Impact of vaginal ascorbic acid on abnormal vaginal microflora / Arch Gynecol Obstet 2013; 288: 1039-1044.
29. Bothuyne-Queste E, et al. Is the bacterial vaginosis risk factor of prematurity? Study of a cohort of 1336 patients in the hospital of Arras/ J Gynecol Obstet Biol Reprod. 2012; 41(3): 262-270.
30. Pustotina OA, Bubnova NI, Yezhova LS. Pathogenesis of hydramnios and oligohydramnios in placental infection and neonatal prognosis /J mat-fetal&neonat med. 2008; 21(1): 267-271.
31. Pustotina OA. Urogenital infection in pregnant women: clinical signs and outcome /J Perinat Med, 2013; 41:135.
32. Simcox R, Sin WT, Seed PT, et al. Prophylactic antibiotics for the prevention of preterm birth in women at rick: a meta-analysis/ Aust N-Z J Obstet Gynaecol. 2007; 47: 368-377.
33. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy/Cochr Database Syst Rev. 2007. N1.P.CD000262.
34. Lamont RF, Duncan SLB, Mandal D, et al. Intravaginal clindamycin to reduce preterm birth in women with abnormal genital tract flora/ Obstet Gynecol. 2003;101:516–522.
Пренатальная (дородовая) диагностика врожденной патологии плода
Рождение здорового ребенка – естественное желание каждой беременной женщины. Но, к сожалению, надежды на счастливое материнство не всегда оправдываются. Около 5% новорожденных имеют различные врожденные заболевания. Скрининг в 1 и во 2 триместрах беременности позволяет определить, насколько велик риск врожденной патологии у будущего ребенка.
В настоящее время существуют достаточно эффективные методы пренатальной (дородовой) диагностики многих заболеваний плода, которые можно выявить с 11 недели беременности. Своевременное проведение скрининговых обследований дает возможность определить большой спектр патологии плода и увидеть ультразвуковые признаки хромосомных аномалий.
Что такое ранний пренатальный скрининг и когда он проводится
Скрининг (от англ. «просеивание») – это совокупность исследований, позволяющих определить группы беременных, у которых существует риск рождения ребенка с хромосомными аномалиями и врожденными пороками. Но ранний скрининг – это только начальный, предварительный этап обследования, после которого женщинам, с выявленным риском врожденных аномалий, рекомендуется более детальное диагностическое обследование, которое точно подтвердит или исключит наличие патологии.
Что включает в себя ранний пренатальный скрининг
В комплексное обследование входят:
Полученные данные: анамнез, УЗИ и биохимические маркеры помещают в специально разработанную программу Astraia, которая рассчитывает риск рождения ребенка с врожденными аномалиями. Комбинация данных исследований увеличивает эффективность выявления плодов с синдромом Дауна и другими хромосомными заболеваниями.
Что такое программа Astraia
Astraia – это профессиональная программа, вычисляющая вероятность хромосомных аномалий у плода. Программа была разработана Фондом Медицины Плода (Fetal Medicine Foundation – FMF) в Лондоне и успешно апробирована на огромном клиническом материале во многих странах мира. Она постоянно совершенствуется под руководством ведущего специалиста в области пренатальной диагностики профессора Кипроса Николаидеса, в соответствии с последними мировыми достижениями в области медицины плода.
Специалист, проводящий ранний пренатальный скрининг, должен иметь международный сертификат FMF, дающий право на выполнение данной диагностики и работу с программой Astraia. Сертификат подтверждается ежегодно после статистического аудита проделанной за год работы и сдачи сертификационного экзамена. Таким образом обеспечивается высокая диагностическая точность полученных рисков.
Проведение раннего пренатального скрининга с помощью данной программы регламентировано приказом Министерства Здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении порядка оказания медицинской помощи по профилю «акушерство-гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Ранний пренатальный скрининг позволяет вычислить следующие риски:
Что оценивается при УЗИ в 1 триместре
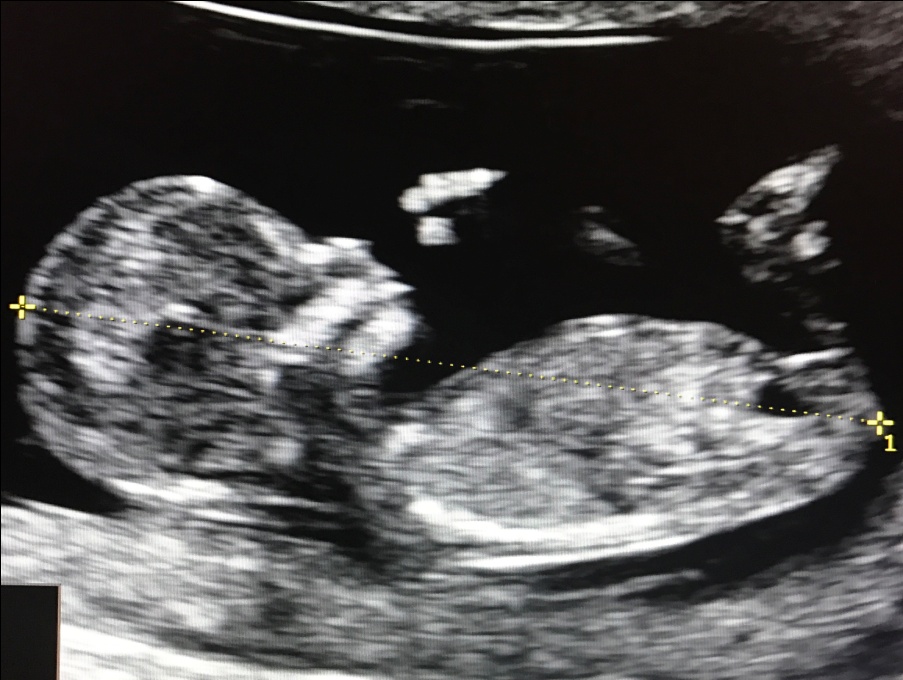
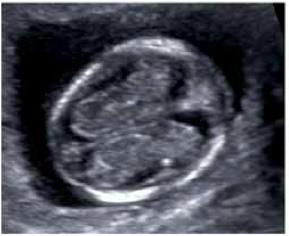
1. Копчико-теменной размер (КТР) плода
Правильное измерение КТР плода
2. Маркеры хромосомной патологии:
— толщина воротникового пространства (ТВП) – является основным признаком хромосомной патологии у плода. Патологической величиной считается увеличение ТВП больше 95-й процентили для каждого срока гестации. Каждое увеличение ТВП повышает риск существования хромосомной аномалии у плода.
ТВП в норме ТВР при патологии
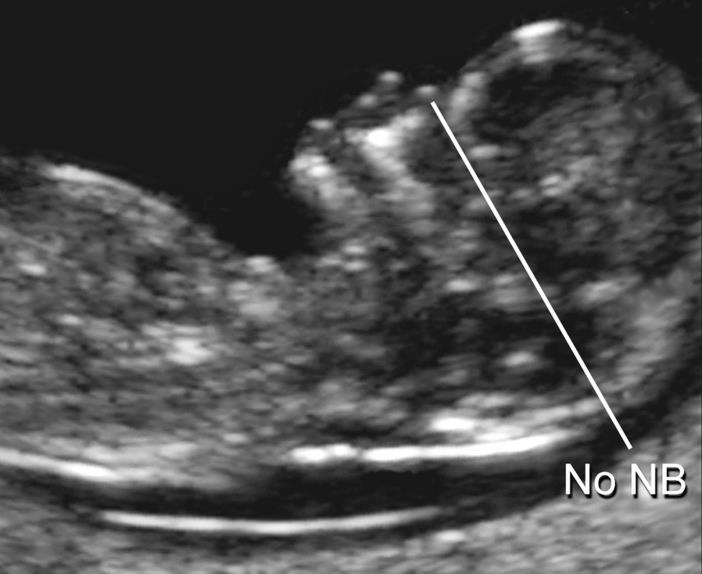
— носовая кость. У плодов с синдромом Дауна носовая кость может отсутствовать, либо быть уменьшенной (гипоплазированной). Очень редко такое может встречаться и у совершенно здоровых детей. Точный диагноз устанавливается только при помощи генетического анализа.
Нормальная носовая кость Отсутствие носовой кости
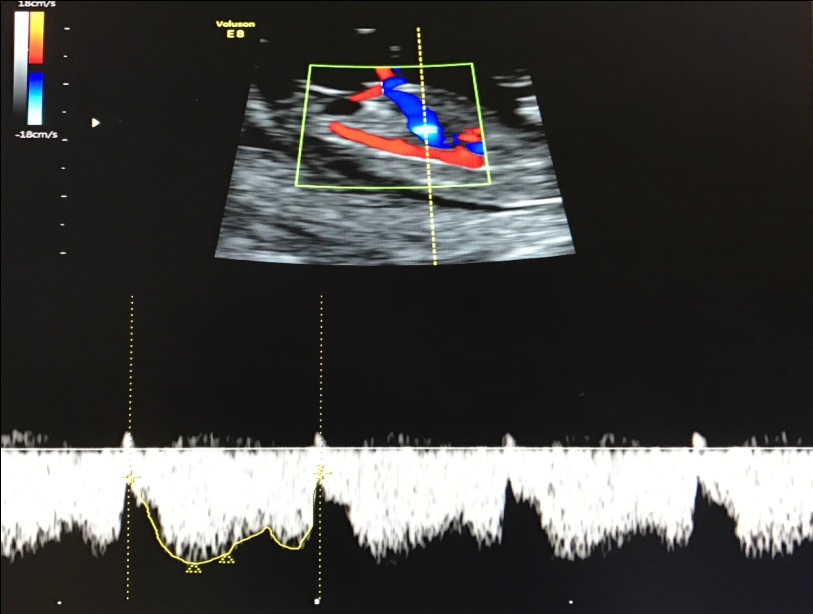
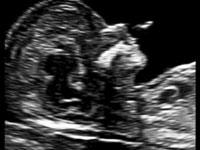
— кровоток в венозном протоке – это маленький сосуд в печени плода. При обратном (ретроградном) токе крови в данном сосуде можно предположить, что у плода хромосомный синдром, либо врожденный порок сердца.
Нормальный кровоток в венозном протоке
Но важно правильно получить этот кровоток и дать ему оценку. Для этого требуются определенные навыки и квалификация врача, которые подтверждаются ежегодной сертификацией FMF.
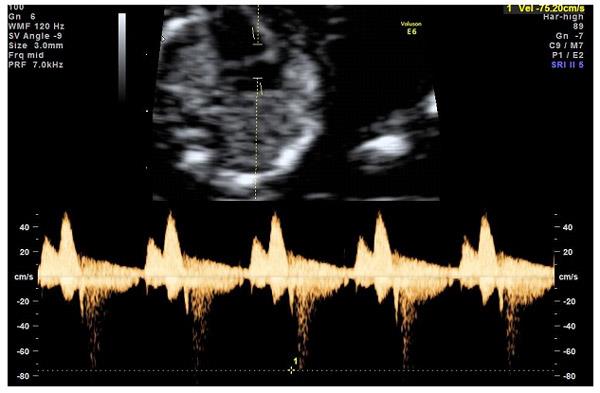
— кровоток через трикуспидальный клапан в сердце плода. Здесь ретроградный (обратный) кровоток тоже указывает на хромосомную патологию, либо может проявляться при врожденных пороках сердца.
3. Анатомические структуры плода и исключение крупных врожденных пороков
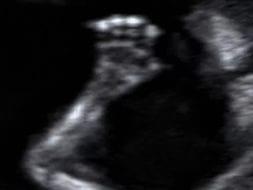
Ручка плода Мозг плода в виде “бабочки” в норме
4. Длина шейки матки
5. Стенки матки и придатков (яичников)
6. Кровоток в маточных артериях
УЗИ может проводиться как трансабдоминально, так и трансвагинально.
Что делать при высоком риске хромосомной патологии у плода
Если комплекс раннего пренатального обследования указывает на высокий риск врожденной патологии у плода, Вам будет рекомендована консультация генетика с последующей инвазивной диагностикой (биопсия ворсин хориона на сроке до 14 недель или амниоцентез, проводимый после 16 недель) и генетическим анализом. Именно генетический анализ точно определяет хромосомные заболевания и врожденные патологии у плода.
Что представляет собой скрининг во втором триместре беременности
Согласно приказу № 572н от 1.11.2012 г., второй скрининг состоит из ультразвукового исследования плода на сроке 18-21 неделя беременности. В этом возрасте кровь на биохимические маркеры уже не сдается. Плод имеет массу около 300-500 грамм и длину 20-25 см, и УЗИ позволяет детально проанализировать все анатомические структуры плода и выявить большинство пороков развития. Тогда же оценивается количество околоплодных вод, расположение и структура плаценты, длина шейки матки и др.
После проведения УЗИ на данных сроках беременности большинство вопросов пренатальной диагностики считаются закрытыми.
Надеемся, что эта информация поможет Вам лучше понять важность и необходимость скрининга в первом и втором триместрах беременности. В нашей клинике у Вас есть уникальная возможность пройти качественное обследование и получить максимально объективные данные о состоянии Вашего плода.