Диагноз фсм у ребенка что
Диагноз фсм у ребенка что
В процессе внутриутробного развития длина спинного мозга соответствует длине позвоночника, однако вследствие разной скорости роста спинного мозга и позвоночника конус спинного мозга у ребенка занимает положение на уровне LI. При нормальной регрессии дистальных отделов эмбрионального спинного мозга образуется тонкая, нитеподобная терминальная нить (filum terminale), которая соединяется с копчиком.
Синдром фиксированного спинного мозга развивается в результате сохранения веревкообразного утолщения терминальной нити и фиксации конуса спинного мозга на уровне или ниже LII. Неврологические проявления могут развиваться в результате патологического напряжения спинного мозга, вызывающего нарушение кровоснабжения, особенно при сгибательных и разгибательных движениях. Диастематомиелия может сочетаться с синдромом фиксированного спинного мозга. При осмотре спины примерно в 70 % случаев видны кожные поражения по срединной линии, включая липому, кожную гемангиому, пучки волос, гиперпигментацию или кожные впадины.
Клинические проявления варьируют у разных пациентов; симптомы заболевания возможны уже при рождении, но могут отсутствовать до взросления.
У детей раннего возраста может наблюдаться асимметричный рост стоп или нижних конечностей в сочетании с деформацией стоп по типу косолапости и атрофией мышц вследствие длительной денервации. У детей наиболее часто встречаются такие симптомы, как нарушение функции мочевого пузыря с парадоксальной ишурией, прогрессирующий сколиоз и диффузная боль в нижних конечностях. На рентгенограмме пояснично-крестцового отдела позвоночника в большинстве случаев spina bifida (обычно незаращение дуги позвонка). МРТ позволяет точно определить уровень расположения конуса спинного мозга и терминальной нити.
Хирургическое рассечение утолщенной терминальной нити останавливает прогрессирование неврологических нарушений и предотвращает дисфункции, если симптомы отсутствуют.
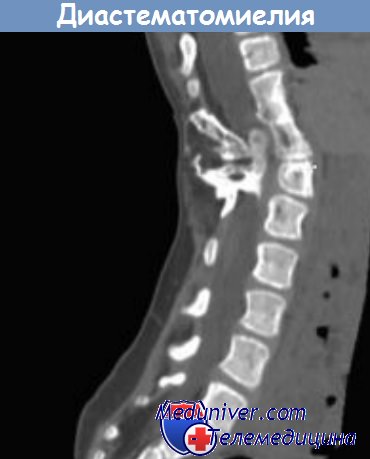
Диастематомиелия
Термин «диастематомиелия» означает разделение спинного мозга на две половины с помощью фиброзно-хрящевой или костной перегородки, начинающейся от задней части тел позвонков и распространяющейся в заднем направлении. Этот порок развития возникает в результате нарушения сращения нервной трубки с сохранением мезодермальной ткани из примитивного нервно-кишечного канала, играющей роль перегородки. Дефект локализуется на уровне поясничных позвонков (LI-LIII) примерно в 50 % случаев и, как правило, ассоциируется с аномалией тел позвонков, включая дефекты сращения, hemivertebra (сохранение половины позвонка), гипоплазию позвонков, кифосколиоз, spina bifida и миеломенингоцеле.
Наличие кожных аномалий по срединной линии, таких как кожные гемангиомы, позволяет предположить порок развития нервной трубки. Неврологические нарушения, вероятно, возникают в результате сгибательных и разгибательных движений, которые вызывают тракцию и дополнительное травматическое повреждение спинного мозга перегородкой. Клинические проявления диастематомиелии варьируют, у некоторых пациентов симптомы заболевания могут отсутствовать. Наиболее часто у ребенка дошкольного возраста отмечается односторонняя деформация стопы, включая косолапость, эквиноварусную деформацию, формирование «когтистой лапы», атрофия икроножной мышцы, а также потеря болевой и температурной чувствительности.
Возможно более прогрессирующее течение с билатеральной слабостью и атрофией мышц нижних конечностей, отсутствием сухожильных рефлексов, недержанием мочи и болью в нижней части спины. При рентгенографии позвоночника перегородка может не выявляться вследствие слабой кальцинации, поэтому методом выбора служит КТ или МРТ. Методом лечения пациентов с клиническими симптомами заболевания служат удаление костной части перегородки и лизис прилегающих сращений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Иммунодефицит у ребенка
Содержание статьи
Такой диагноз у детей означает, что поражен один или несколько элементов системы иммунитета. При такой патологии тяжело протекают инфекционные заболевания, часто проявляются аутоиммунные болезни, возникают опухоли, могут быть аллергии.
Виды заболеваний
Данный синдром может быть как первичным (генетически обусловленным), так и вторичным (появляется ввиду внешних факторов или заболеваний).
Первичный иммунодефицит у детей – что это и откуда берется?
Врожденный иммунодефицит (ИД) у ребенка – это то, что развивается из-за генетических факторов, это первичные нарушения работы иммунной системы. В результате развиваются тяжелые инфекции, быстро переходящие в хроническую форму, а органы и ткани поражаются воспалительными процессами. Без лечения первичный иммунодефицит приводит к смертности детей от осложнений различных инфекционных болезней.
Симптомы первичного иммунодефицита могут не обнаруживаться у детей, потому что болезнь не имеет уникальных признаков. Это может быть простая, но часто повторяющаяся инфекция, например легких или ЛОР-органов, или проблемы с ЖКТ, воспаления суставов. Часто ни родители, ни врачи не осознают, что все эти проблемы – результат дефекта иммунной системы ребенка. Инфекционные заболевания становятся хроническими, проявляются осложнения, нет реакции на курс антибиотиков. Обычно тяжелые формы иммунодефицита видны сразу после рождения младенца или через некоторое время. Источник:
Доан Тхи Май
Рецидивирующие инфекции у детей – риск иммунодефицита
// Педиатр, 2017, т.8, спецвыпуск, с.109-110
Важно отличать первичный иммунодефицит от СПИДа. Второй – это вирусное, приобретенное заболевание, а первичная форма уже «вживлена» в тело из-за генетических дефектов.
Почему у ребенка появляется вторичный иммунодефицит, и что это такое?
Такое заболевание – это тоже нарушение в работе иммунной системы, оно появляется у детей и взрослых и не является результатом дефектов в генах. Вторичный иммунодефицит может вызывать ряд факторов – внешних и внутренних. Любые внешние неблагоприятные факторы, которые нарушают процесс обмена веществ в организме, могут привести к развитию такой патологии. Самые распространенные из них:
Все эти факторы комплексно воздействуют на организм и все его системы, включая иммунную. А такие, как ионизирующее излучение, избирательно угнетают систему кроветворения. У людей, живущих в условиях загрязненности окружающей среды, снижен иммунитет, они чаще переносят инфекции, увеличиваются риски развития онкологии.
Диагностика ИД
Проводится сбор семейного анамнеза и жалоб ребенка (если он не новорожденный), осмотр, а также ряд лабораторных исследований: молекулярно-генетическое, клинический анализ крови и др.
Важно! Если в семье уже есть ребенок с первичной иммунной недостаточностью, то при вынашивании второго крайне важна пренатальная диагностика.
Признаки и симптомы первичного иммунодефицита обнаруживаются у детей уже в первые недели жизни. Когда врач собирает анамнез, особое внимание он обращает на частую заболеваемость вирусами и бактериальными инфекциями, на наследственность, отягощенную нарушениями работы иммунитета, на врожденные пороки развития.
Нередко такую патологию выявляют намного позже и случайно, когда проводят другие анализы.
Основные методы диагностики как врожденных, так и приобретенных нарушений работы иммунитета:
Лечение заболевания
Первичная форма заболевания предполагает:
Скорректировать иммунодефицит можно, применяя иммунореконструкцию, заместительное лечение, иммуномодуляторы. При первичной форме патологии применяют иммуноглобулины, при вторичной используют иммунотропы, заместительную терапию, иммунизацию.
Крайне важна при первичной патологии изоляция ребенка от всех источников заражения. Когда нет обострений инфекций, ребенок может вести нормальный образ жизни. При первичном иммунодефиците на фоне общей недостаточности антител детей нельзя прививать от:
Проживающим вместе с ребенком можно делать прививки только инактивированными вакцинами.
Противомикробное лечение заключается в приеме антибиотиков широкого спектра. При отсутствии быстрого ответа на терапию препарат меняют. Если же эффект есть, то принимать антибиотик ребенок должен минимум 3-4 недели. Лекарства вводятся внутривенно или парентерально. Одновременно назначают противогрибковые препараты и при показаниях – противовирусные, антипротозойные, антимикобактериальные лекарства. Противомикробная терапия может быть даже пожизненной.
При гриппе на фоне ИД обычно прописывают озельтамивир, ремантадин, занамивир, амантадин, ингибиторы нейраминидазы. Если ребенок заболел «ветрянкой» или герпесом, назначают ацикловир, парагрипп требует приема рибавирина. Перед стоматологическим лечением и операциями ребенок должен пройти курс антибиотиков для профилактики инфекции.
При серьезном вторичном или первичном Т-клеточном ИД нужно профилактировать пневмоцистовую пневмонию, в зависимости от показателей анализов крови. Для этого врачи обычно прописывают триметопримсульфометаксозол.
Важно! Любые лекарства должен назначать только врач, самолечение смертельно опасно для ребенка!
Способы коррекции недостаточности иммунитета:
Иммунореконструкция предполагает пересадку костного мозга или стволовых клеток, которые получают из пуповинной крови. При первичном ИД заместительная терапия – это чаще всего прием аллогенного иммуноглобулина, который в последние годы принято вводить внутривенно.
Лечение детей с первичным ИД с общими дефектами выработки антител
В этом случае проводится заместительная терапия иммуноглобулинами, которые вводятся внутривенно, и антибиотиками. Иммуноглобулины вводятся один раз в три-четыре недели пожизненно. Постоянная терапия антибиотиками нужна для профилактики бактериальных инфекций.
При обострении бактериальной инфекции назначаются антибиотики широкого спектра, вводимые парентерально. При гипер IgM-синдроме и общей вариабельной иммунной недостаточности (ОВИН) нужно постоянно принимать противогрибковые и противовирусные препараты. Они могут назначаться курсами. Это определяется врачом индивидуально. Если у ребенка Х-сцепленный гипер IgM-синдром, то ему показана пересадка костного мозга от HLA-идентичного донора.
Методы лечения вторичного ИД
В основном применяется иммунотропная терапия, которая может быть разных направлений:
Выбор иммунотропной терапии зависит от того, насколько остро выражен воспалительно-инфекционный процесс и какой иммунологический дефект выявлен. Когда симптомы болезни отступают, для профилактики может проводиться вакцинотерапия.
В качестве заместительной терапии применяются иммуноглобулины, вводимые внутривенно. Основное их действующее вещество – специальные антитела, получаемые от доноров. Часто назначаются иммуноглобулины, содержащие только IgG.
Иммунотропное лечение вторичного ИД
С помощью иммуномодуляторов можно повысить эффективность антимикробной терапии. Иммуномодуляторы должны быть частью комплексной терапии совместно с этиотропным лечением инфекции. Схемы и дозировку рассчитывает врач индивидуально.
Во время приема иммуномодуляторов должен проводиться иммунологический мониторинг. Если инфекция находится в острой стадии, иммуномодуляторы применяют с осторожностью. Иначе можно вызывать тяжелый общий воспалительный ответ и септический шок в результате него. Источник:
Г.А. Самсыгина, Г.С. Коваль
Проблемы диагностики и лечения часто болеющих детей на современном этапе
// Педиатрия, 2010, т.89, №2, с.137-145
Способы профилактики
ИД проще предупредить, чем лечить. Важно помнить, что состояние ребенка напрямую зависит от того, насколько правильно планировалась беременность. Если у одного из родителей есть проблемы с иммунитетом, он должен пройти специальные процедуры, чтобы исключить подобную патологию у ребенка.
В первые шесть месяцев жизни рекомендуется только грудное вскармливание, потому что в материнском молоке есть все нужные элементы, способствующие выработке полноценного иммунитета. Если нет лактации, нужны качественные искусственные смеси, но обязательно дополняемые поливитаминами.
Источники:
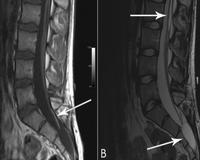
Синдром фиксированного спинного мозга
Синдром фиксированного спинного мозга — это комплекс патологической симптоматики, вызванной натяжением спинного мозга вследствие фиксации его каудального отела. Состояние возникает в результате врожденных пороков развития, либо на протяжении жизни вследствие травм, новообразований. Синдром проявляется нарушениями чувствительности и двигательной функции нижних конечностей, дисфункцией органов таза, кожными симптомами в области поясницы. Для диагностики болезни назначается спинальное МР-сканирование, нейросонография с эхоспондилографией, ЭНМГ. Лечение оперативное: иссечение фиксирующих образований, шунтирование, краниовертебральная костнодуральная декомпрессия.
МКБ-10
Общие сведения
Впервые синдром фиксированного спинного мозга (СФСМ) предположил Фанкс в 1910 г., однако этот термин стал широко использоваться только с 1976 г. после публикации клинических наблюдений невролога Хоффмана, который описал типичные симптомы у 31 пациента. Частота встречаемости синдрома составляет в среднем 0,8-1,4 случай на 1000 живорожденных детей, по другим данным, распространенность патологии в популяции составляет 0,1%. У детей женского пола фиксация спинного мозга диагностируется чаще.
Причины
СФСМ бывает врожденным и приобретенным. В первом случае он обусловлен аномалиями спинномозгового канала, к которым относят spina bifida, пояснично-крестцовые миеломенингоцеле, терминальные липомы медуллярного конуса, мальформации. У детей и взрослых может развиваться приобретенный синдром фиксации, который провоцируют следующие причины:
Среди факторов риска врожденного синдрома фиксированного спинного мозга выделяют дефицит фолиевой кислоты во время первого триместра беременности, что чревато серьезными дефектами формирования нервной трубки. Другие предрасполагающие факторы синдрома включают воздействие тератогенных факторов на эмбрион, наследственную предрасположенность, отягощенный акушерский анамнез.
Патогенез
В норме при сгибании туловища позвоночный канал удлиняется на 7%, при этом не происходит поражение спинальных тканей за счет его растяжения. Физиологически за функцию амортизации отвечает конечная нить, которая состоит из эластиновых, коллагеновых, ретикулярных волокон. Патофизиологической основой синдрома является тракция каудальной части спинного мозга, ее стойкая фиксация на уровне пояснично-крестцовых позвонков.
В случае СФСМ при растяжении спинного мозга ухудшается кровоток в его дистальных отделах, угнетается электрическая активность клеток. На биохимическом уровне аномалия проявляется снижением интенсивности окислительного фосфорилирования в митохондриях нейронов. Исследования демонстрируют функциональный характер возникших дисциркуляторно-метаболических нарушений, о чем свидетельствует сохранность спинномозговых проводящих путей.
Симптомы
Манифестация синдрома происходит в возрасте от 1 года до 4 лет, когда дети учатся ходить, у них происходит заметный скачок роста. Второй пик выявления заболевания приходится на период активного удлинения тела у детей подросткового периода: в 11-15 лет у девочек, в 13-18 лет — у мальчиков. Диагностика фиксированного спинного мозга осложняется из-за распространенности скрытого или малосимптомного течения.
Основную группу симптомов составляют неврологические нарушения, вызванные поражением дистальных спинномозговых отделов. У детей ощущается слабость в ногах, беспокоят неуверенная походка, неуклюжесть движений. Зачастую присоединяются нарушения температурной, тактильной, болевой чувствительности нижних конечностей. Со временем становится заметной гипотрофия мышц, непропорциональность строения тела.
Вторым по частоте встречаемости является кожный синдром, представленный видимыми изменениями в зоне поясницы (подкожная липома, усиленная пигментация, локальный гипертрихоз). Реже определяются гемангиома, дермальный синус. Постепенно у детей появляются и нарастают ортопедические нарушения: деформация стоп, укорочение конечностей, искривление позвоночника (сколиоз, кифоз). Нередко присоединяется дисфункция тазовых органов.
Осложнения
При отсутствии лечения неврологический дефицит у детей прогрессирует, возникают параличи в нижних конечностях, утрачиваются моторные навыки. Тазовые расстройства усугубляются, что проявляется недержанием кала и мочи, императивными позывами к мочеиспусканию, у девушек возможно чувство инородного тела во влагалище. До 37% пациентов сталкиваются с сильными постоянными или приступообразными болями в ногах и пояснице.
Опасным последствием болезни является гидроцефально-гипертензионный синдром, который обусловлен критическими нарушениями циркуляции цереброспинальной жидкости. У детей СФСМ обычно дополняется аномалией Арнольда-Киари. Патология проявляется мозжечковыми расстройствами (нистагм, атаксия, дизартрия), множественными поражениями черепных нервов (бульбарный, псевдобульбарный синдромы), нарушениями функций мозгового ствола.
После нейрохирургической коррекции в 5-50% случаев возможны рецидивы СФСМ, которые сложнее поддаются лечению. При неполном устранении фиксированного спинномозгового участка частота рецидивов достигает 80%. К ранним послеоперационным осложнениям относятся ликворея, краевой некроз кожного лоскута, смещение костных структур. Они требуют ревизии операционной раны.
Диагностика
Прием детского невролога начинается со сбора жалоб и анамнеза заболевания, детального клинического осмотра, проверки мышечной силы, поверхностной и глубокой чувствительности. При синдроме фиксированного спинного мозга симптомы у детей неспецифичны, поэтому для верификации диагноза применяются следующие диагностические методы:
Лечение синдрома фиксированного спинного мозга
Основной метод лечения СФСМ — устранение фиксирующих компонентов, позволяющее высвободить спинной мозг, устранить его патологическое натяжение. Для повышения точности нейрохирургических операций используются системы интраоперационного нейрофизиологического мониторинга, в том числе регистрация ССВП, электростимуляционное картирование. Все хирургические методы объединяются в 2 группы:
При выраженном гидроцефально-гипертензионном синдроме (отек дисков зрительных нервов, нарушения сознания, индекс Эванса более 0,3) коррекция гидроцефалии производится до устранения фиксации спинного мозга. Проводятся ликворошунтирующие операции, эндоскопическая вентрикулоцистернотомия, вентрикулярный дренаж. При аномалии Арнольда-Киари детям показана костнодуральная краниовертебральная декомпрессия, пластика твердой мозговой оболочки.
Прогноз и профилактика
Вероятность излечения определяется степенью фиксации, причиной развития патологических изменений, наличием сопутствующих врожденных пороков или органических болезней ЦНС у ребенка. При радикальном нейрохирургическом устранении фиксирующих элементов прогноз благоприятный, удается достичь полной ликвидации неврологического дефицита. Менее оптимистичный прогноз для детей с осложненным течением заболевания, рецидивами после хирургического лечения.
Первичные превентивные меры: исключение тератогенных влияний на плод, всесторонняя акушерско-гинекологическая помощь беременным, предупреждение бытового и производственного травматизма. Вторичная профилактика заключается в диспансерном наблюдении пациентов у детского невролога с выполнением контрольных МРТ ежегодно в течение 3-х лет, а затем каждые 2-3 года.
Спинальная мышечная атрофия 1 типа
Может ли донор банка половых клеток оказаться носителем тяжелого генетического заболевания?
У людей, решивших воспользоваться услугами банка половых клеток, обычно возникает множество вопросов и переживаний. Часто пара беспокоится о том, что донор может оказаться носителем серьезных наследственных болезней. Например, многие слышали, что есть такая тяжелая болезнь, как спинальная мышечная атрофия. Поговорим о том, что это за патология, и как в Репробанке выявляют кандидатов в доноры, являющихся ее носителями.
Спинальная мышечная атрофиия 1 типа, или младенческая форма СМА (англ. SMA), или болезнь Верднига-Гоффмана – тяжелое наследственное заболевание, которое проявляется в нарушении работы мышц, дыхания, глотания.
Заболевание развивается из-за дефекта в гене SMN1, который находится в длинном плече пятой хромосомы. В нём возникает делеция – выпадение участка генетического материала, которая приводит к некорректной работе гена и отсутствию выработки белка, отвечающего за поддержание двигательных нейронов, являющихся нервными клетками головного и спинного мозга, отвечающими за управление движением мышц.
Спинальная мышечная атрофия 1 типа наследуется аутосомно-рецессивно. То есть для того, чтобы родился больной ребенок, он должен получить генетический дефект сразу в двух копиях гена SMN 1, расположенных на сестринских хроматидах, пришедших от обоих родителей.
Если это происходит, то в организме не синтезируется белок SMN, необходимый для нормальной работы двигательных нейронов (нервных клеток), из-за чего возникают мышечные расстройства.
Внимательный читатель тут задаст вопрос: коль скоро существует первый тип спинальной мышечной атрофии, то должен быть второй и т. д.? Действительно, всего существует пять типов заболевания. Они различаются по характеру генетических нарушений, времени возникновения и тяжести симптомов. Первый тип самый распространенный и один из самых тяжелых.
Частота носительства дефектных генов оценивается, по разным данным, от 1:38 до 1:70. Иными словами, каждый 38–70-й человек имеет одну дефектную копию гена SMN1, на одной из дочерних хроматид, но сам при этом здоров. Если два таких человека решат завести ребенка, вероятность того, что малыш получит оба дефектных гена и родится больным, составляет 25%. Но, как считается, такая тяжелая патология нередко приводит к прерыванию беременности на ранних сроках, поэтому распространенность заболевания не так высока, как должна бы получиться по расчетам: в реальности она составляет 1 случай на 11 000 новорожденных.
Как проявляется младенческая форма СМА?
Симптомы спинальной мышечной атрофии возникают с рождения либо до 6 месяцев. У таких детей отмечается гипотония – сильное ослабление мышечного тонуса, особенно в ручках и ножках. Из-за поражения нервных клеток их мышцы ослаблены, поэтому у таких малышей не формируются основные навыки: они не могут держать головку, сидеть, ползать, стоять. У них нарушено дыхание и глотание, утеряна способность самостоятельно принимать пищу, и их приходится кормить через зонд. Такие дети нуждаются в специальном уходе с участием команды врачей-специалистов.
При этом когнитивные (познавательные) способности больного ребенка обычно не нарушены.
Для выявления болезни Верднига-Гоффмана проводят электромиографию (регистрацию электрических импульсов в мышцах), биопсию мышц (получают небольшой образец мышечной ткани и исследуют под микроскопом). Самый точный метод диагностики – исследование структуры ДНК (для анализа берут кровь).
Каков прогноз? Существует ли эффективное лечение?
Прогноз при спинальной мышечной атрофии неблагоприятный. Большинство детей, родившихся с этим заболеванием, не доживает до 2 лет. Средняя продолжительность жизни составляет 1 год.
Лечения, направленного на причину заболевания, на данный момент не существует, хотя предпринимаются попытки его создать. Большинство детей получают лишь соответствующий уход и симптоматическую терапию. Симптомы постепенно нарастают, и ребенок погибает, как правило, от дыхательной недостаточности.
В 2016 году американским Управлением по контролю качества лекарственных препаратов и продуктов питания (FDA) был одобрен препарат Спинраза (Spinraza), модифицирующий течение спинальной мышечной атрофии. Дело в том, что помимо гена SMN1, в клетках человека есть ген SMN2, который тоже кодирует белок SNM, но его вырабатывается меньше, и он быстрее разрушается. Спинраза заставляет ген SMN2 работать активнее, в результате чего улучшается состояние больного ребенка и увеличивается продолжительность жизни.
В 2019 году FDA одобрило инновационный препарат для генной терапии спинальной мышечной атрофии – Золгенсма (Zolgensma). Это лекарство – по сути искусственно созданный «вирус», который доставляет рабочую копию гена SMN1 в нервные клетки.
В августе 2019 года состоялась регистрация препарата Спинраза (Spinraza ) в РФ.
Несмотря на эти достижения, до победы над СМА еще далеко, а инновационные препараты стоят очень дорого, и к сожалению, доступны не многим, болеющим СМА детям. Поэтому врачи Репробанка тщательно обследуют кандидатов в доноры половых клеток и информируют пациентов банка о необходимости уточнения их статуса носительства частых аутосомно-рецессивных заболеваний, к которым относится СМА, что позволяет значительно снизить риски рождения детей с генетической патологией.
Какие меры принимаются в Репробанке?
Репробанк тщательно проверяет всех доноров половых клеток:
Пользуясь услугами Репробанка, вы максимально снижаете риски передачи наследственных заболеваний от доноров репродуктивных клеток.
Существуют некоторые причины для остаточного риска рождения ребенка с заболеванием, но они крайне малы:
Все эти ситуации встречаются достаточно редко. Для того чтобы дополнительно снизить риски, мы рекомендуем провести генетический анализ на данную патологию второму родителю.
Зиновьева Юлия Михайловна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.