Диагноз мпз что это
Хроническое миелопролиферативное заболевание (ХМПЗ): что это, виды, проявления, диагностика, терапия
© Автор: Солдатенков Илья Витальевич, врач терапевтического отделения, специально для СосудИнфо.ру (об авторах)
Миелопролиферативное заболевание (МПЗ) — довольно редкая гематоонкологическая патология, при которой красный костный мозг продуцирует чрезмерное количество клеток крови. Это опасное заболевание несет серьезную угрозу жизни человека. «Миело» означает «костный мозг», а пролиферация – «быстрое деление». Недуг чаще развивается у мужчин 40-50 лет. Среди детей и женщин встречаются единичные случаи болезни. Лица, имеющие плохую наследственность по развитию онкопатологии кроветворных органов, составляют группу риска.
В норме в губчатом веществе костного мозга, находящегося в полостях крупных костей скелета, продуцируются незрелые стволовые клетки. Постепенно они созревают и преобразуются в полноценные форменные элементы:
созревание форменных элементов крови в норме
При наличии у человека миелопролиферативного заболевания в кровь поступают клетки, неспособные выполнять свои функции. Стволовые клетки при патологии часто преобразуются только в один тип форменных элементов. Патологический процесс отличается медленным прогрессированием.
Миелопролиферативное заболевание — это собирательное понятие, включающее группу гемобластозов, которые характеризуются аномальным разрастание костномозговых структур, отвечающих за образование кровяных телец. Выделяют несколько основных форм МПЗ, при которых поражаются разные клеточные элементы крови:
Эти формы имеют общие признаки и называются «классическими». Они встречаются чаще всего. Лица, получающие надлежащее лечение, не предъявляют никаких жалоб. Клинические проявления болезни минимальны или полностью отсутствуют долгое время. Лица с МПЗ вынуждены всю жизнь наблюдаться у врача и принимать медикаментозные средства, поддерживающие здоровье на оптимальном уровне. Невозможно самостоятельно справиться с дисфункцией костного мозга. При отсутствии адекватного лечения патология приводит к развитию тромбогеморрагических осложнений.
Причины
пример jak2 мутации при истинной полицитемии (избытке эритроцитов)
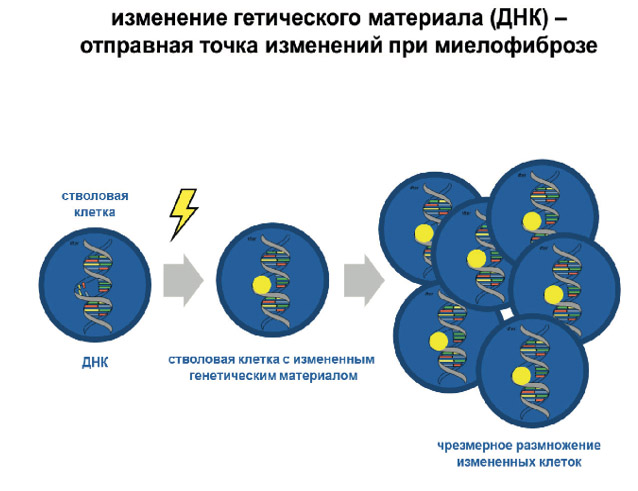
В основе МПЗ лежит приобретенная генная мутация, обусловленная влиянием негативных внешних или внутренних факторов. Мутация генов MPL и jak 2 приводит к повреждению ДНК одной гемопоэтической клетки, которая дает начало всем типам клеточных элементов. Аномально изменившаяся бластная форма приобретает отрицательные черты — перестает развиваться, не созревает полностью, не самоуничтожается, а непрерывно делится и порождает многочисленные клоны. Именно поэтому МПЗ называют клональным. Клоны также остаются на начальном уровне развития и имеют полностью недифференцированную структуру. Повреждаться может как один, так сразу несколько ростков кроветворения.
В результате в костном мозге увеличивается количество клеток-предшественниц эритроцитарного, тромбоцитарного и лейкоцитарного типов. По мере их накопления в кровяном русле ухудшается самочувствие больных. От того, какой росток переродился, зависит характер патологии, ее симптоматика и прогноз. Формы МПЗ отличаются медленным развитием. Если заболевание было выявлено на ранней стадии, у больного есть все шансы добиться стойкой ремиссии.
Причины, вызвавшие мутационные процессы, остаются до конца неизученными. Одни ученые относят к ним негативные факторы окружающей среды, другие — ошибки при делении клеток. МПЗ не является наследственным. Мутации генов могут возникать на протяжении всей жизни человека. Они называются приобретенными. Риск развития патологии увеличивается с возрастом. Лицам старше 50 лет необходимо внимательно относиться к здоровью и при появлении подозрительной симптоматики обращаться к гематологу. Вероятность развития недуга повышается под воздействием факторов риска — облучения и химикатов, оказывающих токсическое влияние на организм.
Классификация
Миелопролиферативные заболевания имеют код по МКБ 10 — D47.1. По типу течения их подразделяют на острые и хронические. В первую группу входят максимально агрессивные и быстро прогрессирующие недуги, поражающие в основном молодых людей. К группе хронических миелопролиферативных заболеваний относятся медленно развивающиеся патологии, имеющие относительно благоприятный прогноз и возникающие у пожилых лиц.
В зависимости от пораженного ростка кроветворения выделяют следующие формы процесса:
Классификация МПЗ имеет важное значение для диагностики онкологических заболеваний органов кроветворения. С ее помощью гематологи-онкологи могут легко определить тип сформировавшейся патологии и подобрать больному адекватную терапию, которая может спасти жизнь.
Видео: лекция по классификации и патогенезу ХМПЗ
Развитие и симптомы
Существует три пути распространения заболевания по организму:
Гематогенное распространение злокачественных клеток считается самым опасным. Таким пациентам вместе с лечебными мероприятиями проводят динамическое наблюдение за функционированием внутренних органов. Данный тип патологии дает метастазы в самые отдаленные участки организма человека, что приводит к формированию вторичных онкологических очагов.
Клиническая картина МПЗ зависит от конкретной формы процесса, сопровождающегося разрастание кроветворных тканей костного мозга и чрезмерным поступлением в кровоток остановившихся в своем развитии атипичных кровяных телец. Каждый вид заболевания отличается характерной симптоматикой. Но существуют общие распространенные симптомы. Это признаки анемии или тромбоза:
Это общая симптоматика, возникающая при любой форме МПЗ. Существуют также специфические проявления, характерные для каждой из них.
картина крови при тромбоцитемии
общая клиника лейкозов
Диагностика
Симптоматика МПЗ — основание для назначения пациенту диагностических процедур, позволяющих подтвердить или опровергнуть наличие процесса, а также выяснить, в какой именно форме протекает патология органов кроветворения.
Обследование начинают с опроса и сбора анамнеза. Врачи уточняют, какой образ жизни ведет больной, имеет ли пагубные пристрастия, какие заболевания перенес и чем лечился. Осмотр пациента – определение общего состояния и выявление признаков, которые обычно отсутствуют у здоровых людей.
Лабораторная диагностика МПЗ заключается в проведении целого ряда исследований и испытаний:
пункция КМ для миелограммы
Помимо лабораторной диагностики для постановки диагноза необходимы результаты инструментальных исследований. Больным проводят УЗИ брюшной полости для определения степени гепатоспленомегалии. В диагностически сложных случаях их направляют на томографическое исследование.
Если больному поставлен диагноз «Хроническое миелопролиферативное заболевание jak 2 позитивное», ему необходимо лечиться. В течение всей жизни он должен находится под наблюдением гематолога. Повторное диагностическое исследование проводится после завершения курса лечения. Результаты лабораторных анализов позволяют вовремя выявить рецидив заболевания и остановить его развитие.
Лечение
Онкогематологи назначают лечение своим больным по результатам диагностических исследований. Существуют стандартные терапевтические методики, которые применяют при различных видах МПЗ. Если у пациента обнаружена начальная стадия процесса, когда еще отсутствуют клинические признаки, за ним устанавливают динамическое наблюдение. При появлении первых признаков патологии переходят непосредственно к лечению.
Каждому больному подбирается индивидуальная лечебная методика в соответствии с его состоянием и степенью выраженности имеющихся нарушений.
трасплантация КМ – наиболее радикальная, но и потенциально действенная методика при удачном исходе
После проведения полного лечебного курса наступает период реабилитации. Больной должен находится под постоянным наблюдением доктора и строго выполнять все его предписания, позволяющие организму быстрее восстановиться.
Миелопролиферативное заболевание — рецидивирующий процесс, способный обостриться в любое время. Именно поэтому всем пациентам необходимо регулярно посещать лечащего врача и проходить диагностические исследования с профилактической целью.
Прогноз МПЗ считается благоприятным только в случае успешной трансплантации костного мозга, которая разрешена не всем больным. Хронические формы переносятся легче острых. Продолжительность жизни пациентов в этом случае составляет 5–7 лет при условии получения комплексной терапии. Если у больных обнаружены метастазы, прогноз становится неутешительным — они погибают в течение 6 месяцев.
Видео: лекция об опыте лечения ХМПЗ
Миелофиброз
Общие сведения
Миелопролиферативное заболевание (МПЗ) – представляет собой группу заболеваний, которая согласно квалификации ВОЗ (2016) включает несколько подкатегорий: первичный миелофиброз, хронический миелолейкоз, хронический эозинофильный лейкоз, истинную полицитемию, хронический нейтрофильный лейкоз, эссенциальную тромбоцитемию и неклассифицированные миелопролиферативные неоплазии.
Заболевание возникает на уровне стволовой кроветворной клетки и обусловлено ее трансформацией. Для него характерен миелопролиферативный синдром. Термин «миелопролиферативный» означает неконтролируемое разрастание одной/нескольких линий миелопоэза, сопровождаемое повышенной продукцией миелоидных клеток (мегакариоцитов, гранулоцитов, тучных эритроидных клеток).
Первичный миелофиброз (синоним — идиопатический миелофиброз) — это заболевания костного мозга, относящееся к группе клональных миелопролиферативных заболеваний для которого характерен фиброз костного мозга, увеличение селезенки и печени и формирование в этих органах экстрамедуллярных очагов кроветворения. Термин «идиопатический» означает заболевание неизвестного происхождение, возникающее самостоятельно. По сути, первичный миелофиброз — это хроническое миелопролиферативное заболевание, представляющее собой генерализованный процесс с изменением гемопоэза и перестройками в различных областях костного мозга фибротического и/или склеротического характера, который сопровождается полным изменением архитектоники кроветворения.
Первичный миелофиброз (ПМФ) протекает в двух стадиях: миелопролиферативной, при которой в костном мозге вырабатываются патологические форменные элементы крови (гиперплазия гемопоэтических клеток костного мозга) и костномозговой недостаточности с явлениями фиброза. Течение заболевания хроническое и в начальной стадии бессимптомное. В литературе это заболевание описывалось и в разные времена называлось как первичный остеомиелофиброз, остеосклероз, агногенная миелоидная метаплазия, фибромиелолейкоз, хронический миелофиброз. Согласно последней классификации миелоидных новообразований (ВОЗ, 2016 г) эти синонимы не употребляются и принято единое название — первичный миелофиброз.
Заболевание встречается редко, показатели заболеваемости ПМФ варьируют в пределах 0,3-1,6
случая/100 000 населения. Гендерных различий нет, наиболее часто заболевание диагностируется в возрасте после 50 лет, медиана 62,5 лет с вариациями от нескольких месяцев до 10-15 лет. Заболевание зачастую осложняется быстро прогрессирующей анемией, симптомами опухолевой интоксикации и спленомегалией. Причинами смерти пациентов чаще всего являются бластная трансформация и прогрессирующие заболевания, осложненные портальной гипертензией, аутоиммунной гемолитической анемией, тромбозами, развитием кровотечений и присоединением инфекции.
Патогенез
Патогенез ПМФ чрезвычайно сложен и до конца не изучен. Развитие заболевания представляет собой цепь патогенетических процессов, основой которых является появление (образование) патологического клона, являющегося главным двигателем заболевания и развившегося воспалительного процесса, протекающего с характерным изменением остова костного мозга и выраженной экспрессией цитокинов.
В процессе пролиферации мегакариоциты и лейкемические моноциты активно продуцируют различные виды патологических цитокинов, избыточное содержание которых стимулирует процесс фиброза и приводит к остеосклерозу. При этом, грубо нарушается связь стволовых клеток костного мозга с микроокружением, что при водит к формированию экстрамедуллярных очагов гемопоэза в селезенке и печени. Выброс цитокинов является также ведущей причиной возникновения комплекса симптомов опухолевой интоксикации, приводящей к выраженному ухудшению качества жизни больных.
В патогенез заболевания вовлечен ростовой фактор, продуцируемый тромбоцитами, эндотелиальный (сосудистый) фактор роста и трансформирующий фактор роста бета-миелоидных предшественников. Вероятно, что под влиянием цитокинов, металлопротеиназ и хемокинов формируется межклеточное патологическое взаимодействии мегакариоцитов, нейтрофилов и моноцитов, приводящее к выходу миелоидных предшественников. По сути, в основе миелофиброза лежит неспецифическая воспалительная реакция на образующиеся медиаторы воспаления и цитокины, продуцируемые трансформированным клоном. При этом, значение имеет не только выраженная пролиферация и дефект созревания мегакариоцитарного ростка, но и пролиферация базофилов и тучных клеток, гиперплазия моноцитов-макрофагов.
Классификация
В клинике ПМФ выделяют две фазы, которые отражают степень прогрессирования тяжести заболевания: хроническую фазу и бластную фазу (фазу терминальную бластной трансформации).
Стадии ПМФ
По морфологическому (гистологическому) признаку выделяют:
Переход пре-фиброзной стадии в фиброзную в среднем занимает около 4 лет и наблюдается в 65% случаев, трансформация в острый лейкоз варьирует в пределах 5-30% случаев. Однако, процесс прогрессирования в фиброзную стадию может замедляться или вообще отсутствовать в течение 10-15 лет.
Причины развития и факторы, способствующие заболеванию
Этиология ПМФ до настоящего времени точно не установлена. Принято считать, что в основе возникновения заболевания лежит врожденная предрасположенность к болезни. Ее реализация (повреждение генома физиологически нормальной гемопоэтической клетки) происходит под воздействием различных внешних факторов, способствующих ее злокачественной трансформации.
Наиболее вероятной причиной развития болезни являются мутации в генах JAK2 и MPL, что приводит к активации JAK-STAT сигнального пути и усиленной пролиферации миелоидного ростка, однако причина выраженного процесса фиброза костного мозга до настоящего времени остается неясной.
Также развитию первичного миелофиброза способствует нарушение иммунного статуса пациентов (в периферической крови — повышенный уровень иммунных комплексов и IgG, увеличение содержания иммунокомпетентных клеток, моноклональная гаммапатия).
Симптомы заболевания костного мозга
Клиника первичного миелофиброза вариабельна и не имеет патогномоничных симптомов. В подавляющем большинстве случаев заболевание на протяжении ряда лет протекает бессимптомно, а его манифестация проявляется несколькими синдромами. Нередко заболевание обнаруживаются при обращении пациента по поводу другого заболевания и проведения клинического анализа крови, в котором присутствуют специфические изменения картины периферической крови или во время проведения профилактического осмотра при случайном выявлении спленомегалии.
Основными клиническими проявлениями заболевания являются:
Тяжесть и выраженность тех или иных симптомов тесно коррелирует со стадийностью патологического процесса. На начальном этапе заболевания происходит быстрое наращивание опухолевой массы и усиленная секреция цитокинов, что вызывает симптоматику опухолевой интоксикации. Выход в периферическую кровь клеток-миелоидных предшественников является причиной возникновения очагов экстрамедуллярного кроветворения в селезенке/печени с развитием спленомегалии и соответствующих симптомов, прежде всего — синдрома портальной гипертензии.
Развившийся тромбоцитоз/лейкоцитоз нарушает микроциркуляции в кровеносных сосудах и способствует развитию тромбозов, что способствует развитию симптоматики сердечно-сосудистых заболеваний. Изменения стромы костного мозга в виде остеомиелофиброза приводят к полному нарушению архитектоники кроветворения и развитию цитопений: анемического синдрома с клиническими проявлениями, лейкопении с развитием инфекционных осложнений, тромбоцитопении с развития спонтанных кровотечений, которые в ряде случаев могут представлять опасность для жизни. Дальнейшая пролиферация опухолевого клона вызывает более высокую степень малигнизации, являющуюся следствием бластной трансформации с развитием терминальной стадии заболевания.
Анализы и диагностика
Диагноз первичного миелофиброза устанавливается на данных комплексного обследования пациента, который включает:
Согласно классификации ВОЗ 23016 года диагноз первичный миелофиброз ставится при наличии 3-х больших и 2-х малых диагностических критериев (рис. ниже).
Лечение
Стандарт оказания медицинской помощи при хроническом миелофиброзе дополнен и пересмотрен в 2015 г. Медикаментозное лечение не приводит к полному излечению, но улучшает качество жизни (устранение анемии, тромбоцитопении, спленомегалии, интоксикации), увеличивает общую выживаемость и предупреждает осложнения и прогрессирование заболевания.
Стандарт оказания медицинской помощи включает:
Лечение хронической фазы проводится цитостатическими лекарственными препаратами или интерферонами, как в виде монотерапии, так и сочетанного их применения. В бластной фазе — по программам лечения острых лейкозов с учетом возраста больных. Выбор тех или иных лекарственных средств и, в целом тактики лечения, зависит от группы риска, степени выраженности симптомов и возраста больного.
Лечение пациентов группы низкого риска
Это больные, имеющие нормальные значения гемоглобина, умеренный лейкоцитоз и фиброз костного мозга, у них отсутствует бластемия. При отсутствии симптомов интоксикации часто проводится только динамическое наблюдение, поскольку использование агрессивных методов лечения вызывает риск побочных эффектов.
У пациентов низкого риска, но с минимальными клиническими проявлениями, которым еще не показана специфическая терапия, проводится симптоматическое лечение:
Эритропоэз-стимулирующие препараты назначают с целью стимуляции эритропоэза и устранения анемии. Лечение анемической формы заболевания без ретикулоцитоза заключается в применении препаратов рекомбинантного эритропоэтина, который вводится подкожно. Эффект от применения эритропоэтинов сохраняется около года.
Глюкокортикоиды назначаются для быстрого купирования симптомов опухолевой интоксикации. Особенно показано их назначение при гемолитической анемии и тромбоцитопении. Эта группа препаратов снижает секрецию цитокинов, уменьшает разрастание фибробластов и соединительной ткани. Они подавляют катаболизм (распад) белков и стимулируют гибель клеток опухоли. Вместе с тем, имеют побочные реакции, а эффект их применения нестойкий, поэтому нужна поддерживающая терапия (почти постоянная).
Гормональные препараты применяются не только в качестве симптоматической терапии, но и в комбинированной терапии с иммуномодуляторами. При использовании глюкокортикостероидов необходимо учитывать противопоказания (остеопороз, сахарный диабет) и побочные эффекты (усугубление остепороза, развитие синдрома Иценко Кушинга).
Андрогены (анаболические стероиды) показаны при анемической форме заболевания. Их механизм действия близок к кортикостероидам и основное действие — уменьшение опухолевой интоксикации, угнетение катаболизма, стимуляция гемопоэза. У 30–40 % больных после их применения отмечается повышение уровня гемоглобина. Вводятся внутримышечно раз в неделю. Эффективность оценивается через 6 месяцев. Побочные эффекты: задержка жидкости, гирсутизм, токсическое действие на печень и повышение риска опухолей печени. Противопоказаны при раке простаты в анамнезе.
В случае, если быстро увеличиваются размеры селезенки и появляется угроза ее разрыва, не устраняются слабость, потливость, что говорит о неэффективности симптоматической терапии, больным показано применение цитостатиков, ингибиторов jak2 (Руксолитиниб), а также препаратов интерферона.
Лечение пациентов группы промежуточного-2 и высокого риска
У этих больных отмечается выраженная анемия, высокий лейкоцитоз и сдвиг до бластов, тромбоцитопения, выраженный фиброз костного мозга. Возможно быстрое развитие бластной трансформации.
В данном случае назначаются основные группы препаратов:
Выбор той или иной группы препаратов, а также назначение их в различных комбинациях зависит от возраста больного и клинической картины. У лиц до 45 лет, не имеющих сопутствующей патологии, сразу обсуждается возможность проведения трансплантации. При невозможности ее выполнения предлагается медикаментозное лечение. Показанием к цитостатической терапии служит нарастающий лейкоцитоз, тромбоцитоз и увеличение селезенки. Помимо цитостатиков у молодых пациентов целесообразно применение препаратов интерферона.
В возрасте 45-65 лет чаще всего используется стандартная лекарственная терапия. При отсутствии противопоказаний редко, но выполняется алло-ТКМ. У больных старше 65 лет важно поддерживать качество жизни и купировать осложнения заболевания. В этом возрасте проводится лечение ингибиторами jak2 (ингибиторы янускиназ), руксолитинибом (Джакави).
Характеристика основных лекарственных групп, применяемых для лечения.
Для пациентов промежуточного-2 и высокого риска препараты ингибиторов янускиназ являются препаратами выбора, а для больных промежуточного-1 риска они рекомендуются в случае нечувствительности к другим цитостатикам. Данные препараты являются основными для пациентов, которым необходимо быстро уменьшить размеры селезенки и устранить симптомы интоксикации перед операцией по пересадке костного мозга.
Лечение и профилактика осложнений основного заболевания:
Диагноз мпз что это
Миелодиспластическое/миелопролиферативное заболевание (МДС/МПЗ) – редкое хроническое заболевание крови, имеющее признаки как миелопролиферативного, так и миелодиспластического синдрома.
В этом случае в заболевшей стволовой клетке произошли такие изменения, что ее потомки имеют как явно опухолевые черты (миелопролиферации), так и признаки нарушения их созревания (дисплазии).
К болезням, сочетающим в себя все эти признаки, относятся
Диагноз
Поставить диагноз МДС\МПЗ довольно сложно, потому что врачу нужно найти у одного пациента черты двух болезней: опухолевые клетки (потомки заболевшей стволовой) и признаки нарушения созревания («взросления») здоровых клеток крови. Для этого необходимо выполнить цитологическое, цитогенетические, гистологическое исследование костного мозга, крови, а также провести другие специальные анализы.
Лечение
Лечение зависит прежде всего от диагноза и общего состояния пациента. Так, к примеру, на начальном этапе при рефрактерной анемии с кольцевидными сидеробластами и тромбоцитозом от активной терапии можно иногда воздержаться: такие пациенты нуждаются время от времени только в переливаниях крови. Атипичный хронический миелоцитарный лейкоз и ювенильный хронический миеломоноцитарный лейкоз всегда требуют лечения. Одной из главных опасностей МПЗ\МДС является переход болезни в острый лейкоз. Если это произошло, то больных лечат по схемам острых лейкозов. Молодых пациентов можно вылечить с помощью пересадки стволовых (материнских) клеток крови.