Диагноз олл у ребенка что
Лейкозы у детей: симптомы, диагностика, лечение
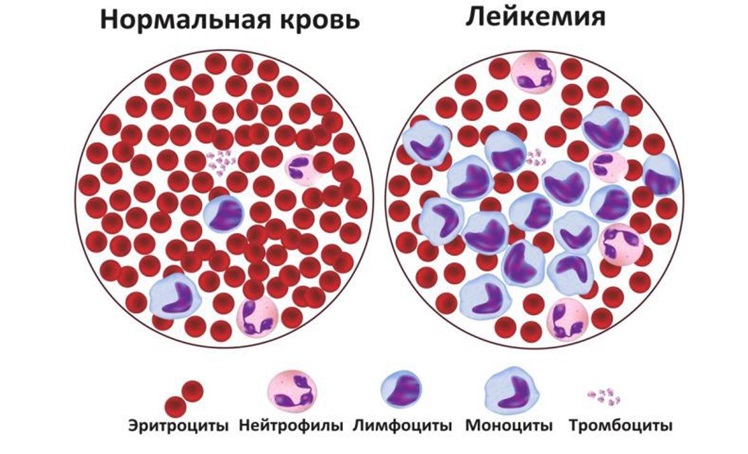
Лейкозы относятся к большой группе злокачественных новообразований системы крови под названием «гемобластозы». Лейкоз (от греческого слова «leukos» — белый) — злокачественная опухоль, возникающая из ранних незрелых кроветворных клеток костного мозга и метастазирующая из костного мозга в кровь, лимфатические узлы, печень, селезенку, головной мозг, спинной мозг и другие органы и ткани.
Все лейкозы можно разделить на острые лимфобластые, острые миелоидные лейкозы (ОМЛ) и хронический миелолейкоз.
Острый лимфобластный лейкоз
Более 80% всех лейкозов у детей составляет острый лимфобластный лейкоз (ОЛЛ). Причиной его развития является химерный ген TEL/AML, формирование которого происходит внутриутробно, возможно, в результате спонтанных ошибок в процессе репликации и репарации ДНК. Накопление генетических аномалий в опухолевом клоне ведет к блоку нормальной клеточной дифференцировки и нарушениям в процессе пролиферации и апоптоза.
В соответствии с франко-американо-британской (FAB) классификацией выделяют три морфологических варианта: L1, L2, L3.
Клинические симптомы ОЛЛ обусловлены степенью инфильтрации костного мозга лимфобластами, а также наличием экстрамедуллярного распространения процесса. Нередко отмечаются общие симптомы опухолевой интоксикации, а именно, повышение температуры тела, снижение аппетита, слабость, вялость. В течение процесса выделяют несколько периодов: начальный, развернутый, период ремиссии.
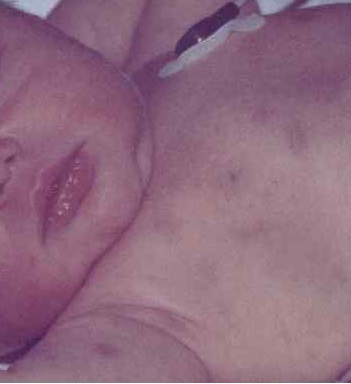
Развернутый период характеризуется бурным началом, многообразием клинических симптомов. К симптомам общей интоксикации присоединяются костные боли вследствие лейкозной инфильтрацией костной ткани (чаще поражаются диафизы длинных трубчатых костей), артралгии, вызванные лейкемической инфильтрацией суставов. Кожные покровы и слизистые становятся бледными. К сожалению, нередко на них появляются кровоизлияния, обусловленные геморрагическим синдромом, а также кровотечения (носовые, желудочно-кишечные, почечные). Увеличение периферических лимфатических узлов (шейно-надключичных, подмышечных, паховых) является одним из основных симптомов заболевания. Практически у всех пациентов отмечается обусловленное пролиферацией лейкозных клеток увеличение печени и селезенки. В некоторых случаях у пациентов поражение кожи и слизистых оболочек проявляется в виде лейкемидов, некроза, гингивита и стоматита.
Таким образом, можно выделить несколько симптомокомплексов, характерных для ОЛЛ:
При диагностике оцениваются морфологические особенности бластов костного мозга и периферической крови. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения при окраске по Романовскому – Гимзе, проводятся следующие методы исследования:
Для подтверждения диагноза ОЛЛ необходимо комплексное обследование, в котором ведущая роль отводится морфологическому методу.
В настоящее время используются программы лечения BFM (БФМ: Берлин-Франкфурт-Мюнстер) и МВ (МБ: Москва-Берлин).
Все лечение можно разделить на базисное и сопроводительное. Базисная терапия представляет собой системную и локальную химиотерапию и, при необходимости, лучевую терапию. Сопроводительное лечение обязательно назначается для профилактики инфекционных осложнений и коррекции постцитостатических реакций. Выделяют следующие этапы в лечении злокачественных процессов: индукция ремиссии, консолидация ремиссии (как правило, несколько фаз), поддерживающее лечение.
Острый миелоидный лейкоз
Острый миелоидный лейкоз составляет 15% всех острых лейкозов у детей. Существующая FAB-классификация (Франко-Американо-Британская) позволяет разделить ОМЛ на следующие варианты:
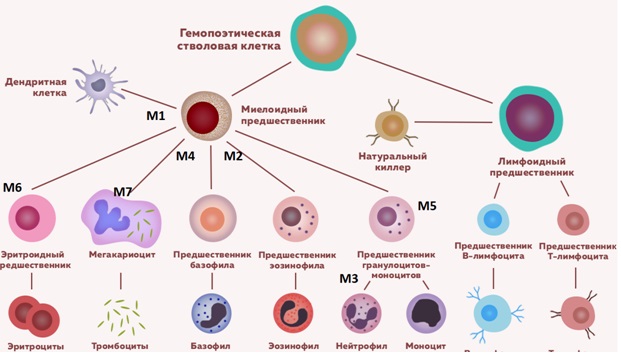
Схема гемопоэза с клетками предшественниками острого миелоидного лейкоза
Клиническая картина ОМЛ также складывается из анемического, геморрагического и токсического синдромов, которые являются следствием снижения продукции эритроцитов, тромбоцитов и гранулоцитов.
У 50% пациентов отмечается увеличение размеров печени (гепатомегалия) и селезенки (спленомегалия) вследствие инфильтрации органов опухолевыми клетками.
Внекостномозговые проявления заболевания связаны с лейкозной инфильтрацией центральной нервной системы и метастатическим поражением оболочек и вещества головного и спинного мозга (нейролейкемия). В этих ситуациях отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига.
Решающую роль в диагностике также имеет цитохимическое, иммунофенотипическое и морфологическое исследование бластов в костном мозге и периферической крови.
Ремиссию заболевания можно достичь посредством проведения высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Благодаря адаптивным протоколам удается достичь ремиссии у 90% детей.
Хронические миелолейкоз
Хронический лейкоз – это вариант гемобластоза, субстратом которого являются созревающие клетки. У детей встречается только хронический миелолейкоз, который характеризуется пролиферацией гранулоцитарного ростка, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированной с хромосомной транслокацией t(9;22)(q34;q11), в результате которой образуется химерный онкоген BCR-ABL.
В течение хронического миелолейкоза выделяют три фазы:
В дебюте заболевание трудно диагностировать, поскольку основные симптомы обусловлены общим опухолевым симптомокомплексом и носят преходящий характер. Наиболее частые симптомы, присоединяющиеся позднее – гепатомегалия и спленомегалия. Нарастающая интоксикация приводит к появлению слабости, утомляемости, повышению температуры тела, болям в костях.
В периферической крови отмечается гиперлейкоцитоз (до 200 – 300 х 10 9 /л и более) с увеличением содержания гранулоцитов до 95% и преобладанием незрелых клеток гранулоцитарного ряда: промиелоцитов, миелоцитов, метамиелоцитов, миелобластов, базофилов (до 10%) и эозинофилов (до 5%). Характерна анемия и повышение СОЭ. Уровень тромбоцитов преимущественно в норме, однако может отмечаться гипертромбоцитоз (до 600 х 10 9 /л и более).
В пунктате костного мозга отмечается увеличение числа миелокариоцитов за счет пролиферирующего пула клеток гранулоцитарного ряда с увеличением базофилов и эозинофилов. Позднее отмечается угнетение эритронормобластического и мегакариоцитарного ростков кроветворения.
Основным средством терапии и стандартом лечения хронического миелолейкоза в настоящее время является применение ингибиторов тирозинкиназы (ИТК). Данные препараты имеют механизм таргетного (целенаправленного) воздействия на BCR-ABL-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза. Для оценки эффективности и переносимости терапии ИТК рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента.
Список литературы
Авторская публикация:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова
Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук НМИЦ онкологии им Н.Н. Петрова
Острый лимфобластный лейкоз (ОЛЛ)
Что такое острый лимфобластный лейкоз?
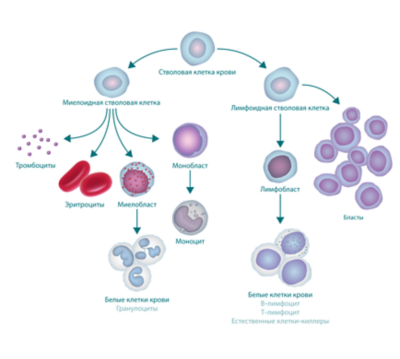
виды лимфоцитов
Существует два вида лимфоцитов: В-лимфоциты и Т-лимфоциты. ОЛЛ может развиваться в любом из них, поэтому случаи ОЛЛ также подразделяют на B-клеточный ОЛЛ или T-клеточный ОЛЛ. Наиболее распространенным является В-клеточный ОЛЛ.
подвиды ОЛЛ
ОЛЛ имеет несколько подвидов. Во многих случаях врачи, определяя лечение, учитывают подвид ОЛЛ и сопряженную группу риска. Подробнее см. в разделе, посвященном лечению.
Подвиды ОЛЛ (Всемирная организация здравоохранения, 2016 г.)
В-клеточный лимфобластный лейкоз
В-клеточный лимфобластный лейкоз, без специфических характеристик
В-клеточный лимфобластный лейкоз с рецидивирующими генетическими нарушениями
В-клеточный лимфобластный лейкоз с транслокацией хромосом 9 и 22 (положительный по филадельфийской хромосоме ОЛЛ)
B-клеточный лимфобластный лейкоз с транслокацией KMT 2A
В-клеточный лимфобластный лейкоз с транслокацией хромосом 12 и 21 (ETV6-RUNX1)
В-клеточный лимфобластный лейкоз у детей с более чем 50 хромосомами
В-клеточный лимфобластный лейкоз у детей с 46 нормальными хромосомами (гиподиплоидия)
В-клеточный лимфобластный лейкоз с транслокациями хромосом 5 и 14 (IL3-IGH)
В-клеточный лимфобластный лейкоз с транслокацией хромосом 1 и 19 (TCF3-PBX1).
В-клеточный лимфобластный лейкоз/лимфома (Ph-подобный)
В-клеточный лимфобластный лейкоз/лимфома с iAMP21
Т-клеточный лимфобластный лейкоз
Острый лимфобластный лейкоз из ранних предшественников Т-клеток
Лимфобластный лейкоз/лимфома из естественных клеток-киллеров (ЕК)
ОЛЛ нарушает процесс созревания разновидности белых клеток крови, называемой лимфоцитами. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых клеток крови (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные лейкоциты, эритроциты и тромбоциты.
ОЛЛ является наиболее распространенным онкологическим заболеванием у детей В США ОЛЛ ежегодно диагностируется у порядка 3000 человек моложе 20 лет. Чаще всего заболевание развивается у детей в возрасте от 2 до 5 лет, но также встречается и у детей старшего возраста и подростков. У мальчиков оно возникает несколько чаще, чем у девочек.
Признаки и симптомы острого лимфобластного лейкоза
Возможные признаки и симптомы ОЛЛ:
Диагностика острого лимфобластного лейкоза
Для диагностики лейкоза требуется провести исследование костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно повышено количество белых кровяных телец.
Медицинский осмотр и изучение истории болезни
Сначала врач проводит медицинский осмотр и изучает историю болезни пациента. В ходе медицинского осмотра врач проверяет общие показатели здоровья, в том числе наличие признаков заболевания — уплотнений или всего, что кажется необычным. Проводится тщательный осмотр глаз, ротовой полости, кожи и ушей. Может быть выполнено исследование состояния центральной нервной системы. При пальпации брюшной полости пациента врач проверяет, не увеличена ли в размере селезенка или печень.
Изучая историю болезни, врачи смотрят на наличие врожденных патологических состояний, которые могут способствовать развитию заболевания. Тем не менее, исследования показали, что только в 8–10% случаев болезнь у детей является наследственной. И сам факт наличия генетического заболевания не означает, что у человека обязательно разовьется опухоль.
Возможные факторы риска:
Наличие определенных врожденных патологических состояний:
Анализы крови
Общий клинический анализ крови
Врачи назначат анализ крови, называемый общим клиническим анализом крови. При этом берут образец крови и определяют количество эритроцитов и тромбоцитов, количество и вид лейкоцитов, количество гемоглобина в эритроцитах и пропорцию эритроцитов в образце крови. При лейкозе в крови может содержаться слишком много белых кровяных телец, многие из которых будут бластами — ранними предшественниками клеток крови. У здоровых детей они обычно обнаруживаются только в костном мозге.
Биохимический анализ крови
В образце крови измеряют количество определенных веществ, выделяемых в кровь органами и тканями организма. Необычное (выше или ниже нормы) количество вещества может являться признаком заболевания.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови.
Исследования костного мозга
Результаты исследований костного мозга, таких как пункция и биопсия костного мозга, используют для подтверждения онкологического диагноза и точного определения заболевания. Многим детям эту процедуру проводят во сне (под наркозом). Если пациент бодрствует во время процедуры, ему дают подходящее болеутоляющеесредство..
Костномозговая пункция: с помощью тонкой иглы врачи возьмут образец костного мозга из тазовой кости. Патологоанатом под микроскопом проверит образец костного мозга на наличие признаков опухоли.
На этом микроскопическом изображении показан нормальный, здоровый костный мозг.
На этом микроскопическом изображении показан костный мозг пациента с острым лимфобластным лейкозом.
Биопсия костного мозга: врачи извлекут небольшой фрагмент костной ткани для определения степени распространения опухоли в костном мозге. Обычно биопсия проводится непосредственно до или сразу после пункции.
Как выполняют пункцию/биопсию костного мозга?
Для диагностики лейкоза требуется провести исследование костного мозга.
При обнаружении опухолевого процесса проводят дополнительные анализы для точного определения вида заболевания. Используют такие исследования:
Иммунофенотипирование
Такими лабораторными анализами являются иммуногистохимическое исследование и проточная цитометрия.
Цитогенетический анализ
Одним из применимых анализов является FISH-анализ (флуоресцентная гибридизация in situ). В ходе этого анализа изучаются гены или хромосомы в клетках и тканях. Фрагменты ДНК, содержащие флуоресцентный краситель, изготавливают в лаборатории и добавляют в клетки или ткани на предметном стекле. Когда эти фрагменты ДНК прикрепляются к определенным генам или областям хромосом на предметном стекле, они становятся различимы.
Молекулярно-генетическое тестирование
Врач порекомендует провести лабораторные анализы для выявления специфических генов, белков и других факторов, влияющих на развитиелейкоза.. Такое исследование важно, поскольку онкозаболевания вызваны ошибками (мутациями) в генах клетки. Выявление этих ошибок способствует диагностике конкретного подвида лейкоза. На основе этой информации врачи могут выбирать варианты лечения, соответствующие конкретному случаю. Детям, у которых лейкоз вызван мутациями с благоприятным прогнозом, назначают менее токсичное лечение. И наоборот, врачи могут назначать более интенсивное лечение, еслилейкозвызван наличием мутаций, имеющих менее благоприятный прогноз. Могут быть выявлены мутации, для которых имеются специальные направленныеметодылечения.
Исследования, определяющие степень распространения заболевания:
Люмбальная пункция
Рентгенография грудной клетки
Рентгеновское излучение — это тип пучка энергии, который способен проходить сквозь тело и, попадая на пленку, создавать изображение областей внутри тела на экране компьютера или специальной пленке. Рентгенографию грудной клетки проводят для того, чтобы определить, есть ли новообразование внутри грудной клетки.
Лечение острого лимфобластного лейкоза
Благодаря недавним достижениям в лечении ОЛЛ существует много различных вариантов лечения. Врачи все чаще могут адаптировать лечение для отдельных пациентов в зависимости от их группы риска.
Группа риска
Группа риска означает вероятность того, что опухоль пациента не будет поддаваться лечению (резистентная опухоль), либо заболевание вернется после первоначальной реакции на лечение (рецидив). Пациентам в группах низкого риска обычно проводят менее интенсивную терапию, которая тем не менее успешно справляетсяс опухолью.. Для пациентов в группах высокого риска обычно применяют более агрессивные методы лечения.
Группу риска определяют следующие факторы:
минимальная остаточная болезнь (МОБ)
Минимальная остаточная болезнь (МОБ) — это термин используется, когда бластных клеток в костном мозге так мало, что их невозможно обнаружить с помощью микроскопа. Высокочувствительные тесты, такие как проточная цитометрия, полимеразная цепная реакция (ПЦР) и секвенирование следующего поколения, способны обнаружить 1 бластную клетку на 10 000–100 000 нормальных клеток костного мозга. МОБ-положительные пациенты (более 1 клетки на 10 000 после завершения первой фазы лечения ОЛЛ (индукция)) подвержены наивысшему риску рецидива.
Острый лимфобластный лейкоз у детей. Клинические рекомендации.
Острый лимфобластный лейкоз у детей
Оглавление
Ключевые слова
Список сокращений
ВОЗ – Всемирная Организация Здравоохранения
Г-КСФ – гнулоцитарный колониестимулирующий фактор
д.м.н. – доктор медицинских наук
КТ – компьютерная томография
МОБ – минимальная остаточная болезнь
МРТ – магнитно-резонансная томография
ОЛЛ – острый лимфобластный лейкоз
СОЛ – синдром острого лизиса опухоли
ТГСК – трансплантация гемопоэтических стволовых клеток
УЗИ – ультразвуковое исследование
ЦНС – центральная нервная система
ЧМН – черепно-мозговые нервы
Ph+-ОЛЛ – острый лимфобластный лейкоз с наличием Филадельфийской хромосомы – t(9;22)/BCR-ABL
Термины и определения
Рецидив – это появление морфологически выявляемых бластных клеток после периода, в течение которого идентифицировать опухолевые клетки доступными методами не представлялось возможным.
Костномозговой рецидив – обнаружение в костном мозге 25% и более лимфобластов, без одновременного поражения ЦНС и/или другого экстрамедулярного поражения после констатации ремиссии.
ЦНС-рецидив (нейрорецидив) – появление лимфобластов в ликворе при цитологическом исследовании, а также неврологическая симптоматика, не связанная с другими заболеваниями и повреждениями. При внутричерепном образовании на КТ/МРТ и при отсутствии бластных клеток в ликворе, крови и костном мозге, для диагностики изолированного рецидива ЦНС необходимо получить гистологическое подтверждение или провести однофотонную эмиссионную КТ головного мозга. В костном мозге число бластных клеток должно составлять менее 5%.
Комбинированные рецидивы: сочетание двух и более поражений различной локализации. При комбинированных рецидивах костный мозг считается пораженным при наличии 5% и более лимфобластов.
Рефрактерность – отсутствие полной ремиссии в сроки, определенные протоколом терапии.
Ph-позитивный ОЛЛ– ОЛЛ с наличием транслокации (9;22)(q34;q11) – t(9;22) или BCR-ABL.
Минимальная остаточная болезнь (МОБ; minimal residual disease – MRD) – наличие остаточных лейкемических клеток у пациента в ремиссии, не выявляемых рутинными морфологическими методами.
1. Краткая информация
1.1 Определение
Острый лимфобластный лейкоз (ОЛЛ) – это злокачественное заболевание системы кроветворения, состоящее в появлении опухолевого клона из клеток линий лимфоидной дифференцировки, составляющего не менее 25% от других ядерных клеточных элементов, и в своем естественном течении неизбежно приводящее к фатальному исходу 2.
1.2 Этиология и патогенез
Точные причины развития ОЛЛ не установлены. Рассматривается возможная роль различных предрасполагающих факторов (генетических, вирусных, радиация, химическое и физическое воздействие и др.), однако их точное влияние на развитие ОЛЛ на сегодняшний день не установлено.
По современным представлениям в основе патогенеза ОЛЛ лежит мутация стволовой клетки, которая приводит к потере способности к нормальной клеточной дифференцировке и нарушениям в процессах пролиферации и апоптоза. Мутантный клон достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз. Вытеснение нормальных гемопоэтических клеток и замещение их опухолевыми клетками, неспособными к созреванию, закономерно приводит к уменьшению в периферической крови зрелых клеток с развитием анемии, гранулоцитопении, лимфопении и тромбоцитопении, что проявляется соответствующей клинической картиной. Опухолевые клетки могут покидать костный мозг и инфильтрировать различные органы и ткани (селезенку, печень, лимфоузлы, тимус, центральную нервную систему (ЦНС), кожу и др.) 4.
1.3 Эпидемиология
ОЛЛ составляет около 25 % от всех злокачественных опухолей у больных в возрасте до 18 лет и является самым частым онкологическим заболеванием детского возраста. Заболеваемость составляет около 4 на 100 000 детского населения. Пик заболеваемости ОЛЛ у детей приходится на дошкольный возраст (2 – 5 лет при медиане 4,7 года). Несколько чаще болеют мальчики – соотношение 1,6:1 для В-линейного и 4:1 для Т-линейного ОЛЛ [2,3,5]
1.4 Кодирование по МКБ-10
С91.0 – острый лимфобластный лейкоз
1.5 Классификация
Классификация ОЛЛ у детей согласно ВОЗ является общепринятой 5:
2. Диагностика
2.1 Жалобы и анамнез
Клинические симптомы ОЛЛ у детей обусловлены степенью инфильтрации костного мозга лимфобластами и экстрамедуллярным распространением процесса. Пациенты с ОЛЛ могут предъявлять жалобы на слабость, лихорадку, недомогание, боли в костях и/или суставах, кровоточивость со слизистых оболочек (носовые, десневые, желудочно-кишечные и др. кровотечения), геморрагический синдром на коже, бледность. Распространение бластных клеток в лимфатические узлы и паренхиматозные органы приводит к лимфаденопатии, увеличению печени и селезенки, проявляющихся болями в животе, расширению средостения с возможным развитием синдрома сдавления, увеличению яичек у мальчиков. Проявлениями нейролейкемии могут быть симптомы поражения черепно-мозговых нервов, общемозговые, менингеальные симптомы 4.
Сбор анамнеза при ОЛЛ подразумевает тщательный расспрос о текущей или проводимой ранее лекарственной терапии, сопутствующих системных заболеваниях и хронической патологии, наличии онкологических заболеваний у родственников. Обязателен сбор эпидемиологического анамнеза семьи: условия проживания, санитарно-гигиенический уровень окружения, наличие хронических инфекционных заболеваний у близких родственников. Очень важно уточнить, откуда поступил больной: из дома или из других лечебных учреждений. Если больной в последнее время лечился в других больницах, обязательно нужно выяснить все детали терапии, в особенности противоинфекционной терапии, а также наличие или отсутствие различных лечебно-диагностических манипуляций, таких как катетеризация, наркоз, интубация, ИВЛ.
2.2 Физикальное обследование
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела, а также детальную оценку состояния всех органов и систем и неврологического статуса. Особое внимание следует обратить на документирование проявлений основного заболевания (описание всех групп увеличенных лимфоузлов с размерами, размеры печени и селезенки (указываются в сантиметрах ниже края реберной дуги по среднеключичной линии), размеры яичек у мальчиков, наличие/отсутствие лейкемидов на коже) и выявление возможных очагов инфекции. 3.
2.3 Лабораторная диагностика
Верификация диагноза проводится с помощью цитологического и цитохимического исследования мазков костного мозга и периферической крови, мультипараметрической проточной цитофлюорометрии клеток костного мозга и цитогенетического и молекулярно-генетического анализа опухолевых лимфобластов 2. Диагностический период не должен занимать более 2-х суток.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: данные общего анализа крови позволяют судить о выраженности тромбоцитопении и анемии, и необходимости проведения заместительной терапии компонентами крови. Общее количество лейкоцитов и наличие бластных клеток в периферической крови необходимо для последующего стадирования, определения группы риска и назначения адекватной терапии 1.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз ОЛЛ ставится на основании обнаружения в пунктате костного мозга более 25% лейкемических клеток, для которых морфологически и цитохимически доказан один из вариантов лимфоидной дифференцировки. При этом в бластных клетках (по данным цитохимического исследования) отсутствует активность миелопероксидазы и неспецифической эстеразы, как ключевых маркёров нелимфоидных клеток-предшественников 6.
Костный мозг аспирируется из 3-х – 4-х анатомических точек. Для пункций используются передние и задние гребни крыльев подвздошных костей.
Морфологическая классификация ОЛЛ согласно группе ФАБ (Франко-Америко-Британская кооперативная Группа) на основании размеров, строения ядра, наличия включений и других признаков подразделяет лимфобласты на группы L1, L2 и L3. В настоящее время острый лейкоз со зрелым В-фенотипом (L3) относится к группе неходжкинских лимфом, и его диагностика и лечение должны проводиться согласно соответствующим клиническим рекомендациями 3.
Цитохимическое исследование опухолевых клеток является важным для дифференциальной диагностики с другими вариантами лейкемии. Обязательным является проведение двух цитохимических реакций – реакции на миелопероксидазу и реакции на неспецифическую эстеразу 4.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Мультипараметрическая проточная цитометрия, проводимая, с целью точного определения иммунофенотипа лейкемического клона занимает центральное место в диагностике ОЛЛ, являясь очень важным и обязательным методом для диагностики различных вариантов ОЛЛ, для стратификации на группы риска и для последующего определения минимальной резидуальной болезни (МОБ) 2. Различные иммунофенотипические варианты болезни представлены в таблице 1.
Таблица 1 – Иммунофенотипическая классификация ОЛЛ по EGIL (Европейская группа иммунодиагностики лейкозов), 1995 [8]
В-линейный острый лимфобластный лейкоз
CD19 + и/или CD79a + и/или СD22cyt +
Экспрессия не менее двух из трех пан-В-клеточных маркеров
Нет экспрессии других маркеров
Цитоплазматические цепи каппа + или лямбда +
Т-линейный острый лимфобластный лейкоз
CD2 + и/или CD5 + и/или CD8 +
Кортикальный Т-ОЛЛ (TIII)
Гамма/дельта + Т-ОЛЛ (б)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Цитогенетическое исследование лейкемических клеток должно включать в себя кариотипирование и исследование методом флуоресцентной in situ гибридизации (FISH) для выявления характерных перестроек. В настоящее время следующие транслокации однозначно имеют клиническое значение – t(9;22)(q34;q11) или BCR-ABL; t(4;11)(q21;q23) и t(12;21)(p13;q22) или TEL/AML1 [3-6, 9-12].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Исследование ликвора обязательно для подтверждения/исключения диагноза поражения ЦНС (нейролейкемии), что необходимо для точного определения группы риска и назначения адекватной терапии.
В результате анализа ликвора возможны следующие варианты:
Диагностическая люмбальная пункция должна проводиться только опытным врачом под общей анестезией с целью снижения риска травматичности и механического заноса бластных клеток периферической крови в ЦНС. Точная диагностика инициального поражения ЦНС возможна только путем приготовления цитопрепарата первичного ликвора на цитоцентрифуге. Оседание клеток ликвора на стекло естественным путём требует больше времени, что неизбежно приводит к деформации клеток, появлению артефактов и неправильной интерпретации данных [3, 4].
2.4 Инструментальная диагностика
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз опухолевой массы в переднем средостении ставится по прямому и правому боковому рентгеновским снимкам грудной клетки 3. Прямой и правый боковой рентгеновские снимки грудной клетки должны быть сделаны одновременно и до начала лечения.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: В случае выявления опухолевой массы в переднем средостении при рентгенографии грудной клетки необходимо провести КТ органов грудной полости с оценкой точных размеров опухолевой массы 4. По окончании индукционной терапии КТ проводится повторно для оценки степени уменьшения опухолевой массы в средостении.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Проведение УЗИ необходимо для оценки наличия поражения и размеров инфильтрированных паренхиматозных органов и лимфатических узлов брюшной полости, яичек, органов малого таза 1.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз инициального поражения яичек устанавливается на основании клинических данных и УЗИ. Биопсия яичка при подозрении на инициальное поражение не показана. Инициальное поражение яичек не влияет на стратификацию и выбор терапии; односторонняя или двухсторонняя орхиэктомия не предусмотрена 4.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Проведение КТ/МРТ головного мозга показано (при наличии неврологической симптоматики обязательно) для исключения/подтверждения инициального поражения ЦНС 2.
2.5 Иная диагностика
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Осмотр невролога показан всем пациентам с ОЛЛ на этапе инициальной диагностики для выявления/исключения признаков нейролейкемии – поражение ЧМН, очаговая симптоматика 4.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Осмотр офтальмолога с обязательным осмотром глазного дна показан всем пациентам с ОЛЛ на этапе инициальной диагностики для выявления/исключения лейкемической инфильтрации 4.
Учитывая необходимость проведения химиотерапии, пациентам с ОЛЛ помимо обязательных исследований, необходимых для установления диагноза, определения степени распространенности процесса и назначения адекватной терапии, на этапе первичной диагностики показано также проведение различных исследований, направленных на определение состояния различных органов и систем (профилактика развития токсических осложнений). Они включают в себя:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Учитывая необходимость проведения ПХТ, на начальном этапе очень важно определить функциональное состояние различных органов и систем с целью профилактики развития возможных токсических осложнений, т.к. в процессе терапии используются препараты, обладающие гепато-, нефро- и панкреатотоксическим действием. Особенно важно в первые дни терапии контролировать функцию почек (мочевина, креатинин, электролиты), т.к. возможно развитие синдрома острого лизиса опухоли (СОЛ). Степень риска развития СОЛ зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма. Биохимический анализ крови с определением основных ключевых показателей обязательно выполняется до начала терапии; в дальнейшем кратность исследований определяется состоянием пациента и протоколом терапии [2-4, 14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Определение инициального состояния системы гемостаза необходимо всем пациентам с ОЛЛ, т.к. в процессе лечения используются препараты, обладающие прокоагулянтными свойствами (аспарагиназа, глюкокортикостероиды) [2-4, 14]. В процессе терапии исследование гемостаза проводится регулярно (сроки регламентируются протоколом терапии).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Определение инициального состояния сердечно-сосудистой системы необходимо всем пациентам с ОЛЛ, т.к. в процессе лечения используются препараты с выраженным кардиотоксическим действием (антрациклины). В процессе терапии ЭКГ и Эхо-КГ должны повторяться перед каждым введением антрациклинов [2-4, 14].
3. Лечение
3.1 Консервативное лечение
Лечение острого лимфобластного лейкоза осуществляется при помощи комбинаций цитостатических препаратов, вводимых р/о, в/в, в/м и интратекально при строгом соблюдении дозы, длительности и времени введения согласно выбранному терапевтическому протоколу [1-6, 9, 10]. Кроме того, для ряда пациентов в предусмотренных протоколом случаях проводится облучение центральной нервной системы [13, 15, 16]. Терапия должна быть начата как можно раньше, однако для начала терапии необходимо быть полностью уверенным в диагнозе и установить объем поражения 4. Для проведения эффективного лечения необходима адекватная сопроводительная и заместительная терапия [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Лечение должно осуществляется только в соответствии с одним из специально разработанных терапевтических протоколов, подробно регламентирующему дозы и комбинации химиопрепаратов, сроки введения, детали обследования и тактику проведения цитостатической и сопроводительной терапии [1-6, 10, 17, 18]. Дозы, сроки и длительность введения химиопрепаратов должны быть в строгом соответствии с выбранным терапевтическим протоколом. Замена препаратов, пропуски введения, изменение дозы, длительности или очередности введения препаратов не допускаются.
В России проводится лечение по протоколам группы BFM (ALL-BFM-95 или ALL-BFM-2000) или группы Москва-Берлин (ALL-MB-2002 или ALL-MB-2008), имеющим сравнимую эффективность [9, 18-22].
До начала терапии пациенты разделяются на группы риска – подгруппы пациентов с более низким и более высоким риском развития рецидивов заболевания, которое проводится на основании прогностических факторов, определенных при диагностике [1-6, 10-12, 18]. Различные терапевтические протоколы имеют несколько отличающиеся друг от друга критерии, определяющие группы риска, согласно которым пациенты получают различные варианты лечения, однако, в основном, больных разделяют на три группы риска: стандартный, промежуточный и высокий.
Современное лечение ОЛЛ состоит из нескольких основных фаз: индукция ремиссии с помощью 4 и более агентов, вводимых в течение 4-6 недель, мультиагентная консолидация («закрепление») ремиссии и поддерживающая терапия, как правило, антиметаболитами в течение 2-3 лет [1, 4, 6, 19, 21, 23]. Основные элементы и возможные используемые химиопрепараты представлены в таблице 2:
Таблица 2. Фазы терапии ОЛЛ и используемые химиопрепараты.
Фаза терапии
Набор химиопрепаратов
преднизолон или дексаметазон, винкристин, даунорубицин, аспарагиназа, циклофосфамид, цитарабин, 6-меркаптопурин.
6-меркаптопурин, метотрексат, аспарагиназа
дексаметазон, аспарагиназа, доксорубицин, винкристин, циатрабин
Имеются убедительные доказательства увеличения эффективности терапии при использовании как минимум 4-компонентной индукционной терапии (глюкокортикостероид, винкристин, антрациклины и аспарагиназа) [1, 9, 10, 12, 18].
Индукция ремиссии у пациентов с ОЛЛ должна проводиться в стационарных условиях. При лечении больного с ОЛЛ необходимо быть готовыми к развитию тяжелых осложнений, требующих безотлагательной интенсивной терапии.
Оценка эффективности терапии проводится на 8, 15 день и по окончании индукции. На 8 день оценивается количество бластных клеток в периферической крови после циторедуктивной профазы. На 15 день – количество бластных клеток в костном мозге. По окончании индукционной терапии оценивается достижение ремиссии – количество бластных клеток в костном мозге, наличие/сохранение экстрамедуллярных очагов. Ликвор оценивается каждый раз при проведении люмбальной пункции. Пациенты, не достигшие ремиссии после индукционной терапии, переводятся в группу высокого риска [1-6, 11].
Пациенты, достигшие ремиссии после индукционной терапии, далее получают консолидирующую терапию в зависимости от выбранного терапевтического протокола. Терапия консолидации при отсутствии осложнений может проводиться в условиях стационарного одного дня. Если терапевтический протокол предусматривает использование высоких доз метотрексата (протоколы BFM), они должны проводиться в условиях круглосуточного стационара. Консолидирующая терапия, как правило, состоит из нескольких фаз (протоколы МВ: фазы S1, S2, S3; протоколы BFM – фаза II протокола I, протокол М, II протокол). Перед началом каждого этапа обязательно исследование общего анализа крови, биохимического анализа крови. Площадь поверхности тела для расчета доз лекарственных препаратов пересчитывается заново перед началом каждой фазы консолидирующей терапии. Условия начала отдельных этапов консолидации прописываются в каждом терапевтическом протоколе и могут несколько отличаться. Обязательным является сохранение клинико-гематологической ремиссии, отсутствие признаков инфекции и отсутствие цитопении в периферической крови [1-4, 6, 14, 19, 21, 23].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Обязательным компонентом в лечении ОЛЛ является профилактика и лечение нейролейкемии. Основными методами профилактики и лечения нейролейкемии являются интратекальное введение химиопрепаратов (метотрексат, цитарабин, преднизолон) в возрастных дозировках и краниальное облучение в ранние сроки от начала лечения. Краниальное облучение имеет непосредственные и отдаленные побочные эффекты, поэтому в современных протоколах оно используется только для небольшой четко выделенной подгруппы пациентов промежуточного/высокого риска [1, 9,13, 15, 16, 24].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Поддерживающая терапия проводится до достижения общей длительности терапии 2 года. Поддерживающая терапия состоит из ежедневного перорального приема 6-меркаптопурина с еженедельным введением метотрексата (в/м или р/о в зависимости от терапевтического протокола) [1-4, 6, 9, 10, 20, 27]. Обязательным условием адекватного проведения поддерживающей терапии является своевременная коррекция дозировки 6-меркаптопурина и метотрексата в зависимости от количества лейкоцитов. Задачей является такая юстировка доз, прежде всего 6-меркаптопурина, чтобы лейкоциты стабильно держались в пределах от 2 000 до 3 000/мкл, не допуская как развития аплазии, так и увеличения лейкоцитов выше 3 000-3 500/мкл.
Протоколы серии Москва-Берлин предусматривают также проведение реиндукций (дексаметазон + винкристин), каждые 6 недель поддерживающей терапии. На первых трех реиндукциях проводятся интратекальные введения 3-х химиопрепаратов. Больным, которым проводилось краниальное облучение, интратекально вводятся только 2 препарата – метотрексат не вводится 21.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Пациенты, определенные в группу высокого риска, по завершении индукционной терапии, получают интенсивную высокодозную полихимиотерапию, представляющую собой короткие последовательные курсы интенсивной ПХТ – «блоки». В зависимости от наличия показаний, совместимого донора и достижения ремиссии, пациентам проводится трансплантация гемопоэтических стволовых клеток (ТГСК) в максимально ранние сроки [1-4, 6, 10, 20, 21, 23].
Терапия пациентов группы высокого риска проводится только в условиях круглосуточного стационара. Перед началом каждого блока высокодозной химиотерапии обязательно исследование общего анализа крови, биохимического анализа крови, исследование функции почек (клиренс по эндогенному креатинину), регистрация ЭКГ. Площадь поверхности тела для расчета доз лекарственных препаратов пересчитывается заново перед началом каждого блока. Оценка статуса ремиссии проводится перед началом каждого блока химиотерапии.
Терапия должна начинаться как можно быстрее, что особенно важно для первых трех терапевтических элементов. Временные промежутки между элементами определяются выходом из аплазии, общим состоянием пациента и объективно регистрируемой органной токсичностью. Минимальный промежуток между началом двух последовательных терапевтических элементов составляет 21 день. Редукция доз не предусмотрена. В случае необходимости сроки введения конкретного препарата сдвигаются или он отменяется. Терапевтический элемент не должен прерываться.
Для адекватного выполнения терапевтического протокола необходимо строгое соблюдение принципов сопроводительной терапии, которые подробно описаны в каждом терапевтическом протоколе и зависят от применяемой химиотерапии. Однако, существуют «общие» рекомендации, которые включают в себя следующее [14]:
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Наличие центрального венозного катетера, обеспечивающего возможность мониторинга ЦВД, частых заборов крови и высокую скорость введения жидкостей является абсолютно необходимым на начальных этапах терапии и у пациентов группы высокого риска, получающих интенсивную высокодозную химиотерапию.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Синдром острого лизиса опухоли (СОЛ) – это комплекс метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов. В основе патофизиологии и клинической картины СОЛ лежат нарушения метаболизма и экскреции калия, кальция, фосфатов и мочевой кислоты. Наиболее часто СОЛ развивается в течение первых 4-х дней после начала ПХТ, однако, описаны случаи и более позднего, до седьмого дня, дебюта синдрома. Степень риска развития СОЛ зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма [14].
Учитывая более низкую растворимость мочевой кислоты в кислой среде, необходимо обеспечить поддержание нейтрального или слабощелочного рН мочи: NaHCO3 60 ммоль на литр инфузии (60 мл 7,5% раствора соды, либо 100-120 мл 4% раствора соды) добавить к постоянной инфузии (или 100-200 ммоль/м 2 /сутки параллельной инфузией). Регулирование необходимого объёма NaHCO3 соответственно pH мочи.
Всем пациентам в первые дни терапии (5-8 дней) показано назначение аллопуринола в дозе 10 мг/кг в сутки в 2-3 приема (предельно допустимая суточная доза – 500 мг/сутки) [14].
При наличии большой массы лейкемических клеток и/или выраженной органомегалии первая доза глюкокортикостероидов для профилактики СОЛ должна составлять 1 /10 – 1 /6 от суточной дозы.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Ко-тримоксазол (Сульфаметоксазол + Триметоприм) 3 раза в неделю в один прием в дозе 5 мг/кг по триметоприму или 20 мг/кг по сульфаметоксазолу per os. (кроме периодов проведения высокодозного метотрексата) [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Лихорадкой у больного с нейтропенией (нейтрофилы 38,5 0 С или несколько подъемов (3 – 4 раза в сутки) до 38 0 С. Принимая во внимание высокий риск фатального исхода у больного с инфекцией, лихорадку у такого пациента с нейтропенией, развившую в ходе миелосупрессивной полихимиотерапии, следует расценивать как наличие инфекции, что требует немедленного начала эмпирической антибактериальной терапии и проведения обследования с целью уточнения характера инфекции.
При выборе стартовой комбинации антибиотиков необходимо учитывать результаты повторных бактериологических исследований в данной клинике у других пациентов; длительность текущей нейтропении, предшествующий курс химиотерапии; инфекционный анамнез больного, предшествующие курсы антибиотиков и их эффективность; наличие клинической симптоматики [14].
Эффективность стартовой антибактериальной терапии положено оценивать через 24-36 часов для того, чтобы судить о её достаточности, однако всегда необходим повторный с интервалами 8-12 часов детальный осмотр такого больного с оценкой стабильности гемодинамики и степени интоксикации, появления новых инфекционных очагов.
Антибактериальная терапия продолжается до разрешения нейтропении.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Имеются данные международных исследований о том, что необоснованное применение G-CSF может увеличивать риск рецидивов [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Во всех случаях, исключая пневмонию и дыхательную недостаточность, переливание эритромассы должно производиться при содержании гемоглобина ниже 70 г/л и гематокрите менее 0,3 или при наличии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка). Доза переливаемой эритромассы – 10 мл/кг. При развитии инфекции эритромасса переливается при снижении гемоглобина ниже 100 г/л [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
3.2 Хирургическое лечение
3.4 Иное лечение
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Краниальное облучение имеет непосредственные и отдаленные побочные эффекты, поэтому в современных протоколах оно используется только для небольшой четко выделенной подгруппы пациентов промежуточного/высокого риска (в зависимости от рекомендаций выбранного терапевтического протокола). Краниальное облучение проводится по окончании консолидации, как правило, в дозе 12 Гр [1-4, 9, 13, 15-17, 24, 28].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: В зависимости от наличия показаний, совместимого донора и достижения ремиссии, пациентам группы высокого риска проводится трансплантация гемопоэтических стволовых клеток (ТГСК) в максимально ранние сроки [1-6, 9, 10, 17, 18, 20].
Проведение ТГСК показано всем больным высокого риска в 1-ой ремиссии и больным с рецидивами ОЛЛ (за исключением пациентов с поздними изолированными экстрамедуллярными рецидивами) при условии обнаружения родственного полностью совместимого (HLA-типирование высокого разрешения) донора. Поэтому всем пациентам HLA-типирование и инициация поиска донора должны проводиться сразу после стратификации пациентов в группу высокого риска.
Показаниями к ТГСК при первичном ОЛЛ у детей считаются: отсутствие ремиссии после индукционной терапии; транслокация (9;22)(q34;q11) или BCR/ABL; транслокация (4;11)(q21;q23) или MLL/AF4 [1-6, 9, 10, 17, 18, 20].
Пациентам, не достигшим ремиссии после проведения индукционной терапии, облигатно показана аллогенная ТГСК любого типа (в зависимости от доступности доноров и от технических возможностей).
4. Реабилитация
Реабилитация детей с ОЛЛ в ремиссии должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации не только ребенка, но и его семьи к нормальной жизни. Такая реабилитация требует кроме медицинской помощи обязательного участия социальных работников, педагогов и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений химиотерапевтического лечения, сопутствующей патологии, социальных и психологических проблем.
Поддерживающая терапия проводится по месту жительства под наблюдением врача-педиатра (если есть должность, то врача-гематолога). Врач-педиатр (гематолог) по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего лечение.
5. Профилактика и диспансерное наблюдение
Периодичность лабораторных и инструментальных исследований, осмотров специалистов в период диспансерного наблюдения [29]:
Пациент снимается с диспансерного учета при условии окончания поддерживающей терапии, наличия полной ремиссии, отсутствия сопутствующих заболеваний и по истечении 5 лет после окончания лечения [29].
6. Дополнительная информация, влияющая на течение и исход заболевания
Вакцинация [29]:
Возможность пребывания в организованном коллективе:
Возможность нагрузок и занятий спортом:
Отношение к рождению детей – Никаких ограничений нет. Риск развития ОЛЛ у потомства минимален.
Критерии оценки качества медицинской помощи
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнена пункция костного мозга (при установке диагноза)
Выполнено цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) и цитохимическое исследование препарата костного мозга (при установке диагноза)
Выполнено иммунофенотипирование бластных клеток костного мозга с помощью проточной цитометрии (при установке диагноза)
Выполнено цитогенетическое исследование и/или молекулярно-генетическое исследование бластных клеток костного мозга (при установке диагноза)
Выполнена спинномозговая пункция (при установке диагноза)
Выполнено исследование спинномозговой жидкости (определение цитоза, белка, глюкозы, цитологическое исследование) (при установке диагноза)
Выполнена рентгенография органов грудной клетки (при установке диагноза)
Выполнены ультразвуковое исследование органов брюшной полости (комплексное) и ультразвуковое исследование забрюшинного пространства (при установке диагноза)
Выполнена компьютерная томография головы и/или магнитно-резонансная томография головного мозга (при установке диагноза в случае наличия неврологической симптоматики)
Выполнена повторная пункция костного мозга на 15 день индукционной терапии и не позднее 40 дня от момента начала индукционной терапии
Выполнено цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) на 15 день индукционной терапии и не позднее 40 дня от момента начала индукционной терапии
Выполнена повторная рентгенография органов грудной клетки не позднее 40 дня от момента начала индукционной терапии (при наличии инициального поражения средостения)
Выполнен общий (клинический) анализ крови развернутый с подсчетом лейкоцитарной формулы не реже 1 раза в 7 дней (при поддерживающей терапии)
Выполнена коррекция доз меркаптопурина и метотрексата в зависимости от количества лейкоцитов в общем (клиническом) анализе крови развернутом не реже 1 раза в 7 дней (при поддерживающей терапии)
Выполнен анализ крови биохимический общетерапевтический (аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтранспептидаза, билирубин, общий белок, альбумин, глюкоза) не реже 1 раза в 3 месяца (при поддерживающей терапии)
Выполнена консультация врачом-гематологом в профильной медицинской организации (при наличии медицинских показаний к трансплантации костного мозга)
Список литературы
Приложение А1. Состав рабочей группы
Конфликт интересов: отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Таблица П1 – Уровни достоверности доказательств
Уровень достоверности
Источник доказательств
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
II (2)
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования «случай-контроль»
III (3)
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
IV (4)
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
Таблица П2 – Уровни убедительности рекомендаций
Уровень убедительности
Описание
Расшифровка
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой
Порядок обновления клинических рекомендаций – пересмотр 1 раз в 3 года.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови – предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей и подростков, на его долю приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения. Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка. Дефицит полноценных лейкоцитов приводит к ослаблению иммунитета, развиваются частые инфекции с высокой температурой.
Распространяясь по организму, лейкемические клетки приводят не только к изменениям в составе крови. Так как лейкозные клетки заполняют костные полости и костный мозг, то появляются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Опухолевые клетки могут скапливаться в печени, селезенке и лимфатических узлах; могут наблюдаться боли в животе. В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы – нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
При ОЛЛ возникают изменения в обычном клиническом анализе крови: могут быть понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки, может быть увеличено количество лейкоцитов. Но для окончательной диагностики необходимо получить клетки костного мозга, для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге. Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что важно не только диагностировать ОЛЛ, но и определить конкретный вариант ОЛЛ. Это важное условие для планирования терапии.
Как только диагноз лейкоза поставлен, для планирования терапии необходимо выяснить, насколько в процесс вовлечены другие органы, кроме костного мозга. Более точную информацию дают такие методы диагностики как ультразвуковое и рентгеновское исследование, магнитно-резонансная и компьютерная томография и др.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала (люмбальная пункция).
Перед лечением (и в процессе) у ребенка проверяют, как работает сердце (ЭКГ и ЭхоКГ) и головной мозг (электроэнцефалограмма). Комплексные лабораторные исследования помогают объективно оценить состояние ребенка и обнаружить нарушения обмена веществ или функций каких-либо органов. Эти изменения обязательно учитываются во время лечения. Для возможно необходимых переливаний крови устанавливают группу крови пациента.
Центральное место в лечении ОЛЛ занимает химиотерапия. У некоторых пациентов дополнительно облучается центральная нервная система и/или проводится трансплантация стволовых клеток. Цель лечения – по возможности полностью уничтожить лейкемические клетки во всем организме. Интенсивность и продолжительность химиотерапии, необходимость лучевой терапии и трансплантации, а также прогноз зависят от типа лейкоза, различных факторов и ответа на терапию.
Химиотерапия – это лечение медикаментами (цитостатики), которые блокируют деление клеток или убивают опухолевые клетки. Для наиболее эффективного лечения применяют различные комбинации препаратов.
Современное лечение ОЛЛ основано на разделении пациентов на группы риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно и внутримышечно, в условиях больничного стационара или стационара одного дня. Поддерживающая терапия представляет собой этап наименее интенсивного лечения, пребывание в больнице при этом не требуется (за исключением периода реиндукций).
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. У некоторых пациентов используется и облучение головы – краниальное облучение.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске, поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе побочных эффектов химиотерапии можно также назвать тошноту, рвоту, выпадение волос. У каждого из цитостатиков есть свои побочные эффекты. Чаще всего они возникают временно, но иногда сопровождают весь курс лечения.
Серьезная проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений.