Дифлюкан или пимафуцин что лучше при кандидозе
Дифлюкан или пимафуцин что лучше при кандидозе
Например:
КАК ЛЕЧИТЬ МОЛОЧНИЦУ? ПРИМЕНЕНИЕ ДИФЛЮКАНА ®
Большая часть инфекций, вызванных грибками, хорошо поддается лечению, и одно из эффективных средств от молочницы — Дифлюкан 150 мг®.
Большая часть инфекций, вызванных грибками, хорошо поддается лечению
При редких проявлениях молочницы (не чаще трех раз на протяжении года) Дифлюкан 150 мг® принимается однократно. При рецидивах требуется длительный курс лечения.
Особенности препарата
Действующее вещество препарата – флуконазол – угнетает синтез стеролов, из которых состоит структура стенок клетки грибка Candida. Дифлюкан 150 мг® используется для лечения молочницы половых органов, ЖКТ, ротовой полости, кожных покровов, кандидозного сепсиса.
При приеме Дифлюкана 150 мг® в виде капсул действующее вещество быстро попадает в кровь. Одновременное употребление лекарства вместе с пищей не снижает его эффективность. При приеме натощак пиковая концентрация препарата наблюдается спустя 30-90 минут.
Как применять Дифлюкан ® при молочнице
Острая форма кандидоза женских органов лечится однократным приемом препарата, доза — 150 мг.
Препараты по теме:
Побочные действия
Дифлюкан 150 мг® обладает благоприятным профилем безопасности, возможные побочные реакции:
Поэтому, обнаружив у себя характерные признаки заболевания, не спешите назначать себе Дифлюкан 150 мг® против молочницы без консультации специалиста! Дозировку, кратность приема и его длительность должен определить врач, изучив все объективные данные.
Противопоказания
Не стоит принимать Дифлюкан 150 мг ® при молочнице:
Существует также ряд других противопоказаний. Необходима консультация врача, который примет решение о целесообразности приема препарата.
Дифлюкан или пимафуцин что лучше при кандидозе
Гастроэнтерология Санкт-Петербурга, 2006, №1-2, С.17-20.
Стандарты и перспективы фармакотерапии кандидоза органов пищеварения.
Увеличение числа пациентов с иммунодефицитными состояниями различного генеза привело к тому, что перед гастроэнтерологами и врачами других специальностей все чаще встает проблема выбора противогрибкового препарата для лечения кандидоза органов пищеварения.
При выборе антифунгального препарата для лечения кандидоза клиницисту приходится учитывать семь факторов: особенности патогенеза, локализацию поражения, чувствительность возбудителя, профиль безопасности антимикотика, состояние функции печени и почек пациента, возможное взаимодействие с другими лекарственными средствами, и, наконец, фармакоэкономические аспекты.
Патогенез и диагностика кандидоза верхних отделов пищеварительного тракта.
Патогенез кандидоза слизистых оболочек пищеварительного тракта характеризуется последовательным прохождением следующих этапов – адгезии, инвазии, кандидемии и висцеральных поражений. На первом этапе микромицеты адгезируются к эпителиоцитам какого-либо участка слизистой оболочки. В дальнейшем, дефекты в системе резистентности позволяют микромицетам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения – решающий фактор, который позволяет инвазирующимся грибам достигать стенки сосудов, разрушать ее и циркулировать в сосудистом русле. Такой этап называют кандидемией. В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах, например, легких, эндокарде, центральной нервной системе, печени и др.
Лечение орофарингеального кандидоза и кандидоза пищевода.
Целью терапии этих форм кандидоза является устранение симптомов и клинических признаков заболевания, а также предотвращение рецидивов. Для части больных орофарингеальным кандидозом имеют значение «местные» факторы риска – ношение зубных протезов и ингаляции кортикостероидных средств. Симптомы орофарингеального кандидоза и кандидоза пищевода, кроме субъективного дискомфорта, могут нарушить глотание пищи и жидкостей и значительно снизить качество жизни.
Для лечения орофарингеального кандидоза можно применять как местнодействующие, так и системно действующие антифунгальные препараты. За рубежом для местной терапии применяют, например, пастилки с клотримазолом или суспензию нистатина или амфотерицина В. В нашей стране такие лекарственные формы не зарегистрированы, и обычно местная терапия представляет собой разжевывание или нанесение на слизистую оболочку размельченных таблеток нистатина или натамицина в дозах от 1 до 4 млн ЕД в сутки с продолжительностью курса до 2-4 недель (2). Эффективность такого «импровизированного» метода лечения в контролируемых исследованиях не изучалась. Местная антифунгальная терапия при кандидозе пищевода неэффективна.
При кандидозе слизистых оболочек верхних отделов пищеварительного тракта могут применяться системнодействующие азоловые антимикотики (кетоконазол, флуконазол, итраконазол или вориконазол), внутривенный амфотерицин B (особенно при азоло-рефрактерных инфекциях), а также – эхинокандиновые препараты (каспофунгин, микафунгин и др.). Для больных с нарушенным актом глотания разработаны парентеральные формы антимикотических средств.
Эффективность и безопасность азоловых и эхинокандиновых антимикотических препаратов изучена достаточно хорошо, накоплена большая база доказательств, основанных на контролируемых исследованиях, а результаты этих работ легли в основу терапевтических стандартов (3-5).
Эффективность антимикотической терапии орофарингеального кандидоза оценена в ходе многократных рандомизированных проспективных исследованиях как у больных со СПИДом, так и у больных со злокачественными новообразованиями. Большинство пациентов отвечают на лечение местнодействующими формами полиеновых антимикотических средств (пастилки и суспензия). Однако у ВИЧ-инфицированных больных рецидивы кандидоза полости рта могут произойти скорее после местной терапии, чем после лечения флуконазолом в дозе 100 мг в сутки, а резистентность возбудителя может развиться при применении любого варианта терапии. Так же было показано, что флуконазол по эффективности превосходит кетоконазол, а итраконазол в капсулах эквивалентен по эффективности кетоконазолу. Пероральный раствор итраконазола лучше абсорбируется в пищеварительном тракте, чем капсульная форма, и сопоставим по эффективности с флуконазолом. Доза раствора итраконазола 2,5 мг/кг 2 раза в день была рекомендована для лечения орофарингеального кандидоза у детей от 5 лет и старше. Эффективность орального раствора итраконазола может быть значительнее за счет суммирования местного и системного эффекта.
Рецидивирующее течение кандидоза обычно отмечают у больных с иммунодефицитами, особенно при СПИДе. Показано, что длительная поддерживающая терапия флуконазолом эффективна для предупреждения развития орофарингельного кандидоза как у онкологических, так и у больных со СПИДом. Длительная поддерживающая терапия флуконазолом ВИЧ-инфицированных больных снижает частоту инвазивного кандидоза, но не влияет на общую выживаемость. Постоянная поддерживающая антифунгальная терапия снижала частоту рецидивов кандидоза по сравнению с интермиттирующим лечением, но уровни развития микробиологической резистентности были одинаковыми в обеих группах.
Пероральные полиеновые средства, такие как амфотерицин B или нистатин, менее эффективны для предупреждения кандидоза слизистой оболочки. В тоже время было установлено, что итраконазол 200 мг в сутки был эффективен как противорецидивная терапия орофарингеального кандидоза в течение 6 месяцев. Показано, что 64-80% пациентов с флуконазол-рефрактерными инфекциями излечиваются от орофарингеального кандидоза при использовании перорального раствора итраконазола. Оральный раствор амфотерицина В был также успешно использован при лечении резистентного к флуконазолу кандидозу слизистой оболочки полости рта.
Микафунгин или каспофунгин внутривенно в дозе 50 мг в сутки могут быть обоснованным альтернативным лечением, особенно при лечении кандидоза, вызванного флуконазол-резистентными штаммами, однако их применение ограничивается высокой стоимостью лечения. Внутривенная антифунгальная терапия может иногда не понадобиться, если применяются или гамма-интерферон или гранулоцитарно-моноцитарный колониестимулирующий фактор в комбинации с пероральной антифунгальной терапией.
У больных со СПИДом рецидивы кандидоза пищевода встречаются довольно часто, и для предотвращения рецидивов эффективна длительная супрессивная терапия флуконазолом (100 мг/день).
Подводя итоги изложенному, сформируем следующие ключевые рекомендации:
Первичный эпизод орофарингеального кандидоза можно лечить назначением местно нистатина 500 тыс ЕД четыре раза в день или натамицина 100 мг 4 раза в день (рассасывание таблеток, нанесение на слизистую оболочку размельченных таблеток) в течение 7-14 дней, однако нужно быть готовым, что эффективность такого лечения ниже, чем лечение азоловыми препаратами.
Препаратами выбора для лечения орофарингеального кандидоза остаются пероральный флуконазол 100 мг/день в течение 7-14 дней или оральный раствор итраконазола 200 мг/день в течение 7-14 дней.
3. Кетоконазол и капсулы итраконазола менее эффективны для лечения орофарингеального кандидоза, чем флуконазол, из-за нестабильной абсорции в пищеварительном тракте.
Орофарингеальный кандидоз, ассоциированный с зубными протезами, для окончательного излечения требует полной дезинфекции последнего.
Резистентные к терапии флуконазолом случаи кандидоза пищевода необходимо лечить раствором итраконазола (не менее 200 мг/день per os ), вориконазолом (200 мг 2 раза в день) или каспофунгином (50 мг в день) или микафунгином (50 мг в день), или внутривенным амфотерицином B (0,3-0,7 мг/кг/день ) до получения клинического ответа.
Проведение in vitro тестов на чувствительность к антимикотикам не обязательно при первичных эпизодах как орофарингеального кандидоза, так и при кандидозе пищевода, но может быть полезным для выбора терапии у больных с резистентным или рецидивирующим течением заболевания.
У больных ВИЧ/СПИД лечение основной инфекции антиретровирусной терапией является важнейшим фактором предотвращения рецидивов и лечения кандидоза.
Диагностика и принципы лечения кандидоза кишечника.
Дифференциальный диагноз кандидоза и кандидоносительства в кишечнике может представлять определенные трудности. Довольно частая ошибка – постановка диагноза кандидоза только на основании выявления факта роста дрожжеподобных грибов в фекалиях. Между тем этот факт может отражать транзиторное кандидоносительство.
Для диагностики кандидоза, впрочем равно как и для любой другой оппортунистической инфекции, важно не только продемонстрировать возбудитель, но и доказать его участие в патологическом процессе. Один из принципиальных критериев диагноза оппортунистической инфекции – наличие поломов в системе антимикробной резистентности, а для рассматриваемой нами формы поражения это дефицит облигатной бактериобиоты – естественных конкурентов микромицетов. Таким образом, диагноз дисбиоза кишечника с избыточным ростом грибов рода Candida устанавливают при наличии следующих критериев (9):
синдром кишечной диспепсии,
лабораторно подтвержденный дисбиоз кишечника,
Эндоскопические исследования с цитологическим изучением препаратов мало информативны, так как чаще всего патологических изменений не выявляют. Дифференциальный диагноз кандидоза кишечника проводят так же с инфекционными колитами, гельминтозами и паразитарными поражениями кишечника, ферментопатиями, опухолями, синдромом раздраженной толстой кишки.
В плане лечения пациента с кандидозом кишечника необходимо предусмотреть следующие терапевтические направления (10):
Лечение основного заболевания согласно принятым стандартам
Селективная деконтаминация кишечника, направленная на устранение причины заболевания – грибов рода Candida
Назначение про- и пребиотиков и других препаратов, способствующих восстановлению естественной антимикробной резистентности слизистой оболочки кишечника с целью предотвращения рецидивов дисбиоза
Симптоматическая терапия и диетотерапия.
Для селективной деконтаминации при кандидозе кишечника чаще используют малорезорбируемые полиеновые антимикотики (нистатин и натамицин). Так же сообщается об антифунгальной активности некоторых синтетических (например, хинолоновых) и биологических энтеросептиков (например, включающих живые культуры Saccharomyces boulardi ). Эффективность этих препаратов как антимикотиков окончательно еще придется оценить в сравнительных исследованиях, однако уже сейчас можно говорить о некоторых преимуществах и недостатках этих средств. Хинолоновые препараты обладают широким спектром антибактериальной и антипротозойной активности, что делает их предпочтительными при микст-инфекциях кишечника. В то же время их выраженная антибактериальная активность может угнетающе сказываться на резидентной нормобиоте и на эффективности одновременно назначаемых пробиотических средств.
Препараты, содержащие живые штаммы Saccharomyces spp кроме энтеросептического, показали иммуномодулирующий эффект (за счет стимуляции выработки IgA слизистой оболочкой кишечника). Однако последние наблюдения демонстрируют серьезную опасность применения их в группах больных с выраженными иммунодефицитами. Так описано 92 случая инвазивных микозов, вызванных сахаромицетами у больных с типичными факторами риска (пациенты с цитопенией, а также получающие антибиотики и имеющие установленный внутривенный катетер), причем 40% больных получали биопрепараты, содержавшие Saccharomyces boulardi (11).
Нистатин, исторически один из первых антимикотических препаратов, по- прежнему широко применяется в нашей стране и за рубежом. Как показали результаты анализов ЦМИ «Фармэксперт», в 2001 г в натуральном выражении, то есть по числу проданных упаковок (единиц) препарата на отечественном рынке антимикотиков на 1-м месте оказался именно нистатин (12). Для селективной деконтаминации при кандидозе кишечника нистатин назначают внутрь в виде таблеток по 250 и 500 тыс ЕД, суточная доза обычно 3-4 млн ЕД, а курсы лечения продолжаются 2-3 недели. Однако нестабильность активного вещества (нистатин в значительной степени теряет активность после пребывания на солнечном свете и открытом воздухе) и раздражающее действие на слизистые оболочки (при приеме препарата иногда отмечают тошноту, рвоту и диарею) ограничивают применение этого препарата.
Успешное решение основной задачи – селективной деконтаминации – позволяет рассчитывать на успех в деле восстановления и консолидации эубиоза – т.е. стойкого устранения дефицита нормобиоты кишечника. С этой целью традиционно используют про- и пребиотики.
Возможно, именно биологическая несовместимость фармакопейных и резидентных штаммов нормобиоты является причиной побочных эффектов (усиление диареи и симптомов раздражения кишечника) и неэффективности лечения при применении пробиотиков. Нужно полагать, что при коррекции дисбиоза кишечника правильнее с патогенетических позиций не пытаться «привить» в кишечнике пробиотический штамм, а стимулировать «остатки» резидентных штаммов, которыми индивидуум был контаминирован еще со времени первых контактов с кожей и слизистыми оболочками матери. Вероятнее всего, именно эти резидентные штаммы нормобиоты наиболее благоприятны для здоровья человека, в том числе с позиций иммунологической совместимости. Если допустить, что каждый пациент в определенной степени «нормобиотически» индивидуален, то логичнее использовать для коррекции дисбиоза пребиотики.
Выбор пребиотиков, т.е. стимуляторов интестинального роста резидентной нормобиоты, не содержащих живые культуры нормобиоты, сегодня достаточно широк. Действующим началом таких средств может являться лактулоза, пектин, некоторые биологически-активные продукты обмена облигатных бактерий и другие.
Одним из наиболее эффективных современных отечественных средств с выраженным пребиотическим эффектом является Эубикор. Препарат содержит инактивированные нежизнеспособные дрожжи Saccharomyces cerevisiae ( vini ), пищевые волокна, витамины, аминокислоты, макро- и микроэлементы. Известно, что пищевые волокна, не подвергаясь изменениям ферментами пищеварительного тракта, легко достигают толстой кишки, где они метаболизируются анаэробной микробиотой до короткоцепочечных жирных кислот. Последние являются главными энергетическими источниками в слизистой оболочке толстой кишки, они стимулируют пролиферацию ее клеток, образование слизи и кровообращение.
Кроме того, пищевые волокна создают дополнительную площадь для адгезии различных бактерий кишечника. Таким образом, в просвете толстой кишки многократно возрастает число мест фиксации облигатных микроорганизмов, что приводит к значительному увеличению их количества и возрастанию метаболической активности кишечного содержимого. При этом на пищевых волокнах в первую очередь фиксируются именно бифидо- и лактобактерии. С другой стороны, хорошо известен детоксикационный эффект пищевых волокон в отношении патогенных микроорганизмов и их токсинов.
К настоящему времени накоплена обширная доказательная база поливалентной клинической эффективности Эубикора (16, 17). В результате повышения защитных и регуляторных свойств нормальной кишечной микрофлоры Эубикор оказывает иммуномодулирующее и антиоксидантное действие, способствует восстановлению ферментативной функции кишечника, защитного барьера его слизистой оболочки. Выраженные сорбционные свойства и метаболические эффекты Эубикора определяют характерное для него антитоксигенное и десенсибилизирующее действие. Назначают Эубикор по 1-2 пакетика 3 раза в день, добавляя в пищу, курсами по 3-4 недели. Эубикор может применяться вместе с препаратами для селективной деконтаминации кишечника, а также для профилактики дисбиоза кишечника.
В период терапии больным кандидозом кишечника рекомендуют пищевой рацион с ограничением продуктов, содержащих простые углеводы (сахар, сладкие фрукты и ягоды, кондитерские изделия, мед, молоко, белокочанная капуста, бобовые, квас, пиво).
Остается добавить, что больные кандидозом пищеварительного тракта, сложные с позиций диагностики и лечения, должны быть обследованы в специализированных микологических клиниках.
1. Шевяков М.А., Колб З.К., Борзова Ю.В. Рецидивирующий кандидоз пищевода у ВИЧ-неинфицированных больных. (Тезисы докладов 7-х Кашкинских чтений) // Проблемы медицинской микологии, 2004, Т.6., N 2, С.131.
2. Баранцевич Е.П., Баранцевич Н.Е., Богомолова Т.С., Колб З.К., Лебедева Т.С. Орофарингеальный кандидоз у больных гемобластозами. Проблемы медицинской микологии, 2005, Т.7, №1, С.19-20.
5. .Parente F., et al., Prevention of symptomatic recurrences of esophageal candidiasis in AIDS patient after the first episode: a prospective open study. American Journal of Gastroenterology, 1994, Vol. 89, N3, P.416-420.
6. Suleiman J., et al. Open label study of micafungin in the treatment of esophageal candidiasis. Abstracts of 42 nd ICAAC, September 27-30, 2002, San Diego, USA, (M-892).
7. Шевяков М.А., Мелехина Ю.Э., Выборнова И.В., Колб З.К., Богомолова Т.С., Климко Н.Н.. Видовая принадлежность и чувствительность к флуконазолу возбудителей рецидивирующего кандидоза пищевода у ВИЧ-негативных больных // Тезисы докладов научно-практической конференции по медицинской микологии ( VIII Кашкинские чтения), Проблемы медицинской микологии, 2005, Том 7, №2, С.81.
8. Mattheus R. Candida immunotherapy. Trends in Medical Mycology, Joint meeting of the 9 th Congress of the ECMM and the 7 th TIFI, 2003, S11.04, P.53.
9. Климко Н.Н и др. Перечень основных методов и критериев диагностики микозов (методические рекомендации). СП б МАПО, Санкт-Петербург, 2001, 24 с.
10. Шевяков М.А. Кандидоз органов пищеварения: клиника, диагностика и лечение: автореф. дис…докт.мед.наук. – СПб., 2000. – 41 с.
13. Кандидоз кишечника в общетерапевтической практике (клиническое значение, диагностика, лечение): Учебно-методическое пособие. – СПб., 2004. – 36 с.
14. Шевяков М.А., Колб З.К., Савельева О.Г., Борзова Ю.В. Характер нарушений интестинального микробоценоза у пациентов с синдромом раздраженного кишечника. (Тезисы докладов на 6 научно-практической конференции по медицинской микологии (6 Кашкинские чтения.) // Проблемы медицинской микологии, 2003, Т.5, №2, С. 43-44.
15. Глушанова Н.А., Блинов А.И. Биосовместимость пробиотических и резидентных лактобацилл. Тезисы 7-го Славяно-Балтийского научного форума «Санкт-Петербург – Гастро-2005» // Гастроэнтерология Санкт-Петербурга, №1-2, 2005, М31.
16. Гриневич В.Б. и др. Теоретическое и практическое обоснование клинического применения препарата «Эубикор» при заболеваниях органов пищеварения (методическое пособие), Санкт-Петербург, 2002, 22 С.
17. Гриневич В.Б. и др. Клинические аспекты диагностики и лечения дисбиоза кишечника в общетерапевтической практике (учебно-методическое пособие). Санкт-Петербург, 2003, 37 С.
КАНДИДОЗ ПИЩЕВОДА
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida. Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражений пищевода. В последние годы прослеживается тенденция нарастания частоты КП, особенно у пациентов с нарушением иммунитета. Рост кандидозной инфекции в значительной степени обусловлен увеличением количества больных с ВИЧ-инфекцией, успехами в трансплантологии и иммуносупрессивной терапии, бесконтрольным использованием антибиотиков. КП встречается у 0,7-1,5% больных гастроэнтерологического профиля [5, 6].
Проблема тяжелых грибковых инфекций, вызываемых оппортунистическими патогенами, состоит в том, что они трудно поддаются лечению и могут приводить к летальному исходу. Было обнаружено, что смертность при инвазивных кандидозных инфекциях составляет 34% [16].
Благоприятные условия для развития инфекционного процесса создают различные нарушения физиологических, анатомических и иммунологических механизмов защиты организма. В качестве факторов, провоцирующих возникновение эзофагеального кандидоза, можно назвать использование антибиотиков, ингаляционных или инъекционных кортикостероидов, антацидную терапию или гипохлоргидрическое состояние, сахарный диабет, алкоголизм, последствия интоксикации, недоедание, пожилой возраст, нарушение моторики пищевода или пищеводную обструкцию, трансплантацию органов и костного мозга, энтеральное и особенно парентеральное питание и др. Ослабление иммунной системы может привести к возникновению кандидозной инфекции. При сахарном диабете повышенный уровень глюкозы в крови способствует росту грибов, так как гипергликемия ослабляет функцию гранулоцитов. Гипофункция паращитовидных желез и надпочечников приводит к нарушению кальциево-фосфорного обмена, что вызывает скрытую спазмофилию пищевода, тем самым снижая его местные защитные возможности [9]. Нарушения нутритивного статуса из-за недостатка белка в организме и низкой калорийности пищи влияют на состояние иммунной системы и создают предпосылки для развития кандидоза [3]. К факторам риска заболевания кандидозом относится снижение кислотности желудочного сока (рН 7,4 является оптимальной для роста грибов Candida, а при сдвиге рН до 4,5 рост грибов полностью угнетается) [3, 4, 7].
Патологические проявления КП разнообразны. Сначала пораженные участки пищевода имеют вид отдельных беловатых или желтоватых очажков, приподнятых над слизистой оболочкой. Позднее эти очажки могут сливаться, образуя плотные налеты с внедрением гриба в подслизистую оболочку или псевдомембранозные наложения с проникновением гриба в мышечную оболочку и сосуды [9]. Пленки, образующиеся на слизистой пищевода в особенно тяжелых случаях, могут почти полностью закрывать просвет пищевода. Налет состоит из слущенных эпителиальных клеток, которые смешиваются с грибками, клетками воспаления и бактериями. Микроскопическое исследование позволяет выявить равномерно окрашенные дрожжеподобные клетки и нити мицелия грибов Candida [9]. Истинное язвообразование наблюдается нечасто и в большинстве случаев отмечается у иммуносупрессированных больных с гранулоцитопенией [29]. Иногда возникает некроз стенки пищевода и развивается флегмонозное воспаление пищевода и средостения, что может стать одной из причин смерти больного [1].
Существует морфологическая классификация, согласно которой все случаи КП подразделяются на три группы в зависимости от степени тяжести процесса, то есть в зависимости от глубины поражения его стенки: 1-я группа — отдельные беловатые налеты с внедрением псевдомицелия гриба между эпителиальными клетками; 2-я группа — пленчатые налеты, сливающиеся между собой и образующие обширные поля, при этом нити псевдомицелия прорастают не только слизистую, но и подслизистую оболочку; 3-я группа — псевдомембранозные наложения, сочетающиеся с глубокими изменениями, при которых нити гриба глубоко проникают в толщу мышечной ткани [10].
Клинические проявления и осложнения. Симптомы заболевания практически отсутствуют у 25-30% пациентов, страдающих КП, особенно у иммунокомпетентных лиц. Тем не менее большинство пациентов предъявляют жалобы, связанные с поражением желудочно-кишечного тракта. Наиболее типичные клинические проявления КП — дисфагия и несколько реже одинофагия. Степень выраженности пищеводных симптомов колеблется от умеренного затруднения при глотании до резко выраженной боли, результатом чего являются неспособность принимать пищу и развитие вторичной дегидратации. При тяжелой одинофагии возможно наличие других причин или коинфекции, особенно у больных со СПИДом. Гораздо реже больные могут жаловаться на загрудинные боли, не связанные с глотанием, изжогу, тошноту, иногда рвоту с выделением пленок (псевдомембран), снижение аппетита и веса, появление жидкого стула со слизью (см. рисунок) [4, 9, 29].
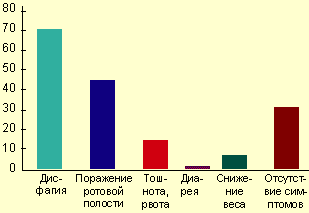 |
| Симптомы кандиозного эзофагита (R. S. Orlando, 1996) |
При КП может быть полезно физикальное исследование. Приблизительно две трети пациентов со
СПИДом и пищеводным кандидозом имеют кандидозный стоматит. КП наблюдается у больных с хроническим слизисто-кожным кандидозом, который относится к тяжелым формам кандидозной инфекции и чаще наблюдается при дисфункции надпочечников и околощитовидных желез [29].
Осложнения пищеводного кандидоза наблюдаются редко. Эзофагеальное кровотечение может наблюдаться при тяжелом течении болезни, сопровождающемся образованием эрозий, язв, и ассоциироваться с коагулопатией; возможно развитие перфорации. Описана вторичная обструкция просвета мицетомой. Редко возникает некроз с развитием флегмонозного воспаления пищевода и средостения [1]. В тяжелых случаях специфический эзофагит может осложниться развитием кандидамикозного сепсиса [6].
Диагностика. Подозрение на пищеводный кандидоз должно возникнуть у любого больного при наличии факторов риска развития пищеводной инфекции и жалоб на дисфагию и одинофагию. Наличие кандидозного стоматита подтверждает этот диагноз, но при его отсутствии поражение пищевода также не исключается.
Рентгенография пищевода с использованием бария обычно применяется для начальной оценки перед проведением эндоскопии. Однако на ранних стадиях кандидозного эзофагита рентгенологическое исследование пищевода не имеет большого диагностического значения, так как оно отражает лишь неспецифические изменения, общие для всех эзофагитов [2]. Классическими рентгенологическими признаками острого эзофагита, вызванного Candida spp., являются линейные или неправильной формы дефекты наполнения с четкими краями. При тяжелом течении кандидозного эзофагита происходит слияние повреждений, из-за чего большие дефекты наполнения иногда образуют скопления в виде гроздьев винограда [2]. Пищевод при этом приобретает «косматый» («ворсистый») вид, симулируя ульцерацию [25]. Наличие больших, хорошо очерченных язв не является признаком кандидозного эзофагита. Могут наблюдаться нарушение моторики и сужение просвета пищевода за счет псевдомембран. Следует помнить о том, что нормальная рентгенограмма пищевода с использованием бария не исключает пищеводного кандидоза. Из-за тяжелой одинофагии больной не сможет выпить барий, что затрудняет рентгеногрфию пищевода [29].
Более информативным для диагностики кандидозного эзофагита считается рентгенологический метод двойного контрастирования, эффективность которого достигает 70% [26].
Цитологическая щетка и баллонный катетер используются для быстрой диагностики пищеводных инфекций без эндоскопии. Эти инструменты могут быть легко введены через носовые ходы или рот сквозь защитный зонд, который предотвращает контаминацию. Материал, полученный на защищенной щетке или баллонном катетере после того, как они будут изъяты из пищевода, оценивается цитологически и культурально. Методика с использованием защищенных щеток имеет чувствительность 88% и специфичность почти 100% [26].
Цитологический метод предполагает окраску мазков-отпечатков или осадка смыва с цитологической щетки в поисках активных форм Candida — почкующихся дрожжевых клеток, псевдомицелия и мицелия. Культуральный метод предполагает помещение исследуемого материала на обогащенную глюкозой среду Сабуро или другие среды, чтобы затем по характеру образующихся колоний судить об этиологии инфекционного процесса в пищеводе.
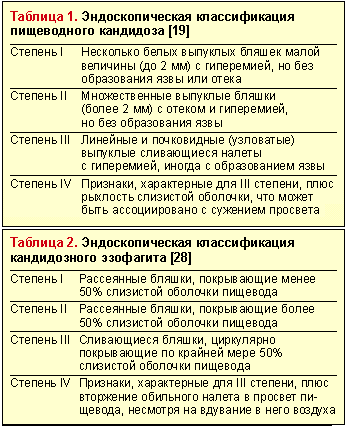
Эндоскопическое исследование пищевода — наиболее чувствительный и специфический метод диагностики пищеводного кандидоза. Эндоскопическая картина КП характеризуется чаще всего наличием легко снимающихся фибринозных рыхлых наложений белого или желтого цвета, под которыми обнаруживается легкоранимая и/или отечная слизистая. Реже наблюдаются катаральный и эрозивно-язвенный эзофагит [19]. Candida spp. редко вызывает истинное язвообразование. Наличие язвы при кандидозном эзофагите нередко служит признаком дополнительного патологического процесса в пищеводе [29]. Существуют различные эндоскопические классификации пищеводного кандидоза (табл. 1 и 2).
В ходе эндоскопии пораженные участки слизистой могут быть подвергнуты щеточной биопсии для цитологического исследования или биопсии для гистологической диагностики. Когда эндоскопически идентифицируются язвы, многократное проведение биопсии помогает исключить наличие сосуществующих патологических процессов. Цитологическое исследование материала, полученного с помощью браш-биопсии, имеет более высокую ступень чувствительности, чем гистологическое исследование образцов биопсии при умеренном поверхностном кандидозе, потому что микроорганизмы могут быть вымыты с поверхности ткани при обработке биопсийного материала [19]. В редких случаях позитивная цитология при наличии отрицательной гистологии указывает на то, что речь идет скорее о колонизации, чем об инфекции. При более тяжелом кандидозном поражении пищевода наибольшее диагностическое значение имеет гистологическое исследование биоптатов слизистой с использованием специальной окраски на нейтральные мукополисахариды по Шиффу PAS (ШИК-реакция) или по Gomori гексаметилентетрамином серебра. Только гистологическое исследование демонстрирует инвазию мицелия или псевдомицелия гриба в глубь ткани пищевода.
Кожное тестирование и серологические тесты малоинформативны для диагностики пищеводного кандидоза.
Лечение. Существует множество пероральных и внутривенных медикаментов, которые используются для лечения кандидозного эзофагита. Несмотря на относительно широкий выбор препаратов, лечение КП является актуальной проблемой, так как некоторые лекарственные средства недостаточно эффективны, другие имеют серьезные побочные эффекты; кроме того, в настоящее время отмечается рост резистентности к антигрибковым препаратам.
При лечении КП первоначально должна быть назначена пероральная терапия, внутривенное введение используется лишь в случае рефрактерного течения заболевания или если имеются противопоказания к пероральному использованию медикаментов. Больным с умеренной степенью тяжести заболевания и минимальным нарушением иммунитета необходим сокращенный курс терапии с использованием системных абсорбируемых лекарственных препаратов типа орального азола. Иммунокомпрометированных больных после трансплантации и больных СПИДом с КП лучше лечить более длинными курсами азола. У пациентов с гранулоцитопенией, когда имеется существенный риск диссеминации Candida инфекции, оправданно использование внутривенных препаратов системного действия (азолов, амфотерицина B) [29].
Арсенал современных противогрибковых средств достаточно широк. Для лечения пищеводного кандидоза используют антигрибковые препараты нескольких групп. Наиболее эффективны препараты из группы азола. Перорально используют невсасывающиеся азолы (клотримазол, миконазол); однако более эффективны препараты системного действия из этой группы (кетоконазол, флуконазол и итраконазол). Эти препараты, подобно другим из группы азола, изменяют проницаемость клеточной мембраны грибов посредством цитохром P450 (CYP)-зависимого вмешательства в биосинтез эргостерола, что приводит к повреждению грибной клетки и ее смерти. Новые триазолы (итраконазол и флуконазол) имеют большее аффинное подобие, чем имидазолы (миконазол и кетоконазол) для грибных CYP-энзимов [14]. Хотя другие средства, такие, как миконазол, клотримазол и нистатин, могут быть использованы для лечения кандидозного стоматита, а также для профилактики пищеводного поражения, эти лекарственные средства менее эффективны в качестве основной группы препаратов для терапии КП [24].
Клотримазол и миконазол — препараты имидазолового ряда. В настоящее время выпускаются клотримазол в таблетках и миконазол для перорального применения. Однако они не всасываются в желудочно-кишечном тракте. Эти препараты могут использоваться при легком кандидозном поражении пищевода у лиц без иммунодефицита.
Кетоконазол (низорал, ороназол) является производным имидазола и при ежедневном приеме в дозе от 200 до 400 мг дает хороший эффект в лечении пищеводного кандидоза. У больных СПИДом, которым обычно требуются более высокие дозы кетоконазола, дневная доза может быть увеличена, если не возникает тошноты, до максимальной (800 мг). Кетоконазол хорошо проникает в различные органы и ткани, но плохо — через гематоэнцефалический барьер. Препарат хорошо всасывается в желудочно-кишечном тракте, но для оптимального всасывания требуется кислая среда. При желудочной гипохлоргидрии и использовании антацидных средств его биодоступность уменьшается. Для улучшения всасывания кетоконазол следует принимать за 2 часа до приема противоязвенных препаратов. Приблизительно у 10-25% больных СПИДом наблюдается снижение желудочной кислотной секреции. Кетоконазол же может вызвать временную блокаду синтеза тестостерона и кортизола [6, 8, 29].
Итраконазол (споранокс) относится к группе триазолов, подобно кетоконазолу, назначается в дозе 200 мг в день. Дальнейшее увеличение дозы удлиняет период полураспада препарата и повышает его эффективность. Всасывание интраконазола уменьшается при снижении pH желудочного сока [23]. Кетоконазол и итраконазол метаболизируются в печени и выделяются с желчью. Период полураспада этих двух препаратов составляет от 7 до 10 часов и от 24 до 42 часов соответственно [14]. Коррекции дозы у больных с почечной недостаточностью не требуется.
Флуконазол (дифлюкан, дифлазон, форкан, флюкостат — отечественный флуконазол) представляет собой водорастворимый триазол и назначается в дозе 100 мг в день. Флуконазол — это препарат, всасывание которого не зависит от pH желудочного сока и который значительно более эффективен при лечении пищеводного кандидоза при СПИДе, чем кетоконазол (200 мг ежедневно) [21]. Флуконазол доступен для перорального и внутривенного применения. Он минимально метаболизируется и выделяется неизмененным с мочой. Флуконазол отличается высоким тканевым тропизмом и не влияет на синтез андрогенов, хорошо проникает через гематоэнцефалический барьер. В отличие от кетоконазола и интраконазола он хорошо растворим в воде и минимально связывается белком. Препарат обладает длительным периодом полураспада (приблизительно 30 часов, если не нарушена функция почек, а наличие пищи или гипохлоргидрия не изменяют всасывание), что позволяет принимать его один раз в сутки. Показано, что введение флуконазола улучшает иммунные показатели по Т- и В-системам [18]. И флуконазол, и итраконазол можно принимать перорально в виде растворов. Эти формы могут быть более эффективны, чем таблетки, потому как усиливают локальный эффект и улучшают всасывание.
Неблагоприятные воздействия кетоконазола, флуконазола и итраконазола прежде всего зависят от дозировки и проявляются в виде тошноты, гепатотоксичности, замедления продукции стероидов и метаболизма циклоспорина [14]. В редких случаях кетоконазол может вызывать фатальный гепатит [12]. Незначительное увеличение аминотрансфераз — общий побочный эффект для всех трех препаратов, однако это не должно служить оправданием для их отмены. Влияние на стероидогенез наиболее выражено у кетоконазола. Обратимое замедление гонадального и надпочечного синтеза стероидов под воздействием кетоконазола может наблюдаться, когда доза превышает 400 мг в сутки [27]. В рекомендуемых дозах флуконазол и итраконазол не влияют на стероидогенез. В результате воздействия на печеночные микросомальные ферменты все три азола ингибируют метаболизм циклоспорина, что приводит к увеличению уровня циклоспорина в крови; этот эффект наиболее ярко выражен у кетоконазола [14].
Новейшим классом противогрибковых препаратов являются кандины, вмешивающиеся в синтез грибковой стенки. Они эффективны в отношении большинства видов Candida, в том числе C. krusei. Первые исследования показали, что капсофунгин, представляющий эту группу препаратов, оказался столь же эффективен при КП, как и амфотерицин В [16].
При лечении больных КП следует учитывать наличие резистентности, которая из-за широкого применения азолов в настоящее время значительно возросла. При развитии резистентности часто бывает полезно увеличить дозу азола. Если этого оказывается недостаточно, переходят на другой препарат из этой группы или используют пероральный раствор итраконазола [13], который нужно назначать в более высоких дозах из-за часто наблюдающейся перекрестной резистентности. Когда высокой дозы (то есть 400 мг ежедневно) флуконазола недостаточно, переходят на внутривенное введение амфотерицина B, при этом результат достигается в 90% случаев. Резистентность к амфотерицину наблюдается редко [29].
В табл. 3 представлено лечение кандидозного эзофагита в зависимости от функции лимфоцитов и гранулоцитов.
При лечении кандидозного эзофагита у больных СПИДом препаратами первого ряда являются кетоконазол и флюконазол, причем предпочтение следует отдавать флюконазолу. Из-за лучшей переносимости он прежде всего показан пациентам, находящимся на поздней стадии болезни, которые имеют много сопутствующих заболеваний. При нарушении глотания могут применяться парентеральные формы флуконазола. При неэффективности препаратов первого ряда используют лекарственные средства из группы резерва (амфотерицин В, итраконазол), которые более токсичные и/или более дорогие. Этиотропная терапия кандидоза пищевода, кроме основного курса лечения, требует проведения поддерживающего лечения, которое может быть пожизненным (табл. 4) [4].
Лечение кандидоза на фоне тяжелого иммунодефицита и лейкопении — задача сложная. Наряду с антигрибковой терапией актуально восстановление пула нейтрофильных лейкоцитов и их функциональной активности, так как нейтрофильные лейкоциты являются одним из основных звеньев механизма защиты от Candida spp. Предлагается в качестве дополнительного средства при лечении кандидозной инфекции на фоне нейтропении использовать гранулоцитарный колониестимулирующий фактор, который сокращает дефицит миелопероксидазы в нейтрофильных лейкоцитах и усиливает их кислородозависимую антикандидозную активность [7]. Получен хороший эффект от эндоскопического введения больным КП концентрата гранулоцитов и высокоинтенсивного импульсного лазерного излучения, что улучшает иммунные функции [5].
Таким образом, для достижения успеха у больных с тяжелыми грибковыми инфекциями, в том числе с кандидозом, целесообразен комплексный подход к диагностике и лечению. Повышению выживаемости будет способствовать оперативная диагностика с последующими подбором эффективной специфической противогрибковой терапии и проведением лечебных мероприятий, направленных на повышение числа гранулоцитов и стимуляцию фагоцитоза [16].
По вопросам литературы обращайтесь в редакцию