Дилатация всех отделов сердца что это
Какие причины и признаки увеличенного сердца
Сердечно-сосудистые заболевания — одна из ведущих причин ранней инвалидности и смерти в мире. Особенно озабочены кардиологи мужским здоровьем, ведь по статистике мужчины в среднем живут на 13 лет меньше женщин. Одна из патологий — увеличенное сердце, или кардиомегалия. Этот дефект может указывать на развитие заболевания, но также является вариантом нормы. Например, у спортсменов сердце имеет большие размеры. Причины и последствия увеличенного сердца у взрослого — тема нашего сегодняшнего разговора. Игнорировать проблему не стоит, поскольку у такого явления могут быть серьезные осложнения.
Увеличено сердце: причины и последствия
Если человек долго занимался спортом и накачал сердечную мышцу, при завершении карьеры ему требуется реабилитация. Снижение физической активности должно проходить под наблюдением врача, хотя в данном случае и не идет речь о патологическом состоянии. Основная причина, почему увеличено сердце у женщины, беременность на позднем сроке или недавние роды. У беременных сердце может увеличиваться из-за увеличения объема циркулирующей крови. Такие причины возникают не из-за болезней. Однако, увеличение сердца может быть симптомом более серьезных заболеваний.
Причины увеличенного сердца у взрослого:
Кардиомегалия может быть неопасным состоянием, а тяжесть патологии зависит от того, какой отдел увеличен. Наибольшую опасность дефект представляет для мужчин и пожилых людей. Если по какой-либо причине сердце увеличено в размерах, особенно в течение длительного времени, возрастает риск сердечной недостаточности, от которой половина пациентов умирает в течение 5 лет. У пациентов с большим сердцем увеличивается вероятность тромбоза и обратного тока крови. Главная опасность кардиомегалии — риск внезапной сердечной смерти.
Признаки увеличенного сердца
В большинстве случаев кардиомегалия протекает бессимптомно. Со временем из-за того, что сердце не может эффективно перекачивать кровь, могут появиться следующие симптомы:
Симптомы неспецифичны и могут указывать на другое заболевание. Поэтому для дальнейшего прогноза важна качественная и своевременная диагностика.
Диагностика и лечение
Обследование позволяет установить причины, почему увеличено сердце, а также подобрать грамотное лечение. Иногда потребуется пожизненный прием медикаментов. Возможно, потребуется имплантация кардиостимулятора или кардиовертера-дефибриллятора (ИКД), операция на сердечном клапане и аортокоронарное шунтирование. Вид лечения подбирается индивидуально в зависимости от тяжести состояния и наличия дополнительных кардиологических проблем.
Диагностика поможет вовремя выявить причины, почему увеличено сердце у человека, а значит вовремя оказать необходимую помощь.
У некоторых людей кардиомегалия — это временное состояние, а кто-то может вести привычный образ жизни даже с увеличенным сердцем. Для других пациентов потребуется срочное лечение.
В целом же, с кардиомегалией нужно придерживаться здорового образа жизни:
Как бы банально ни звучало, но здоровый образ жизни был и остается лучшим средством профилактики сердечно-сосудистых заболеваний в любом возрасте. Конечно, не все проблемы можно решить только упражнениями и диетами, но вкупе с качественной медицинской помощью прогноз становится более благоприятным. Позаботьтесь о своем здоровье вместе с кардиологами из Чеховского сосудистого центра в Московской области. Здесь вы можете пройти диагностику и получить современное эффективное лечение.
Выраженная дилатация правого предсердиякак нетипичный дебют кардиомиопатии,вызванной нарушением в гене LMNA
Авторы: Е.В. Борисова, С.А. Глебова, П.С. Козлов, Е.П. Бурлаченко
АО «Кардиоклиника»; Кузнецовская, 25, Санкт-Петербург, 196105
Осмотр пациентки: С.А. Глебова, П.С. Козлов, Е.В. Борисова
Выполнение трансторакальной ЭХО-КГ С.А. Глебова, П.С. Козлов
Выполнение КТ сердца Е.П. Бурлаченко
Написание текста – С.А. Глебова, Е.В. Борисова, П.С. Козлов, Е.П. Бурлаченко
Редактирование – Е.В. Борисова
Мутация гена LMNA, который кодирует два главных ламиновых белка А и С, вызывает целый спектр болезней, называющихся ламинопатией и включающих в себя дилатационную кардиомиопатию, различные типы мышечных дистрофий, липодистрофию, акрогерию и прогерию. Поражение сердечной мышцы при мутациях в гене LMNA в зарубежной литературе описывается как ‘lamin A/C heart disease’. Типичное течение данного заболевания включает в себя следующие этапы: наджелудочковые экстрасистолы, наджелудочковые аритмии, патологию проводящей системы сердца, гипокинетическую кардиомиопатию без дилатации и дилатационную кардиомиопатию. Однако в ряде случаев симптомы могут появляться беспорядочно или в комбинации. Мы представляем случай поздней диагностики ламинопатии, проявившей себя кардиомиопатией, миопатией и парциальной семейной липодистрофией. Особенность кардиомиопатии в том, что при дилатации всех четырёх камер наиболее выражена дилатация правого предсердия. Генетический анализ выявил нарушения в нуклеотидной последовательности в генах LMNA, ANO5, MYPN.
Ключевые слова: ламинопатия, дилатационная кардиомиопатия, аритмии, семейная частичная липодистрофия.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Dilatation of the right atrium, as atypical debut of cardiomyopathy caused by lamin A/C (LMNA) mutation.
E.V. Borisova, S.A. Glebova, P.S. Kozlov, E.P.Burlachenko.
История изучения ламинопатий насчитывает уже 20 лет, однако широкий спектр её клинических проявлений часто приводит к несвоевременной диагностике. Ассоциация ламинопатий с высоким риском развития внезапной смерти достигает 46%, что требует пристального внимания клиницистов к данной проблеме [1].
Ядерная ламина это белковая «сетка», выполняющая функцию каркаса ядра клетки, определяющая его размер и форму. Она состоит из четырёх ламиновых белков: А, B1, B2, C, которые способны полимеризироваться и образовывать организованную сеть, лежащую в основе внутренней мембраны ядра в большинстве соматических клеток. Белки А и С кодируются геном LMNA, мутация которого вызывает целый спектр болезней, называющихся ламинопатией, и включающих в себя дилатационную кардиомиопатию, различные типы мышечных дистрофий, липодистрофий, акрогерию и прогерию [2].
В 1999 году французские учёные впервые выявили первые четыре разновидности мутаций в гене LMNA у пациентов, страдающих нейро-мышечной дистрофией Эмери-Дрейфуса. У всех этих пациентов наблюдалась характерная триада симптомов: ранние контрактуры сухожилий, мышечная слабость в плечевых и бедренных группах мышц и дилатационная кардиомиопатия (ДКМП) с нарушениями в проводящей системе сердца. Авторы сделали вывод, что мутации в ядерной ламине являются причиной наследственных мышечных заболеваний [4]. В этом же году американские учёные опубликовали работу, демонстрирующую 5 новых мутаций LMNA гена у 11 пациентов, страдающих мышечной дистрофией Эмери-Дрейфуса аутосомно-доминантного типа. Данные мутации авторы связали с дилатационной кардиомиопатией и поражением проводящей системы сердца у этих пациентов [5]. На сегодняшний день известно несколько сотен мутаций в данном гене.
Заболевания сердца, связанные с патологией ламина А/С относятся к злокачественным, так как проявляются сердечной недостаточностью, часто требующей трансплантации сердца, желудочковыми аритмиями, нарушения проводящей системы, а также сопряжены с высоким риском внезапной смерти [7]. Несмотря на то что болезни сердца, связанные с патологией ламина А/С протекают тяжело и у мужчин, и у женщин, более злокачественные фенотипы и более тяжёлые исходы описаны у мужчин [lamin heart].
Считается, что 10% всех ДКМП обусловлены мутацией в гене LMNA. Поэтому эксперты выделили «красные флаги», которые указывают на генетическую причину заболевания. Например:
Липодистрофия, характерная для мутации в гене LMNA представляет собой семейную частичную липодистрофию типа 2. При данной форме липодистрофии у пациентов нормальное распределение жировой ткани в детстве, а в периоде пубертата жировая ткань исчезает с туловища и конечностей и накапливается области лица и шеи [9].
Пациентка, 28 лет. Жалоб не предъявляла. При плановом профилактическом осмотре было выявлено увеличение тени сердца, в связи с чем рекомендовано выполнение ЭХО-КГ и консультация кардиолога.
При объективном осмотре обращал внимание низкий процент жировой ткани в области туловища и конечностей, выраженная рельефность мускулатуры при незначительном снижении мышечной силы, «широкая шея» (за счёт выраженной аккумуляции жировой ткани в данной области). Складывалось впечатление о псевдогипертрофии мышц плечевого пояса и голеней (рис 1,2). АД 110/70 мм рт ст. ЧСС 48 ударов в минуту. Тоны сердца звучные, слабый систолический шум у основания мечевидного отростка. Дыхание везикулярное, хрипы не выслушиваются. При детальном расспросе пациентка сообщила, что рельефность мускулатуры и редкий пульс отмечается у неё с подросткового возраста. По данному поводу обращались к педиатру, патологии выявлено не было.
Псевдогипертрофия мышц голени.
Типичное перераспределение жировой ткани, аккумуляция в области шеи.
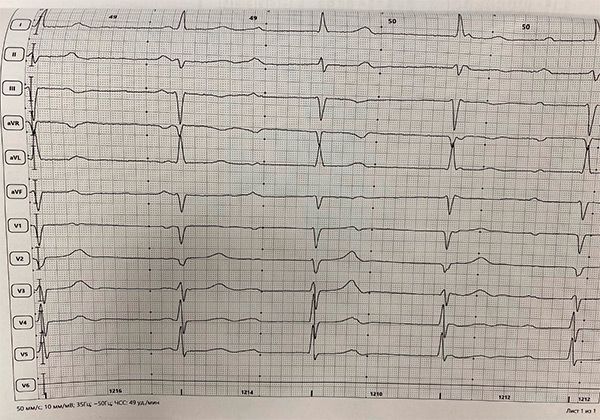
АВ-блокада 3 ст с ЧЖС 49 в минуту.
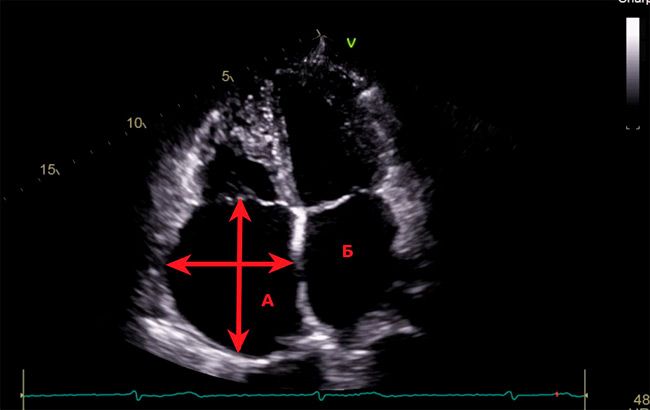
При выполнении ЭХО-КГ было выявлено значительное увеличение правого предсердия (86х75 мм, 190 мл), умеренное увеличение левого предсердия (передне-задний размер 45 мм), умеренное увеличение правого желудочка, трикуспидальная регургитация 2 степени (рисунок 4). Расчётное давление в ЛА 45 мм рт. ст. Размеры ЛЖ находились на верхней границе нормы. Глобальная сократительная способность ЛЖ сохранена. Митральная регургитация физиологическая. Патологические потоки через межжелудочковую и межпредсердную перегородки не визуализировались. Для уточнения диагноза была проведена компьютерная томография (КТ) сердца.
Эхокардиография, 4-х камерная проекция. Выраженная дилатация правого предсердия (86х75 мм). А-правое предсердие. Б-левое предсердие.
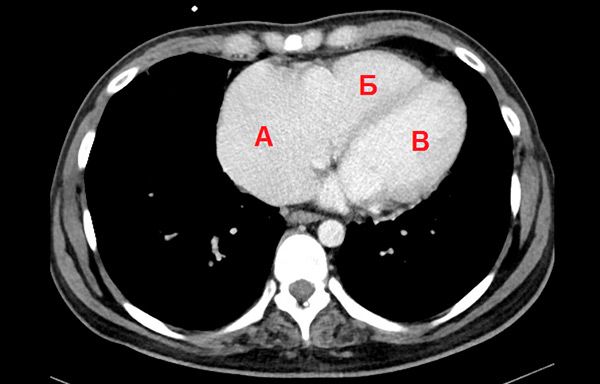
На КТ сердца было подтверждено увеличение правого предсердия, его относительные размеры 85х78х93 мм. Остальные камеры увеличены, однако умерено относительно правого предсердия (рис. 5).
КТ грудной клетки, аксиальная проекция. А-правое предсердие, Б –правый желудочек, В-левый желудочек.
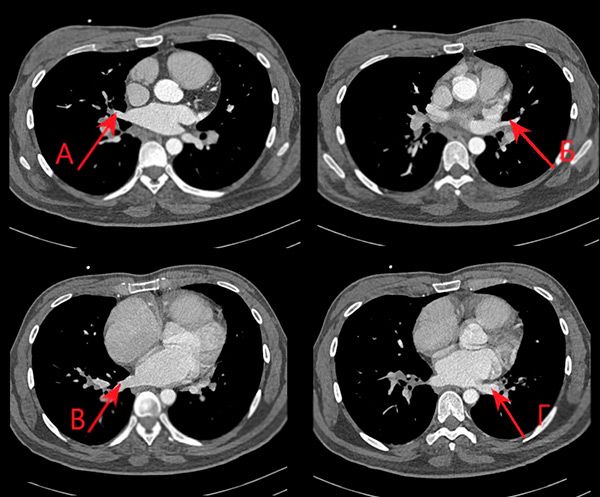
Данных за аномалии лёгочных вен не получено (рис. 6). Для исключения сообщения между полостями сердца был рассчитан показатель Qp-Qs, методом гибридной визуализации. Данный параметр оказался равен 1, что позволило исключить наличие внутрисердечного шунта. Размеры выходных трактов аорты и лёгочной артерии были определены с помощью КТ сердца. Интегралы линейных скоростей через клапаны были получены доплеровским методом при ЭХО-КГ.
КТ грудной клетки, аксиальная проекция. А-правая нижняя лёгочная вена, Б-левая нижняя лёгочная вена, В правая верхняя лёгочная вена, Г-левая верхняя лёгочная вена.
В биохимическом анализе крови было выявлено повышение КФК до 1521 ЕД/л. При проведении МРТ выявлено увеличение обоих желудочков с сохранением их сократительной способности (КДО ЛЖ 213 мл, КСО ЛЖ 95 мл, ФВ ЛЖ 56%, КДО ПЖ 254 мл, КСО ПЖ 128 мл, ФВ ПЖ 50%). Заключение: МР признаки дилатации всех камер сердца, наиболее выражено правого предсердия. Дополнительно пациентке была выполнена липидограмма, в которой не было выявлено нарушений. В связи с сочетанием идиопатического увеличения правых камер сердца с АВ блокадой 3 степени, с патологией мышц, с нарушением распределения жировой ткани пациентка была направлена на консультацию к генетику. При генетическом анализе были выявлены нарушения в нуклеотидной последовательности в генах LMNA, ANO5, MYPN. Кардиомиопатия, обусловленная мутациями ядерного гена ламина (LMNA), часто ассоциирована с нарушениями сердечного ритма, проводимости и различными скелетно-мышечными расстройствами. Мутации в гене ANO5 служат причиной развития поясно-конечностных мышечных дистрофий. Мутации в гене MYPN являются причиной миопатий. Пациентка была направлена на консультацию к аритмологу для решения вопроса о постановке ЭКС.
Особенностью данного случая является выраженное расширение правого предсердия, при умеренном увеличении остальных камер сердца.
Какие признаки увеличенного сердца и чем это опасно
Кардиомегалия — это состояние, при котором по той или иной причине сердце увеличивается в размерах. Большое сердце может быть вариантом нормы. К примеру, у спортсменов, занятых физическим трудом или беременных сердце перекачивает большие объемы крови. После родов, ухода из большого спорта, смены трудовой деятельности размеры постепенно возвращаются к нормальным показателям. Если этого не происходит, пациенту потребуется консультация кардиолога и, возможно, лечение. Проблема может быть врожденной (чаще обнаруживается у детей) и приобретенной — от такого состояния страдают взрослые.
Почему увеличено сердце?
Увеличение размеров сердца отмечается как на фоне сердечно-сосудистых заболеваний, так и из-за болезней, никак не связанных с кровеносной системой. Причины и последствия увеличенного сердца у взрослого:
Причины увеличения сердца могут быть различны, но такое состояние рано или поздно приводит к сердечной недостаточности, которая достаточно опасна. От сердечно-сосудистых заболеваний гибнет больше людей, чем от других болезней, например, онкологии. Проблемы с кровообращением могут привести к сердечному приступу и инсульту, инвалидизации человека. Еще одна угроза — разрастание соединительной ткани, что ведет к снижению эластичности стенок и атрофии мышцы. В группе риска люди преклонного возраста, но это не означает, что молодежи не нужно проходить периодическое обследование.
Признаки увеличенного сердца
На первых порах кардиомегалия протекает без выраженных клинических проявлений. Человек может долгое время вообще не знать о проблеме, а патологию часто обнаруживают случайно, например, на рентгене или флюорографии. Обследуйтесь, если вы входите в группу риска — опасность гипертрофии сердца в том, что она может долгие годы не давать о себе знать и обнаруживается, когда мышца уже достаточно повреждена.
О заболевании сердечной мышцы могут свидетельствовать следующие симптомы:
Синдром «бычьего сердца» хорошо диагностируется кардиологами, но на выяснение причин, вызвавших патологию, может уйти время. Могут понадобиться обследования других органов — щитовидной железы, почек, печени, легких, иммунной системы.
Диагностика, профилактика, лечение
Хотя осложнения кардиологических патологий весьма опасны, в действительности большинство ССЗ можно предотвратить с помощью профилактики. Даже если человек уже заболел, тяжелых последствий можно избежать. Благодаря современному лечению можно затормозить болезнь на ранней стадии и не допустить необратимых последствий.
Физиологическая гипертрофия — это временное состояние: чаще всего спортсменам или людям физического труда требуется обычное наблюдение. Патологически гипертрофированное сердце нуждается в лечении, которое подбирается в зависимости от причин кардиомегалии. Если проблема в сердечных клапанах, проводят операцию и протезирование. АГ, болезни почек и органов дыхания лечат медикаментами. При риске образования тромбов назначают антитромботические препараты. Таким образом, какой-то единой терапии не существует, ведь причины патологии могут быть совершенно разными.
Заниматься самолечением при кардиомегалии бессмысленно, а порой и вредно. Без специальных обследований установить причину патологии невозможно: человек может думать, что осложнение связано с сердцем, а в действительности корни проблемы могут крыться в почках или другом органе. Но пациент может сделать свою жизнь лучше с помощью мер профилактики: умеренных физических нагрузок, контроля давления, коррекции питания, избавления от вредных привычек. Для постановки диагноза делают:
В Октябрьском сосудистом центре республики Башкортостан можно пройти необходимую диагностику, получить консультацию и лечение у профессионалов. В центре пациентам оказывают всестороннюю помощь и обнаруживают признаки гипертрофии уже на первом осмотре. Врачи назначают только необходимый объем исследований, по результатам которых ставят диагноз и подбирают адекватную терапию.
Дилатационная кардиомиопатия
Термин “кардиомиопатии” (КМП) предложен W. Brigden в 1957 г. для обозначения первичных поражений миокарда неизвестной этиологии, вызывающих нарушение функции сердца и не являющихся следствием заболеваний коронарных артерий, клапанного аппарата, перикарда, системной или легочной гипертензии, поражения проводящей системы сердца. Основным критерием отграничения КМП от других поражений миокарда считался признак “неизвестности” происхождения этих заболеваний.
Больные с ДКМП составляют от 26 до 60% всех больных с кардиомиопатиями. Несмотря на то, что ДКМП считается «диагнозом исключения», имеются сообщения о связи ДКМП с гипертензией, приемом агонистов b-адренергических рецепторов или умеренным потреблением алкоголя. Поскольку дилатация и дисфункция желудочков могут возникать вследствие множества приобретенных или наследственных нарушений, большое прогностическое значение имеет дифференциация идиопатической формы заболевания от вторичных и потенциально обратимых форм поражения миокарда.
Что провоцирует / Причины Дилатационной кардиомиопатии:
В последнее десятилетие в большинстве случаев этиологию ДКМП установить не удается (идиопатическая форма ДКМП). Примерно у 20% больных заболевание ассоциируется с перенесенным ранее инфекционным миокардитом. Считают, что воздействие на миофибриллы персистирующих в организме инфекционных агентов (в первую очередь энтеровирусов), в том числе включение вирусной РНК в генетический аппарат кардиомиоцитов или влияние “запущенного” вирусами аутоиммунного процесса, ведет к повреждению митохондрий и нарушению энергетического метаболизма клеток. При использовании полимеразной цепной реакции (ПЦР) у части больных удается выявить присутствие вирусов Коксаки В, вируса гепатита С, герпеса, цитомегаловируса. У части обнаруживаются высокие титры кардиоспецифических аутоантител к миозину тяжелых цепей, актину, тропомиозину, митохондриальной мембране кардиомиоцитов, увеличение цитокинов в крови. Это подчеркивает роль аутоиммунных нарушений. Больные с аутоиммунным дефицитом в большей степени подвержены повреждающему воздействию вирусов и развитию ДКМП.
В происхождении ДКМП большое значение имеет также генетическая предрасположенность к возникновению заболевания. Семейные ДКМП встречаются примерно в случаев заболевания. Для них характерно аутосомно-доминантное наследование. У части больных ДКМП обнаруживаются также гаплотипы НLА В27 и НLА DR4. Имеются данные о неблагоприятном воздействии алкоголя на миокард: нарушение синтеза сократительных белков кардиомиоцитов, повреждение митохондрий, нарушение энергетического метаболизма клеток, критическое снижение сократительной способности миокарда, расширению полостей сердца и формированию ДКМП.
В генезе ДКМП имеет значение взаимодействие нескольких факторов: генетической предрасположенности к возникновению заболевания; воздействия экзогенных факторов (вирусная инфекция, алкоголь) и аутоиммунных нарушений. Если на начальных стадиях развития ДКМП в ряде случаев удается подтвердить вторичную природу поражения сердца (наличие вирусной инфекции), то на поздних стадиях клиническая картина уже мало зависит от возможных пусковых механизмов болезни. На практике в большинстве случаев конкретные причины остаются невыясненными и ДКМП трактуется как идиопатическая форма заболевания, удовлетворяющая традиционным критериям КМП по J. Goodwin.
Патогенез (что происходит?) во время Дилатационной кардиомиопатии:
В результате воздействия перечисленных выше и некоторых других снижение энергетического метаболизма клеток и уменьшение количества нормально функционирующих миофибрилл. Это ведет к прогрессирующему уменьшению сократительной способности миокарда и насосной функции сердца. В результате снижения инотропной функции миокарда происходит дилатация полостей сердца, которая, согласно механизму Старлинга, в течение некоторого времени поддерживает УО и ФВ на достаточном уровне. Одновременно развивающаяся тахикардия (активация САС) также способствует сохранению сердечного выброса (МО, СИ). Однако такая компенсация весьма невыгодна с энергетической точки зрения, поскольку согласно закону Лапласа, для создания адекватного давления в полости желудочка дилатированная стенка ЛЖ должна развивать значительно большее внутримиокардиальное напряжение.
Следствиями такого прогрессирующего увеличения постнагрузки являются: развитие компенсаторной гипертрофии миокарда желудочков, которая способствует некоторому снижению внутримиокардиального напряжения; увеличение потребности миокарда в кислороде, которое со временем ведет к развитию относительной коронарной недостаточности и ишемии миокарда; дальнейшее повреждение кардиомиоцитов и еще большее снижение сократимости; развитие диффузного и очагового кардиофиброза.
В результате происходит снижение насосной функции сердца, повышается КДД в желудочках и развивается выраженная миогенная дилатация полостей сердца. Эти явления усугубляются развитием относительной недостаточности митрального и трехстворчатого клапанов, что способствует еще большей дилатации предсердий и желудочков. Формируется и быстро прогрессирует ХСН с преимущественным нарушением систолической функции желудочков, застоем крови в малом и большом кругах кровообращения, падением сердечного выброса и нарушением перфузии периферических органов и тканей.
Значительное увеличение массы сердца за счет гипертрофии миокарда обычно не сопровождается заметным утолщением стенки желудочков, поскольку при ДКМП всегда преобладает выраженная дилатация камер сердца, которая как бы нивелирует увеличение мышечной массы. Важное значение в ремоделировании сердечной мышцы и развитии сердечной декомпенсации имеет чрезмерная активация нейрогормональных систем организма, в том числе САС, РААС, АДГ, тканевых РАС и эндотелиальных факторов.
В результате активации этих систем происходит задержка Nа+ и воды в организме, что усугубляет застойные явления в малом и большом кругах кровообращения. Повышенное содержание катехоламинов, ангиотензина II, цитокинов, фактора роста опухолей, тромбоксана приводит к еще большему повреждению миокарда, периферической вазоконстрикции, а также к значительным нарушениям свертывающей и фибринолитической систем крови.
Симптомы Дилатационной кардиомиопатии:
КЛАССИФИКАЦИЯ
По классификации J. Goodwin (1989) различают 3 группы КПМ: 1. Дилатационная КМП (ДКМП) характеризуется значительной дилатацией камер сердца, систоло-диастолической дисфункцией миокарда и отсутствием выраженной гипертрофии сердечной мышцы. 2. Гипертрофическая КМП (ГКМП) отличается значительной, чаще асимметричной, гипертрофией миокарда левого и/или правого желудочков, отчетливым преобладанием диастолической дисфункции миокарда и отсутствием дилатации полостей сердца. 3. Рестриктивная КМП (РКМП) характеризуется нарушением диастолического наполнения ЛЖ и/или ПЖ, уменьшением их объема, нормальной или почти нормальной систолической функцией.
В 1995 г. экспертами ВОЗ и Международного общества кардиологов рекомендовано использовать термин “кардиомиопатия” для всех случаев поражения миокарда, ассоциированных с нарушением его функции. Согласно этой классификации ВОЗ выделяют 6 групп КМП: ДКМП; ГКМП; РКМП; аритмогенная дисплазия ПЖ; специфические КМП; неклассифицируемые КМП (таблица 37).
Таблица 37. Классификация кардиомиопатий (ВОЗ, 1995)
Приведенная классификация несовершенна. Во-первых, термин “кардиомиопатия” предлагается использовать для обозначения неограниченного количества заболеваний сердца известной и неизвестной этиологии, для которых характерно поражение миокарда, ассоциированное с нарушением его функции. Это приводит к неоправданно широкому употреблению понятия “кардиомиопатия” и полной утрате его нозологической самостоятельности. Во-вторых, вызывает большие сомнения правомочность включения в группу “специфических КМП” так называемых “ишемической”, “гипертензивной”, “клапанной” кардиомиопатий, которые на самом деле представляют собой лишь последствия известных заболеваний сердечно-сосудистой системы (ИБС, АГ, пороков сердца), осложненных сердечной недостаточностью и/или дисфункцией желудочков.
В рекомендациях ВОЗ упоминается, что к этим вариантам специфических КМП отнесены те случаи заболевания, при которых выраженность нарушений функции сердца не соответствует степени нарушений коронарного кровотока, клапанных поражений, уровню АД. На практике решить вопрос о таком соответствии или несоответствии в большинстве случаев довольно сложно.
Делатационная кардиомиопатия манифестирует чаще в возрасте 20-50 лет, однако встречается у детей и пожилых людей. Наиболее частым клиническим проявлением является СН (75-85%). При этом в момент установления диагноза у 90% пациентов определяется уже III–IV ФК ХСН по NYHA. Доминирует симптоматика левожелудочковой СН – снижение переносимости физической нагрузки, прогрессирующая одышка, вплоть до ортопноэ и сердечной астмы. Основные жалобы пациентов обычно на одышку при нагрузке (86%), сердцебиение (30%), периферические отеки (29%). Бессимптомная кардиомегалия выявляется у 4–13% больных. С прогрессированием заболевания симптоматика СН появляется у 95% больных.
Современная клиническая картина ДКМП проявляется тремя основными синдромами: 1. Систолической ХСН (левожелудочковой или бивентрикулярной) с признаками застоя крови в малом и большом кругах кровообращения. 2. Частым возникновением нарушений ритма и проводимости (желудочковые аритмии, фибрилляция предсердий, АВ-блокады и блокады ножек пучка Гиса). 3. Тромбоэмболическими осложнениями (ТЭЛА и эмболия в артерии большого круга кровообращения). Клинические проявления ДКМП и результаты инструментально-лабораторных исследований неспецифичны, что затрудняет дифференциальный диагноз. Поэтому диагноз ДКМП ставится методом исключения других заболеваний сердца с систолической дисфункцией желудочков (ИБС, АГ, миокардит, легочное сердце.
Жалобы
Заболевание длительное время может протекать бессимптомно, несмотря на наличие объективных (эхокардиографических) признаков дилатации желудочков и нарушения их функции. Обычно первые клинические проявления болезни связаны с сердечной декомпенсацией, застоем крови в малом, а затем и в большом кругах кровообращения и снижением сердечного выброса. Больные жалуются на одышку при физической нагрузке и в покое, усиливающуюся в горизонтальном положении больного (ортопноэ). В далеко зашедших случаях возникают приступы удушья, чаще развивающегося по ночам (сердечная астма и отек легких).
Характерна быстрая утомляемость, мышечная слабость, тяжесть в ногах при выполнении физических нагрузок. Признаки правожелудочковой недостаточности (отеки ног, тяжесть в правом подреберье, увеличение живота в объеме, диспептические явления) появляются позже. Примерно у половины больных развиваются разнообразные нарушения ритма и проводимости, часть которых вызывает у больных ДКМП неприятные ощущения (сердцебиения, перебои в работе сердца, приступы пароксизмальной тахикардии и мерцательной аритмии). Наиболее тяжелыми осложнениями являются тромбозы и тромбоэмболии, развивающиеся у 20% больных ДКМП. Наиболее часто эти осложнения возникают у больных с фибрилляцией предсердий. Иногда больные ДКМП отмечают боли в области сердца, которые в большинстве случаев отличаются от типичных приступов стенокардии. Боли часто имеют атипичную локализацию и не связаны с физической нагрузкой.
Физикальное исследование
Физикальные данные, получаемые при обследовании больных ДКМП, неспецифичны. При общем осмотре выявляются признаки СН: акроцианоз, отеки ног, положение ортопноэ, увеличение живота в объеме, набухание шейных вен, иногда положительный венный пульс. При исследовании легких в нижних отделах могут выслушиваться влажные мелкопузырчатые хрипы. Отмечается увеличение печени, появляются признаки сердечной кахексии.
Осмотр, пальпация, перкуссия сердца
Аускультация сердца
Превый тон на верхушке ослаблен. При развитии легочной гипертензии определяется акцент и расщепление II тона. Нередко на верхушке выслушивается протодиастолический ритм галопа (за счет появления III патологического тона), что связано с выраженной объемной перегрузкой желудочков. Характерны систолические шумы на верхушке и в точке выслушивания трехстворчатого клапана, которые указывают на формирование относительной недостаточности митрального и трикуспидального клапанов. При возникновении фибрилляции предсердий или экстрасистолии тоны сердца аритмичные. Специфических изменений артериального пульса нет.
Таблица 38. Предикторы смертности у больных ДКМП
Пятилетняя выживаемость больных ДКМП составляет 60-76%. Более благоприятный прогноз у женщин с ДКМП и I-III ФК СН, а также у пациентов относительно молодого возраста. В последние годы продолжительность жизни этих пациентов значительно увеличилась. С помощью комплексной терапии ингибиторами АПФ, блокаторами b-адренергических рецепторов, диуретиками удается продлить жизнь некоторых больных ДКМП до 8-10 лет. Трансплантация сердца существенно улучшает прогноз. После операции десятилетняя выживаемость достигает 70-80%.
Диагностика Дилатационной кардиомиопатии:
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Электрокардиография
Электрокардиографическое исследование не позволяет выявить специфические особенности электрического поля сердца, характерные для ДКМП. На ЭКГ обычно определяются: признаки гипертрофии ЛЖ и ЛП, иногда в сочетании с гипертрофией ПЖ. Особенно характерна депрессия сегмента RS–Т в левых грудных отведениях (V5 и V6) и отведениях I и аVL; признаки блокады левой ножки пучка Гиса (частая находка); фибрилляция предсердий и/или другие нарушения ритма сердца; удлинение интервала Q–Т. В ряде случаев на ЭКГ можно выявить признаки крупноочагового или трансмурального рубца миокарда в виде патологических зубцов Q и комплекса QS. Эти изменения отражают характерное для ДКМП развитие очагового фиброза миокарда ЛЖ.
Эхокардиография
ЭхоКГ является наиболее информативным неинвазивным методом исследования больных ДКМП. Во многих случаях эхокардиографическое исследование позволяет впервые выдвинуть диагностическую концепцию ДКМП, оценить степень нарушений систолической и диастолической функций желудочков, а также доказать отсутствие клапанных поражений, заболеваний перикарда. Наиболее характерными эхокардиографическими признаками ДКМП являются значительная дилатация ЛЖ при нормальной или уменьшенной толщине его стенок и снижение ФВ (ниже 30-20%). Часто отмечается расширение других камер сердца (ПЖ, ЛП).
Развиваются тотальная гипокинезия стенок ЛЖ, значительное снижение скорости кровотока в восходящем отделе аорты и выносящем тракте ЛЖ и в легочной артерии (допплеровский режим). Нередко визуализируются внутрисердечные пристеночные тромбы. В некоторых случаях при ДКМП можно обнаружить региональные нарушения сократимости ЛЖ, аневризму верхушки ЛЖ. Это затрудняет дифференциальную диагностику этого заболевания с ИБС. Исследование в двухмерном и допплеровском режимах позволяет выявить признаки относительной недостаточности митрального и трехстворчатого клапанов без деформации их створок.
Рентгенография
Рентгенологическое исследование позволяет визуализировать следующие изменения: признаки кардиомегалии; сглаженность контуров левых отделов сердца; шаровидную форму сердца за счет дилатации всех полостей (в тяжелых случаях); признаки венозной и артериальной легочной гипертензии и расширение корней легких.
Коронароангиография и вентрикулография
Эти инвазивные методы исследования используются в тех случаях, когда возникает необходимость проведения дифференциальной диагностики ДКМП и ИБС при решении вопроса о хирургическом лечении. У больных ДКМП отсутствует гемодинамически значимое сужение КА, определяются повышение показателей КДО и резкое снижение ФВ. Иногда можно выявить нарушения локальной сократимости миокарда ЛЖ.
Эндомиокардиальная биопсия
Проводится в специализированных медицинских центрах. Метод позволяет оценить степень разрушения мышечных филаментов в биоптате, что имеет прогностическое значение.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Диагностика ДКМП начинается после выявления дилатации ЛЖ сердца с низкой систолической функцией у пациента, который обращается с жалобами на одышку, отеки и слабость. Данные анамнеза, аускультативная картина, рентгенологическое исследование и эхокардиограмма (ЭхоКГ) чаще всего сразу позволяют исключить определенный круг причин дилатации и СН (аневризму ЛЖ сердца, АГ, злоупотребление алкоголем, приобретенные и врожденные пороки сердца). Сбор семейного анамнеза помогает в диагностике наследственных кардиомиопатий, однако при бессимптомных нарушениях выявить больных родственников возможно только с помощью ЭхоКГ.
Электрокардиограмма может оставаться нормальной или отражать лишь неспецифические нарушения реполяризации. Нарушения проводимости встречаются почти у 80% больных и включают атрио-вентрикулярную блокаду I степени, блокаду левой ножки пучка Гиса, блокаду передней левой ветви и неспецифические нарушения внутрижелудочковой проводимости. Блокада правой ножки пучка Гиса встречается реже.
Нарушения проводимости чаще наблюдаются у больных с длительно текущим заболеванием и свидетельствуют о нарастании интерстициального фиброза и гипертрофии кардиомиоцитов. Часто встречаются также признаки гипертрофии ЛЖ, комплексы типа QS в отведениях, отражающих потенциал передней стенки, и отсутствие нарастания амплитуды зубца R в грудных отведениях. Мерцание предсердий, плохо переносимое больными, развивается почти у 20% пациентов, однако это не является свидетельством плохого прогноза. Наиболее широко используемой неинвазивной методикой является ЭхоКГ. Она позволяет выявить дилатацию ЛЖ, оценить толщину его стенок и их сократимость.
Нарушение сократимости является обязательным симптомом ДКМП, обычно диагноз устанавливается при снижении ФИ ниже 45%. Хотя обычным при ДКМП является глобальное нарушение сократимости, почти у 60% больных выявляются сегментарные дисфункции ЛЖ. Более благоприятный прогноз имеется у больных с более выраженным сегментарным, чем тотальным поражением. Дилатация предсердий также встречается часто, однако имеет меньшее значение, чем дилатация желудочков. Внутриполостные тромбы чаще всего выявляются в верхушке ЛЖ. Хотя ДКМП в основном является диффузным процессом, некоторые авторы наблюдали 10-15% больных с изолированной дисфункцией ЛЖ без вовлечения правого. В такой ситуации необходимо в первую очередь исключить коронарный генез дилатации. Допплеровское исследование позволяет выявить умеренную митральную или трикуспидальную регургитации, не слышные при аускультации.
Сцинтиграфия миокарда с 99mТс позволяет количественно оценить систолическую и диастолическую функции ЛЖ и используется в ситуациях, когда проведение ЭхоКГ невозможно (плохое ультразвуковое окно). Нет необходимости проводить катетеризацию полостей сердца всем пациентам, тем более нет необходимости в проведении нескольких последовательных исследований. Катетеризация правых отделов используется для подбора терапии у больных с тяжелым течением заболевания, но исходная оценка гемодинамики перед началом лечения показана редко.
Низкая диагностическая ценность эндомиокардиальной биопсии делает необходимым переосмысление значения этой процедуры. Проведение эндомиокардиальной биопсии необходимо при наличии дисфункции миокарда и системного заболевания, поражающего миокард и поддающегося специфическому лечению (саркоидоз, эозинофилия). Ценность этого метода может возрасти, когда будут внедрены новые технологии диагностики ДКМП на субклеточном и молекулярном уровнях.
Чаще всего сложности возникают при исключении ИБС и миокардита, как причин дилатации ЛЖ. Данные анамнеза и клиническая картина дилатационной кардиомиопатии зачастую имеют сходство со стенокардией, ЭКГ изменения (наличие патологических зубцов Q) не позволяют исключить постинфарктные изменения. Поэтому в сомнительных случаях больным с СН и дилатацией ЛЖ сердца показана коронарография, поскольку реваскуляризация при наличии стенозов коронарных артерий может привести к восстановлению систолической функции.
Недавно перенесенное вирусное заболевание, особенно сопровождавшееся миалгиями или перикардитом, позволяет предположить главенствующую роль миокардита. Однако дифференциальный диагноз дилатационной кардиомиопатии и хронического рецидивирующего миокардита (воспалительной кардиомиопатии) не всегда прост. Более редкой причиной дилатации ЛЖ и снижения его систолической функции является длительно существующая аритмия с частым ритмом сокращения желудочков (кардиомиопатия, индуцированная тахикардией). Дифференциально-диагностическим критерием является восстановление систолической функции ЛЖ и полная обратимость его дилатации после восстановления синусового ритма или контроля ЧСС.
Лечение Дилатационной кардиомиопатии:
Лечение больных ДКМП является в настоящее время трудной задачей. Поскольку причину заболевания установить не удается, патогенетическая терапия больных должна быть направлена на коррекцию ХСН; лечение и профилактику аритмий; лечение и профилактику тромбоэмболических осложнений. Больные ДКМП рефрактерны к лечению инотропными средствами, которые не приводят к уменьшению клинических проявлений ХСН, способствуют возникновению сердечных аритмий.
Консервативное лечение
Лечение ХСН у больных ДКМП основано на определенных принципах. Ограничение физических нагрузок, потребления поваренной соли, особенно при наличии отечного синдрома. Ингибиторы АПФ являются средством первого выбора в лечении больных ДКМП. Назначение этих препаратов (при отсутствии противопоказаний) целесообразно на всех стадиях развития болезни, даже при отсутствии выраженных клинических проявлений ХСН. Ингибиторы АПФ способны предупреждать некроз кардиомиоцитов, развитие кардиофиброза; способствуют обратному развитию гипертрофии, снижают величину постнагрузки (внутримиокардиальное напряжение), уменьшают степень митральной регургитации, давление в ЛП и секрецию ПНУФ.
В-адреноблокаторы целесообразно комбинировать с ингибиторами АПФ. Особенно показаны b-адреноблокаторы у больных со стойкой синусовой тахикардией, а также у пациентов с мерцательной аритмией. У больных ДКМП b-адреноблокаторы используются не только как средство профилактики и лечения нарушений сердечного ритма и контроля ЧСС, но и как препараты, оказывающие влияние на гиперактивированные САС и РААС. Их действие на эти системы сопровождается улучшением гемодинамики, уменьшением ишемии миокарда и повреждения кардиомиоцитов. В-адреноблокаторы улучшают качество жизни, прогноз и выживаемость больных ДКМП. Используют любые b-адреноблокаторы (метопролол, бисопролол, атенолол, карведилол).
Лечение начинают с малых доз препаратов, постепенно увеличивая их до максимально переносимых. У части больных в первые 2–3 недели лечения b-адреноблокаторами могут наблюдаться уменьшение ФВ, УО и некоторое ухудшение состояния, что связано преимущественно с отрицательным инотропным действием этих препаратов. Однако у большинства таких больных со временем начинают преобладать положительные эффекты b-адреноблокаторов, обусловленные стабилизацией нейрогормональной регуляции кровообращения, восстановлением плотности b-адренорецепторов на клеточных мембранах кардиомиоцитов и уменьшением кардиотоксического действия катехоламинов. Постепенно возрастает ФВ и уменьшаются клинические проявления ХСН.Применение b-адреноблокаторов при ДКМП требует осторожности, особенно у больных ХСН III–IV ФК по NYHА, хотя принципиально они не противопоказаны и при тяжелой декомпенсации.
Сердечные гликозиды показаны больным с постоянной формой мерцательной аритмии. В этих случаях положительные эффекты сердечных гликозидов (уменьшение ЧСС) объясняются не положительным инотропным действием этих препаратов, а их ваготропным действием, проявляющимся увеличением рефрактерных периодов АВ-узла и замедлением проведения электрического импульса по АВ-соединению. В результате тахисистолическую форму мерцательной аритмии удается перевести в нормосистолическую, что улучшает процессы диастолического наполнения ЛЖ, снижает давление в ЛП и венах малого круга кровообращения и способствует уменьшению одышки и других проявлений застоя крови в легких.
Дискуссионным остается вопрос о целесообразности применения сердечных гликозидов у больных ДКМП с синусовым ритмом и выраженной систолической дисфункцией ЛЖ (ФВ = 25-30%). Монотерапия сердечными гликозидами бывает неэффективной, поскольку в большистве случаев отсутствует морфологический субстрат для действия этих инотропных лекарственных средств, а именно: имеется значительное и распространенное повреждение кардиомиоцитов, уменьшение количества миофибрилл, нарушения клеточного метаболизма и выраженный кардиофиброз.
Применение сердечных гликозидов у тяжелых больных с выраженной систолической дисфункцией ЛЖ и синусовым ритмом, возможно только в комбинации с ингибиторами АПФ, диуретиками под контролем содержания электролитов и мониторинга ЭКГ. Длительное применение негликозидных инотропных средств у больных ДКМП и ХСН не рекомендуется, так как достоверно увеличивает смертность этих больных. Кратковременное применение негликозидных инотропных лекарственных средств (леводопа, добутамин, милринон, амринон) оправдано при подготовке больных к трансплантации сердца.
Назначение антиагрегантов показано всем больным ДКМП, поскольку в 30% случаев течение заболевания осложняется внутрисердечным тромбозом и развитием тромбоэмболий. С этой целью используется постоянный прием ацетилсалициловой кислоты в дозе 0,25–0,3 г в сутки, применение других антиагрегантов по схемам (трентал, дипиридамол, вазобрал, тонакан). У больных с мерцательной аритмией показано назначение непрямых антикоагулянтов (варфарин) под контролем показателей коагулограммы. Дозы препарата подбираются так, чтобы величина МНО составляла 2-3 ед. Многие специалисты считают показанием для назначения непрямых антикоагулянтов выявление у больных ДКМП внутрисердечных тромбов.
Хирургическое лечение
Серьезной проблемой, ограничивающей широкое распространение этого метода лечения, является высокая стоимость оперативного вмешательства и организационные проблемы. В последние годы в экономически развитых странах длина листа ожидания трансплантации сердца значительно выросла. Тщательный отбор пациентов основан на определении предоперационных характеристик, являющихся лучшими предикторами хорошего исхода.
Двухкамерная электростимуляция сердца с помощью имплантируемого электрокардиостимулятора типа DDD в некоторых случаях позволяет добиться улучшения внутрисердечной гемодинамики, повышая систолическую функцию желудочков, предупредить развитие тяжелых осложнений.
Динамическая кардиомиопластика играет важную роль в лечении больных ДКМП. Используется мышечный лоскут из левой широчайшей мышцы спины, который оборачивается вокруг сердца. Сокращения синхронизируются с помощью электрокардиостимулятора. Эта процедура позволяет улучшить функциональный статус больных, качество жизни, повысить переносимость физической нагрузки. Снижается потребность в госпитализации, медикаментах. Однако не очень оптимистично выглядит показатель выживаемости (70%) при исключении смертности в раннем периоперационном периоде. Кардиомиопластика наиболее эффективна у больных с III ФК ХСН. При более выраженной симптоматике эффект медикаментозной терапии равен или более выражен, чем эффект от операции.
В последнее десятилетие контингент больных ДКМП существенно изменился. Возросло число больных с доклиническими и субклиническими проявлениями болезни. Это связано с широким внедрением в клиническую практику эхокардиографии, позволяющей проводить раннюю диагностику заболевания. Тем не менее, остается много нерешенных проблем в отношении причин, механизмов развития, ранней диагностики и специфического лечения ДКМП.