Диоксидин и дексаметазон в нос для чего
Опыт применения комбинированных препаратов при лечении ринитов и синуситов у детей
Заболеваемость синуситами до настоящего времени достаточно высока. По данным различных авторов, заболеваниями носа и околоносовых пазух страдает от 17 до 22% детского населения. Одним из существенных факторов патогенеза острых
Заболеваемость синуситами до настоящего времени достаточно высока. По данным различных авторов, заболеваниями носа и околоносовых пазух страдает от 17 до 22% детского населения. Одним из существенных факторов патогенеза острых и особенно хронических воспалительных заболеваний носа и околоносовых пазух является нарушение механизма мукоцилиарного транспорта. Это чаще всего связано с отеком слизистой оболочки, избыточным образованием и повышением вязкости носового секрета, что влечет за собой расстройство дренажной, дыхательной, секреторной и обонятельной функций. Наиболее распространенный метод лечения синуситов — пероральное или внутримышечное назначение антибиотиков. Так как поступление антибиотика из кровяного русла в очаг воспаления ограничено, лечение синуситов должно носить комплексный характер.
В первую очередь это должно касаться улучшения вентиляции, а также дренажа околоносовых пазух и носоглотки.
До настоящего времени врачи-оториноларингологи не всегда практикуют назначение включенных в схему терапии больных синуситами адекватных мукорегулирующих препаратов, которые, разжижая густой вязкий секрет и улучшая мукоцилиарный клиренс, способствуют удалению секрета из пазух. Среди препаратов, воздействующих на мукоцилиарную активность, ранее использовались средства, стимулирующие разжижение ринобронхиального секрета, или так называемые муколитики, которые изменяют вязкость секрета, воздействуя на его физико-химические свойства. Речь идет о ферментах (трипсине, химотрипсине и т. д.), которые из-за наличия побочных эффектов в настоящее время не применяются.
Муколитическим действием обладают также препараты, снижающие поверхностное натяжение, т. е. воздействующие на гель-фазу отделяемого и разжижающие как мокроту, так и носоглоточный секрет. К этой группе относится флуимуцил (N-ацетилцистеин), действие которого связано со способностью свободной сульфгидрильной группы N-ацетилцистеина расщеплять межмолекулярные дисульфидные связи агрегатов гликопротеинов слизи, оказывая сильное разжижающее действие и уменьшая вязкость в отношении любого вида секрета: гнойного, слизисто-гнойного, слизистого. Особенность флуимуцила состоит в том, что помимо прямого муколитического действия N-ацетилцистеин обладает мощными антиоксидантными свойствами и способен обеспечить защиту органов дыхания от цитотоксического воздействия метаболитов воспаления, факторов окружающей среды, табачного дыма.
В группе муколитиков большой интерес представляют комбинированные препараты, а именно ринофлуимуцил, в состав которого кроме N-ацетилцистеина, разжижающего секрет, входит симпатомиметик — туаминогептана сульфат, обладающий мягким сосудосуживающим действием и не вызывающий излишней сухости слизистой оболочки. После разрыва дисульфидных мостиков слизь и мокрота теряют вязкость, начинают впитывать в себя воду и мягко удаляются при сморкании, чихании, кашле. Показаниями к применению ринофлуимуцила являются:
Оценка эффективности препарата производилась в группе из 55 пациентов в возрасте от 6 до 14 лет; ринофлуимуцил впрыскивали по одной дозе в каждую половину носа 3-4 раза в день, курс составил 6-7 дней. Состояние детей оценивали по их субъективным ощущениям до и после применения препарата, а также объективным критериям (уменьшение гиперемии и застойных явлений в слизистой оболочке, улучшение носового дыхания, уменьшение слизи, изменение ее реологических свойств).
Уже после 6-8 ингаляций ринофлуимуцила была отмечена положительная динамика.
Результат применения препарата оценивался следующим образом: 70% больных — отлично; 20% — хорошо; 10% — удовлетворительно.
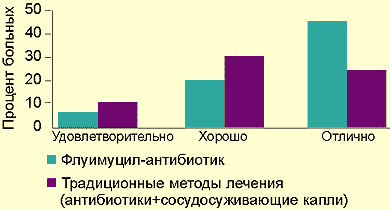 |
| Рисунок. Сравнительные результаты лечения флуимуцилом-антибиотиком ИТ и традиционными методами |
Побочных явлений от применения препарата не отмечено. Достоинство ринофлуимуцила в том, что он воздействует на поверхность слизистой оболочки и, разжижая слизь, уменьшает ее вязкость и способствует продуктивному физиологическому акту очищения полости носа.
Следующий препарат, на который следует обратить внимание, — это флуимуцил-антибиотик ИТ, соединяющий в одной лекарственной форме два компонента: N-ацетилцистеин и тиамфеникола глицинат (тиамфеникол — препарат из группы хлорамфениколов). Спектр антимикробной активности препарата представлен в табл. 1 (Клиническая фармакология антибактериальных препаратов/Под ред. Ю. Б. Белоусова, 1988).
Препарат обладает сочетанным антибактериальным и муколитическим действием и рекомендуется для лечения заболеваний органов дыхания, вызванных бактериальной инфекцией и сопровождающихся образованием густого вязкого секрета. Антимикробная активность тиамфеникола обусловлена его вмешательством в синтез бактериальных белков. Последние исследования показали, что сочетание тиамфеникола и N-ацетилцистеина позволяет препарату сохранять неконъюгированную форму и достигать очага воспаления в концентрациях, достаточных для создания бактерицидного эффекта. Препарат проявляет муколитическую активность в отношении любого вида секрета — слизистого, слизисто-гнойного, гнойного. Флуимуцил-антибиотик ИТ облегчает отделение мокроты и носовой слизи. Препарат эффективен при введении в околоносовые пазухи.
Мы располагаем данными лечения препаратом флуимуцил-антибиотик ИТ у 37 детей, из них у 17 был диагностирован острый гайморит, у 10 — обострение хронического гайморита и у 10 — обострение хронического гнойного гаймороэтмоидита. Контрольная группа пациентов лечилась традиционным методом без применения флуимуцила-антибиотика. Сравнительные данные представлены на рисунке.
Препарат использовался для промывания околоносовых пазух после пункций или после оперативного вмешательства, в том числе после эндоназального вскрытия клеток решетчатого лабиринта. Хорошие результаты были получены уже после 2-3 промываний: улучшилось носовое дыхание, сократился отек слизистой оболочки полости носа, уменьшилось количество секрета, исчез его гнойный характер. Показания и способы применения препарата представлены в табл. 2.
Эффективность флуимуцила-антибиотика ИТ определяется не только антибактериальным воздействием, но и способностью обеспечивать быстрое и полное удаление экссудата, что в свою очередь усиливает антибактериальный эффект.
Литература
Обратите внимание!
Флуимуцил-антибиотик ИТ обладает следующими фармакологическими и терапевтическими свойствами:
Возможности местной терапии инфекционно-воспалительных заболеваний ЛОР-органов
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Инфекционно-воспалительные заболевания ЛОР-органов до сих пор остаются наиболее распространенными патологическими процессами, отличающимися упорным течением, несмотря на значительные успехи современной клинической медицины. Нозологические формы инфекции ЛОР-органов достаточно разнообразны – различные виды наружных и средних отитов, заболевания верхних отделов дыхательной трубки: риносинуситы, тонзиллофарингиты, ларингиты. Большое клиническое и социальное значение патологии верхних отделов дыхательных путей и уха обусловлено ее чрезвычайной распространенностью. В связи с резистентностью ряда возбудителей к антимикробным препаратам данные заболевания могут часто рецидивировать, принимать затяжное, хроническое течение, в ряде случаев возникает риск формирования синдрома системного воспалительного ответа (SIRS – systemic inflammatory response syndrome) и развития тяжелых, угрожающих жизни осложнений.
Проблема выбора этиотропной терапии, а также вида, способа применения и дозы лекарственного средства при лечении больных с инфекционной патологией ЛОР-органов является актуальной. При назначении антимикробных препаратов врачу необходимо ответить на ряд важных вопросов:
Основные параметры, которым должно соответствовать противомикробное лекарственное средство, – высокая активность против наиболее часто встречающихся возбудителей данной патологии, бактерицидное действие, минимальный риск селекции устойчивых микроорганизмов, достаточная аккумуляция в патологическом очаге, безопасность, хорошая переносимость, простота использования. Широкое и неадекватное использование системной антибактериальной терапии является главной причиной развития резистентности микроорганизмов. Феномен бактериальной устойчивости представляет большую проблему в терапии инфекционных заболеваний населения и создает реальную угрозу здравоохранению во всем мире. Необходимо менять тактику назначения системных антибиотиков – они должны использоваться только в случаях абсолютной необходимости, с соблюдением оптимальных дозировок и продолжительности лечения.
С учетом вышеизложенного большее значение приобретает местная антимикробная терапия, при которой обеспечивается доставка оптимальной дозы активного ингредиента непосредственно на слизистую оболочку дыхательных путей или в очаг воспаления. Преимуществами местной терапии при инфекционно-воспалительных заболеваниях верхних отделов дыхательных путей и уха являются простота и доступность введения в зону патологических изменений, высокая концентрация лекарственного вещества в очаге воспаления при малой общей дозе препарата, минимальный риск системных побочных эффектов.
Арсенал подобных средств в настоящее время достаточно скуден. В этом аспекте определенный интерес у врачей вызывает антимикробный химиопрепарат гидроксиметилхиноксалиндиоксид (Диоксидин); химическая формула – C10H10N2O4. Диоксидин является производным ди-N-окиси хиноксалина, обладает антибактериальной и антипротозойной активностью, характеризуется высокими реакционными свойствами, повышенной способностью к поляризации и окислительно-восстановительным реакциям. Производные ди-N-окиси хиноксалина интенсивно разрабатывались и изучались еще с 1960-х гг. как в России, так и в других странах. В частности, за рубежом в этот период были созданы такие препараты, как квиндоксин, меквидокс, карбадокс, темадокс, олахиндокс, обладающие высокой антимикробной активностью и имеющие широкий спектр действия.
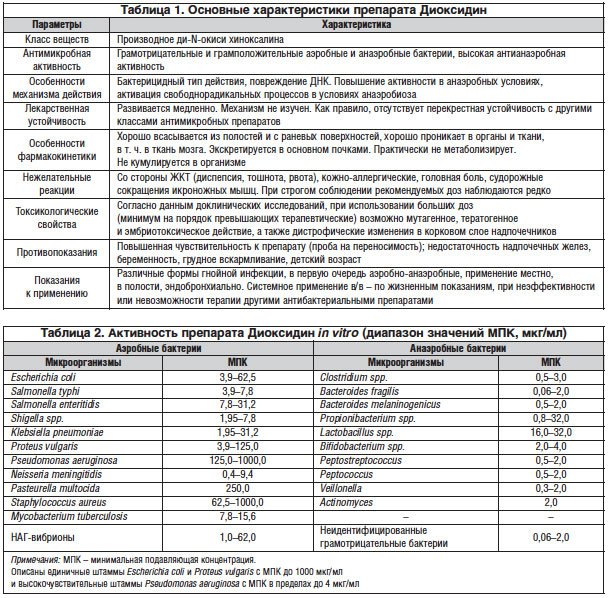
Во Всесоюзном научно-исследовательском химико-фармацевтическом институте (в настоящее время – Центр по химии лекарственных средств (ЦХЛС ВНИХФИ), Москва) коллективом авторов под руководством А.С. Елиной в 1972 г. в результате фундаментальных поисковых исследований были синтезированы 2 производных ди-N-окиси хиноксалина, одним из которых является Диоксидин. Второй препарат – хиноксидин, по существу, является лекарственной формой Диоксидина для применения внутрь, т. к. действующее начало хиноксидина – его основной метаболит Диоксидин. Диоксидин выпускается только в Российской Федерации, регистрационный номер: Р N003934/01-040411, форма выпуска – раствор для внутриполостного и наружного применения. Основные характеристики Диоксидина представлены в таблице 1 [19].
Диоксидин обладает избирательной активностью в отношении различных микроорганизмов – бактерий, вирусов, грибов, простейших. Высокая химиотерапевтическая активность in vivo на модельных инфекциях, близких по патогенезу к патологическим процессам у человека (гнойные менингиты, пиелонефрит, септикопиемии), вызванных штаммами аэробных бактерий, устойчивыми к препаратам других классов (в т. ч. полирезистентными), включая штаммы Pseudomonas aeruginosa и метициллиноустойчивых стафилококков, обусловила возможность разработки Диоксидина как лекарственного препарата [1, 16, 17]. Дополнительным основанием рекомендации для использования Диоксидина в клинической практике явилась его высокая активность в отношении анаэробных бактерий [4, 15, 22].
По данным ряда исследований, Диоксидин характеризуется широким антибактериальным спектром и бактерицидным типом действия [1, 4, 15, 17, 19, 22, 23]. Активность препарата in vitro представлена в таблице 2. Повреждение биосинтеза ДНК микробной клетки с глубокими нарушениями структуры нуклеоида происходит уже при субингибирующих концентрациях Диоксидина [14, 27].
Активность Диоксидина значительно повышается в анаэробных условиях. Данный феномен характерен для всех производных ди-N-окиси хиноксалина с антимикробной активностью и не описан для других классов антимикробных веществ [27]. В анаэробных условиях, в т. ч. в инфицированном организме, Диоксидин, как и другие производные ди-N-окиси хиноксалина, активирует свободнорадикальные процессы, индуцируя образование так называемых активных форм кислорода [8, 21, 27]. Вероятно, именно данное свойство Диоксидина лежит в основе не только высокой антимикробной активности препарата in vivo, но и ряда других его биологических свойств [19].
Особенностью Диоксидина как антимикробного агента является отсутствие корреляции эффектов in vitro (при определении в аэробных условиях) и в инфицированном организме. В ряде экспериментов было продемонстрировано, что Диоксидин практически не метаболизируется, а специально синтезированные, теоретически возможные метаболиты Диоксидина не обладают антибактериальным действием [5, 15, 16]. Диоксидин хорошо проникает в различные органы и ткани, экскретируется главным образом почечными механизмами и при повторных введениях не кумулирует, однако его фармакокинетика у человека изучена не в полном объеме [5, 15, 16, 23, 25, 26]. Активность препарата при введении внутрь и парентерально на различных моделях экспериментальных инфекций позволяет рассмативать его как истинный химиотерапевтический препарат [15]. Несмотря на длительный (более чем 30 лет) период применения Диоксидина для лечения гнойно-воспалительных процессов в клинической практике эффективность данного препарата сохранилась – следовательно, резистентность микроорганизмов к нему практически не развивается. Это подтверждает результат многоцентрового исследования, проведенного в 2011 г. Диоксидин в терапевтических концентрациях активен в отношении (93%) исследованных штаммов микроорганизмов [13].
Полученные результаты данного мультицентрового исследования свидетельствуют о необходимости и целесообразности использования Диоксидина в качестве антимикробного препарата для местного лечения бактериальных инфекций. При условии обеспечения адекватных тканевых концентраций в комплексной антимикробной терапии гнойно-воспалительных процессов Диоксидин применяется в виде 5% мази и 0,5 и 1% раствора для наружного применения [13].
В Институте медицинской генетики РАМН специально проводился анализ цитогенетических свойств Диоксидина для решения вопроса о возможности его применения в медицинской практике. Исследования показали, что при местном применении в рекомендуемых терапевтических дозах Диоксидин не повышает частоты мутаций в клетках крови человека, т. е. противопоказаний для наружного применения Диоксидина нет.
Опубликованы данные о хорошей переносимости препарата при местном применении. При терапии Диоксидином не отмечено нефротоксического и ототоксического действия, а также отрицательного влияния на функцию печени. Частота побочных эффектов монотерапии Диоксидином – менее 3% (1% раствор для внутриполостного и наружного применения). Побочные явления, которые наблюдались при местном применении, были рассмотрены как несерьезные и спонтанно исчезали в течение лечения [9, 19]. Согласно инструкции по медицинскому применению Диоксидина, максимальная суточная доза препарата для введения в полости – 70 мл 1% раствора. Терапевтическая доза при местной терапии (введение в каплях) в 150 раз меньше предельно допустимой (1 мл – 20 капель, соответственно на 1 введение 3 капли – 0,15 мл, по 3 капли 3 р./сут – 0,45 мл).
Клинические данные по итогам широкого изучения терапевтической эффективности Диоксидина более чем у 6 тыс. больных в 24 клиниках различного профиля при разных формах гнойной инфекции в урологической, хирургической и оториноларингологической практике показывают эффективность препарата при применении местно, при введении в полости, эндобронхиально, ингаляционно и в/в. Эти результаты опубликованы [1–3, 6, 7, 10–12, 17, 18, 20, 24, 26]. Показания для соответствующего способа применения препарата определялись характером патологического процесса, причем в первую очередь Диоксидин назначали в случаях тяжелых форм гнойной инфекции, при резистентности возбудителя к другим антимикробным агентам.
В Московском НИИ уха, горла, носа и речи Диоксидин широко применялся с 1970-х гг. для лечения гнойно-воспалительной патологии ЛОР-органов: синуситов, хронического тонзиллита, обострения хронических ларингитов и ларинготрахеитов, хронических гнойных средних отитов, а также в лечении ран при заживлении вторичным натяжением в послеоперационном периоде. Данный клинический опыт использования Диоксидина в оториноларингологии свидетельствует о высокой эффективности и безопасности препарата при местном использовании. Диоксидин хорошо переносится больными, не вызывает выраженного дисбактериоза и может быть рекомендован к использованию в практике ЛОР-врача [6].
Показаниями к внутриполостному и наружному использованию Диоксидина являются гнойные бактериальные инфекции, вызванные чувствительной микрофлорой, при неэффективности других химиотерапевтических средств или их плохой переносимости. Противопоказания: индивидуальная непереносимость препарата, надпочечниковая недостаточность, в т. ч. в анамнезе, беременность, период лактации, детский возраст до 18 лет. С осторожностью Диоксидин применяется при почечной недостаточности.
В оториноларингологии возможно использование различных лекарственных форм Диоксидина: для местного лечения – 5% мазь, для введения в полости – 0,5 и 1% водные растворы в ампулах и флаконах. Возможные области применения препарата в оториноларингологии: гнойные риносинуситы, абсцессы перегородки носа, фурункулы, карбункулы, сикоз преддверия носа, хронический тонзиллит, паратонзиллярные, парафарингеальные абсцессы, острый ларингит и обострение хронических воспалительных процессов в гортани, канюленосительство, средние перфоративные отиты, заболевания слуховой трубы, наружные отиты, состояния после вскрытия отогематомы, флегмоны шеи, медиастиниты, травмы и состояния после хирургических вмешательств на верхних отделах дыхательных путей и уха и некоторые другие патологические состояния. Средние сроки использования Диоксидина при заболеваниях ЛОР-органов – 7–10 дней.
Таким образом, высокая эффективность, практическое отсутствие микробной резистентности, безопасность при местном использовании, хорошая переносимость позволяют рекомендовать Диоксидин в качестве топического средства для лечения ряда инфекционно-воспалительных процессов в оториноларингологии.
Только для зарегистрированных пользователей
Особенности лечения осложненных форм аллергического ринита
Наблюдаемый во всем мире рост числа больных, страдающих аллергией, дал ВОЗ возможность сделать неутешительный прогноз, что эта тенденция будет сохраняться, особенно среди детей. Так, распространенность аллергического ринита (АР) у детей России (по данным
Наблюдаемый во всем мире рост числа больных, страдающих аллергией, дал ВОЗ возможность сделать неутешительный прогноз, что эта тенденция будет сохраняться, особенно среди детей. Так, распространенность аллергического ринита (АР) у детей России (по данным ISAAC (International Study of Asthma and Allergic in Children)) в 1993–2000 гг. составила 9,8–29,6%. Опасность АР связана с возможностью последующего (у 45–60%) развития бронхиальной астмы (БА) [1, 2].
В соответствии с международной классификацией (ARIA, 2001) выделяют интермитирующую и персистирующую формы АР, которые по клинике соответствуют ранее принятым сезонной и круглогодичной формам.
В процессе течения аллергического воспаления повышается экспрессия адгезивных молекул, которые осуществляют прилипание эозинофилов к сосудистому эндотелию. Доказано, что адгезивные молекулы являются одновременно рецепторами для вирусов, в том числе и для риновирусов. Этим объясняется тот факт, что больные с АР и БА более подвержены развитию вирусных инфекций. При этом частые респираторно-вирусные заболевания у пациентов с атопией снижают местный иммунитет, особенно в области верхних дыхательных путей, способствуя формированию очагов хронического воспаления (аденоидита, синусита, ринита, тонзиллита) вследствие присоединения вторичной инфекции. Обострения этих заболеваний, протекающих на фоне аллергического воспаления, приводят к более частым и продолжительным эпизодам нетрудоспособности таких пациентов [6].
Наиболее часто в развитии хронических заболеваний ЛОР-органов участвуют Str. pneumonia, H. influenzae, M. catarrhalis, реже St. aureus, Ps. aeroginosus, Kl. pneumoniae и другие микроорганизмы. Доказано, что энтеротоксины St. aureus иногда относят к «суперантигенам», которые, видимо, способны стимулировать эозинофильное воспаление и IgE-опосредованный ответ при атопии, а также при типичных неаллергических полипах носа [7, 8].
Аллергологи-клиницисты выделяют следующие формы АР: гиперсекреторную, отечную и смешанную. Гиперсекреторная форма проявляется выраженной ринореей, зудом, чиханием («чихальщики» и «сморкальщики») и чаще встречается при интермитирующем АР. При этой форме высокоэффективны антигистаминные препараты. При отечной форме у больных постоянно затруднено носовое дыхание («блокадники» или «сопельщики»), в то время как другие классические симптомы АР их беспокоят в меньшей степени. В этом случае больные не могут обходиться без сосудосуживающих капель, системные антигистаминные средства чаще не дают выраженного терапевтического эффекта.
Диагностику аллергии и выявление причинно-значимых аллергенов осуществляет аллерголог. На основании данных анамнеза, симптоматики и результатов лабораторного обследования врач устанавливает и форму АР, однако объективизировать клиническое течение процесса возможно лишь при осмотре полости носа, осуществляемой оториноларингологом. ЛОР-врач выполняет эндоскопическое исследование полости носа до и после анемизации его слизистой оболочки. Характерными особенностями ее вида является типичный белесый или синюшный цвет, а также наличие пятен Воячека. Осмотр ЛОР-органов позволяет выявить очаги хронического воспаления и определить показания к определению состоянию биоценоза. При необходимости, чаще обусловленной наличием хронического ринита, синусита, аденоидита, тонзиллита, проводят микробиологическое исследование микрофлоры из очагов воспаления и ее чувствительности к антибиотикам. Кроме того, ЛОР-врач определяет пороги обоняния и состояние мукоцилиарного транспорта, выполняет активную переднюю риноманометрию и акустическую ринометрию, которые дают ценную информацию о состоянии носового дыхания и функции слизистой оболочки [3].
Терапия АР должна быть щадящей и комплексной, направленной на все звенья аллергического воспаления, зависимой от тяжести заболевания. Она включает комплекс элиминационных мероприятий, фармакотерапию, иммунотерапию, специфическую иммунотерапию (СИТ) и образовательные мероприятия [5].
Программа элиминационных мер разрабатывается в зависимости от этиологии аллергии аллергологом и экологом по жилью. Кроме того, важной ее составляющей является снижение контакта аллергенов со слизистой оболочкой полости носа, его можно добиться, используя ирригационную терапию. Такую терапию больной может проводить самостоятельно в домашних условиях, а при тяжелом течении или при присоединении инфекции в амбулаторных условиях с помощью метода перемещения по Проэтцу. Дома пациенты используют такие препараты на основе морской воды для промывания полости носа, как Аква Марис, Аквалор, Салин и другие, а также приспособления Долфин, Living Lab и Coclin. Рекомендации по использованию этих средств дает оториноларинголог в зависимости от возраста пациента, выраженности и распространенности процесса и риноскопии. Так, в раннем детском возрасте наиболее целесообразно использовать препарат Аквалор беби и Аква Марис, так как эти аэрозольные формы не дают сильной струи, пугающей ребенка. А электрические приборы Living Lab и Coclin, позволяющие не только промывать полость носа, но и отсасывать при необходимости отделяемое носоглотки, универсальны. Промывание полости носа целесообразно осуществлять регулярно 2 раза в день утром и вечером с целью удаления с поверхности слизистой оболочки триггеров и аэроаллергенов, поддерживающих аллергическое воспаление, и патологические бактерии, способствующие развитию инфекционного воспаления. Особенно это необходимо в период обострения АР.
Фармакотерапия АР включает топические и системные препараты. В детском возрасте предпочтение следует отдавать местным лекарственным средствам. К ним относятся: деконгестанты, стабилизаторы мембран тучных клеток, антигистаминные препараты и глюкокортикостероиды (ГКС).
При назначении топических сосудосуживающих препаратов следует руководствоваться инструкцией, которая информирует о возрастных особенностях использования средства. В аптечной сети имеется шесть разновидностей топических деконгестантов, применяемых местно. Это ксилометазолин (Бризолин, Галазолин, Гриппостад Рино, Доктор Тайсс Назолин, Инфлюрин, Ксилен, Ксимелин, Отривин, Ринонорм, Риностоп, Тизин Ксило, Фармазолин), нафазолин (Нафтизин, Санорин, Нафтизин-Хемофарм), фенилэфрин (Ирифрин, Мезатон, Назол Бэби, Назол Кидс), оксиметазолин (Називин, Нокспрей, Назол, Саноринчик), эпинефрин (Адреналина гидрохлорид, Эпинефрина гидротартрат) и тетризолин (Визин, Тизин, Октилия). В последнее время появились новые препараты, которые можно использовать у детей грудного возраста (Називин, Отривин, Назол Бэби), кроме ранее используемых: Бризолин 0,5%, Галазолин 0,5%, Длянос 0,5% и Гриппостад Рино 0,05%. Возрастные особенности назначения других препаратов этого ряда отражены в табл. 1. Следует отметить, что псевдоэффедрин не рекомендован детям до года и людям старше 60 лет, а также беременным женщинам, страдающим гипертонией, гипертиреозом, глаукомой и гиперплазией простаты. Деконгестанты являются высокоэффективными противоотечными средствами, но использовать их следует не более 7–10 дней, так как при длительном применении у пациентов возникают симптомы медикаментозного ринита, который в свою очередь ведет к затруднению и без того нарушенного носового дыхания, а также трудно поддается консервативному лечению.
Стабилизаторы мембран тучных клеток (препараты кромоглициевой кислоты), действующие на раннюю и позднюю фазы аллергии, снижающие зуд, чихание и носовую блокаду, используют обычно как профилактические средства, они хорошо зарекомендовали себя при персистирующем АР. Назальные спреи (Ломузол, Кромоглин, Кромосол, Ифирал, КромоГЕКСАЛ) рекомендовано применять с возраста двух лет, а выпускаемые формы дозированных аэрозолей требуют активного участия маленького пациента, поэтому их применяют у детей с пяти лет. Кратковременность действия кромонов определяет необходимость их частого приема, что создает неудобства для больного.
Из топических антигистаминных средств в виде аэрозолей выпускают: азеластин (Аллергодил) и левокабастин (Гистимет). Они представляют собой высокоспецифичные антагонисты H1-рецепторов. Их использование уменьшает ринорею и чиханье, а при регулярном использовании дважды в день они предотвращают нарастание симптомов АР. Азеластин и левокабастин назначают при легких формах заболевания, чаще в комбинации с другими препаратами. Используют также комбинированный препарат Виброцил, в состав которого входит фенилэфрин и диметинден, выпускаемый в форме капель, спрея и мази. Виброцил в виде спрея и геля можно применять детям с шести лет, а в форме капель — с одного года.
Обязательным составляющим компонентом лечения любой формы АР согласно утвержденному стандарту терапии в Российской Федерации являются системные Н1-блокаторы (антигистаминные препараты), так как именно они способны купировать тканевые эффекты гистамина, приводящие к развитию основных клинических проявлений АР. В настоящее время выпускают два поколения антигистаминных препаратов, каждый из которых имеет свои особенности и возрастные ограничения. В связи с индивидуальной чувствительностью к этим средствам пациентов необходимо подбирать наиболее эффективный в каждом конкретном случае препарат. Кроме того, следует учитывать удобство применения (например, дозирование 1 раз в сутки) и возрастные особенности.
Среди системных антигистаминных препаратов Фенистил может быть использован в наиболее раннем возрасте — с 1-го месяца, что выгодно отличает его от других средств этой группы.
Одним из современных антигистаминных препаратов является Зиртек. Его назначают не только с лечебной, но и с профилактической целью; поскольку он обладает всеми преимуществами препаратов II поколения. Зиртек выпускают в удобных формах (в каплях и таблетках), разрешен к применению у детей с 6-месячного возраста. Препарат действует в течение 24 часов, рекомендован одноразовый прием в сутки. Начало действия Зиртека после приема наступает уже через 20 минут. Препарат можно применять как короткими курсами, так и длительно.
При средней и тяжелой формах АР целесообразно использовать топические ГКС, которые воздействуют практически на все звенья патогенеза АР. В России используют: флутиказон (Фликсоназе, Фликсотид, Кутивейт), мометазон (Назонекс, Асманекс Твистхейлер), беклометазон (Насобек, Альдецин, Ринокленил и др.), будесонид (Тафен Назаль) и другие. При этом очень важно помнить, что назальные ГКС начинают действовать спустя 12 часов, а максимальный эффект наступает примерно на третий день. Также установлено, что они могут уменьшать выраженность глазных симптомов при аллергии.
Всем топическим ГКС присуща высокая эффективность, а незначительное системное воздействие объясняется их низкой биодоступностью. Это дает возможность использовать их длительно (примерно 3 недели) при очень низком риске развития системных эффектов. Однако при длительном использовании этих препаратов возможно развитие побочных эффектов: носовые кровотечения, кровяные корки, сухость, а также дисбиоз слизистой оболочки [9]. Существует и более серьезная клиническая опасность (наблюдают у 1–10% пациентов): развитие тромбоза внутренней сонной артерии, тромбоза артерий сетчатки, что способствует развитию у пациентов слепоты.
При тяжелом течении аллергического заболевания, чаще при наличии осложненных форм АР, БА или назальном полипозе, используют системные кортикостероиды — метилпреднизолон (Метипред, Медрол). Их назначают внутрь по 4–60 мг в сутки однократно или в разделенных дозах с особой осторожностью.
Особые проблемы возникают при обострении АР, протекающего на фоне хронических заболеваний ЛОР-органов. При этом обильная ринорея плавно сменяется слизисто-гнойным отделяемым из полости носа, продолжающимся в течение длительного времени и сопровождающимся выраженной заложенностью носа. Нередко в этой ситуации больные не обращаются к врачу, объясняя все течением аллергии, это способствует развитию хронического ринита и синусита.
В этих ситуациях можно рекомендовать препарат «Полидекса с фенилэфрином», определение терапевтической эффективности (ТЭ) которого мы оценивали в проведенном нами сравнительном контролируемом открытом исследовании, проведенном на больных, страдающих АР с осложнением в виде инфекционного ринита. Полидекса с фенилэфрином — это комплексный препарат, в состав которого входят: глюкокортикоид — дексаметазона натрия метасульфобензоат, два антибиотика аминогликозидного ряда — неомицина сульфат и поликмиксина В сульфат, а также гидрохлорид фенилэфрина. Терапевтический эффект препарата обусловлен противовоспалительным влиянием дексаметазона на слизистую оболочку полости носа, противомикробным действием антибиотиков, сосудосуживающим и противоотечным свойством фенилэфрина. Сочетание такого рода компонентов в препарате «Полидекса с фенилэфрином» дает основание для назначения его больным с АР, осложненным присоединением вторичной инфекции. Использование этого препарата рекомендовано с возраста 2,5 лет.
Развитие синусита в результате активизации вторичной флоры на фоне течения АР синусита наблюдают достаточно часто. При этом ведение больного соответствует обычной терапии, включая применение системных антибиотиков.
Однако существуют ситуации, когда течение АР осложняется частыми синуситами, развитием полипов и истинной формы гипертрофического ринита, которые требуют определенного рода хирургических оториноларингологических вмешательств.
В табл. 2 сделана попытка свести воедино возрастные ограничения назначения препаратов, используемых при АР.
При длительном течении АР, особенно в сочетании с БА и хроническими заболеваниями ЛОР-органов, нередко диагностируют отклонения в состоянии иммунного статуса. В этих случаях аллерголог-иммунолог назначает иммунотерапию, направленную непосредственно на восстановление соответствующего его звена.
Вне периодов обострения АР, чаще в осенне-зимний период, больным, страдающим АР, рекомендуют СИТ причинно-значимыми аллергенами, что у многих пациентов оказывается весьма эффективным [10].
Обязательным является профессиональное информирование пациента о его заболевании. Очень хорошо, если на уровне обучения, да еще методом мозгового штурма, в специально созданные образовательные программы включена информация о причинах, клинике, терапии и профилактике АР. На основании современных знаний об АР создаваемые программы должны быть направлены на повышение индивидуального здоровья, соблюдение неспецифической гипоаллергенной диеты, своевременное и эффективное лечение любых имеющихся заболеваний, снижение вероятности контакта с аллергеном. Такие программы должны разрабатывать совместно аллергологи и оториноларингологи. Они реализуются в аллергошколах, которые могут функционировать при медицинских и педагогических учреждениях.
По вопросам литературы обращайтесь в редакцию.
Г. Д. Тарасова, доктор медицинских наук, профессор
НКЦО, Москва