Диполь воды это что
Строение воды

В молекуле воды главным действующим лицом является атом кислорода.
Поэтому вся молекула воды является диполем, то есть молекулой с двумя разноименными полюсами. Дипольная структура молекулы воды во многом определяет ее необычные свойства.
Молекула воды – это диамагнетик.
При изменении состояния молекулы воды длина сторон и угол между ними изменяются в тетраэдре.
Например, если молекула воды находится в парообразном состоянии, то угол, образованный ее сторонами, равняется 104°27′. В водном состоянии угол составляет 105°03′. И в состоянии льда угол равен 109,5°.
Если разделить пополам эти углы, то получим углы:
104°27′: 2 = 52°13′,
105°03′: 2 = 52°31′,
106°16′: 2 = 53°08′,
109,5°: 2 = 54°32′.
Молекула воды приобретает строение золотой пропорции на пути, когда вода переходит в лед, и наоборот, когда лед тает. Очевидно, за это состояние и ценится талая вода, когда ее структура в построении имеет пропорции золотого сечения.
Теперь становится понятным, что знаменитый египетский треугольник с соотношением сторон 3:4:5 «взят» из одного из состояний молекулы воды. Сама же геометрия молекулы воды образована двумя египетскими прямоугольными треугольниками, имеющими общий катет равный 3.
Молекула воды, имеющая в основе соотношение золотой пропорции, является физическим проявлением Божественной Природы, которая участвует в создании жизнь. Именно поэтому в земной природе заложена та гармония, которая присуща всему космосу.
И поэтому древние египтяне обожествляли числа 3, 4, 5, а сам треугольник считали священным и старались заложить его свойства, его гармонию в любую конструкцию, дома, пирамиды и даже в разметку полей. Кстати, украинские хаты строились тоже с применением соотношения золотой пропорции.
Если представить вид гипотетической модели молекулы воды в объеме, то она передает форму треугольной пирамиды, у которой имеется 4 грани, а у каждой грани по 3 ребра. В геометрии треугольная пирамида называется тетраэдром. Такое строение свойственно кристаллам.
Таким образом, молекула воды образует прочную уголковую структуру, которую она сохраняет даже, когда находится в парообразном состоянии, на грани перехода в лед, и когда превращается в лед.
Такие структурные свойства молекулы воды в различных условиях объясняются прочными связями между двумя атомами водорода и одним атомом кислорода. Эта связь примерно в 25 раз сильнее, чем связь между соседними молекулами воды. Поэтому легче отделить одну молекулу воды от другой, например, при нагревании, чем разрушить саму молекулу воды.
За счет ориентационных, индукционных, дисперсионных взаимодействий (сил Ван-дер-Ваальса) и водородных связей между атомами водорода и кислорода соседних молекул молекулы воды способны образовывать как случайные ассоциаты, т.е. не имеющие упорядоченной структуры, так и кластеры – ассоциаты, имеющие определенную структуру.
В результате исследований, проведенных российским ученым С. В. Зениным, были обнаружены стабильные долгоживущие кластеры воды.
Зенин установил, что молекулы воды первоначально образуют додекаэдр. Четыре додекаэдра соединяясь, образует основной структурный элемент воды — кластер, состоящий из 57 молекул воды.
В кластере додекаэдры имеют общие грани, а их центры образуют правильный тетраэдр. Это объёмное соединение молекул воды, в том числе гексамеров, которое имеет положительные и отрицательные полюса.
Водородные мостики позволяют молекулам воды объединяться самыми различными способами. Благодаря этому в воде наблюдается бесконечное разнообразие кластеров.
Кластеры могут взаимодействовать друг с другом за счет свободных водородных связей, что приводит к появлению структур второго порядка в виде шестигранников. Они состоят из 912 молекул воды, которые практически не способны к взаимодействию. Время существования такой структуры весьма велико.
Эту структуру, похожую на маленький острый кристаллик льда из 6 ромбических граней, С.В. Зенин назвал «основным структурным элементом воды”. Многочисленные эксперименты подтвердили; в воде — мириады таких кристалликов.
Эти кристаллики льда почти не взаимодействуют друг с другом, поэтому не образуют более сложных устойчивых конструкций и легко скользят гранями относительно друг друга, создавая текучесть. В этом смысле вода напоминает переохлажденный раствор, который никак не может кристаллизоваться.
Какое строение имеет молекула воды
Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.

По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода. Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.

Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
Структура молекул воды и их ассоциатов
Вода начинается с молекулы
Итак, молекула воды ( 1 H2 16 O) состоит из двух атомов водорода ( 1 H) и одного атома кислорода ( 16 O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его – сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, – по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
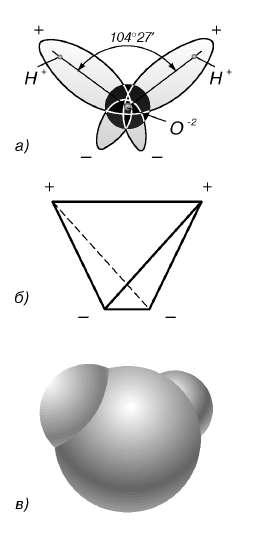
Рис. 1.5. Строение молекулы воды
а – угол между связями O-H;
б – расположение полюсов заряда;
в – внешний вид электронного облака молекулы воды.
Электронное строение молекулы воды
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Вода растворяет все!
Во многом благодаря диэлектрической проницаемости, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
Минеральный состав воды
В пресных природных водах – речных, озерных – содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном – 18, а в Красном море – около 40 г/л. В среднем в 1 л океанской воды растворено 34. 35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно – натрия и кальция), на 10% – из сульфатов (натрия, калия и магния), на 1% – из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) – до 80%. Сульфатов (натрия, кальция и магния) – около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода – до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты – растворимые соединения типа белков, сахаров, спиртов, углеводородов и т.п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
Формирование кластеров воды
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H2O)x
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес-кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Презентация была опубликована 9 лет назад пользователемwww.zavuch.info
Похожие презентации
3 1. Универсальный растворитель Гидрофильные соединения – вещества, хорошо растворяющиеся в воде (hidros – вода, рhileo – люблю) Например: соли, аминокислоты, сахара, белки, простые спирты
4 Гидрофобные соединения в воде растворяются очень плохо или вообще не растворяются (hidros – вода, рhobos – страх) Например: жиры (липиды), жироподобные вещества (липоиды), полисахариды, некоторые белки
5 2. Вода является средой для протекания химических реакций Большинство процессов, протекающих в клетке, могут осуществляться только в водной среде
6 3. Участвует во многих метаболических процессах А) Например, реакции гидролиза Белки аминокислоты Крахмал глюкоза
7 Б) реакция с АТФ Высвобождение энергии В) участие в реакциях фотосинтеза Г) участие в синтезе АТФ в митохондриях
8 1. Высокая теплоемкость – способность поглощать тепло при минимальном изменении собственной температуры Физические свойства
9 Вода – идеальная жидкость для поддержания теплового равновесия Тепло быстро и равномерно распределяется между всеми частями организма
10 3. Высокая интенсивность испарения Быстрая потеря тепла, предохранение от перегрева Например: испарение у растений потоотделение у животных
11 4. Несжимаемость Тургорное давление Поддержание формы, объема и упругости клетки
12 Вода является дисперсионной средой, играющей важную роль в коллоидной системе цитоплазмы Вода обладает свойством смазки
13 6. Высокая сила поверхностного натяжения А) Восходящий и нисходящий транспорт веществ у растений Б) Движение крови в капиллярах В) Удержание и передвижение по поверхности мелких организмов
15 Минеральные соли Соли в виде ионов анионыкатионы Соли в твердом состоянии CaCO 3 CaPO 4 MgPO 4
18 * Поддерживают постоянство реакций среды в клетке и в окружающих растворах, т.е. являются компонентами буферных систем
Строение воды, ее аномалии и важнейшие физические свойства
ГЛАВА 2. ОСНОВНЫЕ ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ
СВОЙСТВА ВОДЫ. § 5. Строение воды, ее аномалии и важнейшие физические свойства
При образовании воды кислород отнимает от атомов водорода их электроны и становится отрицательно. заряженным ионом, а атомы водорода — положительно заряженными ионами. Так как атомы водорода расположены не на одной прямой с атомом кислорода, а под углом, т. е. несимметрично, то внутримолекулярные силы компенсируются неполностью. Появляются остаточные силы. Молекула воды образует электрический диполь, т. е. совокупность равных по величине и противоположных по знаку электрических зарядов, находящихся на малом расстоянии. Диполь молекулы воды характеризуется дипольным моментом, т. е. вектором, направленным от отрицательного к положительному заряду. Он равен произведению зарядов на расстояние между ними. Значительный дипольный момент определяет способность молекулы воды ассоциироваться в различные комплексы, представляющие собой сочетание двух—восьми отдельных молекул.
В парообразном состоянии (при температуре 100° С) вода состоит главным образом из простых молекул, называемых гидролями и соответствующих формуле Н2О. В жидкой фазе вода представляет смесь простых молекул гидролей (Н2О), двойных — дигидролей (Н2О)2 и тройных молекул — тригидролей (Н2О)3.
Рис. 1. Строение молекул воды (а) и тетраэдральное расположение молекул (б).
Согласно кинетической теории газов и жидкости, удельный объем всех тел при повышении температуры увеличивается, т. е. уменьшается плотность. Вода отличается от других тел и в этом отношении: в интервале от 0 до 4° С ее плотность увеличивается в связи с частичным разрушением тетраэдральной структуры, а при дальнейшем повышении температуры плотность уменьшается (удельный объем увеличивается) вследствие увеличения расстояния между молекулами. У морской воды температура наибольшей плотности зависит и от солености. С повышением температуры и понижением солености плотность уменьшается, а с понижением. температуры и увеличением солености увеличивается.
Вода обладает наибольшей из всех веществ удельной теплоемкостью, равной 1,000 кал/г • град, (в системе СИ 4,19 • 10 3 Дж/(кг • К)), за исключением водорода (3,4 кал/г * град., т. е. 14,2-10 3 Дж/(кг.Х ХК)) и жидкого аммиака (1,2 кал/г • град., или 5,02Х Х10 3 Дж/(кг * К)). Удельной теплоемкостью вещества называется количество теплоты, необходимое для нагревания 1 кг вещества на 1К (или 1°С). Теплоемкость морской воды несколько ниже, чем пресной, так как присутствующие в ее растворе вещества имеют незначительную теплоемкость. Обычно теплоемкость всех тел, как жидких, так и твердых, увеличивается с повышением температуры. Теплоемкость воды с повышением температуры от 0 до 40° С падает, а затем начинает повышаться. Теплоемкость морской воды уменьшается и с увеличением солености (при t=10° С и S = 10‰ удельная теплоемкость равна 4064 Дж/(кг • К), — при той же температуре и солености 30‰ — теплоемкость 3943 Дж/(кг * К)). Удельная теплоемкость воздуха и пород земной коры значительно меньше удельной теплоемкости воды: воздуха 993 Дж/(кг * К), кварца 796 Дж/(кг * К) и гранита 838 Дж/(кг * К). Большая теплоемкость воды по сравнению с теплоемкостью воздуха и пород суши имеет огромное климатическое значение, оказывает влияние на тепловые и динамические процессы, протекающие на Земле.
Теплопроводность
Вода, лед и воздух плохо. проводят тепло, поэтому в естественных водоемах передача тепла в глубины происходит чрезвычайно медленно. Обогревание же глубинных вод связано с процессами вертикального перемешивания. Для Мирового океана — важную роль играет теплопроводность, связанная с турбулентностью, коэффициент которой в тысячи раз превосходит коэффициент молекулярной теплопроводности. Для оценки скорости переноса тепла определяют температуропроводность. Она равна отношению коэффициента теплопроводности воды к ее плотности и теплоемкости при постоянном давлении. Весьма малая теплопроводность воды, льда и снега и высокая теплоемкость благоприятны для развития жизни в водоемах.
Скрытая теплота испарения и льдообразования
Высокая теплота испарения воды и плавления льда имеет важное значение для теплового баланса Земли.
Диэлектрическая постоянная воды
Диэлектрическая постоянная воды (ε) весьма высока — она равна 81. У большинства тел она находится в пределах 2—8. Высокий дипольный момент при незначительном молекулярном объеме воды обусловливает высокое значение ε. Только немногие соединения обладают высокой диэлектрической постоянной (нитробензол 36, спирты метиловый 33, этиловый 26 и рутил 170). Вследствие большой диэлектрической постоянной вода отличается большой ионизирующей способностью (способностью расщеплять молекулы растворенных веществ на ионы) и высокой растворимостью различных элементов, входящих в состав почв и горных пород.
Поверхностное натяжение
Вязкость
Вязкость. Вода обладает вязкостью, или внутренним трением. Сила внутреннего трения для воды

где fη — сила внутреннего трения; η — коэффициент турбулентной вязкости (трения);
При исследовании ламинарных движений коэффициент молекулярной вязкости иногда заменяют коэффициентом кинематической
Вязкости ν=η/ ρ (где ρ — плотность воды). С повышением температуры молекулярная вязкость заметно понижается, а с увеличением солености повышается. В природных условиях молекулярная вязкость имеет меньшее значение, чем турбулентная. Скорости и масштабы реальных динамических процессов определяют не 15 ламинарный, а турбулентный характер движения, при котором возникают вихреобразование и пульсации скорости. Коэффициент. молекулярной вязкости в этом случае заменяется коэффициентом турбулентного внутреннего трения.
Вода отличается большой подвижностью. Под влиянием. различных внешних и внутренних сил воды естественных водоемов приходят в движение. Наряду с такими крупномасштабными движениями, как приливы, сейсмические волны, течения, а также волнение, колебания. уровня, вертикальное перемешивание, движение воды может происходить под влиянием молекулярных сил. Силы взаимного притяжения и отталкивания между частицами воды и веществ, с которыми они взаимодействуют, определяют движение воды в капиллярах почв и грунтов. Исследования физических свойств воды показывают, что у пресной воды эти силы зависят главным образом от изменений температуры и давления, а у морской, кроме того, и от солености. Так, например, морская вода, представляя собой высоко ионизированный раствор различных солей, хорошо проводит электрический ток.
Электропроводность
Электропроводность морской воды зависит от температуры и солености. При изменении температуры от 0 до 24° С и солености от б до 40‰ электропроводность увеличивается от 0,6 до 6,1 1/(Ом * м). Пресная вода плохо проводит электрический ток.
В воде обнаружены теллурические токи, обусловленные корпускулярным излучением Солнца, связанным с числом солнечных пятен. Величина ‘этих токов в Мировом океане выше, чем в земной коре, вследствие лучшей электропроводности морской воды. Эти токи усиливаются при магнитных бурях и увеличении интенсивности солнечных сияний, т. е. в периоды солнечной активности.
Кроме теллурических токов, в воде обнаружены токи индукции, вызванные движением воды относительно силовых линий магнитного поля Земли.
При изучении физических и химических свойств воды необходимо принимать во внимание не только строение молекул воды.
Физические характеристики Н2О и D2O
| Характеристика | Н2О (вода) | D2O (тяжелая вода) |
| Плотность при 25° С | 0,99704 • 10 3 кг/м З | 1,10469 • 10 3 кг/м З |
| Температура плавления | 0°С | -3,82° С |
| Температура кипения | 100° С | 101,42°С |
| Температура наибольшей плотности | 3,98° С | 11,4° С |
| Диэлектрическая постоянная | 81 | 80,5 |
| Показатель преломления | ||
| Поверхностное натяжение | 1,33300 | 1,32844 |
| 7,23 Н/м 2 (72,53 дин/см 2 ) | 6,78 Н/м 2 (67,8 дин/см 2 ) |
Значения физических констант дистиллированной воды в разных системах единиц
Тепловые свойства воды
Источник: Общая гидрология, Гидрометеоиздат, Ленинград, 1973










