Дисбактериоз во влагащение лекарства чем лечить
Рецидивирующие формы бактериального вагиноза: долгосрочное решение
Монотерапия клиндамицином – оптимальное решение проблемы бактериального вагиноза, направленное на основную причину заболевания – специфические механизмы, приводящие к образованию биопленки и обеспечивающие резистентность к классическим антибиотикам.
Одной из самых частых жалоб в практике врача-гинеколога были и остаются патологические выделения из влагалища. Симптом, нередко кажущийся самим пациенткам незначительным, требует тщательной диагностики, так как обычно связан с инфекционной патологией половых путей и высоким риском грозных осложнений.
Таким образом, сегодня необычайно высока необходимость в препаратах, учитывающих патогенез бактериального вагиноза и направленных против бактерий, ответственных за формирование устойчивости и определяющих тенденцию к рецидивированию. Большим плюсом для лекарственного средства будет также его эффективность при кратком курсе применения, который повысит приверженность к терапии. На данный момент этим критериям соответствует только Далацин® — оригинальный клиндамицин – от компании Pfizer.
Влагалищный микробиоценоз в норме и в патологии
Если доля лактобацилл снижается, их место в экосистеме занимают облигатно и факультативно анаэробные условно-патогенные микробы: Gardnerella vaginalis, Atopobium vaginae, Bacteroides spp., Peptostreptococcus spp., Mobiluncus spp., Mycoplasma hominis и многие другие.
Роль Atopobium vaginae и Gardnerella vaginalis в патогенезе рецидивирующего бактериального вагиноза
Появление методов амплификации нуклеиновых кислот в содержимом влагалища женщин с бактериальным вагинозом позволило выявить Atopobium vaginae, бактерию семейства Corinobacteriaceae spp., сегодня считающуюся высокоспецифичным маркером этого заболевания и имеющую ключевую роль в его патогенезе. Этот строго анаэробный микроорганизм часто существует в комбинации с Gardnerella vaginalis и существенно ослабляет иммунный ответ на локальном уровне.
Таким образом, бактерии, образующие биопленку, являются основной мишенью патогенетически-обусловленной терапии. Препараты, высоко активные в отношении Atopobium vaginae и Gardnerella vaginalis, решают принципиально важную проблему элиминации патологических очагов на слизистой, которые становятся причиной возврата заболевания. И таким образом позволяют женщине, наконец, перестать обращаться к врачу с одними и теми же жалобами.
Фокусная терапия рецидивирующих форм бактериального вагиноза
Для пациенток с рецидивирующей формой бактериального вагиноза оптимальным решением является Далацин® (оригинальный клиндамицин), один из немногих препаратов, эффективных одновременно против Atopobium vaginae и Gardnerella vaginalis.
Эффективность фокусной терапии рецидивирующих форм бактериального вагиноза, ассоциированных с Atopobium vaginae, была не раз доказана в клинических исследованиях.
Инструкция по медицинскому применению лекарственного препарата Далацин®
Регистрационные удостоверения: крем – П N011553/01, суппозитории – П N011553/02.
Служба Медицинской Информации: Medinfo.Russia@Pfizer.com. Доступ к информации о рецептурных препаратах Pfizer в России: www.pfizermedinfo.ru
Copyright 2020 Пфайзер Россия. Все права защищены. Информация предназначена только для специалистов здравоохранения Российской Федерации.
OOO «Пфайзер Инновации»
123112, Москва, Пресненская наб., д.10, БЦ «Башня на Набережной» (блок С)
Тел.: +7 495 287 50 00. Факс: +7 495 287 53 00
PP-CLO-RUS-0225 07.09.2020
Бактериальный вагиноз: место пероральной пробиотической терапии
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма.
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма. Значительная часть (более 60%) микрофлоры заселяет различные отделы желудочно-кишечного тракта, примерно 15% приходится на ротоглотку, на урогенитальный тракт — 11%(из них на вагинальный отдел — 9%), 14% — на кожные покровы. Одновременная эволюция организма хозяина и микроорганизмов благодаря двунаправленному обмену способствовала закреплению взаимовыгодных коллективных взаимодействий. Резидентные микроорганизмы, взаимодействующие с человеком на протяжении тысячелетий, контактируют с толл-подобными рецепторами (toll-like receptors (TLR)) слизистых оболочек пищеварительного тракта. Активация TLR влияет на секрецию цитокинов мукоцитами, воздействуя, таким образом, на дальнейший процессинг и презентацию антигенов бактерий клеткам хозяина, выработку и секрецию иммуноглобулина А, связанного с секреторным компонентом лизоцима, лактоферрина и других биологически активных веществ.
Взаимодействие между физиологической микрофлорой и организмом хозяина происходит на поверхности слизистых оболочек, из которых самой большой по площади является слизистая оболочка кишечника.
Попытки воздействовать на кишечный биоценоз и через него — на здоровье человека имеют долгую историю. Еще И. И. Мечников в 1910 г. предлагал использовать кисломолочные продукты для омоложения и продления жизни.
Сегодня фармацевтический рынок предлагает практическому врачу широкий спектр лекарственных средств, способствующих нормализации микробиоценоза толстой кишки. Все средства, положительно влияющие на состав кишечной микрофлоры, можно разделить на пробиотики, пребиотики и синбиотики.
Пробиотики представляют собой гетерогенную группу непатогенных бактерий. С 30-х годов прошлого столетия ведут отсчет препараты, содержащие лактобактерии и бифидобактерии, так называемые пробиотики. В соответствии с определением рабочей группы ВОЗ к ним относят живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.
Препараты, входящие в группу пробиотиков, должны соответствовать следующим требованиям:
В ходе международного конгресса гастроэнтерологов (Монреаль, 2005 г.) было дано определение пробиотиков как препаратов на основе кишечных комменсалов, способных осуществлять биологический контроль в организме и обладающих регуляторными, триггерными свойствами. Такой биологический потенциал пробиотиков объясняется многочисленными метаболическими эффектами энтеральной микрофлоры, включая синтез витаминов В и К, короткоцепочечных жирных кислот, инактивацию пищевых канцерогенов, бактериальную ферментацию некоторых лекарственных препаратов, синтез сигнальных молекул и др.
К пробиотикам относят такие препараты, как Линекс, Энтерол, Бактисубтил, Бифидумбактерин, Лактобактерин и др. Пробиотики подразделяются по количеству входящих в состав препарата культур на монокомпонентные (Бифидумбактерин, Энтерол, Бактисубтил и т. д.) и поликомпонентные (Линекс), а также по свойству пробиотической культуры на самоэлиминирующиеся антагонисты (Энтерол, Бактисубтил) и на бифидосодержащие, лактосодержащие и колисодержащие. Например, препарат Линекс относится к поликомпонентным бифидо- и лактосодержащим пробиотикам, так как в его состав входят три микроорганизма — Bifidobacterium infantis, Lactobacillus acidophilus и Enterococcus faecium. Комбинированные пробиотики отличаются большей эффективностью в сравнении с монокомпонентными: лактобактерии и энтерококк преимущественно колонизируют тонкую кишку, а бифидобактерии — толстую, поэтому пробиотические культуры наиболее физиологично поддерживают колонизационную резистентность и способствуют выполнению функций индигенной кишечной микрофлоры.
Пребиотики представляют собой стабилизаторы среды обитания и стимуляторы роста нормальной микрофлоры. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством — стимулировать рост и развитие нормальной микрофлоры кишечника. К пребиотикам относят лактулозу, глюкозу, протеины, камедь, аминокислоты, витамины и минералы, каолин, пищевые волокна, инулин и олигофруктозу.
Комбинированные средства, сочетающие в себе как про-, так и пребиотический компоненты, относят к синбиотикам (например, Линекс Био).
Действие пероральной пробиотической терапии не сводится к простому заселению кишечника, как это зачастую представляется. Их влияние более сложно и многопланово. Это и конкуренция с патогенной и условно-патогенной микрофлорой; адгезия к слизистой оболочке кишечника и взаимодействие с эпителиоцитами; иммуномодулирующий эффект. Микробные липополисахариды и гликопептиды пробиотической флоры взаимодействуют с TLR с последующей передачей стимулирующего импульса на белок NFkB, вследствие чего последний транспортируется в ядро клетки. Активация NFkB приводит к переключению дифференцировки Th0-лимфоцитов на Thl-путь и стимуляции выработки провоспалительных цитокинов. Пробиотические штаммы лактобактерий (LGG, L. acidophylus), E. faecium, Str. thermophylus воспринимаются TLR и стимулируют ответ хозяина, усиливая выработку Th1 и IL-1, INF-альфа. Они стимулируют фагоцитарную активность нейтрофилов и выработку sIgА. В то же время бифидобактерии оказывают стимулирующее воздействие на Th-reg и, соответственно, выработку TGF-бета, IL-10, способствуя формированию иммунологической толерантности. Этот процесс сопровождается снижением синтеза IgE и усилением синтеза sIgA. Наиболее активно повышают уровень IL-10 В. longum, B. bifidum, B. infantis. Пробиотики, в состав которых входят симбионтные штаммы бактерий, аэробы и анаэробы, вероятно, могут оказывать более многоплановое и мощное иммуномодулирующее действие, чем монокомпонентные препараты.
Иммунорегулирующее действие пробиотиков расширяет возможности их использования и раскрывает широкие перспективы для применения в разных клинических ситуациях. Например, с позиций гастроэнтеролога эффективность пробиотических средств изучается в лечении заболеваний, ассоциированных с инфекцией Helicobacter pylori, воспалительных заболеваний кишечника, диффузных заболеваний печени, а также функциональной патологии кишечника. Мы имеем собственный опыт применения поликомпонентного пробиотика Линекс в лечении пациентов с язвенной болезнью, ассоциированной с инфекцией H. pylori. Эффективность включения Линекса в качестве препарата сопровождения к стандартной эрадикационной терапии тестировалась в открытом когортном проспективном рандомизированном (метод простой рандомизации с помощью конвертов) исследовании с включением 30 пациентов. Полученные нами данные свидетельствуют, что комбинация стандартной антихеликобактерной терапии с пробиотиком существенно снижает частоту развития синдрома кишечной диспепсии посредством протективного действия в отношении кишечного микробиоценоза, повышает приверженность пациентов к лечению и, таким образом, способствуют эрадикации инфекта.
Иммуногенный потенциал пробиотических средств привлекает внимание не только специалистов-гастроэнтерологов, но и врачей других специальностей, являясь отражением необходимости междисциплинарного подхода к восстановлению микроэкологического статуса макроорганизма. Так, проблема лечения и профилактики рецидивирующего бактериального вагиноза все чаще заставляет искать возможности восстановления физиологической микрофлоры влагалища путем нормализации кишечного биотопа для достижения адекватного функционирования местного иммунного ответа слизистых оболочек.
Бактериальный вагиноз — общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа и сопровождающийся чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища. Трудности в курации пациенток с бактериальным вагинозом определяются нередким сочетанием с папилломавирусной инфекцией (ПВИ) гениталий у женщин и другими инфекциями, передаваемыми половым путем (ИППП). Восстановление микробиоценоза влагалища уменьшает риск ИППП, и способствует улучшению репродуктивного здоровья и качества жизни женщин.
Пероральная терапия пробиотиками в лечении бактериального вагиноза
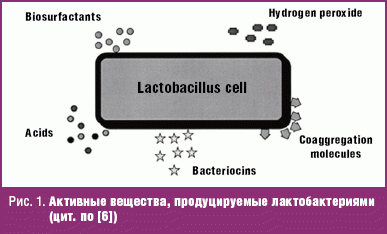
Предпосылкой к разработке схем терапии бактериального вагиноза с включением в антибактериальную терапию приема пробиотических культур послужило появление доказательств об эффективности определенных штаммов пробиотических культур при прямом введении во влагалище или когда они восходят из прямой кишки после перорального приема, а также благодаря их иммуногенному потенциалу. Как минимум для двух штаммов лактобактерий (Lactobacullus rhamnosus GR-1 и L. fermentum RC-1) доказана возможность колонизации влагалища восходящим путем. Основной акцент в отношении лактобактерий сделан в связи с тем, что именно лактобациллы доминируют в микробном пейзаже влагалища. Эти физиологические бактерии продуцируют кислоты, бактериоцины, перекись кислорода, биосульфактанты, препятствуют колонизации патогенной и грибковой флоры (рис. 1).
Результаты проведенных контролируемых исследований подтверждают положительный эффект применения пробиотиков, в том числе и перорально, при бактериальном вагинозе, рецидивирующих инфекциях мочеполового тракта и вульвовагинальном кандидозе у женщин. В 2007 году был опубликован систематизированный обзор, включивший результаты адекватных контролируемых исследований, посвященных оценке эффективности пробиотической терапии в лечении больных бактериальным вагинозом. Результаты клинических исследований с пероральным приемом пробиотиков разнились в зависимости от стартового фона микробиоценоза (не только влагалища, но и кишечника), наличия сопутствующей соматической патологии, а также вида назначенных пробиотических культур. Вместе с тем была отмечена эффективность, статистически достоверно превышающая эффект плацебо, перорального приема культур L. аcidophilus, L. rhamnosus GR-1, L. fermentum RC-14 при условии их приема от 14 дней до 2 месяцев в лечении бактериального вагиноза.
Эффективность пробиотических культур, содержащих лактобактерии, в качестве средств сопровождения к антибактериальной терапии, статистически достоверно выше плацебо и составляет от 60% (р = 0,004) до 88% (р Купить номер с этой статьей в pdf
Оптимизация терапии вагинальных дисбиозов
Изучение микроэкологии влагалища (вагинального биотопа), начатое более 100 лет тому назад А. Дедерлейном, показало, что настоящая экосистема сложная, многокомпонентная, гормонально зависимая и легкоранимая.
Изучение микроэкологии влагалища (вагинального биотопа), начатое более 100 лет тому назад А. Дедерлейном, показало, что настоящая экосистема сложная, многокомпонентная, гормонально зависимая и легкоранимая. Состояние ее динамического равновесия определяется, во-первых, уровнем гликогена в клетках эпителия влагалища, который в свою очередь связан с функциональным состоянием яичников, затем концентрацией лактофлоры, рН влагалищного содержимого и состоянием местного иммунитета.
Наличие индигенной флоры является одним из основных механизмов защиты половых путей от патогенных бактерий. Выраженный антагонистический эффект в отношении широкого круга патогенов проявляют лактобациллы, которые помимо образования молочной кислоты продуцируют перекись водорода, и бактериоцины, угнетающие развитие посторонних микробов. Кроме того, лактобактерии и неспорообразующие анаэробы проявляют высокую конкурентоспособность в заселении экологической нищи. Имеет большое значение и фактор адгезии индигенной флоры между собой и к поверхности эпителиоцитов. Специфическое прикрепление обеспечивается как за счет выростов в виде пилей и фимбрий, так и особыми химическими агентами— лектинами-гликопротеинами. В результате таких взаимодействий формируется гликокаликс, защищающий микробный пул от воздействия неблагоприятных факторов— антител, лизоцима, бактериофагов. Все вышеперечисленное входит в понятие «колонизационная резистентность», означающее совокупность механизмов, придающих стабильность влагалищного биотопа и предотвращающих заселение данной ниши.
В последнее десятилетие все больше внимания уделяется проблеме микозов, актуальность ее обусловлена продолжающимся ростом заболеваемости различными видами грибковой инфекции во всем мире, в частности, хроническими кандидозами кожи и слизистых, висцеральными микозами с поражением желудочно-кишечного тракта, респираторной системы и репродуктивных органов.
В акушерской и гинекологической практике прослеживается явная тенденция увеличения числа заболеваемости инфекционными процессами нижнего отдела гениталий, в частности бактериальным вагинозом и кандидозной инфекцией. Последние два заболевания зачастую объединяют в понятие «дисбиоз влагалища», который можно определить как полимикробный инфекционный синдром, представляющий собой патологию экосистемы влагалища, вызванную дисбалансом, проявляющимся уменьшением количества ферментирующих лактобацилл с одновременным увеличением количества условно-патогенных микроорганизмов.
В нашей стране вагинальный дисбиоз прочно занимает одно из ведущих мест в структуре причин обращений пациенток на амбулаторно-поликлинический этап оказания медицинской помощи населению. Внедрение современных технологий в клиническую микробиологию позволило существенно расширить представления специалистов и наглядно продемонстрировать, что отрицательное воздействие эндогенных и экзогенных факторов на микрофлору биотопов макроорганизма различной локализации, в том числе влагалища, ведет к развитию разнообразных патологических процессов как воспалительного, так и невоспалительного генеза. Несмотря на значительные успехи, достигнутые в диагностике, терапии и профилактике дисбиозов влагалища, их частота продолжает оставаться высокой (Стрижаков А. Н. с соавт., 2003; Радзинский В. Е. с соавт., 2006; Кира Е. Ф. с соавт., 2007; Макаров О. В. с соавт., 2007; Culligan P. J. et al., 2005; Klebanoff M. A. et al., 1991, 2005).
Одной из важных причин этого является рост числа иммунодефицитных состояний, наблюдаемый на фоне ухудшения экологической обстановки, нерационального питания, стрессов, «бума самодиагностики и самолечения» с бесконтрольным применением лекарственных средств, в первую очередь антибиотиков. Чаще всего генитальная инфекция обусловлена несколькими патогенными факторами: вирусами, бактериями, грибами, простейшими, которые вызывают схожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Анализ видового и количественного состава микрофлоры влагалища пациенток с урогенитальным кандидозом позволил выделить В. И. Кисиной с соавт. (1999) следующие типы вагинального микроценоза у обследованных женщин:
I тип. Выделение дрожжеподобных грибов рода Candida с сохранением лактофлоры у 12,1% пациенток в концентрации 10 4 –10 5 КОЕ/мл, у 18,97%— в концентрации 10 6 –10 7 КОЕ/мл.
IIа тип. Выделение дрожжеподобных грибов рода Candida в количестве 105–107 КОЕ/мл на фоне полимикробной микрофлоры с наличием Gardnerella vaginalis и/или Mobiluncus, «ключевых» клеток, снижения/отсутствия лактобацилл у 12,1% пациенток.
IIб тип. Картина микроценоза, аналогичная таковой при типе IIа, в ассоциации с Mycoplasma hominis и/или Ureaplasma urealyticum в количестве 4 –10 6 КОЕ/мл в ассоциации с Chlamydia trachomatis, с сохранением лактофлоры у 22,4% пациенток.
IVa тип. Выделение дрожжеподобных грибов рода Candida в количестве 10 5 –10 7 КОЕ/мл в ассоциации с С. trachomatis, M.hominis и/или U.urealyticum, с сохранением лактофлоры у 8,6% пациенток.
IVб тип. Выделение дрожжеподобных грибов рода Candida в количестве 10 5 –10 7 КОЕ/мл в ассоциации с М.hominis и/или U.urealyticum, с сохранением лактофлоры у 24,1% пациенток.
Кроме этого, у 87,9% пациенток обнаружен один или несколько факультативно-анаэробных микроорганизмов (стафилококки, коринебактерии, кишечная палочка, энтерококки) в концентрации от 10 3 до 10 6 КОЕ/мл.
При анализе результатов изучения кишечного микроценоза установлено умеренное уменьшение численности популяции бифидобактерий, лактобактерий в сочетании с резким снижением содержания полноценных Escherichia coli у 56,9% пациенток. Наряду с изменениями количественного состава нормальной микрофлоры зарегистрированы и ее качественные сдвиги: значительное увеличение количества лактозонегативных энтеробактерий у 53,4% пациенток, Escherichia coli со сниженными ферментативными свойствами у 20,7%, кокковых форм в количестве 10 6 –10 8 КОЕ/мл (Staphilococcus aureus, S.saprophiticus, S.epidermidis) у 77,6% пациенток. Повышенная пролиферация дрожжеподобных грибов рода Candida в количестве 10 5 –10 8 КОЕ/мл обнаружена в кишечнике у 46,6% обследованных.
Следует отметить, что манифестация кандидозной инфекции на фоне уже имеющегося инфекционного процесса влагалища усугубляет течение последнего и затрудняет лечение. Таким образом, формируется своеобразный порочный круг: кольпиты любой этиологии способствуют активации вульвовагинального кандидоза, который, в свою очередь, осложняет течение и усложняет лечение кольпита, обусловленного бактериально-вирусной инфекцией (Краснопольский В. И. с соавт., 2005; Мальцева Л. И. с соавт., 2004, 2007).
Все чаще приходится сталкиваться с необоснованными подходами к диагностике и лечению вульвовагинального кандидоза, что объясняется, с одной стороны, недостаточно полной осведомленностью врачей в вопросах современных особенностей этиологии и патогенеза настоящего заболевания, с другой стороны, излишне агрессивным лоббированием интересов производителей как оригинальных, так и генерических антимикотиков. Одним из вопросов, важных для гинекологов, сталкивающихся с проблемой кандидозной инфекции, является причина ее резистентности к традиционным методам терапии.
Традиционными подходами к лечению вагинальных дисбиозов следует признать различные методы, основанные на стадийности проводимого лечения и базирующиеся на понятиях коррекции, элиминации и восстановления влагалищного биотопа (Кира Е. Ф., 2001, 2007; Кондулукова И. А. с соавт., 1999; Линева О. И. с соавт., 2005; Мельников В. А., 2007; Шляпников М. Е., 2005, 2008). Применяемые для коррекции многокомпонентные препараты для локального (интравагинального) введения всегда оставались популярны как среди практикующих врачей, так и среди пациенток, благодаря высокой комплаентности, относительно невысокой стоимости курса лечения в сочетании с достаточной клинической и микробиологической эффективностью.
Одним из таких препаратов, появившихся в последнее время на российском рынке, является «Метрогил Плюс» в виде вагинального геля, содержащий наряду с традиционно используемым для лечения бактериального вагиноза метронидазолом, антимикотический компонент— клотримазол, что дает полное основание для использовании препарата в первую очередь для коррекции бактериального вагиноза, сочетанного с микотической инфекцией. Обоснованным следует считать введение в состав препарата именно клотримазола, поскольку, согласно исследованием последних лет (Кудрина М. И. с соавт., 2005; Пестрикова Т. Ю с соавт., 2005), параллельно с ростом резистентности грибов к флуконазолам происходит процесс восстановления чувствительности к таким ранее традиционно используемым на протяжении десятилетий препаратам, как нистатин и клотримазол (Жестков А. В. с соавт., 2007; Шляпников М. Е. с соавт., 2008). Дополнительным преимуществом препарата, выгодно отличающим его от большинства вагинальных форм, следует отметить гелевую основу, способствующую максимально равномерному распределению активных компонентов препарата на слизистой оболочке влагалища и экзоцервикса.
Нами проведено проспективное исследование эффективности использования препарата у 30 женщин репродуктивного возраста с верифицированным состоянием дисбиоза влагалища.
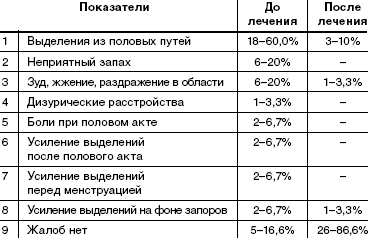
При анализе жалоб, с которыми обратились пациентки, выявлено, что большинство пациенток беспокоит наличие выделений из половых путей (60%), выделения с неприятным запахом (20%), наличие зуда, жжения в области вульвы и промежности (20%). У 4 пациенток (13,3%) выделения усиливались и начинали беспокоить только после полового акта или перед менструацией. У 2 пациенток (6,7%) выделения усиливались на фоне запоров кишечника (табл. 1).У 5 (16,6%) пациенток жалобы отсутствовали. Диагноз был поставлен при профилактическом обращении после гинекологического осмотра и микроскопии влагалищных выделений.
После пятидневного курса лечения препаратом «Метрогил Плюс» в виде вагинального геля субъективные жалобы отсутствовали у 86,6% женщин. У 10% сохранялись жалобы на выделения из половых путей: 1 случай (3,3%)— только выделения, 1 случай (3,3%) выделения в сочетании с усиливающимся зудом, 1 случай (3,3%) жалобы на усиление выделений на фоне запора.
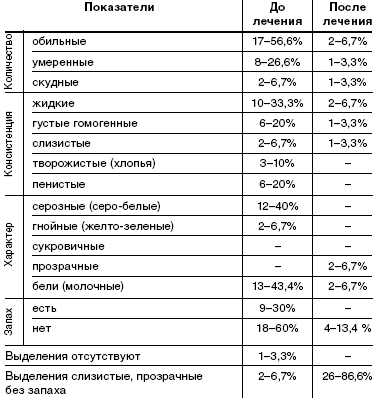
Характер выделений описан в табл. 2. До лечения у пациенток при гинекологическом осмотре выделения носили следующий характер: в основном обильные (56,6%), жидкие (33,3%) или пенистые (20%), серо-белые (40%) или молочные (43,3%), с неприятным запахом(60%). У 3 женщин из 30 (10%) при гинекологическом осмотре выделения соответствовали норме.
При осмотре после лечения препаратом «Метрогил плюс» в виде вагинального геля у 26 (86,6%) пациенток выделения имели критерии нормы: умеренные, слизистые, прозрачные, без запаха. У 4 пациенток (13,4%) выделения имели патологический характер: обильные 6,7%, жидкие 6,7%. Серозных, гнойных, пенистых, с неприятным запахом выделений после лечения не наблюдалось.
Из табл. 3 видно, что у большинства пациенток слизистая влагалища при вагинальном дисбиозе не изменена (63,3%). Но у 26,6% пациенток отмечалась гиперемия слизистой влагалища, у 6,7%— отечность, в 1 случае (3,3%)— мацерация слизистой влагалища.
После лечения в 96,7% видимой патологии слизистой влагалища не отмечается. В 1 случае (3,3%) сохранялась умеренная гиперемия.Эффективность действия препарата по этому признаку составляет 91%.
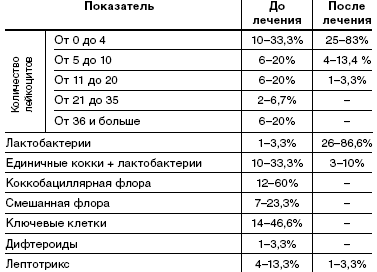
При анализе микроскопии влагалищного содержимого у пациенток исследуемой группы до лечения в 20% в мазке большое количество лейкоцитов, в 60% коккобациллярная флора, в 46,6%— в мазке «ключевые клетки», в 23,3% смешанная флора. Влагалищная флора, состоящая только из лактобактерий, в одном случае— 3,3%.
После лечения у 86,6% пациенток влагалищная флора состояла только из лактобактерий, лактобактерии с единичными кокками у 10% пациенток, наличие лептотрикса отмечалось в 3,3% случаев. В 83,3% мазков лейкоциты были единичные, большого количества лейкоцитов не отмечалось (табл. 4).
Степень чистоты влагалища до лечения в 96,7% случаев была IV; II степени чистоты влагалища до лечения в исследуемой группе пациентов не было. После курса лечения препаратом «Метрогил Плюс» в виде вагинального геля в 76,6% случаев стала II степень чистоты.
Данные, приведенные в табл. 5, наглядно демонстрируют достаточно высокий комплаенс использования препарата «Метрогил Плюс» в виде вагинального геля.
Таким образом, на основании проведенного исследования можно сделать вывод о высокой клинической и лабораторной эффективности использования препарата «Метрогил Плюс» в виде вагинального геля при коррекции дисбиотических состояний влагалищного биотопа. Наличие в составе препарата двух высокоэффективных компонентов— метронидазола и клотримазола, гелевой основы, обусловливающей равномерное распределение активных компонентов на слизистой оболочке, в сочетании с высоким комплаенсом, предопределяют максимально широкое применение Метрогила Плюс в качестве препарата «первой линии» у женщин с вагинальными дисбиозами.
По вопросам литературы обращайтесь в редакцию.
Н. В.Спиридонова, доктор медицинских наук, доцент М. Е.Шляпников, кандидат медицинских наук, доцент Е. А.Махлина *СГМУ, *клиника «Панацея», Самара