Дисбиоз неуточненной этиологии у женщин что это такое
Оптимизация терапии вагинальных дисбиозов
Изучение микроэкологии влагалища (вагинального биотопа), начатое более 100 лет тому назад А. Дедерлейном, показало, что настоящая экосистема сложная, многокомпонентная, гормонально зависимая и легкоранимая.
Изучение микроэкологии влагалища (вагинального биотопа), начатое более 100 лет тому назад А. Дедерлейном, показало, что настоящая экосистема сложная, многокомпонентная, гормонально зависимая и легкоранимая. Состояние ее динамического равновесия определяется, во-первых, уровнем гликогена в клетках эпителия влагалища, который в свою очередь связан с функциональным состоянием яичников, затем концентрацией лактофлоры, рН влагалищного содержимого и состоянием местного иммунитета.
Наличие индигенной флоры является одним из основных механизмов защиты половых путей от патогенных бактерий. Выраженный антагонистический эффект в отношении широкого круга патогенов проявляют лактобациллы, которые помимо образования молочной кислоты продуцируют перекись водорода, и бактериоцины, угнетающие развитие посторонних микробов. Кроме того, лактобактерии и неспорообразующие анаэробы проявляют высокую конкурентоспособность в заселении экологической нищи. Имеет большое значение и фактор адгезии индигенной флоры между собой и к поверхности эпителиоцитов. Специфическое прикрепление обеспечивается как за счет выростов в виде пилей и фимбрий, так и особыми химическими агентами— лектинами-гликопротеинами. В результате таких взаимодействий формируется гликокаликс, защищающий микробный пул от воздействия неблагоприятных факторов— антител, лизоцима, бактериофагов. Все вышеперечисленное входит в понятие «колонизационная резистентность», означающее совокупность механизмов, придающих стабильность влагалищного биотопа и предотвращающих заселение данной ниши.
В последнее десятилетие все больше внимания уделяется проблеме микозов, актуальность ее обусловлена продолжающимся ростом заболеваемости различными видами грибковой инфекции во всем мире, в частности, хроническими кандидозами кожи и слизистых, висцеральными микозами с поражением желудочно-кишечного тракта, респираторной системы и репродуктивных органов.
В акушерской и гинекологической практике прослеживается явная тенденция увеличения числа заболеваемости инфекционными процессами нижнего отдела гениталий, в частности бактериальным вагинозом и кандидозной инфекцией. Последние два заболевания зачастую объединяют в понятие «дисбиоз влагалища», который можно определить как полимикробный инфекционный синдром, представляющий собой патологию экосистемы влагалища, вызванную дисбалансом, проявляющимся уменьшением количества ферментирующих лактобацилл с одновременным увеличением количества условно-патогенных микроорганизмов.
В нашей стране вагинальный дисбиоз прочно занимает одно из ведущих мест в структуре причин обращений пациенток на амбулаторно-поликлинический этап оказания медицинской помощи населению. Внедрение современных технологий в клиническую микробиологию позволило существенно расширить представления специалистов и наглядно продемонстрировать, что отрицательное воздействие эндогенных и экзогенных факторов на микрофлору биотопов макроорганизма различной локализации, в том числе влагалища, ведет к развитию разнообразных патологических процессов как воспалительного, так и невоспалительного генеза. Несмотря на значительные успехи, достигнутые в диагностике, терапии и профилактике дисбиозов влагалища, их частота продолжает оставаться высокой (Стрижаков А. Н. с соавт., 2003; Радзинский В. Е. с соавт., 2006; Кира Е. Ф. с соавт., 2007; Макаров О. В. с соавт., 2007; Culligan P. J. et al., 2005; Klebanoff M. A. et al., 1991, 2005).
Одной из важных причин этого является рост числа иммунодефицитных состояний, наблюдаемый на фоне ухудшения экологической обстановки, нерационального питания, стрессов, «бума самодиагностики и самолечения» с бесконтрольным применением лекарственных средств, в первую очередь антибиотиков. Чаще всего генитальная инфекция обусловлена несколькими патогенными факторами: вирусами, бактериями, грибами, простейшими, которые вызывают схожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Анализ видового и количественного состава микрофлоры влагалища пациенток с урогенитальным кандидозом позволил выделить В. И. Кисиной с соавт. (1999) следующие типы вагинального микроценоза у обследованных женщин:
I тип. Выделение дрожжеподобных грибов рода Candida с сохранением лактофлоры у 12,1% пациенток в концентрации 10 4 –10 5 КОЕ/мл, у 18,97%— в концентрации 10 6 –10 7 КОЕ/мл.
IIа тип. Выделение дрожжеподобных грибов рода Candida в количестве 105–107 КОЕ/мл на фоне полимикробной микрофлоры с наличием Gardnerella vaginalis и/или Mobiluncus, «ключевых» клеток, снижения/отсутствия лактобацилл у 12,1% пациенток.
IIб тип. Картина микроценоза, аналогичная таковой при типе IIа, в ассоциации с Mycoplasma hominis и/или Ureaplasma urealyticum в количестве 4 –10 6 КОЕ/мл в ассоциации с Chlamydia trachomatis, с сохранением лактофлоры у 22,4% пациенток.
IVa тип. Выделение дрожжеподобных грибов рода Candida в количестве 10 5 –10 7 КОЕ/мл в ассоциации с С. trachomatis, M.hominis и/или U.urealyticum, с сохранением лактофлоры у 8,6% пациенток.
IVб тип. Выделение дрожжеподобных грибов рода Candida в количестве 10 5 –10 7 КОЕ/мл в ассоциации с М.hominis и/или U.urealyticum, с сохранением лактофлоры у 24,1% пациенток.
Кроме этого, у 87,9% пациенток обнаружен один или несколько факультативно-анаэробных микроорганизмов (стафилококки, коринебактерии, кишечная палочка, энтерококки) в концентрации от 10 3 до 10 6 КОЕ/мл.
При анализе результатов изучения кишечного микроценоза установлено умеренное уменьшение численности популяции бифидобактерий, лактобактерий в сочетании с резким снижением содержания полноценных Escherichia coli у 56,9% пациенток. Наряду с изменениями количественного состава нормальной микрофлоры зарегистрированы и ее качественные сдвиги: значительное увеличение количества лактозонегативных энтеробактерий у 53,4% пациенток, Escherichia coli со сниженными ферментативными свойствами у 20,7%, кокковых форм в количестве 10 6 –10 8 КОЕ/мл (Staphilococcus aureus, S.saprophiticus, S.epidermidis) у 77,6% пациенток. Повышенная пролиферация дрожжеподобных грибов рода Candida в количестве 10 5 –10 8 КОЕ/мл обнаружена в кишечнике у 46,6% обследованных.
Следует отметить, что манифестация кандидозной инфекции на фоне уже имеющегося инфекционного процесса влагалища усугубляет течение последнего и затрудняет лечение. Таким образом, формируется своеобразный порочный круг: кольпиты любой этиологии способствуют активации вульвовагинального кандидоза, который, в свою очередь, осложняет течение и усложняет лечение кольпита, обусловленного бактериально-вирусной инфекцией (Краснопольский В. И. с соавт., 2005; Мальцева Л. И. с соавт., 2004, 2007).
Все чаще приходится сталкиваться с необоснованными подходами к диагностике и лечению вульвовагинального кандидоза, что объясняется, с одной стороны, недостаточно полной осведомленностью врачей в вопросах современных особенностей этиологии и патогенеза настоящего заболевания, с другой стороны, излишне агрессивным лоббированием интересов производителей как оригинальных, так и генерических антимикотиков. Одним из вопросов, важных для гинекологов, сталкивающихся с проблемой кандидозной инфекции, является причина ее резистентности к традиционным методам терапии.
Традиционными подходами к лечению вагинальных дисбиозов следует признать различные методы, основанные на стадийности проводимого лечения и базирующиеся на понятиях коррекции, элиминации и восстановления влагалищного биотопа (Кира Е. Ф., 2001, 2007; Кондулукова И. А. с соавт., 1999; Линева О. И. с соавт., 2005; Мельников В. А., 2007; Шляпников М. Е., 2005, 2008). Применяемые для коррекции многокомпонентные препараты для локального (интравагинального) введения всегда оставались популярны как среди практикующих врачей, так и среди пациенток, благодаря высокой комплаентности, относительно невысокой стоимости курса лечения в сочетании с достаточной клинической и микробиологической эффективностью.
Одним из таких препаратов, появившихся в последнее время на российском рынке, является «Метрогил Плюс» в виде вагинального геля, содержащий наряду с традиционно используемым для лечения бактериального вагиноза метронидазолом, антимикотический компонент— клотримазол, что дает полное основание для использовании препарата в первую очередь для коррекции бактериального вагиноза, сочетанного с микотической инфекцией. Обоснованным следует считать введение в состав препарата именно клотримазола, поскольку, согласно исследованием последних лет (Кудрина М. И. с соавт., 2005; Пестрикова Т. Ю с соавт., 2005), параллельно с ростом резистентности грибов к флуконазолам происходит процесс восстановления чувствительности к таким ранее традиционно используемым на протяжении десятилетий препаратам, как нистатин и клотримазол (Жестков А. В. с соавт., 2007; Шляпников М. Е. с соавт., 2008). Дополнительным преимуществом препарата, выгодно отличающим его от большинства вагинальных форм, следует отметить гелевую основу, способствующую максимально равномерному распределению активных компонентов препарата на слизистой оболочке влагалища и экзоцервикса.
Нами проведено проспективное исследование эффективности использования препарата у 30 женщин репродуктивного возраста с верифицированным состоянием дисбиоза влагалища.
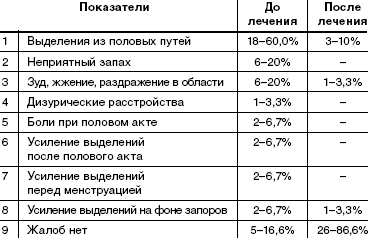
При анализе жалоб, с которыми обратились пациентки, выявлено, что большинство пациенток беспокоит наличие выделений из половых путей (60%), выделения с неприятным запахом (20%), наличие зуда, жжения в области вульвы и промежности (20%). У 4 пациенток (13,3%) выделения усиливались и начинали беспокоить только после полового акта или перед менструацией. У 2 пациенток (6,7%) выделения усиливались на фоне запоров кишечника (табл. 1).У 5 (16,6%) пациенток жалобы отсутствовали. Диагноз был поставлен при профилактическом обращении после гинекологического осмотра и микроскопии влагалищных выделений.
После пятидневного курса лечения препаратом «Метрогил Плюс» в виде вагинального геля субъективные жалобы отсутствовали у 86,6% женщин. У 10% сохранялись жалобы на выделения из половых путей: 1 случай (3,3%)— только выделения, 1 случай (3,3%) выделения в сочетании с усиливающимся зудом, 1 случай (3,3%) жалобы на усиление выделений на фоне запора.
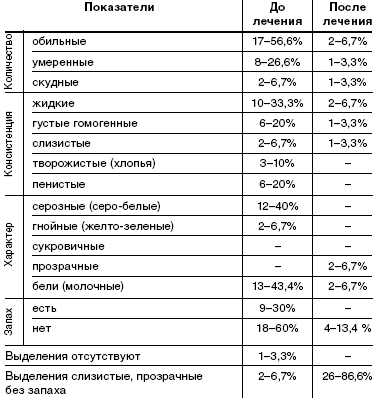
Характер выделений описан в табл. 2. До лечения у пациенток при гинекологическом осмотре выделения носили следующий характер: в основном обильные (56,6%), жидкие (33,3%) или пенистые (20%), серо-белые (40%) или молочные (43,3%), с неприятным запахом(60%). У 3 женщин из 30 (10%) при гинекологическом осмотре выделения соответствовали норме.
При осмотре после лечения препаратом «Метрогил плюс» в виде вагинального геля у 26 (86,6%) пациенток выделения имели критерии нормы: умеренные, слизистые, прозрачные, без запаха. У 4 пациенток (13,4%) выделения имели патологический характер: обильные 6,7%, жидкие 6,7%. Серозных, гнойных, пенистых, с неприятным запахом выделений после лечения не наблюдалось.
Из табл. 3 видно, что у большинства пациенток слизистая влагалища при вагинальном дисбиозе не изменена (63,3%). Но у 26,6% пациенток отмечалась гиперемия слизистой влагалища, у 6,7%— отечность, в 1 случае (3,3%)— мацерация слизистой влагалища.
После лечения в 96,7% видимой патологии слизистой влагалища не отмечается. В 1 случае (3,3%) сохранялась умеренная гиперемия.Эффективность действия препарата по этому признаку составляет 91%.
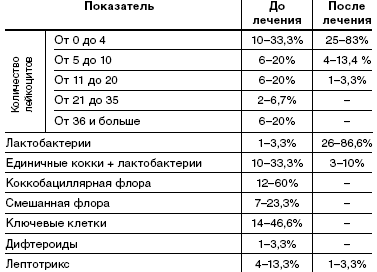
При анализе микроскопии влагалищного содержимого у пациенток исследуемой группы до лечения в 20% в мазке большое количество лейкоцитов, в 60% коккобациллярная флора, в 46,6%— в мазке «ключевые клетки», в 23,3% смешанная флора. Влагалищная флора, состоящая только из лактобактерий, в одном случае— 3,3%.
После лечения у 86,6% пациенток влагалищная флора состояла только из лактобактерий, лактобактерии с единичными кокками у 10% пациенток, наличие лептотрикса отмечалось в 3,3% случаев. В 83,3% мазков лейкоциты были единичные, большого количества лейкоцитов не отмечалось (табл. 4).
Степень чистоты влагалища до лечения в 96,7% случаев была IV; II степени чистоты влагалища до лечения в исследуемой группе пациентов не было. После курса лечения препаратом «Метрогил Плюс» в виде вагинального геля в 76,6% случаев стала II степень чистоты.
Данные, приведенные в табл. 5, наглядно демонстрируют достаточно высокий комплаенс использования препарата «Метрогил Плюс» в виде вагинального геля.
Таким образом, на основании проведенного исследования можно сделать вывод о высокой клинической и лабораторной эффективности использования препарата «Метрогил Плюс» в виде вагинального геля при коррекции дисбиотических состояний влагалищного биотопа. Наличие в составе препарата двух высокоэффективных компонентов— метронидазола и клотримазола, гелевой основы, обусловливающей равномерное распределение активных компонентов на слизистой оболочке, в сочетании с высоким комплаенсом, предопределяют максимально широкое применение Метрогила Плюс в качестве препарата «первой линии» у женщин с вагинальными дисбиозами.
По вопросам литературы обращайтесь в редакцию.
Н. В.Спиридонова, доктор медицинских наук, доцент М. Е.Шляпников, кандидат медицинских наук, доцент Е. А.Махлина *СГМУ, *клиника «Панацея», Самара
Дисбиоз влагалища как междисциплинарная проблема. Взгляд с позиций гинеколога и иммунолога. Методы, пути и перспективы решения (интервью с Т.Н. Бебневой и А.А. Дышковцом)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Развитие клинической практики и лечение заболеваний в современных условиях невозможны без использования системного подхода, т. е. комплекса методов, рассматривающих организм пациента в единстве и взаимодействии его органов и систем. Системный подход довольно давно стал неотъемлемым условием успешной диагностики, лечения и профилактики многих заболеваний. Причем настолько давно, что в некоторых случаях приобрел формализованный, условный характер. В то же время узкая специализация существенно изменила суть медицинской практики, а потому наиболее сложными для лечения и профилактики являются состояния, которые требуют междисциплинарного подхода. Одной из таких проблем, дисбиозу влагалища, и была посвящена беседа корреспондента «РМЖ» с сотрудником клинико-диагностического отделения лечебно-реабилитационного отдела ФГБУ «НМИЦ эндокринологии» Минздрава России гинекологом к.м.н. Т.Н. Бебневой и аллергологом-иммунологом ФГБУ «Поликлиника № 3» к.м.н. А.А. Дышковцом.
Ключевые слова: дисбиоз влагалища, бактериальный вагиноз, вульвовагинальный кандидоз, папилломавирусная инфекция, мукозальный иммунитет, топические иммуномодуляторы, глицирризиновая кислота.
Для цитирования: Дисбиоз влагалища как междисциплинарная проблема. Взгляд с позиций гинеколога и иммунолога. Методы, пути и перспективы решения (интервью с Т.Н. Бебневой и А.А. Дышковцом). РМЖ. Мать и дитя. 2020;3(3):157-162. DOI: 10.32364/2618-8430-2020-3-3-157-162.
The advances in clinical practice and the treatment for various disorders in the current context are not possible without using a systemic approach, i.e., a set of methods that view a patient with respect to the whole and, in particular, the interactions between the organs and systems. Systemic approach is a prerequisite for the successful diagnosis, treatment, and prevention of many diseases. However, this approach is used for such a long time that sometimes it becomes a formal and conditional one. Meanwhile, narrow specialization has greatly changed the essence of medical practice. Therefore, the conditions which require an interdisciplinary approach are the most complex diseases to manage and prevent. We have interviewed T.N. Bebneva, Cand. of Sci. (Med.), the gynecologist of the Clinical Diagnostic Department of the Treatment and Rehabilitation Division of the National Medical Research Center of Endocrinology, and A.A. Dyshkovets, Cand. of Sci. (Med.), the allergist of the Polyclinics No. 3, on vaginal dysbiosis.
Keywords: vaginal dysbiosis, bacterial vaginosis, vulvovaginal candidiasis, papillomavirus infection, mucous immunity, topical immunomodulators, glycyrrhizinic acid.
For citation: Vaginal dysbiosis is an interdisciplinary issue. Perspectives from a gynecologist and immunologist. Methods, options, and prospects for addressing (interview with T.N. Bebneva and A.A. Dyshkovets). Russian Journal of Woman and Child Health. 2020;3(3):157–162. DOI: 10.32364/2618-8430-2020-3-3-157-162.
Актуальность проблемы дисбиозов урогенитального тракта определяется не только наиболее высокой их распространенностью в практике акушера-гинеколога и неблагоприятным влиянием на течение и исходы беременности, но и сложностью ее решения в рамках одной медицинской специальности.
Если рассматривать общую тенденцию в современной клинической практике, то, как правило, мы наблюдаем три основных подхода. Первый, определяемый медицинскими стандартами и федеральными рекомендациями, довольно консервативен и в большей степени опирается на лечение обострений (манифестаций) воспалительного процесса, вызванного патогенной и условно-патогенной микрофлорой. Второй, так же как и первый, реализуется исключительно акушерами-гинекологами с привлечением средств и методов, включающих в себя лекарственные средства и пособия, направленные на нормализацию микрофлоры, химического гомеостаза слизистых оболочек, и топические иммуномодуляторы. И наконец, третий, довольно редко встречающийся подход — комплексное ведение пациентки группой специалистов (гастроэнтеролога, эндокринолога, аллерголога-иммунолога и проктолога) с учетом индивидуальных особенностей возникновения, течения заболевания и приоритета этиологических и патогенетических факторов данной группы нозологий.
Согласно мировой статистике, бактериальный вагиноз (БВ) занимает одно из первых мест среди заболеваний влагалища. Встречаемость его в популяции колеблется от 12% до 80% в зависимости от контингента обследованных женщин. Частота выявления заболевания у беременных достигает 37–40%. Та же картина характерна и для вульвовагинального кандидоза (ВВК): приблизительно 75% женщин переносят в течение жизни по крайней мере один эпизод этого заболевания, а у 40–50% из них развивается хотя бы один рецидив. Установить диагноз и провести лечение обострения — несложная задача для клинициста. Однако через некоторое время пациентка с высокой вероятностью возвращается к врачу с той же самой проблемой.
Что же является причиной длительного торпидного течения, распространенности в популяции и частого рецидивирования дисбиозов влагалища, в т. ч. и на фоне персистирующих вирусных инфекций урогенитального тракта?
С этим вопросом корреспондент «РМЖ» обратился к специалистам, занимающимся данной проблемой: сотруднику клинико-диагностического отделения лечебно-реабилитационного отдела ФГБУ «НМИЦ эндокринологии» Минздрава России гинекологу к.м.н. Тамаре Николаевне Бебневой и аллергологу-иммунологу ФГБУ «Поликлиника № 3» к.м.н. Андрею Анатольевичу Дышковцу.
Принято считать, что проблема дисбиоза влагалища в большинстве случаев связана с частой сменой половых партнеров, частыми половыми контактами и т. д. А что еще может быть причиной развития этой патологии?
Что касается ВВК, то это мультифакторное заболевание, в развитии которого участвуют несколько компонентов: дисбаланс микробиоты влагалища, рH влагалища, гормональная составляющая, сексуальная активность, предрасполагающие факторы, генетика и особенности штаммов гриба рода Candida. К предрасполагающим факторам следует отнести и снижение защитных сил организма. Отмечу, что после анаэробного бактериального вагиноза ВВК считается второй по распространенности вагинальной инфекцией, поражающей 75–80% женщин. Кстати, БВ и ВВК часто сочетаются, это еще раз косвенно указывает на нарушения в системе иммунной защиты слизистой оболочки влагалища. Здесь самое время передать слово иммунологу для более детального освещения причин и следствий, лежащих в основе этих нарушений.
А.А. Дышковец: Вполне справедливо будет утверждать, что почти во всех процессах воспалительного характера в организме человека иммунная система принимает то или иное участие. В частности, это касается и обсуждаемой нами сегодня проблемы. Говоря о БВ, клинические иммунологи рассматривают эту патологию скорее в глобальном плане, чем в узкоспециализированном. Возникновение целого ряда заболеваний вульвы, влагалища и шейки матки, вызванных патогенной и условно-патогенной микрофлорой, но обретающих новые свойства на фоне изменений экологических и социальных условий существования человека в современном мире, — одна из серьезнейших проблем, с которыми пришлось столкнуться в конце XX — начале XXI столетия. С известной долей уверенности причинами такого положения, помимо промискуитета, можно назвать и изменчивость микроорганизмов, диагностическую и лечебную агрессию, скученность населения, протезирование функции иммунной системы вакцинами, сыворотками, гормонами, модуляторами, эволюционную неподготовленность населения к научно-технической революции, снижение качества жизни и здоровья, постарение, неполноценное питание, усиление миграционных процессов.
Какова роль локального и системного иммунитета при воспалительных заболеваниях влагалища?
А.А. Дышковец: Результаты ряда исследований дают основание считать, что хронические воспалительные заболевания вульвы, влагалища и шейки матки сопровождаются не только изменениями в клеточном и гуморальном звеньях иммунной системы и митохондриальной оксидативной системе, но и нарушениями биоценоза влагалища и мукозальных факторов резистентности, зависимых, в свою очередь, от микрофлоры толстого кишечника, эндокринного статуса и кровообращения в области малого таза, обеспечивающих нормальный гомеостаз этой зоны организма. Помимо нормальной микрофлоры влагалища важную роль в поддержании противоинфекционной защиты органов репродуктивной системы женщины имеет локальный иммунитет слизистых оболочек, основным эффекторным звеном которого служит система иммуноглобулинов (Ig). Во влагалищном содержимом и в слизи цервикального канала выявлены Ig всех классов (A, G, M), однако преобладающим является IgA.
Являются ли вирусно-бактериальные ассоциации следствием нарушений иммунной защиты или, наоборот, их причиной?
Т.Н. Бебнева: В настоящее время в научной среде активно изучаются и обсуждаются причины персистенции инфекции, вызванной вирусом папилломы человека (ВПЧ). Так вот одной из причин признан БВ. Разнообразие вагинальной микробиоты влагалища в сочетании с уменьшением относительной численности Lactobacillus spp. — фактор риска инфицирования и персистенции ВПЧ, а также развития предрака и рака шейки матки. Считается, что сиалидазы и другие вырабатываемые условно-патогенной флорой ферменты при БВ разрушают клетки многослойного плоского эпителия, таким образом создавая условия для инфицирования и персистенции ВПЧ-инфекции. Нельзя не сказать и о таком важном моменте, как эктопия шейки матки, которая является вариантом нормы, но в то же время и очень уязвимой зоной как для бактериальной, так и для вирусной инфекции, что способствует развитию хронического цервицита и препятствует нормальной эпителизации.
Сроки эпителизации могут значительно варьировать в зависимости от эндокринного статуса, приема комбинированных оральных контрацептивов, хронических воспалительных процессов, частоты половых контактов с разными партнерами. Подростки и молодые женщины имеют большую площадь эктопии по сравнению с женщинами более позднего репродуктивного возраста, и под цилиндрическим эпителием находится большое число резервных клеток, являющихся мишенью для ВПЧ.
А.А. Дышковец: Следует признать, что БВ может возникать вследствие нарушений мукозального иммунитета, биоценоза влагалища и сбоев в работе оксидативной системы, а также самостоятельно стать причиной нарушений, приводящих к переходу субклинических форм персистирующих вирусных инфекций урогенитального тракта в клинические. Если мы говорим о персистирующих вирусных инфекциях, вызванных ВПЧ и герпесвирусами, то здесь ситуация гораздо сложнее, чем при бактериальной инфекции, так как данные типы вирусов имеют способность уходить из-под контроля иммунной системы. Поясню это на примере папилломавирусной инфекции.
Основными механизмами защиты организма в условиях «уклонения» ВПЧ от иммунного ответа могут быть: наличие антител (секреторный IgA — sIgA) в цервикальной слизи к основному белку капсида L1 (мукозальный иммунитет); стимуляция клеточных компонентов, участвующих в распознавании и эффекторных реакциях (адаптивный клеточный иммунитет); выработка цитокинов кератиноцитами (врожденный клеточный иммунитет).
Среди цитокинов основными являются:
трансформирующий фактор роста β (TGF-β), который является элементом обратной регуляции иммунного ответа, и прежде всего воспалительной реакции;
фактор некроза опухоли α (TNF-α) — один из самых важных факторов защиты от внутриклеточных паразитов, включая вирусы;
интерлейкины (IL), например IL-1, которые обеспечивают мобилизацию воспалительного ответа;
интерфероны I типа (IFN-α и IFN-β), оказывающие цитопатический эффект, и II типа (IFN-γ) — обеспечивающие поляризацию иммунного ответа Th1/Th2 (T-клеточный иммунный ответ / В-клеточный (гуморальный) ответ).
При сочетании БВ с ВПЧ-инфекцией значительно снижается вероятность естественной элиминации вирусных частиц и возрастает риск развития ассоциированной патологии, в т. ч. и экзофитных кондилом, интраэпителиальной дисплазии, плоскоклеточной интраэпителиальной неоплазии. При этом нарушение влагалищного микробиоценоза также может привести к активации неопластических процессов в цервиковагинальной зоне.
Большинство инфекционных агентов, способных вызывать длительное вялотекущее хроническое воспаление, «избегают» контроля иммунной системы, создавая ситуацию неполноценного иммунного ответа. Данная картина характерна для персистенции ВПЧ и вируса простого герпеса, а также вирусно-бактериальных ассоциаций. При этом не стоит забывать, что с каждым рецидивом (тех инфекций, у которых существует рецидивный сценарий) степень нарушения функций иммунной системы может нарастать. Вопрос об инфекционных ассоциациях ставился относительно инфекций, передаваемых половым путем, очень давно, как причине неэффективности антибактериальной терапии. В настоящее время появились дополнительные объяснения торпидности подобных состояний. К ним относят:
формирование бактериально-лимфоцитарных пленок при БВ. Это один из механизмов защиты бактерий от окружающей среды, в т. ч. и иммунной системы. Биопленка — единый многоклеточный организм с присущим ему циклом развития и кооперативным поведением составляющих его особей, что координируется системой Quorum sensing, основанной на социальном поведении членов микробного сообщества;
возникновение интерферонорезистентности при длительном применении системных препаратов интерферона и индукторов интерферона.
Исследования, касающиеся роли бактериальных ассоциаций, до сих пор не дают ответов на существующие и вновь возникающие вопросы.
С учетом вышесказанного является ли основной концепцией в лечении БВ, ВВК и других дисбиотических состояний использование не только антибактериальных и противогрибковых препаратов, но и препаратов, улучшающих состояние иммунной защиты?
Т.Н. Бебнева: В случае диагностики одного из вышеперечисленных дисбиозов, но при этом в сочетании с вирусной инфекцией, целесообразно после коррекции последних рекомендовать противовирусные препараты. Одним из таких препаратов является глицирризиновая кислота, которая обладает рядом эффектов: противовирусным действием на разные типы ДНК и РНК вирусов in vitro
и in vivo (Varicella zoster; вирус простого герпеса 1 и 2 типов; цитомегаловирус, различные типы ВПЧ, в т. ч. онкогенные). Активированная глицирризиновая кислота прерывает репликацию вирусов на ранних стадиях, вызывает выход вириона из капсида, тем самым не допуская его проникновение в клетки. Кроме того, обладает противовоспалительной активностью, сочетающейся со стимулирующим влиянием на гуморальные и клеточные факторы иммунитета. Важно также отметить ее регенерирующее действие, обусловленное улучшением репарации кожи и слизистых шейки матки и влагалища. Учитывая, что рецидивы БВ встречаются в 30% случаев в первые 3–6 мес. после лечения, важно понимать необходимость назначения препаратов, которые обладают вышеперечисленными свойствами.
А.А. Дышковец: Концепция применения системных иммуномодуляторов «по умолчанию» для БВ неприемлема. Важен дифференцированный подход и разделение средств иммунокоррекции с учетом их точек приложения и выраженности системного действия. Концепция иммунокорригирующей терапии БВ должна опираться прежде всего на комплексный подход с выделением в общем алгоритме поэтапных приоритетов этиотропного лечения, подключения к терапии смежных специалистов при появляющихся к этому объективных показаниях.
В связи с вышесказанным перед клиницистом возникают два вопроса: о необходимости коррекции и выборе метода коррекции описанных нарушений слизистых влагалища и шейки матки у пациенток с персистирующими и манифестирующими вирусными инфекциями на фоне дисбиоза влагалища. Справедливости ради стоит отметить, что многопричинность патологических процессов, возникающих параллельно или последовательно и усугубляющих течение БВ, априори обусловливает сложность выбора средств коррекции, так как по-настоящему универсальных средств с достаточным уровнем доказательности на сегодняшний день не существует. Использование средств системной иммунокоррекции требует взвешенного и обоснованного подхода. Большинство иммуномодуляторов для парентерального и энтерального приема имеют ряд существенных ограничений и недостаточную доказательную базу по вышеуказанным нозологиям. Поэтому в большинстве случаев целесообразно использовать лекарственные средства топической направленности, т. е. действующие непосредственно в очаге воспаления, а применение системных средств тщательно обосновывать.
В настоящее время принято выделять следующие группы топических лекарственных средств.
Биотерапевтические препараты: биомассы лакто- или бифидобактерий в активном или лиофилизированном состоянии (ацилакт, лактобактерин, бифидумбактерин, бифидин). Ограничением биотерапевтических препаратов, используемых в настоящее время в акушерстве и гинекологии для коррекции состояния микрофлоры влагалища, является то, что они содержат штаммы бифидобактерий или лактобактерий, выделенные из кишечника людей. При попадании в нехарактерную для их обитания нишу (влагалище) эти микроорганизмы, обладающие слабой адгезивной активностью по отношению к вагинальным эпителиоцитам, не в состоянии прижиться там на продолжительное время.
Комбинированные препараты, например гель с молочной кислотой и метронидазолом. Однако при их использовании корректируются лишь нарушения в оксидативной системе и частично в микробиоте, а применение ограничено во времени.
Монопрепараты с комплексным действием. Активированная глицирризиновая кислота (спрей Эпиген интим) нормализует локальное соотношение цитокинов Th1 и Th2, снижает уровень IL-1, IL-6, TNF-α, IFN-α до оптимальных значений, повышает содержание IL-4, IL-10, уменьшает концентрацию IgG и увеличивает концентрацию IgА и IgМ, оказывает противовирусное действие (прерывает репликацию вируса на ранней стадии и потенцирует выход вириона из капсида) и противовоспалительное действие (тормозит выброс кининов и простагландина). Применение практически не имеет ограничений по длительности и не зависит от фазы воспаления. Хорошо комбинируется с препаратами других групп вплоть до синергетического эффекта. Регенерирующее действие обеспечивает восстановление целостности слизистой и ее функциональной активности. Средство показано как для лечения, так и для профилактики рецидивов генитальных инфекций.
а) цитокиновые: суперлимф (стандартизированный комплекс цитокинов IL-1, IL-2, IL-6, TNF-α, фактора ингибирующего миграцию фагоцитов, трансформирующего фактора роста). Усиливает функциональную активность макрофагов и пролиферативную активность фибробластов, активирует выход лизосомальных ферментов. Однако максимальную эффективность он проявляет лишь в присутствии вирусного или бактериального агентов, а также не показан для профилактического применения;
б) интерфероны: генферон и виферон (интерферон альфа-2b). Подавляют репликацию РНК- и ДНК-содержащих вирусов. Иммуномодулирующие свойства интерферона альфа-2b, такие как усиление фагоцитарной активности макрофагов, увеличение специфической цитотоксичности лимфоцитов к клеткам-мишеням, обусловливают его опосредованную антибактериальную активность;
в) синтетические, например полиоксидоний (суппозитории). Эффект препарата обеспечивается прямой активацией фагоцитов и естественных киллеров, а также стимуляцией антителообразования.
Две последние подгруппы препаратов правильнее было бы отнести к условно-топическим препаратам, так как ввиду особенностей механизма действия их эффекты не могут быть строго ограничены зоной слизистой оболочки.
Выше приведены лишь основные группы препаратов. И список этот постоянно пополняется. Еще раз отметим, что речь идет о топических лекарственных средствах, почти не имеющих ограничений в применении там, где системные иммуномодуляторы противопоказаны.
Из системных препаратов узкой направленности перспективны в использовании лечебные вакцины. В прошлом довольно эффективными показали себя солкотриховак и уросолкотриховак. Из современных — мукозальная вакцина, способствующая продукции антигенспецифического IgA слизистой оболочки и IgG крови на уровнях, способных вызывать эффективную иммунную индукцию (пока это только экспериментальные разработки и результаты клинических испытаний еще недоступны).
При выборе препаратов для лечения БВ необходимо строго обосновывать назначение системных иммуномодуляторов, режим дозирования и длительность применения, а также учитывать показания и доказанную эффективность применения этой группы препаратов. При обследовании пациенток с БВ следует обязательно уточнять частоту и длительность использования иммуномодуляторов, которые, возможно, назначались ранее, но по другим показаниям.
Важная особенность топических иммуно- и биопрепаратов заключается в том, что их можно назначать как с профилактической, так и с лечебной целью. Длительность их применения обусловлена лишь эффективностью и клиническими показаниями. Более широкие показания и хорошая сочетаемость с препаратами других групп делают топические иммуномодуляторы приоритетными при хроническом воспалении. Низкий риск возникновения нежелательных эффектов со стороны системного иммунного ответа, других органов и систем, чувствительных к регуляторам воспаления, ставит эти препараты в ряд средств с высоким индексом безопасности.
На сегодняшний день ситуация с выбором препаратов осложняется тем, что не существует стандартизированной общепринятой и общедоступной методики оценки состояния мукозального иммунитета влагалища. Современные разработки, такие, например, как «Способ оценки состояния мукозального иммунитета при урогенитальной инфекции у беременных», остаются лишь научными разработками. Проблемой является даже простое определение sIgA в вагинальной слизи, не говоря уже о стандартном методе оценки микробиоты влагалища. Споры о «золотом стандарте» оценки БВ ведутся по настоящее время. Клинические критерии БВ (критерии Амселя), микроскопический метод с оценкой баллов по Nugent, микроскопический метод в соответствии со шкалой Ison — Hay являются косвенными, оставляют много неразрешенных вопросов и применяются с неодинаковой частотой в разных медицинских сообществах. Новые молекулярные технологии, такие как пиросеквенирование, MALDI-TOF масс-спектрометрия, техники ДНК-микрочипов, являются более перспективными для изучения микрофлоры влагалища в норме и при патологии, но они малодоступны для обычного клинициста.
В заключение еще раз хотелось бы акцентировать внимание на том, что эффективное лечение дисбиотических состояний влагалища на современном этапе, безусловно, невозможно без комплексного подхода: патогенетического медикаментозного лечения с учетом фазы течения заболевания, изменения режима и рациона питания, образа жизни и половых отношений. Особое внимание следует уделять ведению и контролю периода реабилитации, профилактике повторных обострений.
Редакция благодарит компанию «Инвар» за помощь в организации и проведении интервью.
Editorial Board is grateful to LLC “Invar” for the assistance to organize and manage the interview.
Только для зарегистрированных пользователей