Дисмегакариоцитопоэз что это такое
Дисмегакариоцитопоэз что это такое
Из дисмегакариоцитопоэза при миелодиспластических синдромах в крови определяется, как правило, тромбоцитопения, изредка тромбоцитоз. Частота тромбоцитопении при миелодиспластических синдромах варьирует по различным источникам от 28 до 65 %. Как правило, снижение числа тромбоцитов сочетается с другими цитопениями. Изолированная тромбоцитопения обнаруживается в единичных наблюдениях. В нашей серии наблюдений тромбоцитопения установлена у 68,3 % больных: в составе 3-ростковой цитопении — у 47,6 %, только в сочетании с анемией — у 17,1 %, только в сочетании с лейкопенией — у 2,4 %, изолированная тромбоцитопения — у 1,2%. Тромбоцитоз свыше 400*109/л был обнаружен в 2 % случаев.
Как и по данным других авторов, мы наблюдали несколько большую частоту тромбоцитопении при «продвинутых» вариантах, чем при РА и РАКС.
Морфологические аномалии тромбоцитов при миелодиспластических синдромах заключаются в анизоцитозе и гипогрануляции. В крови появляются гигантские формы тромбоцитов, а также их обломки, фрагменты мегакариоцитов. Описана субпопуляция тромбоцитов, характеризующаяся при фазовоконтрастном микроскопическом исследовании особой выпуклой шарообразной формой мембраны клеток.
Как показали собственные данные, средний объем тромбоцитов был уменьшен до 5,0 фл (при норме 7,2—11,0 фл) в случаях с тромбоцитопенией. Во всех наблюдениях был констатирован анизоцитоз тромбоцитов на основании увеличения показателя PDW (ширина распределения тромбоцитов по объему).
При миелодиспластических синдромах (МДС) выявлены значительные функциональные нарушения тромбоцитов вследствие изменения строения мембранных структур и метаболизма ферментов. В плотных гранулах тромбоцитов уменьшено содержание аденозиндифосфата, серотонина и тром-боцитарного фактора 4. Кроме того, констатировано уменьшение адгезии тромбоцитов к стеклу и коллагену, а также снижение активности фактора 3. Патологические формы тромбоцитов продуцируют, кроме нормального тромбоксана В2, также и тромбоксан А2 с низкой биологической активностью. У ряда больных длительность жизни тромбоцитов существенно короче по сравнению с нормальной (0,5— 2,65 дня и 6,5—12 дней соответственно).
В связи с функциональной неполноценностью тромбоцитов геморрагический синдром отмечен у больных с нормальным числом тромбоцитов. Удлинение времени кровотечения может быть связано с нарушением агрегации клеток, выявляемой во многих случаях миелодиспластических синдромов пробой с индукцией экзогенных активаторов тромбоцитов — эпинефрином, коллагеном, ристоцетином, арахидоновой кислотой.
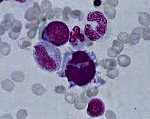
Разнообразные изменения клеток мегакариоцитарного ростка в костном мозге наблюдаются у большинства пациентов. Количество мегакарио-цитов колеблется от единичных клеток до резко повышенных показателей, в том числе в связи с тем, что приблизительная визуальная характеристика мазков не дает точного результата. Подсчет мегакариоцитов в камере также может занизить искомые данные, так как мелкие одноядерные формы неотличимы от клеток гранулоцитарной и моноцитарной линий. Окраска на а-нафтилацетатэстеразу дает возможность визуализировать и идентифицировать на мазках все без исключения патологические формы мегакариоцитов.
Наш опыт свидетельствует о том, что использование цитохимического подхода позволило в отдельных случаях выявить вдвое больше мегакариоцитов, чем при обычной окраске.
Диспластические изменения касаются ядер и цитоплазмы мегакариоцитов. В результате разобщения ядер они располагаются в цитоплазме разъединенно. Вместо многоядерных форм обнаруживаются одно-или двуядерные клетки, а также микроформы мегакариоцитов размером менее 12 мк. Возможно образование мелких мегакариоцитов с компактным ядром, окруженных отложением ретикулина. Цитоплазма клеток либо гипогранулярна, либо содержит аномальные крупные гранулы. Морфологическая аномалия мегакариоцитов определяется в большем числе случаев при РАИБ и РАИБ-Т, чем при РА.
Патологические формы мегакариоцитов сохраняют свою способность отшнуровывать тромбоциты, однако корреляция между числом мегакариоцитов и содержанием тромбоцитов в крови отсутствует. По мнению некоторых исследователей, сочетание двух признаков диспоэза: микрогенераций мегакариоцитов с пельгероидными формами нейтрофилов дает основание для уверенной диагностики миелодиспластического синдрома.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дисмегакариоцитопоэз что это такое
Установление диагноза миелодиспластических синдромов (МДС) основывается на выявлении диспластических изменений одного или нескольких ростков гемопоэза. Морфологические изменения клеток эритро-, гранулоцито- и мегакариоцитопоэза в костном мозге и крови очень разнообразны, соотношение нормальных и диспластических элементов у разных больных существенно варьирует. Принято считать клеточную линию измененной, если число диспластических элементов в ней составляет более 10 %.
Для подтверждения клональности процесса и прогнозирования течения заболевания диагностика миелодиспластических синдромов (МДС) должна непременно включать цитогенетическое исследование клеток костного мозга, особенно при незначительном числе гемопоэтических клеток с признаками дисплазии или отсутствии цитопении.
Нарушения эритропоэза при миелодиспластических синдромах. Анемия — наиболее частая патология кроветворения, наблюдаемая у большинства пациентов. Как показали собственные исследования (82 больных первичными миелодиспластическими синдромами (МДС)), анемия была диагностирована у 95,2 % пациентов: наиболее часто — в составе панцитопении (47,6 %), только в сочетании с лейкопенией — 15,9 % и тромбоцитопенией — 17,1 %. Изолированная анемия обнаруживалась у 14,6 % больных. По данным другого отечественного исследования (71 больной первичным МДС), одноростковая цитопения определялась у 33,9 % больных, двухростковая — у 40,8 %, панцитопения выявлялась наиболее редко — у 25 %.
Обычно анемия носит макро- или нормоцитарный характер. В редких наблюдениях описана микроцитарная анемия, выражающаяся в преобладании микроцитов в общей популяции эритроцитов. По данным нашего исследования, наиболее часто отмечалась макроцитарная анемия (53 %), несколько реже — нормоцитарная (44 %). Микроцитарная анемия была выявлена только у 4 % пациентов.
Использование автоматических анализаторов крови позволяет точно измерить средний объем клеток и охарактеризовать распределение фракций по размеру в популяции эритроцитов. Увеличение среднего объема эритроцитов (MCV) более 100 фл свидетельствует о макроцитозе, уменьшение менее 85 фл — о микроцитозе. Показатель средней концентрации гемоглобина в эритроците (МСН) выше 31 пг свидетельствует о гиперхромном характере изменений, ниже 27 пг — о гипохромном.
В большинстве случаев у больных миелодиспластическими синдромами (МДС) констатируется нормохромная анемия. Следует отметить, что анемия у больных миелодиспластическими синдромами (МДС) может иметь смешанный характер и протекать на фоне хронической железодефицитной анемии, особенно у женщин, поэтому на основании данных автоматического анализатора анемия может быть квалифицирована как нормоили микроцитарная, а также нормо- или гипохромная. Только микроскопическое исследование мазков крови в этих случаях позволяет более точно охарактеризовать свойства эритроцитов.
Количество ретикулоцитов у больных миелодиспластическими синдромами (МДС) может колебаться достаточно широко, обычно их число нормальное или сниженное. Ретикулоцитоз может быть обусловлен появлением патологической фракции длительно живущих клеток (4 дня вместо 36 ч в норме), что позволяет обозначить этот процесс как «псевдоретикулоцитоз». В других случаях выраженность анемии при миелодиспластических синдромах (МДС) может усугубляться за счет продукции антиэритроцитарных антител и гемолиза эритроцитов, который сопровождается ретикулоцитозом. Аутоиммунный гемолиз с ретикулоцитозом определяют у 7—14 % больных, в связи с чем предложено выделять подвариант миелодиспластического синдрома с гемолитическим компонентом анемии.
Дисплазия эритроцитов выражается в изменении их формы, в частности, возникающем вследствие нарушения белков цитоскелета. В мазках крови выявляют пойкилоциты, овалоциты, эллиптоциты, стоматоциты и акантоциты. В литературе приводятся наблюдения о сфероцитозе эритроцитов, предшествовавшем развитию миелодиспластического синдрома. Для картины крови характерны также тельца Жолли, кольца Кеббота, базофильная пунктация цитоплазмы и ядросодержащие эритроциты. Подобные признаки не являются строго специфичными для миелодиспластического синдрома и могут быть обнаружены при различных других патологических состояниях.
Наличие нормоцитов в периферической крови наблюдается у 1/4— 1/3 больных миелодиспластическими синдромами (МДС). По нашим наблюдениям, нормоциты присутствуют у 26 % больных первичными миелодиспластическими синдромами (МДС), среднее количество нормоцитов составляет 1,7 ± 1,4 на 100 лейкоцитов.
Данные автоматических анализаторов и тщательное морфологическое исследование мазков являются важными условиями для правильной оценки количественных и качественных параметров красной крови.
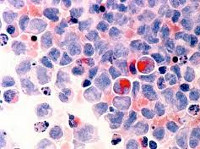
В пунктате костного мозга определяется либо резкое уменьшение (до 5 % всех ядросодержащих клеток), либо расширение (до 90 %) красного ростка. Наиболее частым признаком дизэритропоэза является его мегалобластоидный характер, наблюдаемый почти у 90 % больных. В этих случаях определяются макронормобласты как с базофильной окраской цитоплазмы, так и с оксифильной. Встречаются многоядерные формы нормобластов и клетки с цитоплазматической перемычкой. Цитоплазма клеток окрашена неравномерно, включает тельца Жолли и имеет неправильные очертания. Ядра дольчатые, фрагментированные, клетки соединяются ядерными мостиками вследствие нарушенного митоза. Встречаются двух- и многоядерные формы. Структура хроматина — разреженная.
При цитохимическом исследовании реакции Перлса в части случаев в нормобластах определяют резкое увеличение числа (более 10) сидерофильных гранул, расположенных венчиком вокруг ядра. Они представляют собой митохондрии с избыточным накоплением железа. Такие клетки обозначаются как кольцевые сидеробласты. В отдельных работах имеются указания на то, что сидеробластоз при миелодиспластическх синдромах (МДС) может ассоциироваться с редко встречающимся микроцитарным характером анемии].
Нарушение строения органелл эритроцитов сопровождается образованием патологических форм гемоглобина. В литературных источниках указывается, что HbF обнаруживается у 87,5 % пациентов РА, причем преимущественно в эритробластах (F-бластах), но не в эритроцитах, что свидетельствует, по мнению авторов, о неспособности эритробластов к нормальной дифференцировке.
Диспластические нарушения клеток эритроидного ростка включают изменения энзимного спектра клеток. Снижается активность ферментов гликолиза, повышается содержание а-нафтилацетатэстеразы и кислой фосфатазы в нормобластах и эритроцитах. В части случаев наблюдается увеличение содержания ШИК-положительного вещества в диффузной и гранулярной форме. Однако эти цитохимические особенности не являются специфичными для миелодиспластических синдромов (МДС) и могут быть обнаружены при других гемобластозах.
Представляют интерес наблюдения миелодиспластических синдромов (МДС), при которых в клетках эритроидного ростка обнаружены ферменты, характерные только для нейтрофилов. Так, в нормобластах костного мозга цитохимическим методом обнаружена щелочная фосфатаза, а электронно-микроскопическим — пероксидаза. По нашим данным, щелочная фосфатаза в нормобластах присутствует у 69 % больных миелодиспластическими синдромами, число ферментсодержащих клеток составляет 2—63 %. Указанные цитохимические особенности эритроидных предшественников выявляются при любых вариантах заболевания и свидетельствуют о глубоких нарушениях процесса дифференцировки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Дисмегакариоцитопоэз что это такое
Лейкопения у больных миелодиспластическими синдромами встречается нередко, хотя частота ее выявления существенно варьирует, по данным разных исследователей, от 25 до 90 %. Лейкоцитоз обычно наблюдается в единичных случаях, как правило, у больных ХММЛ или при сопутствующих инфекциях. По данным нашего исследования, у больных первичными миелодиспластическими синдромами (МДС) лейкопения отмечается у 64,7 % больных, как составляющая панцитопении — 47,6%, только в сочетании с анемией — 17,1 %, только с тромбоцитопенией — 2,4 %.
Изолированная лейкопения была выявлена у 1,2 % больных. Ней-тропения менее 1,5•10 9 /л диагностировалась у половины больных.
Лейкопения обычно коррелирует с выраженностью нейтропении. У 30—80 % больных миелодиспластическими синдромами (МДС) в гемограмме отмечается сдвиг формулы крови влево до миелоцитов. В ряде случаев в крови определяют увеличение числа эозинофилов и базофилов (до 5 %), при «продвинутых» вариантах — наличие миелобластов, в том числе с палочками Ауэра. Обязательным диагностическим признаком ХММЛ является абсолютный моноцитоз (свыше 1,0•109/л).
Наряду с количественными изменениями в гранулоцитарном и моноцитарном ростках в крови отмечают также и диспластические нарушения клеток. Последние более отчетливо выявляются при исследовании пунктатов костного мозга. Однако с высокой степенью достоверности установлено, что частота аномальных форм нейтрофилов в крови и костном мозге идентична. Наш опыт сравнения подсчета цитограммы нейтрофилов с выделением патологических форм тремя независимыми морфологами показал, что факт аномалий в каждом случае устанавливается всеми экспертами, а расхождения в 13 % случаев касались только количественной оценки частоты аномалий.
Признаки дисплазии нейтрофилов крови и костного мозга определяют у большинства больных миелодиспластическими синдромами (МДС). К проявлениям дисплазии относят уменьшение или увеличение зернистости цитоплазмы, снижение или увеличение сегментированности ядер, пельгероидные (синонимы — пельгероподобные, псевдопельгеровские) формы гранулоцитов. Частота обнаружения пельгероидных форм гранулоцитов у разных исследователей различается существенно, однако многие авторы сходятся во мнении, что при РА эти патологические формы выявляются реже, чем при «продвинутых» вариантах.
В наших наблюдениях пельгероидные формы гранулоцитов определялись в 43 % из 63 случаев первичных миелодиспластических синдромов (МДС), в наблюдениях М. А. Заваденко — в 28 % из 71 случая. В исследовании Л. И. Яворковского и соавт. частота пельгероидных форм гранулоцитов варьировала от 45 % при РА до 68 % при РАИБ. Наибольшее число случаев обнаружения пельгероидных гранулоцитов указывают R. Hast и соавт. — 84 %. К более редким проявлениям дисплазии относят изменение хроматина ядер нейтрофилов, который имеет форму грубо конденсированных блоков, разделенных светлыми промежутками, имитирующими сегментацию ядра. М. Tomonaga и соавт. показали, что подобная патология может встречаться как при миелодиспластических синдромах (МДС), так и при апластической анемии (АА)].
Другим частым признаком дисгранулопоэза является снижение зернистости в цитоплазме вплоть до полного ее исчезновения. По нашим данным, снижение зернистости нейтрофилов обнаруживается у 65 % больных, по данным других исследований — у 45 %. В редких случаях в нейтрофилах могут встречаться тельца Чедиака—Хигаси — крупные азурофильные гранулы, представляющие собой лизосомы.
Помимо перечисленных выше нарушений клеток нейтрофильного ряда, для миелодиспластических синдромов (МДС) характерно наличие гигантских форм нейтрофилов. В наших наблюдениях при первичных миелодиспластических синдромов гигантские формы грануло-цитов в среднем количестве 15 % обнаружены у 85 % больных.
Значительные сложности для трактовки представляют собой дисплазированные клетки моноцитарного ряда. Ядра моноцитов имеют гиперсегментированную или, наоборот, округлую форму. Цитоплазма клеток резко базофильна. В моноцитах возможно большое количество включений, и при наличии округлого ядра их трудно отличить от миелоцитов. Эти клетки иногда обозначают как миеломоноциты.
Изучение функций нейтрофилов и моноцитов включает различные физиологические пробы со стимуляторами, цитохимические, иммунофенотипиче-ские и радиобиологические методы, а также клонирование клеток в искусственных средах. Выявлены снижение фагоцитоза, адгезии, антибактериальной активности и хемотаксиса клеток. Результаты некоторых исследований свидетельствует о том, что при «продвинутых» вариантах миелодиспластических синдромов изменения функций нейтрофилов выражены в большей степени, чем при РА.
Нарушение энзимного статуса — характерное проявление дисгранулопоэза. Уменьшение уровня щелочной фосфатазы вплоть до полного ее исчезновения, впервые описанное при ХМЛ, выявлено также при ОМЛ и миелодиспластических синдромах. Дефицит фермента при МДС обнаруживается с разной частотой: по данным Л. И. Яворковского и соавт. — у 32 % больных, по нашим наблюдениям — у 34 %, в работе К. Bendix-Hansen и соавт. —у 50 %.
Дефицит миелопероксидазы обнаруживается реже, чем щелочной фосфатазы: по данным К. Bendix-Hansen и G. Kemdrup — в 25 % случаев, по нашим данным — в 10 %. Полученные показатели подтверждают результаты исследования крови на автоматических анализаторах. На основании многократных анализов на автоматическом анализаторе Техникой Н-1 (Technicon Chemicals Co. S. А., Бельгия) нами было установлено, что дефицит пероксидазы в нейтрофилах у пациентов с миелодиспластическими синдромами (МДС) сохранялся стабильно на протяжении многих месяцев.
В моноцитах и монобластах наряду с характерной активностью неспецифической эстеразы (а-нафтилацетатэстеразы, чувствительной к фториду натрия) может выявляться ASD-хлорацетатэстераза, специфичная для гранулоцитов. Это указывает на то, что моноциты при миелодиспластических синдромах (МДС) в части случаев обладают признаками двойной дифференцировки: моноцитарной и гранулоцитарной. Энзимный статус моноцитов при миелодиспластических синдромах может претерпевать и другие изменения. Как показало крупное исследование, в которое было включено 380 больных с миелодиспластическими синдромами (МДС), в 14 % случаев было констатировано отсутствие в моноцитах а-нафтил-ацетатэстеразы.
Эти нарушения в определенных случаях затрудняют дифференциальную диагностику, так как только цитохимические исследования иногда дают возможность отличить дисплазированные моноциты от молодых элементов гранулоцитарного ряда.
Цитохимические исследования ферментов нейтрофилов и моноцитов не имеют решающего значения в диагностике миелодиспластических синдромов, однако способствуют выявлению неполноценности обменных процессов в клетках. В тех случаях, когда морфологические признаки дисплазии выражены неотчетливо, цитохимические данные могут способствовать более точной характеристике патологического процесса. Клинически дисгрануломоноцитопоэз проявляется частыми инфекционными осложнениями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021