Дисплазия и метаплазия в чем разница
Как определить риск развития аденокарциномы желудка у пациентов с метаплазией и дисплазией?
Материалы и методы
В популяционное исследованиебыл включен 4331 пациент с диагностированной дисплазией или кишечнойметаплазией с 1997 по 2006 год, за которыми впоследствии продолжали наблюдатьвплоть до декабря 2013 года.
В работе оценивали частотуразвития желудочной аденокарциномы и факторы, предрасполагающие к прогрессииметаплазии и дисплазии. Сравнение проводилось с общей популяцией.
Среди 4146 пациентов с кишечной метаплазией и 141 больногос дисплазией низкой степени за период наблюдения (24 440 человек/лет) былидиагностированы 17 и 6 случаев аденокарциномы желудка.
Заболеваемость аденокарциномой составила 0.72/1000человек/лет для лиц с кишечной метаплазией, относительный риск 2.56 (95% CI,1.49–4.10) и 7.7/1000 человек/лет для лиц с дисплазиейнизкой степени, относительный риск 25.6 (95% CI, 9.4–55.7).
Среднее время прогрессии до аденокарциномы желудка упациентов с кишечной метаплазией составляло 6.1 год, у пациентов с дисплазиейнизкой степени 2.6 года.
Кишечная метаплазия и дисплазия выступают в качествеосновных предикторов желудочной аденокарциномы. При этом низкий рискзлокачественной трансформации, ассоциированный с кишечной метаплазией, неподдерживает рутинное проведениеэндоскопического исследования. Однаконаблюдение необходимо за пациентами с дисплазией.
Источник: Dan Li,Marita C Bautista, Sheng-Fang Jiang, Paras Daryani, Marilyn Brackett, Mary AnneArmstrong MA, Yun-Yi Hung, Debbie Postlethwaite, Uri Ladabaum. Risks and Predictors of GastricAdenocarcinoma in Patients with Gastric Intestinal Metaplasia and Dysplasia: APopulation-Based Study. Am J Gastroenterol 2016; 111:1104–1113.
Дисплазия и метаплазия в чем разница
Наиболее серьезным осложнением ГЭРБ является пищевод Баррета (метаплазия Баррета), заболевание, являющееся фактором риска развития рака пищевода (аденокарциномы). Перерождение клеток слизистой оболочки при пищеводе Баррета происходит по типу так называемой кишечной метаплазии, когда обычные клетки слизистой оболочки пищевода замещаются клетками, характерными для слизистой оболочки кишечника.
Кишечная метаплазия может перейти в дисплазию (метаплазия и дисплазия – последовательные по нарастающей тяжести изменений процессы перерождения клеток) и затем развиться в злокачественную опухоль. Поэтому метаплазия Баррета является предраковым состоянием, хотя рак пищевода – довольно редкое заболевание, больше распространенное среди мужчин. Распространенность пищевода Баррета среди взрослого населения составляет 8-10%.
Кроме собственно рефлюксной болезни независимым фактором риска развития аденокарциномы пищевода является ожирение. При наличии обоих факторов риск развития аденокарциномы значительно повышается. Однако абсолютный риск аденокарциномы остается достаточно низким даже у людей с выраженными симптомами рефлюкса.
В зависимости от участка пищевода, где развивается метаплазия Баррета (и затем, возможно, аденокарцинома), специалисты разделяют это заболевание на три типа: метаплазия в области длинного сегмента пищевода, метаплазия в области короткого сегмента пищевода (в 3 см и менее от места перехода пищевода в желудок) и метаплазия в области кардиальной части желудка (часть желудка, расположенная сразу после перехода пищевода в желудок).
Распространенность метаплазии Баррета в области длинного сегмента пищевода по данным эндоскопических исследований составляет около 1%. Этот процент возрастает с увеличением тяжести ГЭРБ. Этот тип метаплазии чаще встречается в возрасте 55-65 лет, значительно чаще у мужчин (соотношение мужчин и женщин 10:1).
Метаплазия Баррета в области короткого сегмента встречается чаще, однако, распространенность этого заболевания оценить сложно, так как этот тип метаплазии при эндоскопическом исследовании сложно отличить от метаплазии в кардиальном отделе желудка. При этом злокачественная опухоль при метаплазии в области короткого сегмента пищевода и кардиальной части желудка развивается реже, чем при метаплазии в области длинного сегмента пищевода.
Хотя совершенно очевидно, что метаплазия Баррета в пищеводе возникает на фоне ГЭРБ и иногда приводит к развитию рака пищевода, остается не совсем ясно, почему происходит перерождение клеток по типу кишечной метаплазии в области кардиальной части желудка. Этот тип метаплазии встречается как при ГЭРБ, так и при гастрите при наличии инфекции Helicobacter pylori. Причем согласно данным исследований, метаплазия Баррета с области кардиальной части желудка, скорее всего, развивается на фоне гастрита даже чаще, чем на фоне ГЭРБ. Однако кишечная метаплазия и воспаление в этой области могут появиться и в отсутствии Helicobacter pylori, и в этом случае являться следствием хронического рефлюкса. Распространенность этого типа метаплазии составляет 1,4%.
Хотя непосредственная причина метаплазии Баррета остается неясной, тем не менее, очевидным является тот факт, что метаплазия развивается на фоне ГЭРБ и связана с чрезмерным патологическим воздействием кислоты на слизистую оболочку пищевода. Исследования с использованием рН-мониторирования показали, что у пациентов с метаплазией Баррета значительно увеличена частота рефлюксов и продолжительность пищеводного клиренса. Это может быть связано с выраженным нарушением сократительной функции мышц пищевода, развивающимся вследствие тяжелого эзофагита. Кроме того, у большинства пациентов с тяжелым эзофагитом имеется грыжа пищеводного отверстия диафрагмы.
Кроме того, манометрические измерения в области длинного сегмента пищевода при метаплазии Баррета показали, что при этом имеется снижение тонуса нижнего пищеводного сфинктера и нарушение перистальтики, сходные с таковыми при тяжелом эзофагите. Остается неясным, почему у одних пациентов с выраженным эзофагитом развивается метаплазия Баррета, а у других – нет. Существует предположение, что определенное значение имеет генетическая предрасположенность.
В терапии больных с пищеводом Баррета основное внимание уделяется двум моментам: лечению ГЭРБ, на фоне которой развилась метаплазия, и предотвращение развития аденокарциномы пищевода. Принципы лечения имеющегося эзофагита и метаплазии Баррета остаются такими же, как и при обычной ГЭРБ, с учетом того, что поскольку имеется более выраженное воздействие кислоты на слизистую оболочку пищевода, терапия должна быть более интенсивной. Обычно бывает достаточно назначения ингибиторов протонной помпы, однако, может потребоваться и хирургическое вмешательство в случае неэффективности медикаментозного лечения.
Некоторые специалисты, основываясь на данных исследований, которые показали, что клеточные изменения происходят именно за счет патологического воздействия кислоты на слизистую оболочку желудка, предлагают использовать для лечения пищевода Баррета препараты, подавляющие секрецию соляной кислоты в желудке. Однако клинически не доказано, что применение антисекреторных препаратов или антирефлюксная операция могут предотвратить развитие аденокарциномы пищевода или привести к обратному развитию кишечной метаплазии. Таким образом, основной целью лечения является терапия эзофагита..
Поскольку в настоящее время не известны пути предотвращения развития метаплазии Баррета, действия врача должны быть направлены на уменьшение риска развития рака пищевода. С этой целью пациенты с пищеводом Баррета периодически проходят эндоскопическое обследование с обязательной биопсией на предмет степени перерождения клеток слизистой оболочки пищевода (метаплазия или дисплазия; насколько выраженная).
Сроки обследования устанавливаются в зависимости от тяжести имеющихся изменений слизистой оболочки пищевода. Так пациенты, у которых имеется только метаплазия Баррета без дисплазии, проходят обследование один раз в 2-3 года.
Если обнаружена дисплазия, проводится более тщательное обследование для определения степени дисплазии, так как при дисплазии высокой степени рак может развиться в течение 4 лет.
Пациентам с низкой степенью дисплазии назначается 12-недельный курс ингибиторов протонной помпы в высоких дозах, затем проводится повторное обследование с биопсией. Если обследование подтверждает наличие дисплазии низкой степени выраженности, то в последующем эндоскопия проводится через 6 месяцев, а затем ежегодно, если не отмечено развития дисплазии высокой степени.
Хирургическое лечение пищевода Баррета
Хирургическое лечение пищевода Баррета направлено на снижение количества эпизодов рефлюкса.
Хотя рефлюксная болезнь является фактором риска развития аденокарциномы пищевода, до конца не ясно, само ли существование пищевода Баррета предрасполагает к развитию рака или какие-то другие причины способствуют злокачественно перерождению клеток при наличии пищевода Баррета.
Уменьшению симптомов заболевания способствует как медикаментозное, так и хирургическое лечение пищевода Баррета. Однако по данным исследований даже прием ингибиторов протонной помпы в больших дозах не способствует уменьшению частоты рефлюкса. Поэтому, несмотря на улучшение состояния пациентов вследствие приема лекарств, хирургическое лечение пищевода Баррета имеет большое значение. Кроме того, данные некоторых исследований показывают, что после лапароскопической фундопликации риск развития рака пищевода значительно снижается, по сравнению с медикаментозной терапией. Хотя после хирургической операции повышается риск смертности, что связано с необъяснимым увеличением частоты заболеваний сердца у таких пациентов. В связи с этим решение об операции принимается врачом после тщательного взвешивания всех аргументов за и против хирургического лечения. Если операция проводится опытным хирургом, то ее результат может быть очень хорошим, хотя и не гарантирует полностью исчезновение симптомов заболевания, что иногда требует послеоперационного приема препаратов.
Данные исследований показывают, что медикаментозная терапия, в отличие от хирургического лечения, оказывает меньший эффект на частоту возникновения рефлюкса во время сна. В этой ситуации достаточно эффективными оказываются как лапароскопическая, так и открытая операция.
Кроме того, по некоторым данным, основанным на продолжительных наблюдениях, после фундопликации риск развития дисплазии и рака пищевода ниже, чем после лекарственной терапии.
Хирургическое лечение рекомендуется также пациентам, с пищеводом Баррета в сочетании с наличием грыжи пищеводного отверстия диафрагмы.
Эндоскопическая абляция
Этот метод хирургического лечения пищевода Баррета сопряжен с меньшим риском развития осложнений, чем большая хирургическая операция. Теоретически, данный метод является относительно безопасным.
Методика операции состоит в удалении пораженной части слизистой оболочки пищевода. На этом месте в дальнейшем происходит восстановление нормальной слизистой оболочки, что снижает риск развития рака пищевода. Пораженная часть слизистой оболочки удаляется с помощью воздействия лазерного или другого высокоэнергетического излучения. При этом пациенту назначается дополнительный прием ингибиторов протонной помпы в высоких дозах для улучшения восстановления нормальной слизистой оболочки пищевода.
Операция проводится либо без подготовки, либо после приема специальных препаратов, воздействующих на клетки измененной части пищевода и подготавливающих к лазерному воздействию для улучшения результата операции.
Хирургическое лечение при наличии высокой степени дисплазии
При дисплазии высокой степени риск развития аденокарциномы также становится высоким. Дисплазия может быть обнаружена только на одном участке слизистой оболочки пищевода (фокальная), а может развиться сразу в нескольких местах (мультифокальная), и такая дисплазия сочетается со значительным риском развития аденокарциномы (27% в течение 3 лет).
У пациентов с пищеводом Баррета с высокой степенью дисплазии не всегда целесообразно проведение эндоскопической абляции слизистой оболочки пищевода. Это связано с тем, что при таком подходе достаточно трудно полностью удалить пораженную ткань, а при высокой степени дисплазии риск развития рака пищевода также является высоким, даже при наличии небольшого участка пораженной ткани. Поэтому для проведения эндоскопической операции должны быть строгие показания. Должен быть тщательно оценен риск операции.
Эндоскопическая абляция проводится у тех пациентов, которым не рекомендуется проведение эзофагэктомии (большая операция, при которой удаляется часть пищевода или весь пищевод). В остальных случаях предпочтительным методом хирургического лечения пищевода Баррета с высокой степенью дисплазии остается эзофагэктомия.
Эзофагэктомия является эффективным методом лечения у молодых и в остальном здоровых пациентов, однако сопряжена с относительно высоким риском смертности (3-10%). В связи с этим некоторые специалисты рекомендуют вместо немедленной операции при дисплазии высокой степени у пациентов с пищеводом Баррета поводить постоянное (с высокой периодичностью) эндоскопическое наблюдение.
Поскольку операция удаления пищевода сопряжена с высоким риском, в качестве альтернативного метода хирургического лечения пищевода Баррета с высокой степенью дисплазии применяется эндоскопическая абляция. Эта операция может проводиться термическим, химическим или механическим способом. В любом случае операция состоит в удалении метаплазированного или дисплазированного эпителия в сочетании с интенсивной антисекреторной терапией, что в последующем обуславливает восстановление нормального эпителия слизистой оболочки пищевода.
Эндоскопическая резекция слизистой оболочки пищевода
Это еще один метод хирургического лечения пищевода Баррета. Методика операции состоит в хирургическом иссечении пораженной части слизистой оболочки с помощью специальных эндоскопических инструментов, в том числе электрокоагулятора (который используется, например, при эндоскопическом удалении полипов).
Успех данной операции достаточно высок, однако часто уже в течение первого года после операции может развиться рецидив заболевания.
Термическая абляция производится с помощью электрокоагулятора, аргонового плазменного коагулятора или лазерного облучения. Одним из осложнений данной операции является перфорация пищевода. Другой способ абляции – фотодинамическое облучение с помощью специального прибора. Как и термическая абляция, данный метод может вызвать некоторые побочные эффекты: боль в груди, тошноту и развитие стриктур пищевода. Кроме того, следует предупредить пациентов о том, что после операции необходимо избегать длительного пребывания на солнце, так как возможно развитие реакции повышенной чувствительности к ультрафиолетовому облучению со стороны кожи. Данная процедура является весьма эффективной и приводит к обратному развитию дисплазии у 90% пациентов. Остаточные явления метаплазии Баррета наблюдаются в течение 2-62 месяцев у 58% пациентов, прошедших процедуру фотодинамической абляции.
Механическая абляция заключается в механическом удалении измененной части слизистой оболочки пищевода с помощью специальных эндоскопических инструментов. Эта процедура рекомендуется тем пациентам, у которых наблюдается ранняя стадия развития рака пищевода и которым по тем или иным причинам не может быть проведена большая хирургическая операция (удаление пищевода).
Обзор современных концепций кишечной метаплазии желудка и рака желудка
Обзор современных концепций кишечной метаплазии желудка и рака желудка.
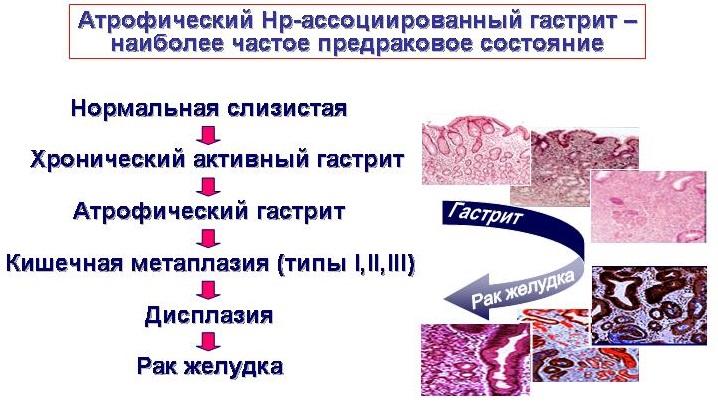
Кишечная метаплазия желудка является предраковым изменением слизистой оболочки желудка и связана с повышенным риском дисплазии и рака. В патогенезе прогрессирования от предраковых состояний к аденокарциноме желудка кишечного типа, согласно предложенного каскада Correa, считают переход от нормального эпителия желудка через воспаление, атрофию, внутрислизистую карциному, и наконец, к инвазивной карциноме. Множественные факторы риска были связаны с развитием взаимосвязи кишечной метаплазии желудка, включая инфекцию желудка H. pylori, генетических факторов, экологической среды, ревматических болезней, табакокурения, питания, желчного рефлюкса и кишечной микробиоты. Во всем мире в странах с высоким уровнем заболеваемости разработаны руководящие принципы скрининга.
Кишечная метаплазия желудка определяется как замена поверхностного, фовеолярного, и/или железистого эпителия кислотопродуцирующей или антральной слизистой желудка кишечным эпителием. Кишечная метаплазия желудка характеризуется анатомически как ограниченный процесс, если он находится в одной области желудка или как обширный, если вовлечены две области желудка. Гистологически кишечная метаплазия желудка считается либо полной, либо неполной. Полный (I тип) кишечная метаплазия определяется слизистой оболочкой тонкой кишки со зрелыми абсорбирующими клетками, бокаловидными клетками (Гоблета) и щеточной каймой. Неполная (II тип) кишечная метаплазия секретирует сиаломуцины и сходна с толстокишечным эпителием с цилиндрическими “промежуточными” клетками на различных стадиях дифференцировки, неравномерными каплями муцина и отсутствием щеточной каймы.
Самый высокий риск развития рака желудка связан с неполным и/или обширной кишечной метаплазией желудка. Систематический обзор, который включал 10 наблюдательных исследований по всей Европе, Азии и Латинской Америке в диапазоне от 10 месяцев до 19 лет наблюдения, показал, что риск рака желудка составляет в 4-11 раз выше при наличии неполной метаплазии по сравнению с ее отсутствием.
Первым изменением в гистологическом каскаде является либо активное хроническое воспаление неатрофического хронического гастрита, характеризующегося наличием желез, либо мультифокальный атрофический гастрит. Последующие гистологические изменения прогрессируют через появление полной метаплазии, неполной метаплазии, дисплазии низкой и высокой степени с последующей карциномой. В Нидерландах было проведено общенациональное когортное исследование для оценки риска развития рака желудка, связанного с различными предраковыми поражениями желудка. Атрофический гастрит, кишечная метаплазия, умеренно выраженная дисплазия, и высокая дисплазия были связаны с ежегодной заболеваемостью рака желудка в 0,1%, 0,25%, 0,6%, и 6,0%, соответственно. Заболеваемость раком желудка, ассоциированным с кишечной метаплазией желудка, в систематических обзорах колеблется от 0% до 10%, причем переменный диапазон обусловлен различными размерами выборки и периодами наблюдения.
Эндоскопический скрининг и наблюдение
Пациентам с высоким риском рекомендовано пройти эндоскопическое обследование с картированием биопсий по модифицированной Сиднейской системе (MSS) из 5 точек – антрального отдела (большая кривизна, малая кривизна), угол желудка и тело желудка (большая кривизна, малая кривизна). Следует отметить, что биопсии тела особенно ценны после длительного лечения ингибиторами протонной помпы, так как кислотопродуцирующая слизистая оболочка может быть изолировано инфицирована H. pylori. Биопсии с угла желудка также особенно важны, так как они, скорее всего, выявят максимальную атрофию, кишечную метаплазию и предраковую дисплазию. De Vries и его коллеги провели проспективное многоцентровое исследование в 2010 году. Золотым стандартом считалось получение 12 биопсий. На основе MSS (5 биопсий) выявили 90% пациентов с кишечной метаплазией желудка и 50% пациентов с дисплазией, в отличие от 97% и 100%, соответственно, когда было получено не менее 7 биопсий. De Vries и его коллеги пришли к выводу, что по крайней мере 9 биопсий, в том числе из кардии, необходимы для адекватного наблюдения предраковых поражений в популяции с низкой частотой рака желудка, к которым относятся европеоиды и белые американцы не испанского, африканского или восточноазиатского происхождения.
В настоящее время ASGE не рекомендуют общее наблюдение за людьми с кишечной метаплазией желудка, если не присутствуют другие факторы риска рака желудка, например, семейного анамнеза рака желудка и азиатского происхождения. Однако, европейский партнер, ESGE, рекомендует лечение H. pylori, если установлено, что пациент заражен бактериями, с последующим картированием биопсий по выявлению дисплазии каждые 3 года. Если слабая дисплазии (LGD) обнаруживается у пациента с кишечной метаплазией желудка, то ЭГДС с картированием необходима в течение 1 года для оценки эндоскопически видимых поражений. Пациентам с подтвержденной дисплазией высокой степени (HGD) при отсутствии эндоскопически видимого поражения рекомендуется повторное ЭГДC через 6-12 месяцев для наблюдения видимых поражений. Эти пациенты с поражениями должны пройти надлежащее либо хирургическую, либо эндоскопическую резекцию из-за высокой вероятности сосуществования инвазивной аденокарциномы, так как 25% пациентов с дисплазией высокой степени могут спрогрессировать до аденокарциномы в течение 1 года.
David S. Jencks, Jason D. Adam, Marie L. Borum, Joyce M. Koh, Sindu Stephen, David B. Doman. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol Hepatol (NY). 2018 Feb; 14(2): 92–101.
Кишечная метаплазия, дисплазия слизистой желудка
Часто приходят на прием пациенты, которым было проведено эндоскопическое исследование желудка и в заключении специалист пишет: «хронический гастрит, кишечная метаплазия». Если о хроническом гастрите наши пациенты наслышаны, то кишечная метаплазия вызывает тревогу и мысли о злокачественном поражении желудка. Так ли это?
Термин «хронический гастрит» обозначает хроническое воспаление желудка, но речь идет не обо всей стенке желудка, а только слизистой оболочке, в которой наряду с воспалительными и атрофическими процессами развивается нарушение обновления клеток слизистой желудка, что является важным признаком гастрита и может определять прогноз хронического гастрита.
О слизистой желудка подробнее
Слизистой желудка свойственно постоянное клеточное обновление. При любых повреждениях слизистой желудка активизируется регенерация, что приводит к восстановлению структуры слизистой. Свидетельством нарушения клеточного обновления при хроническом гастрите служат характерные для него изменения слизистой, нарушение фаз клеточного обновления, которые хорошо известны морфологам и определяются как нарушения морфологической перестройки слизистой оболочки желудка в виде кишечной метаплазии и дисплазии слизистой.
Поэтому при проведении эндоскопического исследования необходимо провести множественные биопсии слизистой желудка, чтобы подтвердить диагноз хронического гастрита, при котором может наблюдаться качественное нарушение регенерации (восстановления) клеток и замещение их несвойственными для желудка или его отделов клетками, т.е. речь идет о замещении желудочного эпителия кишечным. Метаплазия (от греческого «образование, формирование) — стойкое замещение клеток одного типа на клетки другого типа при сохранении видовой принадлежности ткани.
Что представляет собой кишечная метаплазия
Кишечная метаплазия была описана более ста лет назад, и до настоящего времени она изучается, главным образом, из-за возможной связи с раком желудка. Кишечная метаплазия встречается достаточно часто. В пожилом возрасте ее находят и у практически здоровых людей, но особенно часто при атрофическом гастрите почти в 100%. При язвах желудка – в 81%. При язвах 12-перстной кишки – 47%. Рак желудка занимает 4 место в структуре онкологических заболеваний.
Уровень пепсиногенов в крови является маркером хронического атрофического гастрита и риска развития рака желудка. Поэтому проведение определения по анализу крови уровня пепсиногенов и хеликобактерной инфекции улучшает выявление хронического атрофического гастрита и рака желудка.
При подозрении у пациента хронического атрофического гастрита (по результатам гастропанели) показано проведение гастродуоденоскопии с множественной биопсией слизистой желудка. Гистологическое подтверждение кишечной метаплазии является наиболее надежным маркером атрофии слизистой оболочки желудка. Пациенты, у которых диагностирован хронический атрофический гастрит с кишечной метаплазией, находятся в группе риска по развитию рака желудка (аденокарциномы желудка).
Факторами риска кишечной метаплазии могут быть:
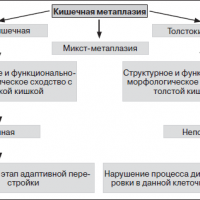
Кишечная метаплазия — типы
В настоящее время различают два типа метаплазии – полную, напоминающую слизистую тонкой кишки, метаплазия 1 типа и неполную, напоминающую слизистую толстой кишки, метаплазия 2 типа.
Полная кишечная метаплазия
Она встречается наиболее часто при хронических гастритах. Тонкокишечный эпителий, образующий участки метаплазии, вообще мало склонен к малигнизации (раковому перерождению). Широко известным фактором является большая редкость рака тонкой кишки. Поэтому полную кишечную метаплазию не относят к предраковым изменениям слизистой. Если наблюдаются проявления хронического гастрита, то динамическое наблюдение и проведение гастродуодкерскопии проводится через 3-5 лет.
В питании показано употреблять продукты, обладающие обволакивающими свойствами — рисовый отвар, кисель, фрукты в запеченном виде, джемы на пектинах, из трав – семя льна.
Неполная кишечная метаплазия
Напоминает слизистую толстой кишки и выявляется у 11% больных всеми доброкачественными заболеваниями желудка, но при раке желудка она наблюдается в 94% случаев. Неполная кишечная метаплазия показала более высокую специфичность этого признака изменения слизистой желудка к раку, но низкая чувствительность (38%) говорит об ограниченном значении ее как показателя прогноза развития рака кишечного типа. Важным фактором при этом имеет большая площадь замещения нормального желудочного эпителия кишечным.
Известна связь хронического атрофического гастрита, кишечной метаплазии и хеликобактер пилори, при которых ликвидация хеликобактера способна предотвратить развитие и прогрессирование атрофии, а также возможно обратное развитие атрофии слизистой желудка. Наличие же кишечной метаплазии является признаком хеликобактерного гастрита. Пациенты с неполной кишечной метаплазией наблюдаются динамически ежегодно.
Неполная кишечная метаплазия слизистой желудка часто переходит в следующую стадию перестройки слизистой – дисплазию метаплазированного эпителия.
Морфологическая диагностика болезней желудка
Дисплазия метаплазированного эпителия – диагноз морфологический. О ней можно говорить при наличии клеточной атипии и нарушении структуры клеток слизистой оболочки желудка. В зависимости от выраженности этих изменений выделяют 3 степени дисплазии:
Понятие дисплазии было предложено для обозначения предраковых изменений, формирования групп повышенного риска для наблюдения и превентивного лечения. Исследования развития дисплазий показали, что у больных с дисплазией 2 степени в 4-8% найдено прогрессирование в дисплазию 3 степени.
Наблюдение больных дисплазией 1 и 2 степени
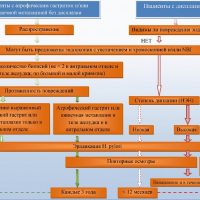
При выявлении в биоптатах слизистой желудка признаков тяжелой дисплазии следует провести множественные повторные биопсии через 6-12 месяцев, так как тяжелая дисплазия чаще свидетельствует не о том, что у больного может возникнуть рак, а о том, что он уже есть. И если даже рак еще не обнаружен, то таким больным рекомендуется хирургическое лечение — хирургическая или эндоскопическая резекция из-за высокой вероятности развития аденокарциномы (рака желудка). У 25% дисплазия высокой степени может спрогрессировать до аденокарциномы в течение года.
Иначе просто динамическое наблюдение даже с множеством биопсий при эндоскопии при подтверждении тяжелой дисплазии слизистой желудка может закончиться тем, что будет упущено время для диагностики раннего рака желудка и своевременного лечения и выздоровления.
Лечение больных дисплазией 3 степени
У пациентов, у которых выявлен хронический атрофический гастрит с дисплазией, которая связана со штаммами хеликобактер пилори высокой вирулентности, повышенный риск развития рака желудка. Эрадикация хеликобактер пилори может привести к регрессу атрофических процессов в желудке и снижению риска рака желудка. При дисплазии требуется эрадикация хеликобактер пилори, ритмичное питание, защита слизистой желудка от повреждения ее лекарственными средствами.
Если при обследовании выявлен низкий уровень пепсиногена I и низкое соотношение пепсиноген I/пепсиноген II, это уже серьезная стадия атрофического гастрита/ Рекомендуется гастродуоденоскопия с множественной биопсией, даже в тех случаях, если серологический тест (определение антител в сыворотке крови) на хеликобактер пилори не выявил инфекцию в желудке.
Морфологами в биоптатах слизистой оболочки желудка по новой системе стадирования атрофического гастрита (OLGA) cумммируются показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате. III и IV стадии выраженности атрофического гастрита по этой системе свидетельствует о высокой реальности развития рака желудка
Кишечная метаплазия – будьте бдительны!
В заключении хочу привести слова проф. Аруина Л.И., опытного и знающего морфолога, который сказал: «хронический гастрит и рак желудка разделяет дистанция огромного размера, а дисплазия и рак желудка живут в одной квартире».
Будьте внимательны к своему здоровью, вовремя проводите обследования, задавайте вопросы доктору, следуйте его рекомендациям. Здоровья вам!