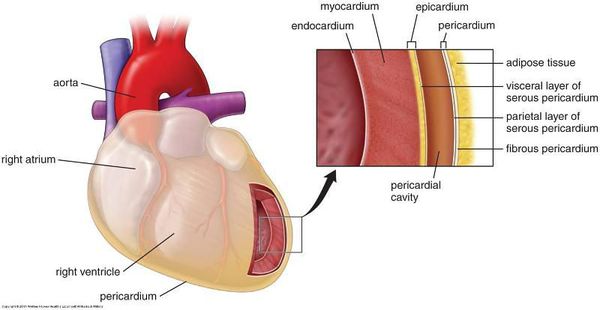
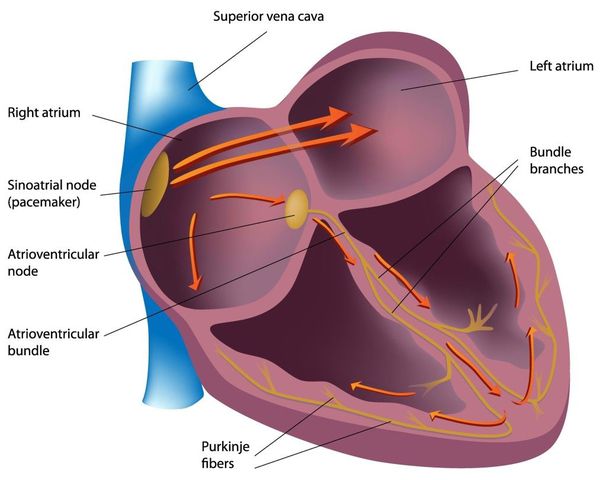
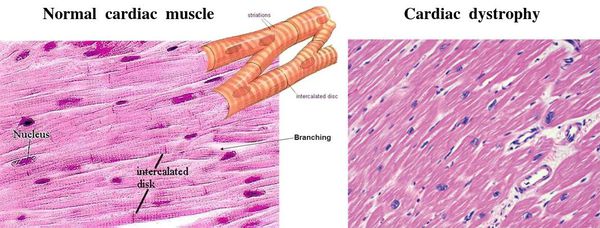
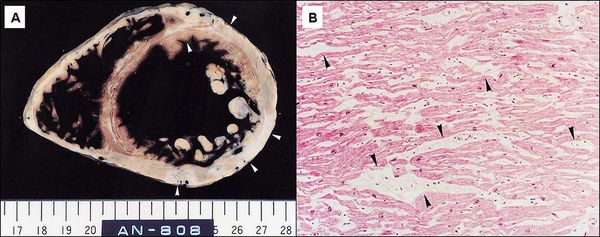
Дистрофия правого желудочка сердца что это такое
Дистрофия миокарда

Этиология
К причинами дистрофии относят:
Дистрофия миокарда может патологически не изменяться или наоборот ярко проявить себя разными дегенерализованными изменениями – жировым, белковым, восковидным перерождением мышечного волокна, мутными набуханиями, жировыми инфильтратами.
Клиника
У больных самым главным признаком является одышка, со временем присоединяется сердцебиение, неприятное чувство в области сердца, утомляемость, слабость, апатия, снижение трудоспособности. При аускультации прослушиваются систолические шумы, артериальное давление понижается, пульс учащается. Из-за задержки воды при гипотиреозе в организме мышечные сегменты сердца набухают, сердечные мышцы отекают и сердце увеличивается в размере, сердечные толчки слабеют, тон становится глухим. На электрокардиограмме отмечается синусовая брадикардия.
Прогноз
Прогноз при дистрофии миокарда более благоприятный, если во время вылечить главное заболевание, которое сподвигло дистрофические изменения в миокарде.
Лечение
На первом месте нужно выявить и начать лечить основное заболевание (тиреотоксикозы, анемию, интоксикацию, а так же инфекционные очаги), то, что могло стать причиной основного заболевания. Назначают сердечно-сосудистые средства, по показаниям диетотерапию, лечебную физкультуру и физиотерапию.
Профилактика
Рекомендуют вовремя и тщательно вылечить главное заболевание, исключать болезни инфекционного характера, посещать эндокринолога, улучшать условия быта и труда, заниматься лечебной гимнастикой, вести здоровый образ жизни, отказаться от табакокурения и злоупотребления алкоголем.
Что такое миокардиодистрофия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мадоян М. А., кардиолога со стажем в 20 лет.
Определение болезни. Причины заболевания
Миокардиодистрофия (МКД) — группа вторичных обратимых поражений мышечного слоя сердца (миокарда) невоспалительной и некоронарогенной природы, которые обусловлены нарушением обмена веществ в миокарде и проявляются нарушением его функций. [1] [3] [5]
Общие признаки миокардиодистрофий:
Заболевание поражает разные возрастные группы, но чаще встречается после 40 лет. [2] [3] [4] [6] [7]
К миокардиодистрофии могут приводить самые различные внутренние и внешние факторы, нарушающие обмен веществ и энергии в тканях сердца. [1] [3] [5] [6] [7]
Внутренние (эндогенные) факторы — патологические процессы в организме, осложнившиеся миокардиодистрофией. Эндогенные факторы можно разделить на две большие группы: сердечные и несердечные причины возникновения МКД.
К сердечным факторам относятся:
Внешние (экзогенные) факторы — патологические воздействия на организм внешней среды и образа жизни:
Симптомы миокардиодистрофии
Характеристика симптомов при миокардиодистрофии:
Виды симптомов при МКД:
Патогенез миокардиодистрофии
В патогенезе миокардиодистрофии задействованы ткани сердца следующих видов:
При нарушении обменных процессов (электролитного, белкового, энергетического) нарушаются и функции сердечных тканей [1] [2] [5] : мышечные клетки утрачивают способность к нормальным сокращениям, нервные — к генерированию и проведению нормальных импульсов.
Причём поражается не сразу вся ткань сердца. Сначала возникают одиночные очаги дистрофии из нескольких клеток, а соседние неповреждённые клетки пытаются восполнить потерю и усиливают свою функцию. Затем количество и размер поражённых очагов увеличиваются, происходит их слияние, здоровые участки теряют способность компенсировать ухудшение работы, появляется расширение сердечных камер и выраженное нарушение функций сердца. [3]
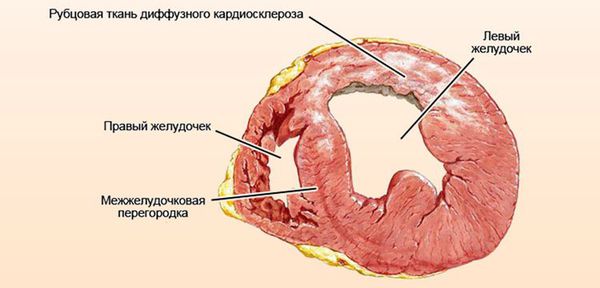
Далее при прекращении воздействия причинного фактора начинается медленное восстановление структуры и функции клеток. [7] При продолжающемся воздействии причинного фактора происходит гибель клеток и их замещение рубцовой (соединительной) тканью. Соединительная ткань не способна сокращаться и расслабляться, генерировать и проводить импульсы, заменяться здоровыми клетками. Процесс формирования соединительной ткани в сердце называется кардиосклероз, на этом этапе у болезни уже не может быть обратного развития. [3]
Классификация и стадии развития миокардиодистрофии
Миокардиодистрофии классифицируют по причинам возникновения, перечисленным выше, а также по скорости развития и стадиям заболевания. [1] [5]
По скорости развития миокардиодистрофий различают:
По стадиям миокардиодистрофий выделяют:
Осложнения миокардиодистрофии
Диагностика миокардиодистрофии
Задачи диагностического процесса:
В диагностике миокардиодистрофий большое значение имеет грамотный расспрос и внимательный осмотр пациента. Также проводят электрокардиографию, УЗИ сердца, рентгенологичесское исследование органов грудной клетки, лабораторные исследование крови и мочи. [3] Специфических изменений результатов данных исследований для миокардиодистрофий нет, но они позволяют выявить заболевания — причины миокардиодистрофий. ЭКГ и УЗИ сердца могут проводить повторно для оценки положительной динамики функций сердца на фоне проводимого лечения.
Лечение миокардиодистрофии
Задачи лечебного процесса:
Своевременность и полнота устранения причины миокардиодистрофии определяет эффективность терапии и её сроки. На этапе устранения причины лечебный процесс сильно разнится у больных с разными причинами заболевания: [1] [2] [5] [6] [7]
Однако не всякую выявленную причину миокардиодистрофии можно устранить. Например, сами заболевания (длительные или хронические) и токсические препараты, применяемые для их лечения, лучевая терапия онкологических больных, некупируемые зависимости и другое.
Параллельно лечению основного заболевания, вызвавшего миокардиодистрофию (независимо от того, можно его устранить или нет), всех больных наблюдает кардиолог, по его назначению применяются виды лечения, направленные на улучшение обмена веществ в сердечных тканях, уменьшение симптомов и профилактику осложнений. [3]
Немедикаментозное лечение — нормализация образа жизни и питания, отказ от вредных привычек. Важно, чтобы пациент придерживался определённого режима дня, полноценно отдыхал и питался, обязательно имел регулярные, адекватные именно для него физические нагрузки, ежедневно находился на свежем воздухе. Также очень важно, чтобы в жизни пациента было увлекающее его дело. Немедикаментозное лечение — это зона ответственности пациента. Врач может порекомендовать, но реализовывать должен сам пациент.
Медикаментозное лечение:
Медикаментозное лечение — это зона ответственности врача. Ни в коем случае не надо пытаться лечиться самостоятельно. Каждый медикаментозный препарат (витамины и стимуляторы обменных процессов в том числе) может при определённых условиях нанести вред.
Прогноз. Профилактика
При I и II стадиях прогноз благоприятный. После устранения причинного фактора функции сердца могут полностью восстановиться. Длительность периода восстановления зависит от времени начала лечения (чем быстрее начата адекватная терапия, тем быстрее регрессируют патологические изменения) и от общего состояния организма (молодой возраст, отсутствие сопутствующих заболеваний способствуют быстрейшему восстановлению) и может составлять от года до многих лет. [7]
При III стадии прогноз зависит от выраженности изменений и наличия осложнений. Так как изменения в сердце уже необратимы, речь идёт не о восстановлении нормальных параметров сердца и хорошего самочувствия, а о замедлении прогрессирования хронической сердечной недостаточности и нарушений ритма. При III стадии необходимо пожизненное лечение, профессиональная деятельность ограничена либо невозможна, а при отсутствии лечения неблагоприятным становится и прогноз жизни.
Профилактика:
Миокардиодистрофия
Миокардиодистрофия – вторичное поражение миокарда, обусловленное метаболическими нарушениями и приводящее к дистрофии и дисфункции сердечной мышцы. Миокардиодистрофия сопровождается кардиалгией, перебоями сердечного ритма, умеренной тахикардией, быстрой утомляемостью, головокружением, одышкой. Диагностика миокардиодистрофии основывается на данных анамнеза и клиники, электрокардиографии, фонокардиографии, рентгенографии, эхокардиографии, МРТ, сцинтиграфии, биохимического исследования крови и др. Лечение миокардиодистрофии предполагает проведение патогенетической терапии кардиотрофиками и симптоматической терапии антиаритмическими, антигипертензивными препаратами, сердечными гликозидами и т. д.
Общие сведения
Термином «миокардиодистрофия» (вторичная кардиомиопатия, дистрофия миокарда) в кардиологии объединяют группу невоспалительных и недегенеративных поражений миокарда, сопровождающихся выраженным расстройством обменных процессов и значительным снижением сократительной способности сердечной мышцы. Миокардиодистрофия всегда является вторичным процессом, включающим дисметаболические, электролитные, ферментные, нейрогуморальные и вегетативные нарушения. Миокардиодистрофия характеризуется дистрофией миоцитов и структур проводящей системы сердца, что ведет к нарушению основных функций сердечной мышцы – сократимости, возбудимости, автоматизма, проводимости.
Миокардиодистрофия, особенно на своих начальных стадиях, имеет, как правило, обратимый характер, что отличает ее от дегенеративных изменений миокарда, возникающих при гемохроматозе и амилоидозе сердца.
Причины миокардиодистрофии
К миокардиодистрофии могут приводить самые различные внешние и внутренние факторы, нарушающие протекание обмена веществ и энергии в миокарде. Миокардиодистрофия может развиваться под влиянием:
Причинами миокардиодистрофии у новорожденных и детей раннего возраста могут быть перинатальная энцефалопатия, внутриутробные инфекции, синдром дезадаптации сердечно-сосудистой системы на фоне гипоксии.У спортсменов миокардиодистрофия может возникать в результате чрезмерного физического перенапряжения (патологическое спортивное сердце).
Патогенез
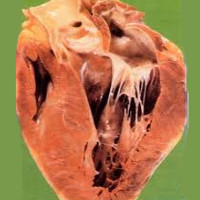
Различные неблагоприятные факторы вызывают расстройство электролитного, белкового, энергетического обмена в кардиомиоцитах, накопление патологических метаболитов. Изменения биохимических процессов в миокарде приводят к нарушению сократительной функции мышечных волокон, различным нарушениям ритма и проводимости, сердечной недостаточности. При устранении этиологического фактора трофические процессы в миоцитах могут полностью восстанавливаться. Однако при длительном неблагоприятном воздействии происходит гибель части кардиомиоцитов и их замещение соединительной тканью – формируется кардиосклероз.
Клинические формы миокардиодистрофии
Миокардиодистрофия при анемиях
Нарушения в миокарде развиваются при уменьшении гемоглобина до 90-80 г/л. На этом фоне развивается гемическая гипоксия, сопровождающаяся энергетическим дефицитом в миокарде. Анемическая миокардиодистрофия может возникать при железодефицитной и гемолитической анемии, при острой и хронической кровопотере, ДВС-синдроме.
Клиническими проявлениями миокардиодистрофии при анемии служат бледность кожных покровов, головокружение, одышка, тахикардия, усиление пульсации сонных артерий. Перкуторное исследование выявляет расширение границ сердца, свидетельствующее о гипертрофии миокарда. Аускультативно обнаруживаются громкие тоны сердца, систолические шумы над сердцем и сосудами, «шум волчка» на шейных сосудах. Сердечная недостаточность развивается при длительной анемии и неадекватном лечении.
Миокардиодистрофия при тиреотоксикозе
Под влиянием избыточного количества тиреоидных гормонов в сердечной мышце снижается синтез аденозинтрифосфорной кислоты (АТФ) и креатинфосфата (КФ), что сопровождается энергетическим, а затем и белковым дефицитом. В то же время, тиреоидные гормоны стимулируют активность симпатической нервной системы, вызывая увеличение ЧСС, минутного объема крови, скорости кровотока, ОЦК. В таких условиях изменение внутрисердечной гемодинамики не может быть подкреплено энергетически, что в итоге приводит к развитию миокардиодистрофии.
В клинике миокардиодистрофии при тиреотоксикозе преобладают аритмии (синусовая тахикардия, экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия). Длительный тиреотоксикоз вызывает хроническую недостаточность кровообращения, преимущественно по правожелудочковому типу, которая проявляется болями в области сердца, отеками, гепатомегалией. Иногда при тиреотоксикозе доминируют симптомы миокардиодистрофии, в связи с чем пациенты обращаются, в первую очередь, к кардиологу, а уже затем попадают к эндокринологу.
Миокардиодистрофия при гипотиреозе
Патогенетической основой миокардиодистрофии при гипотиреозе служит дефицит тиреоидных гормонов, ведущий к снижению активности метаболизма в миокарде. При этом в результате повышения проницаемости сосудов происходит задержка жидкости в миоцитах, что сопровождается развитием дисметаболических и электролитных нарушений (повышением содержания натрия и уменьшением калия).
Миокардиодистрофия при гипотиреозе характеризуется постоянными ноющими болями в сердце, аритмиями (синусовой брадикардией), блокадами (предсердной, атриовентрикулярной, желудочковыми).
Алкогольная и токсическая миокардиодистрофия
Считается, что к алкогольной миокардиодистрофии приводит ежедневный прием 80-100 мл этилового спирта на протяжении 10 лет. Однако при наследственном дефиците ряда ферментов, расщепляющих этанол, стрессах, частых вирусных инфекциях миокардиодистрофия может развиться и в более короткие сроки – за 2-3 года даже при употреблении меньших количеств алкоголя. Алкогольная миокардиодистрофия встречается преимущественно у мужчин 20—50 лет.
Токсическая миокардиодистрофия встречается у лиц, получающих длительную терапию иммунодепрессантами (цитостатиками, глюкокортикостероидами), НПВП, некоторыми антибиотиками, транквилизаторами, а также при отравлениях хлороформом, фосфором, мышьяком, угарным газом и т. д. Такие варианты миокардиодистрофии могут протекать в кардиалгической (болевой), острой аритмической, сочетанной и застойной формах.
Кардиалгическая форма миокардиодистрофии характеризуется щемящими или ноющими болями в грудной клетке, преходящим ощущением жара или зябкости конечностей, потливостью. Больных беспокоит общая слабость, быстрая утомляемость, снижение физической выносливости, головные боли.
Тонзиллогенная миокардиодистрофия
Поражения миокарда при тонзиллите возникают у 30—60% пациентов. Тонзиллогенная миокардиодистрофия обычно развивается после серии перенесенных ангин, протекающих с высокой лихорадкой и интоксикацией. В клинике тонзиллогенной миокардиодистрофии превалируют жалобы на боли в области сердца интенсивного характера, выраженную слабость, неритмичный пульс, одышку, очаговую или диффузную потливость, субфебрилитет, артралгии.
Миокардиодистрофия физического перенапряжения
Данный вариант миокардиодистрофии в основном проявляется симптомами общего характера: слабостью, вялостью, быстрой утомляемостью, угнетенным настроением, снижением интереса к спорту. Может возникать сердцебиение, покалывание в области сердца, перебои.
Климактерическая миокардиодистрофия
Развивается вследствие дисгормональных процессов у женщин в возрасте 45 – 50 лет. Климактерическая миокардиодистрофия проявляется болями в области сердца давящего, колющего или ноющего характера, иррадиирующими в левую руку. Кардиалгии усиливаются в связи с «приливами», сопровождаются ощущением жара, учащенным сердцебиением, повышенной потливостью. Сердечная недостаточность при климактерической миокардиодистрофии может развиться при имеющейся сопутствующей артериальной гипертензии.
Диагностика миокардиодистрофии
У пациентов с миокардиодистрофией в анамнезе обычно выявляются заболевания или патологические состояния, сопровождающиеся тканевым гипоксическим синдромом и нарушением метаболических процессов. Объективное исследование сердца обнаруживает нерегулярный пульс, приглушение сердечных тонов, ослабление I тона на верхушке, систолический шум.
При электрокардиографии регистрируются различные аритмии, нарушения процессов реполяризации миокарда, снижение сократительной функции миокарда. Проведение нагрузочных и фармакологических проб при миокардиодистрофии, как правило, дает отрицательные результаты. Фонокардиография обнаруживает изменения соотношения длительности электрической и механической систолы, появление галопного ритма и систолического шума на основании и верхушке, приглушение тонов сердца. С помощью эхокардиографии определяется расширение камер сердца, изменение структуры миокарда, отсутствие органической патологии.
Выявляемая при рентгенографии грудной клетки миопатическая конфигурация сердца, свидетельствует о глубоком поражении миокарда. Сцинтиграфия позволяет оценить метаболизм и перфузию миокарда, выявить очаговые и диффузные дефекты накопления как, указывающие на снижение числа функционирующих кардиомиоцитов.
К биопсии сердечной мышцы прибегают в сомнительных случаях, при неинформативности неинвазивных исследований. Дифференциальный диагноз миокардиодистрофии проводится с ИБС, миокардитами, атеросклеротическим кардиосклерозом, легочным сердцем, пороками сердца.
Лечение миокардиодистрофии
Комплексная терапия миокардиодистрофии складывается из лечения основного заболевания, патогенетической (метаболической) и симптоматической терапии. В связи с этим лечебная тактика при миокардиодистрофии определяется не только кардиологом, но и узкими специалистами – гематологом, отоларингологом, эндокринологом, ревматологом, гинекологом-эндокринологом, спортивным врачом. Больным рекомендуется щадящий физический режим, исключение вредных профессиональных воздействий, контакта с химикатами, приема алкоголя и курения.
Метаболическая терапия миокардиодистрофии предполагает назначение витаминов группы В, кокарбоксилазы, АТФ, препаратов калия и магния, инозина, анаболических стероидов и других препаратов, улучшающих метаболические процессы и питание сердечной мышцы.
При сердечной недостаточности показаны диуретики, сердечные гликозиды; при аритмиях – противоаритмические средства. При климактерической миокардиодистрофии назначается ЗГТ, седативные и гипотензивные препараты. Этиотропная терапия тонзиллогенной миокардиодистрофии требует интенсивного лечения тонзиллита вплоть до тонзиллэктомии.
Прогноз и профилактика миокардиодистрофии
Обратимость изменений миокарда при миокардиодистрофии зависит от своевременности и адекватности лечения основного заболевания. Исходом длительно протекающей миокардиодистрофии служит миокардиосклероз и сердечная недостаточность.
Предупреждение миокардиодистрофии основано на устранении текущих заболеваний, учете возраста и физической подготовки при занятиях спортом, отказе от алкоголя, исключении профессиональных вредностей, полноценном питании, обязательной санации очагов инфекции. Рекомендуются повторные медикаментозные курсы кардиотрофной терапии 2–3 раза в год.
Аритмогенная дисплазия правого желудочка
Терминология
Аритмогенная дисплазия правого желудочка (АДПЖ) – сравнительно редкое кардиологическое заболевание, в отношении которого по сей день остается множество вопросов и противоречивых представлений.
Первое клиническое описание принадлежит выдающемуся итальянскому мыслителю, врачу, анатому Джованни-Мария Ланчизи (все прочие транскрибации итальянской фамилии Lancisi, а именно «Ланциси», «Ланцизи» и т.п. – являются неверными). Ему же принадлежат авангардные для того времени (ХVII- ХVIII вв) труды о нервно-мозговой организации, о малярии, о связи сифилиса и сосудистых аневризм, об эпизоотиях крупного рогатого скота. Датой же написания кардиологического исследования «De Motu Cordis et Aneurysmatibus», где Дж.-М. Ланчизи подробно описал АДПЖ как наследственное заболевание в четырех поколениях одного рода, отечественные источники называют то 1736 год, то 1745, – без каких-либо оговорок касательно того факта, что сам Ланчизи умер в 1720 году. На самом деле издание было посмертным и вышло в 1728 году.
Все это может показаться несущественным, но есть и другие неоднозначности в отношении аритмогенной дисплазии ПЖ. Современная формулировка диагноза АДПЖ была предложена только в 1977 году, но уже через пять лет (1982) в употребление вошел синонимический диагноз «аритмогенная кардиомиопатия правого желудочка», который используется, в частности, в МКБ-10 (рубрика «Другие болезни сердца / Кардиомиопатии»). Заболевание обычно называют наследственным, но зачастую в том же самом тексте сообщается, что генетический фактор прослеживается менее чем в половине случаев. Эпидемиологические данные неполны и неточны, аритмогенная кардиомиопатия ПЖ отнесена к редким болезням, но при этом является второй по частоте причиной внезапной сердечной смерти в молодом возрасте.
Причины
Какая бы из этих гипотез ни подтвердилась дальнейшими исследованиями, лежащие в ее основе причины, патогенетические механизмы, закономерности также необходимо будет еще найти и аргументировать.
Симптоматика
Выше показано, что АДПЖ считается болезнью преимущественно молодого возраста. Это так и есть, хотя возрастной интервал учтенных различными исследованиями больных простирается, строго говоря, от 2 до 70 лет; на долю допубертатной и пожилой (старше 50 лет) категорий приходится в общей сложности около 8% всего объема выявляемой аритмогенной дисплазии ПЖ. Клиническая картина неспецифична и может включать признаки любых других аритмий; наиболее частыми симптомами являются усиленное сердцебиение, ощущение «сбоев» в работе миокарда, чувство нехватки воздуха, сердечные боли, синкопальные обмороки, головокружения, утомляемость, постепенное снижение выносливости к физическим нагрузкам и т.д. Риск внезапной смерти (см. выше), которая при АДПЖ наступает от фибрилляции желудочков, после сорока лет снижается.
Во многих случаях аритмогенная дисплазия ПЖ в течение длительного времени протекает бессимптомно, однако процесс структурного перерождения ткани неостановим; в той или иной степени он прогрессирует, пусть даже латентно.
Диагностика
Аритмогенная кардиомиопатия правого желудочка сложна в диагностике и дифференциации от других кардиологических заболеваний, особенно на ранних стадиях развития. Неоднократно предпринимались попытки разработать четкие критерии клинической, электрофизиологической, патоморфологической диагностики. Сегодня применяются, в целом, достаточно информативные диагностические протоколы, опирающиеся на анамнестические сведения (включая семейный анамнез), данные осмотра, а также результаты ЭКГ, ЭхоКГ, тредмил-тестов, суточного мониторирования. По мере необходимости назначают обзорные и специальные рентгенографические методы, МРТ; иногда решающие аргументы удается получить только путем инвазивной диагностической процедуры – эндомиокардиальной биопсии (ЭМБ), позволяющей отобрать прижизненные образцы ткани ПЖ для гистологического анализа. Согласно современным представлениям, для уверенной диагностики АДПЖ в биоптате должно присутствовать не менее 3-5% соединительной ткани и не менее 40% жировой; другие критерии базируются, наоборот, на сокращении доли интактных кардиомиоцитов до 60% и ниже.
В значительной части случаев аритмогенная кардиомиопатия правого желудочка остается недиагностированной, что является одной из причин статистической неопределенности.
Лечение
Первоочередной задачей является снижение риска внезапной сердечной смерти и профилактика аритмий. В консервативных терапевтических схемах применяют антиаритмические препараты (в основном, стандартные бета-адреноблокаторы), иногда в сочетании с другими медикаментами, однако эффективность подобных мер в плане решения упомянутых профилактических задач пока недостаточно исследована. Обязательной является коррекция образа жизни, в частности, исключение экстремальных физических нагрузок и других факторов, могущих спровоцировать острые нарушения сердечной деятельности. Накапливается и изучается опыт применения радиочастотной катетерной абляции. Некоторые авторы рекомендуют методом выбора считать хирургическое вмешательство, – вплоть до пересадки сердца, – однако другие обоснованно возражают, что даже имплантация кардиовертера-дефибриллятора (что представляется наиболее адекватным решением), из-за определенного риска постоперационных осложнений едва ли целесообразна в тех случаях, когда АДПЖ протекает бессимптомно или малосимптомно. Однако к имплантации КД необходимо прибегать при наличии прогностически неблагоприятных признаков (например, эпизодов необъяснимой и внешне беспричинной потери сознания).
По индивидуальным показаниям назначают диуретики, ингибиторы АТФ, сердечные гликозиды и т.д.
В целом, для современной кардиологии проблема АДПЖ остается достаточно острой, актуальной, требующей по возможности быстрого прояснения всех накопившихся вопросов.