Для чего холестерин в мембране
Холестерин и его функции в организме
Холестери́н (др.-греч. χολή — жёлчь и στερεός — твёрдый) — органическое соединение, природный полициклический липофильный спирт, содержащийся в клеточных мембранах всех животных и человека. Холестерин в составе клеточной плазматической мембраны придает ей определённую жёсткость за счёт увеличения плотности «упаковки» молекул фосфолипидов. Таким образом, холестерин — стабилизатор текучести плазматической мембраны. Холестерин открывает цепь биосинтеза стероидных половых гормонов (эстрогены, прогестерон, тестостерон) и кортикостероидов (кортизол, альдостерон), служит основой для образования желчных кислот и витаминов группы D, участвует в регулировании проницаемости клеток и предохраняет эритроциты крови от действия гемолитических ядов.
Холестерин бывает двух видов: низкой плотности (ЛПНП) и высокой плотности (ЛПВП). Большое содержание ЛПВП в крови характерно для здорового организма, поэтому часто эти липопротеиды называют «хорошими». Высокомолекулярные липопротеиды хорошо растворимы и не склонны к выделению холестерина в осадок, и тем самым защищают сосуды от атеросклеротических изменений (то есть не являются атерогенными).
Уровень холестерина в крови измеряется либо в ммоль/л (миллимоль на литр — единица, действующая в РФ) либо в мг/дл (миллиграмм на децилитр, 1 ммоль/л равен 38,665 мг/дл). Идеально, когда уровень «плохих» низкомолекулярных липопротеидов ниже 2,586 ммоль/л (для лиц с высоким риском сердечно-сосудистых заболеваний — ниже 1,81 ммоль/л). Такой уровень, однако, у взрослых достигается редко. Если уровень низкомолекулярных липопротеидов выше 4,138 ммоль/л, рекомендуется использовать диету для снижения его ниже 3,362 ммоль/л (что может привести к депрессивным расстройствам, повышенному риску инфекционных и онкологических заболеваний. Если этот уровень выше 4,914 ммоль/л или упорно держится выше 4,138 мг/дл, рекомендуется рассмотреть возможность лекарственной терапии. Для лиц с высоким риском сердечно-сосудистых заболеваний эти цифры могут снижаться. Доля «хороших» высокомолекулярных липопротеидов в общем уровне холестерин-связывающих липопротеидов чем выше, тем лучше. Хорошим показателем считается, если он гораздо выше 1/5 от общего уровня холестерин-связывающих липопротеидов.
К факторам, повышающим уровень «плохого» холестерина, относятся:
В организме здорового человека в результате обменных процессов количество холестерина поддерживается на постоянном уровне. При этом некоторое его количество поступает в организм с продуктами питания, так называемый пищевой холестерин, а большая часть синтезируется в организме из жиров и углеводов. Прием холестерина в пределах суточной нормы (0,6 г) существенно не влияет на его уровень в крови. Холестерин преимущественно продуцируется в печени, причем его синтез находится в обратной зависимости от количества холестерина, поступающего с пищей. Повышенное потребление продуктов с высоким содержанием холестерина при нормальном липидном обмене снижает его выработку в организме. Однако, при длительном потреблении пищевого холестерина сверх дневной нормы его уровень в крови повышается. При нарушенном липидном обмене даже незначительное увеличение потребляемого с пищей холестерина приводит к повышению его уровня в крови. Нарушение липидного обмена может произойти при длительном несоблюдении правильного режима питания, при некоторых хронических заболеваниях, в результате изменения гормонального фона организма, от генетической предрасположенности и т.д. Наряду с тем, что холестерин относится к физиологически необходимым веществам, выполняющим жизненно важные функции в организме, он также является основным фактором развития атеросклероза.
К продуктам с высоким содержанием холестерина относятся яичный желток, говяжий жир, мозги животных, печень, почки, икра, масло, сметана и другие жирные молочные продукты. При нарушении липидного обмена следует сократить потребление продуктов с высоким содержанием холестерина, особенно больным атеросклерозом и ишемической болезнью сердца, а также людям пожилого возраста. Исключение составляют яйца и молочные жиры, содержащие лицетин. Благодаря содержанию в нем фосфора и холина, лецитин является биологическим антагонистом холестерина, он способствует улучшению процессов обмена холестерина в организме и препятствует возникновению атеросклероза. Здоровым людям не следует строго соблюдать бесхолестериновые диеты. Пища, даже с высоким содержанием холестерина, потребляемая в умеренных количествах, не может вызвать серьезных отрицательных последствий. Но и перегружать организм избыточным потреблением продуктов с высоким содержанием холестерина тоже нельзя.
Информация подготовлена врачом по гигиеническому воспитанию ФБУЗ «Центр гигиены и эпидемиологии в Калининградской области» Деревягиной В.А.
Хороший, плохой, злой холестерин
Хороший, плохой, злой холестерин
Нарушение жирового обмена является основным фактором развития атеросклероза и связанных с ним осложнений (ишемическая болезнь сердца, инфаркт, инсульт, облитерация сосудов нижних конечностей и пр.). При этом наиболее важным фактором повышенного риска атеросклероза является повышение содержания в крови атерогенных липопротеинов.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Довольно подробно о роли холестерина в работе биомембран рассказывается в статье «Липидный фундамент жизни» [12]. — Ред.
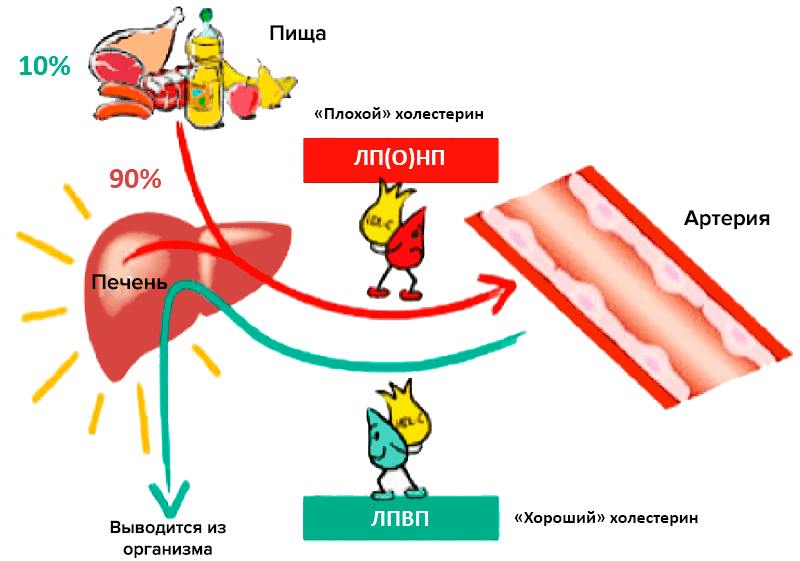
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
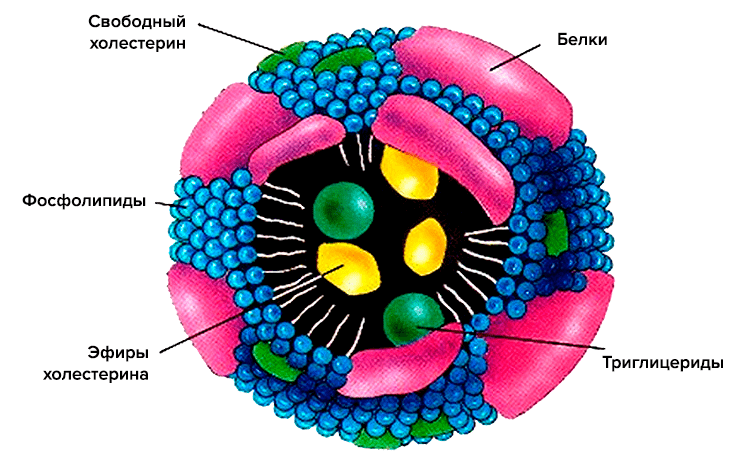
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1–5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2–6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4–14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20–22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25–35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30–80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75–1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
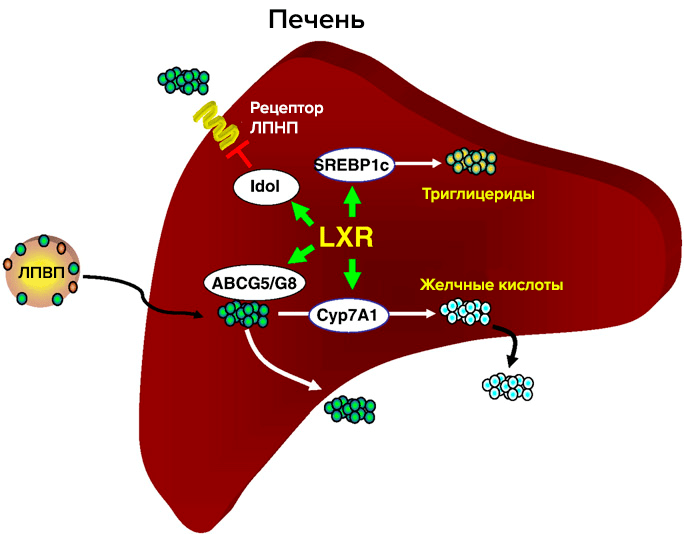
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
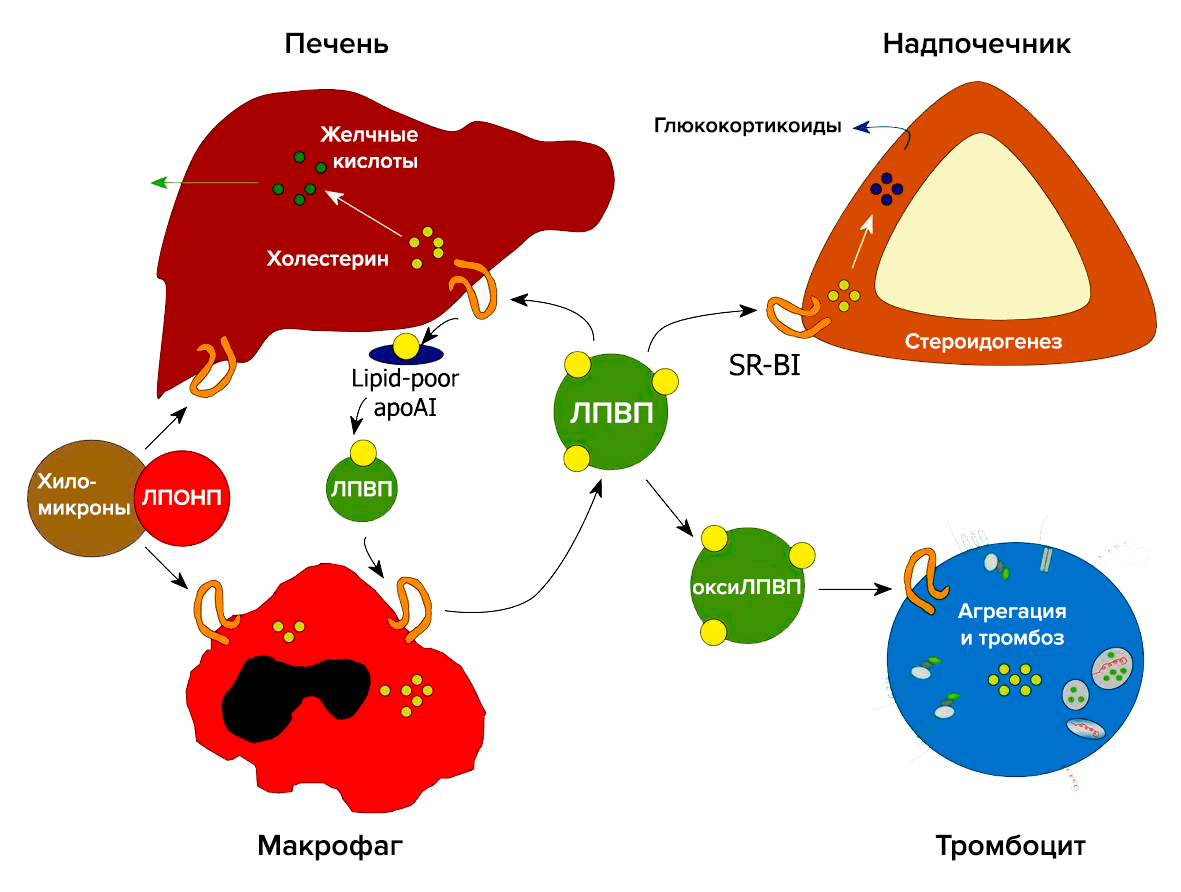
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Восстановление этого баланса искусственным путем (например, на молекулярном уровне с использованием наночастиц) когда-нибудь станет основным способом лечения атеросклероза (см. «Наночастицами — по „плохому“ холестерину!» [13]). — Ред.
Холестерин. Молекула XX века
Обзор подготовили:
Обзор подготовили Т. Ю. Гроздова, д. м. н., профессор, Л. М. Пичугина, к. м. н., врач-инфекционист высшей категории, А. А. Никитина, врач-терапевт высшей категории
Холестерин был и остается главным героем обсуждений, изучений и анализа риска развития заболеваний сердечно-сосудистой системы. С каждым днем увеличивается количество научных трудов, содержащих информацию о принципах комплексного воздействия факторов питания на такие заболевания, как атеросклероз, ишемическая болезнь сердца, заболевания сосудистой системы и т. д. И все чаще и чаще возникают вопросы: что вредного в этом веществе — холестерине, как с ним бороться, да и надо ли вообще это делать?
История возникновения данных вопросов уходит своими корнями в XVIII в., когда впервые благодаря работам Д. Фуркруа (1789 г.) холестерин стали рассматривать как компонент желчных камней. Именно поэтому название этого вещества происходит от греческих слов chole — «желчь» и stereos — «жесткий, твердый». Холестерин содержится не только в продуктах животного происхождения, но и в некоторых растениях в виде фитостеринов. Благодаря сходству с холестерином фитостерин тормозит его всасывание в кишечнике и может использоваться как гиполипидемическое средство.
Борьба с пандемией
До 1960-х гг. практически отсутствовала информация, основанная на принципах доказательной медицины, о патофизиологии липидного обмена и научно-обоснованной системе профилактики атеросклероза. В результате к 1968 г. развитые страны оказались перед лицом пандемии атеросклероза. Ежегодно из-за этого заболевания в СССР и США умирало около 1 100 000 человек.
Ситуация коренным образом изменилась благодаря проведению масштабных мультицентровых исследований и практическому внедрению в практику профилактической и лечебной медицины новых сведений о механизмах нарушений липидного метаболизма. И как результат работы в этом направлении к концу 1980-х гг. в Северной Америке было получено (по сравнению с пиковым уровнем) практически 60%-ное понижение показателя смертности от ишемической болезни сердца и уменьшение на треть частоты инфарктов миокарда. Был достигнут самый впечатляющий за всю историю успех профилактической медицины в борьбе с неинфекционной патологией. Достаточно большую роль в реализации данного направления работы сыграла рациональная, научно обоснованная диетотерапия.
Холестерин — это не яд
Современная классификация липидов включает в себя простые и сложные липиды, и в группу простых липидов — липоспиртов — входит холестерин вместе с ретинолом и кальциферолом. Разнообразие липидов, особенности их метаболизма определили их основные функции в организме человека:
Биологические функции липидов определяются прежде всего тем, что они являются источниками энергии. Эту функцию выполняют жирные кислоты, освобождающиеся после распада жиров. Фосфолипиды, гликолипиды и холестерин участвуют в образовании клеточных мембран. Производные некоторых полиненасыщенных жирных кислот (простагландины) выполняют регуляторную функцию, эти жирные кислоты представляют собой незаменимые пищевые факторы.
Овощи и трава
Томат (Lycopersion esculentum). Плоды содержат 94 % воды, 1 % белков, 0,1 % жиров, 4 % углеводов, 0,6 % клетчатки, органические кислоты, пектиновые вещества, витамины А, С, РР, К и др. По уровню железа и магния занимают первое место среди пищевых продуктов, превосходя куриное мясо и молоко. Биологически активные вещества томатов — фитостерины — снижают уровень холестерина, способствуют образованию гемоглобина.
Баклажан (Solanum melongena). Зрелые плоды содержат 3–4 % углеводов, 1 % белков, витамины группы В, РP, каротин, С, дубильные и пектиновые вещества. Очень богаты минеральными солями, особенно много калия, меди. В плодах баклажана обнаружены вещества, снижающие уровень холестерина в крови, улучшающие состояние больных атеросклерозом.
Кольраби, или капуста стеблеплодная (Brassica oleracea var. gongylodes). Содержит минеральные элементы: калий, кальций, магний, фосфор, железо. Нормализует работу сердечной мышцы, помогает удалению холестерина из организма.
Брокколи (Brassica oleracea convar. Botrytis var. cymosa). Накапливает соли калия, фосфора, кальция, магния, витамины В1, В2, С, Е, РР, каротин. Витамина С в брокколи в три раза больше, чем в цветной капусте. Содержит высокий уровень фитостеринов, используется как гипохолестеринемическое средство.
Редис (Raphanus sativus var. radicula). Корнеплоды содержат 3,2 % сахаров и крахмала, белок, витамины С, В1, В2, В3, каротин, микроэлементы (калий, кальций, фосфор, магний), органические кислоты, ферменты. По наличию кремния редис превосходит большинство овощных культур. Этот элемент придает прочность кровеносным сосудам, препятствует отложению холестерина, образованию бляшек. Редис способен связывать холестерин и токсические продукты обмена, помогает выведению их из организма.
Редька (Raphanus sativus var. sativus), дайкон (Raphanus sativus ssp. Acanthiformis). Энергетическая ценность этих корнеплодов составляет 34 ккал на 100 г продукта. Они богаты биологически активными веществами, фитонцидами, витамином С (11–39 мг%), солями калия, железа, магния. Обладают хорошо выраженными желчегонным и мочегонным свойствами. Выводят холестерин из организма, нормализуя функции печени и кишечника, и способствуют их очищению.
Щавель (Remex acetosa L.). Молодые листья богаты белками, углеводами, витамином С, рутином, макро- и микроэлементами, содержат каротин и витамины В1, В2,
РР, Е, К. Приятный вкус обусловлен органическими кислотами. Весной листья щавеля содержат больше лимонной, яблочной и щавелевой кислоты. Щавель активизирует обмен веществ, действует на организм как стимулирующее средство, нормализует функцию печени и желчного пузыря, стимулирует отток желчи и уменьшает образование холестерина.
Пищеварение и холестерин
Расщепление липидов совершается в 12-перстной кишке, куда поступают липаза с соком поджелудочной железы и конъюгированные желчные кислоты в составе желчи. Происходят следующие процессы:
Функции холестерина
Холестерин является предшественником в синтезе других стероидов: желчных кислот, стероидных гормонов, витамина D3. Он входит как структурный компонент в состав мембран всех клеток. Существует два пути поступления холестерина:
Холестерин может синтезироваться не только в печени, но в небольшом количестве и в клетках кишечника и кожи.
В организме человека это вещество играет достаточно большую роль, выполняя многие физиологические функции:
В организме человека содержится около 150 г холестерина (2 мг на 1 кг). Условно его можно разделить на три пула:
Пул А: быстро обменивающийся (около 30 г), содержит холестерин, содержащийся в печени и в других паренхиматозных органах, кишечной стенке и плазме крови. Обновление этого пула происходит ежедневно со скоростью около 1 г в сутки, полное обновление происходит за 30 суток.
Пул Б: медленно обменивающийся пул (около 50 г), содержит холестерин всех других органов и тканей, кроме нервной системы и соединительной ткани.
Пул В: очень медленно обновляющийся пул (около 60 г), содержит холестерин головного мозга, нервов и соединительной ткани. Скорость обновления этого пула очень мала и может исчисляться месяцами и годами.
Ценный фермент
Липопротеинлипаза — фермент, обеспечивающий потребление экзогенных жиров тканями, располагается в эндотелии сосудов, где в результате гидролиза из жиров образуется глицерин и жирные кислоты, которые и поступают в клетку. Потребность в жирах составляет 50–100 г в сутки — в зависимости от характера питания и энергетических затрат.
Расход холестерина
Ежедневно организм человека расходует 1200–1300 мг холестерина. Часть идет на образование желчных кислот, стероидных гормонов, другая часть выводится с калом, теряется со слущивающимся эпителием кожи, с секретом сальных желез. При этом используются запасы пула А. Для его восполнения организм ежедневно синтезирует 800–1000 мг холестерина, дополнительно получая около 500 мг с пищей.
Революционное открытие
В 1984 г. М. С. Браун и Дж. Гольдштейн были удостоены Нобелевской премии по медицине за раскрытие механизмов рецепторного эндоцитоза липопротеинов клетками последующих событий, адаптирующих клетки к нагрузке холестерином.
Транспорт холестерина
Жиры и холестерин, поступающие в организм с пищей или синтезированные в печени, должны транспортироваться в другие органы, где они используются. Это возможно при образовании транспортных частиц — липопротеинов, в которых триацилглицерины и эфиры холестерина взаимодействуют с амфифильными фосфолипидами и белками, обеспечивающими их растворимость и перенос пищевых жиров в печень, присоединение ЛПВП к клеткам, удаление ЛПНП, ЛПОНП из циркуляции, что способствует переносу холестерина из печени в ткани.
При проведении исследований нарушения липидного обмена в практическом здравоохранении сталкиваются в основном с показателями плотности липопротеинов:
В клетках слизистой кишечника экзогенный (пищевой) холестерин встраивается в хиломикроны и далее транспортируются кровью. В печени пул холестерина составляется из синтезированного холестерина самими клетками и поступившего из остаточных хиломикронов. Этот пул холестерина существует не только для собственных нужд печени, но и для снабжения других тканей.
Что такое гиперхолестеринемия
Как правило, пациент узнаёт о повышении уровня холестерина при общем обследовании в связи с заболеваниями или по подсказке знакомых и родственников. Получив анализ, он делает вывод о наличии угрозы для своего здоровья и переходит на различные диеты, применяет лекарственные препараты, чаще всего достигая временного эффекта.
Для того чтобы врачу понять самому и потом объяснить пациенту значение ряда показателей, ему необходимо знать основы циркуляции липопротеинов и значение их для организма. Именно поэтому очень большая просьба к вам, дорогие читатели, не пропускайте этот абзац, прочитайте его полностью, и тогда мы спокойно перейдем к рассмотрению этой достаточно запутанной проблемы.
В клетках — потребителях холестерина существуют рецепторы для липопротеинов низкой плотности (ЛНП). Взаимодействие рецепторов с ЛНП происходит с помощью аполипопротеинов, после чего ЛНП путем эндоцитоза поглощаются клеткой. Потребление холестерина клеткой регулируется путем изменения количества рецепторов на поверхности клетки. При снижении потребности клетки в холестерине уменьшается количество рецепторов. Регулятором является сам холестерин, который репрессирует транскрипцию генов, соответствующих этим белкам. Липопротеины, циркулирующие в крови, обмениваются холестерином. Особенно активно это происходит между ЛНП и липопротеинами высокой плотности (ЛВП), причем поток холестерина направлен в сторону ЛВП. Двусторонняя диффузия холестерина происходит и при контакте ЛВП с клетками, при этом ЛВП извлекают холестерин из мембран клеток. ЛВП, нагруженные холестерином, поглощаются в основном печенью путем эндоцитоза и там освобождают холестерин.
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!
Следовательно, липопротеины высокой плотности предупреждают накопление холестерина, а липопротеины низкой плотности обеспечивают клетку холестерином по мере потребности в нем. Таким способом поддерживается постоянство содержания холестерина в клетках. Нарушение соотношения между ЛНП и ЛВП в сторону ЛНП может быть причиной гиперхолестеринемии.
Для назначения адекватной диетотерапии, направленной на снижение или недопущение увеличения уровня холестерина, врач-диетолог должен знать, что уровень холестерина зависит от многих показателей, таких как:
Необходимо помнить еще одно правило — у пациента должно быть ежедневное полное опорожнение кишечника.
Холестерин в цифрах
Самое интересное
Желчные кислоты образуются в клетках печени из холестерина. При неблагоприятном составе желчи отдельные компоненты могут кристаллизоваться. Это влечет за собой отложение желчных камней, которые чаще всего состоят из холестерина и кальциевых солей желчных кислот (холестериновые камни), но иногда эти камни содержат и желчные пигменты.
После выделения в кишечник под влиянием бактерий желчные кислоты преобразуются и участвуют в дальнейшем метаболизме в составе желчи. После переваривания и всасывания они возвращаются через воротную вену в печень, совершая такой цикл до 10 раз в сутки. Этот цикл называется «кишечно-печеночная циркуляция желчных кислот».
Постоянным компонентом желчи является холестерин. Как и желчные кислоты, он подвергается обратному всасыванию, но некоторое количество желчных кислот и холестерина теряется с калом. Для восполнения потери желчных кислот, выводимых с фекалиями, постоянно происходит синтез желчных кислот из холестерина. Получается, что удаление холестерина в свободном виде или в виде желчных кислот является единственным способом освобождения организма от него.
Биосинтез холестерина
Процесс биосинтеза холестерина происходит в клетке. Скорость синтеза зависит от количества экзогенного холестерина, т. е. поступающего с пищей. При поступлении 2–3 г холестерина в сутки синтез эндогенного холестерина подавляется.
Фермент гидроксиметилглутарил- СоА-редуктаза играет главную роль в регуляции синтеза холестерина, избыток холестерина подавляет синтез этого фермента и, таким образом, по механизму отрицательной обратной связи снижает скорость своего собственного эндогенного синтеза.
Важно знать!
Метаболизм холестерина напрямую связан с процессом удаления холестерина из организма с фекалиями, что очень важно как при назначении диетотерапии, так и выяснении причин повышения уровня холестерина в крови, связанных с патологией органов пищеварения.
Таблица 1. Критерии максимального содержания липопротеинов, холестерина и триглицеридов
| Показатель | Низкая степень риска атеро- склероза | Средняя степень риска атеросклероза (пограничная) | Высокая степень риска атеросклероза |
| Холестерин | Менее 5,2 ммоль/л (200 мг/дл) | От 5,2 до 6,0 ммоль/л умеренная гиперхолестеринемия | Выше 6,0 ммоль/л (240 мг/дл) выраженная гипер- холестеринемия |
| Триглицериды (общие) | Менее 1,6 ммоль/л (140 мг/дл) | 1,6-2,2 ммоль/л (140–200 мг/ дл) допустим, начальная степень гипертриглицеридемии | 2,2 ммоль/л и выше (200– 250 мг/дл) нежелателен, повышенный риск для здоровья |
Заболевания и холестерин
Классификация холестеринопатий по Ю. М. Лопухину — А. С. Фокину
1. Общие холестеринопатии.
2.1.1. Первичные: семейная наследственная гиперхолестеринемия, гиперхолестеринемия при семейной гипетриглицеридемии, семейная дисбеталипопротеинемия.
2.1.2. Вторичные: механическая желтуха, первичный билиарный цирроз печени, сахарный диабет, гипотиреоз, нефротический синдром, гиперкортицизм, моноклональные гаммапатии, гепатома, беременность, применение пероральных контрацептивов, отравление 4,4-дихлор-дифенилтрихлорэтаном (ДДТ).
3. Локальный холестериноз.
Выявление причины
Врач-диетолог, перед тем как решить вопрос о необходимости и длительности назначения диетотерапии у пациентов с повышенным уровнем содержания холестерина в крови, должен четко представлять, что явилось причиной данного состояния. Особенно важно в первую очередь исключить вторичные гиперхолестеринемии (пункт 2.1.2.). Именно поэтому врач- диетолог должен иметь в основе своей профессиональной подготовки общеклинические знания клинических проявлений заболеваний, методы диагностики, общие принципы постановки клинического диагноза.
Следующим шагом к рассмотрению и назначению диетотерапии должно стать изучение особенностей повышения уровня холестерина у конкретного пациента. Для этого необходимо провести исследование липидного состава плазмы крови, в том числе холестерина, триглицеридов, липопротеинов высокой плотности, низкой плотности и очень низкой плотности.
Исследование липидного состава
Нормальные показатели липопротеинов, холестерина и триглицеридов в плазме крови столь широко варьируют, что разумным представляется указать не на чисто статистическую норму, которая соответствует обычно 90–95 % популяции, а на желаемый уровень, который будет, как правило, уже ниже, так как основная цель достижения данных показателей это уменьшение скорости прогрессирования атеросклероза (Дж. Гольдштейн [1994], П. Чандрасома, К. Тейлор [1998]).
Уровень липопротеинов низкой плотности составляет 130–140 мг/ дл (1,3–4,3 г/л) и прямо коррелирует со степенью риска атеросклероза: уровень выше 4,3 г/л указывает на атерогенности выявленных у пациента вышеуказанных гиперлипидемий (гиперхолестеринемии).
Уровень липопротеинов высокой плотности составляет у мужчин 125–425 мг/дл (1,3–4,3 г/л), у женщин — выше из-за высокого содержания эстрогенов, способствующих синтезу ЛВП, и составляет в норме 250–660 мг/дл (2,5–6,6 г/л). Снижение уровня ЛВП ниже этих цифр умеренно повышает риск атеросклероза. При уменьшении уровня ЛВП ниже 1,05 г/л у мужчин и 1,3 г/у женщин риск атеросклероза становится высоким.
Исследование уровня холестерина в составе ЛВП является более точной оценкой степени риска развития атеросклероза: снижение его содержания в ЛВП менее 35 мг/дл (0,9 ммоль/л) коррелирует с риском атеросклероза и ишемической болезни сердца в 8 раз сильнее, чем общий холестерин плазмы крови. На практике часто используется холестериновый коэффициент атерогенности (ХКА): ХКА = общий холестерин – холестерин ЛВП / холестерин ЛНП. Так при ишемической болезни величина ХКА, как правило, более 4 и нередко 6.
Измеряя липидологические показатели у пациента с целью определения риска развития атеросклероза, ишемической болезни сердца, к сожалению, даже при всех критериях физиологической нормы, в том числе и уровня холестерина, нельзя с полной достоверностью считать, что у конкретного больного отсутствует данный риск развития патологических состояний. Поскольку даже небольшое содержание в плазме крови так называемых аномальных минорных липопротеинов может привести к быстрому развитию атеросклероза.
Разделение по группам
Рассмотрев основные принципы лабораторной диагностики повышения уровня холестерина и других липопротеинов, специалист, в том числе и диетолог, должен выделить из группы пациентов больных с первичными гиперлипопротеинемиями и вторичными.
Пациентам с вторичными нарушениями обмена липопротеинов, т. е. с повышенным уровнем холестерина плазмы крови, необходимо назначить диету, направленную на снижение уровня холестерина. Такие больные должны наблюдаться у профильного специалиста в соответствии с выявленным у него основным заболеванием, а также у кардиолога, если установлен высокий уровень риска развития атеросклероза.
К назначению лечения у пациентов с гиперлипопротеинемиями (дислипопротеинемиями) необходимо подойти с другой стороны. Дело в том, что эти заболевания могут протекать бессимптомно, но в итоге сильно влияют на вероятность, скорость развития таких угрожающих жизни недугов, какими являются атеросклероз, панкреатит и их осложнения. Ранний диагноз, своевременное назначение лечения, в том числе и диетотерапии, могут реально удлинить жизнь пациентов и улучшить ее качество. Различные виды гиперпротеинемий коррелируют с продолжительностью жизни, что имеет большое прогностическое значение.
Признаки нарушения обмена веществ
Гиперлипопротеинемии — самые распространенные нарушения обмена веществ у европеоидов и негроидов. Пораженность населения этими заболеваниями достигает от 10 до 25 %. Такие внешние проявления, как ксантоматоз (век, сухожилий и т. д.), липидная дуга роговицы, являются признаками наличия нарушений липидного обмена. Своевременно обратив внимание на такие проявления, врач-диетолог может предпринять все необходимые меры для восстановления обмена веществ.
Гиперлипопротеинемия. Критерии постановки диагноза
Первичная гиперлипопротеинемия 1-го типа. Имеется наследственный аутосомно-рецессивный дефект фермента липопротеиновой липазы. Из-за блока фермента в крови накапливается большое количество хиломикрон (транспортеров пищевых липидов), провоцируются тромбозы и микронекрозы, особенно характерные для поджелудочной железы. Характерны наблюдаемые с раннего детства абдоминальные колики, формируется хронический рецидивирующий панкреатит. На коже спины, плеч, ягодицах характерны ксантомы — желтовато-розовые папулы. Накопление хиломикрон способствует гиперспленомегалии. Приобретенная фенокопия заболевания формируется у больных с аутоиммунными заболеваниями соединительной ткани. Необходимы назначение диетотерапии и консультация врача-диетолога. Диетотерапия показана в ряде случаев как монотерапия. Медикаментозная коррекция дает незначительный эффект. Частота встречаемости — 0,1 % населения.
Первичная гиперлипопротеинемия типа 2а. Развивается при наследственном заболевании семейной гиперхолестеринемии, имеет аутосомно-доминантное наследование. Ведет к раннему развитию ишемической болезни сердца. По статистике, каждый 20-й инфаркт происходит у носителя данного заболевания. Характерен выраженный ксантоматоз. Наиболее типичны ксантомы сухожилий, четырехглавой мышцы бедра, век, голени, коленей («бугорчатые ксантомы»). В местах травматизации кожи возникают множественные плоские ксантомы. Вторичные формы заболевания: гипотиреоз, гиперкортицизм, перемежающаяся порфирия, диабет. В основном применяется медикаментозная коррекция. Диетотерапия как монотерапия неэффективна. Частота встречаемости — 0,2 % населения.
Первичная гиперлипопротеинемия типа 2б. Характерна для семейной смешанной гиперлипидемии. Аутосомно-доминантное наследование. Значительно ускоряется развитие атеросклероза. Ксантоматоз менее выражен, сухожильные ксантомы отсутствуют. Сопутствующие состояния: избыточный вес, гипертензия, гиперурикемия, стеатоз печени. Значительно зависит от переедания, диеты, образа жизни. Вторичные формы заболевания: гипотиреоз, гиперкортицизм, перемежающаяся порфирия, диабет. Необходимы назначение диетотерапии и консультация врача-диетолога. Частота встречаемости — 2 % населения.
Гиперлипопротеинемия 3-го типа. Относится к дисбеталипопротеинемиям. Болезнь проявляется в третьем десятилетии жизни. Характерен ксантоматоз, ладонные и подошвенные ксантомы, образующие оранжево-желтые следы в области давления колец, в межпальцевых складках. Имеются туберозные ксантомы на локтях и коленях. Характерен ускоренный атеросклероз коронарной, церебральной и абдоминальной локализаций. Ишемическая болезнь сердца сопровождается перемежающейся хромотой вплоть до гангрены. Характерно развитие энцефалопатии, быстро осложняющейся инсультами. Сопровождается повышенным весом, диабетом, стеатозом печени. Приобретенные формы заболевания характерны для гипотиреоза, при холестазе. Необходимо медикаментозное лечение. Диетотерапия применяется. Частота встречаемости — 2 % населения.
Гиперлипопротеинемия 4-го типа. Самая распространенная гиперлипопротеинемия. Характерен метаболический синдром с развитием ожирения (как правило, андроидного типа), инсулинрезистентный и скрытый сахарный диабет 2-го типа, гиперурикемия, гипертензия и стеатоз печени. Характерно быстрое развитие атеросклероза, снижение зрения, развитие импотенции. Фенокопии заболевания развиваются при диабете, хроническом алкоголизме, стрессе, приеме оральных контрацептивов, гликогенозе 1-го типа. Необходима медикаментозная коррекция и диета с ограничением углеводов и насыщенных жиров. Частота встречаемости — более 2,5 % населения.
Гиперлипопротеинемия 5-го типа. Аутосомно-рецессивное наследование. Основные симптомы болезни сходны с гиперлипопротеинемией 1-го типа. Панкреатит протекает менее тяжело, клиника болезни развивается позже во взрослом состоянии. Ксантоматоз характерен в виде эруптивных ксантом сгибательных поверхностей плеча и т. д. Вторичные формы заболевания: гипотиреоз, гиперкортицизм, перемежающаяся порфирия, диабет. Диетотерапия показана в ряде случаев как монотерапия. Частота встречаемости — менее 0,2 % населения.
Если врач-диетолог обнаружил у пациента симптомы, характерные для наследственных гиперлипопротеинемий, то необходимо проконсультировать пациента у врача-кардиолога, терапевта и, возможно, у эндокринолога для выявления возможных наследственных заболеваний или фенокопий. Это нужно сделать для того, чтобы разработать комплексный план диетотерапии и медикаментозного лечения. Поскольку в ряде случаев при наследственных гиперлипопротеинемиях гипохолестериновая диета не имеет никакого значения, а при некоторых из них играет основную роль, особенно при наличии семейных заболеваний, где применение профилактической диетотерапии может значительно снизить сроки развития и тяжесть течения наследственной болезни.
Опасности гипохолестериновой диеты
Представленные характеристики некоторых видов гиперлипидемий еще раз показывают многообразие форм нарушений холестеринового обмена, и каждая из них будет связана с изменением уровня холестерина и липопротеинов в крови. Можно говорить не только о патогенности избытка холестерина в организме (например, холестероз как фактор риска развития атеросклероза), но и о патогенности общего недостатка холестерина (холестериндефицит, являющийся фактором риска опухолевых и вирусных заболеваний).
Как правило, врачи и диетологи, назначая диету с низким содержанием жира, рекомендуют соблюдать ее достаточно долго и не предвидят последствий от данных ими рекомендаций.
По данным П. Е. Калмыкова, М. Н. Лопаткина (1974 г.), у здорового человека даже полугодовое пребывание на безжировой диете не ведет к патологическим последствиям, так как жирорастворимые витамины и ненасыщенные жирные кислоты поставляются из депо, а иные липиды синтезируются из предшественников. Но более длительная или постоянная диета со значительным ограничением липидов приводит к расстройству здоровья, возникает алиментарная липидная недостаточность. Основные проявления алиментарной липидной недостаточности: роговая дистрофия, гиперкератоз, гиперхолестеринемия.
«Лекарства» от алиментарной липидной недостаточности
Основные проявления алиментарной липидной недостаточности снимаются введением полиненасыщенных жирных кислот. Поэтому нехватка в диете полиеновых кислот ускоряет развитие атеросклероза, стеатоза печени, развиваются различные формы дерматитов.
Основными «лекарствами» в данной ситуации, которые в обязательном порядке должны присутствовать в составе пищевого рациона, становятся следующие полиеновые кислоты:
Методы снижения холестерина
Еще в середине прошлого века одна из первых исследователей в области нутрициологии Дэйзи Аделия Дэвис высказывала в своей книге «Нутрицевтика. Питание для жизни, здоровья и долголетия» актуальные и по сей день мысли:
«Как мне кажется, проблемы, связанные с отложениями холестерина, будут нарастать с каждым годом. Стало модным контролировать свой вес, отказываясь от очередного приема пищи. В результате организм страдает от недоедания, а потом „оглушается“ большим количеством пищи, поглощенной за один прием. В экспериментах на людях и животных было показано, что при 1–2-разовом питании холестерин в крови повышается и, наоборот, понижается, если есть часто и небольшими порциями».
В XXI в. мы уже имеем возможность использовать в работе результаты многочисленных исследований, применять различные новые методы снижения уровня холестерина в организме. Далее мы расскажем о некоторых из них.
При нормально функционирующей печени как органа не только детоксикационного, но и синтетического в достаточном количестве вырабатываются фосфолипиды — лецитин. Основной особенностью этих веществ является прямое влияние на уровень холестерина в крови. Данные вещества способны переводить холестерин в быстроусвояемые формы и препятствовать его накоплению в организме.
Лецитин синтезируется в печени из жиров, холина, инозитола и ненасыщенных жирных кислот при непосредственном участии ферментов, для работы которых необходим витамин В6 и магний. При недостатке в диете данных компонентов синтез лецитина тормозится и растет уровень накопления холестерина. Необходимо отметить, что каждое из перечисленных веществ может снижать уровень холестерина. При правильно сбалансированном питании уровень холестерина в крови находится в норме. В случае увеличения в составе пищи твердых жиров значительно увеличивается потребность в холине, лецитине, магнии. В данной ситуации прием лецитина может стать и профилактическим средством при возможном нарушении диеты.
В ряде исследований было показано, что без применения гипохолестериновой диеты, но с условием достаточного количества в диете витаминов группы В, магния и лецитина, уровень холестерина в крови может находиться в норме. Данный принцип положен при применении биологически активных добавок к пище в виде нутрицевтиков, содержащих лецитин. Основной принцип диетотерапии не в ограничении ряда компонентов, а в первую очередь в полноценности состава пищевого рациона для каждого конкретного пациента.
Необходимо отметить еще один интересный факт при проведении врачом-диетологом диетотерапии у пациента с гиперхолестеринемией. Как правило, диетолог рекомендует ввести в состав пищевого рациона большой объем растительных масел, исключить ряд продуктов, в том числе те, в состав которых входят твердые жиры (различные сорта мяса, свинину, баранину и т. д.). Подобным рекомендациям исследователь Дэйзи Аделия Дэвис дает достаточно емкую оценку в своей книге «Нутрицевтика. Питание для жизни, здоровья и долголетия»:
«Подобные рекомендации, лишающие пациентов таких превосходных продуктов, как яйца, печень, почки, мозги, морские моллюски и крабы, сливки, сливочное масло и цельное молоко — содержащие питательные вещества, необходимые для синтеза лецитина, — мягко говоря, кажутся неправильными. Холестерин, помимо того что поступает с пищей, вырабатывается в организме в основном в печени. Если среднее дневное поступление холестерина 500–700 мг, то в организме вырабатывается около 1000 мг. При уменьшении поступления холестерина с пищей его выработка увеличивается».
Необходимо помнить, что значительное увеличение в пищевом рационе растительных масел без увеличения ежедневного приема витамина Е недопустимо, т. к. некоторые растительные жиры являются более насыщенными, но не от природы, а в результате технической переработки при приготовлении, вызывая тем самым увеличение потребности организма в холине.
«Суточная потребность витамина Е колеблется от 30 МЕ (минимальное потребление) до нескольких сотен единиц. Более тщательные исследования показали, что взрослому человеку, как правило, требуется не менее 140–210 МЕ в день, а на каждую столовую ложку растительного масла необходимо добавлять еще до 100 МЕ», — отмечает Дэйзи Аделия Дэвис в книге «Нутрицевтика. Питание для жизни, здоровья и долголетия».
Выводы для доктора
Познакомившись с представленным информационным обзором, врач-диетолог должен более детально подойти к системе ограничений в диетотерапии гиперхолестеринемий, задуматься над вопросом их целесообразности и определить в первую очередь приоритеты для выбора тактики лечения конкретного пациента, исключения ряда продуктов питания.
В заключение информационного обзора хотелось бы представить еще одно интересное мнение Дэйзи Аделия Дэвис: «Когда холестерин удается понизить до нормального уровня, это еще не значит, что накопленные его отложения разрушились. Удаление старых отложений процесс длительный, поэтому придерживаться полноценного рациона питания следует постоянно».
Мы представили два мнения экспертов разных специальностей — врача-диетолога и терапевта — о роли гиперхолестеринемии в формировании заболеваний, критериях диагностики лечения данного состояния. Если эта тема вас заинтересовала или вы имеете свое собственное мнение, основанное на клиническом опыте, проведенных научных исследованиях, просим поделиться с нашими читателями на страницах журнала.
Адрес нашей электронной почты:
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!