Для чего назначают кошкам метипред
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
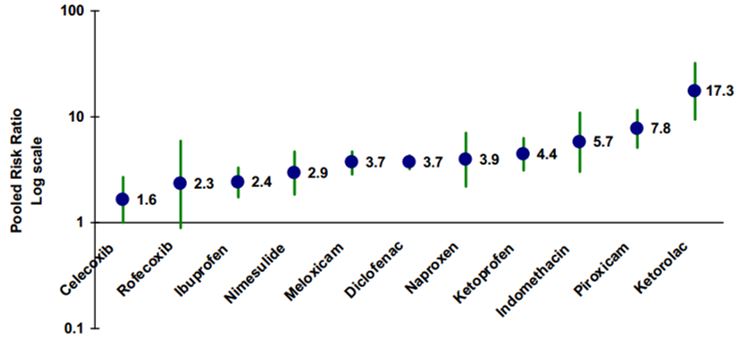
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Глюкокортикоидная терапия сегодня: эффективность и безопасность
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Лечение тиреотоксикоза
Тиреотоксикоз обусловлен избыточной секрецией тиреоидных гормонов щитовидной железой и встречается при многих клинических состояниях. Причинами развития тиреотоксикоза могут быть: диффузный токсический зоб (ДТЗ, болезнь Грейвса, болезнь Базедова); аутоим
Тиреотоксикоз обусловлен избыточной секрецией тиреоидных гормонов щитовидной железой и встречается при многих клинических состояниях. Причинами развития тиреотоксикоза могут быть: диффузный токсический зоб (ДТЗ, болезнь Грейвса, болезнь Базедова); аутоиммунный тиреоидит в фазе тиреотоксикоза; функциональная автономия (токсическая аденома, многоузловой токсический зоб); йод-индуцированный тиреотоксикоз; резистентность к тиреоидным гормонам; ТТГ-продуцирующая аденома; гестационный транзиторный тиреотоксикоз; метастазы рака, продуцирующие тиреоидные гормоны; Struma ovarii; ятрогенный тиреотоксикоз; тиреотоксическая стадия подострого тиреоидита (де Кервена).
При наличии у пациента клинических симптомов тиреотоксикоза, прежде чем приступать к лечению, очень важно точно установить причину его развития, поскольку от этого будет зависеть адекватность выбранного метода терапии.
Гормональными маркерами гиперфункции, равно как и других заболеваний щитовидной железы, являются тиреотропный гормон (ТТГ) и свободный тироксин (св.Т4). В тех случаях когда при исследовании ТТГ оказывается сниженным, а св. Т4 в пределах нормы, проводится определение свободного трийодтиронина (св.Т3) с целью диагностики Т3-тиреотоксикоза (рис.1). На следующем этапе диагностики необходимо установить причину тиреотоксикоза. В медицинской практике нам наиболее часто приходится наблюдать пациентов с аутоиммунными заболеваниями щитовидной железы — ДТЗ и аутоиммунный тиреоидит. ДТЗ обусловлен выработкой тиреостимулирующих иммуноглобулинов (ТСИ), которые связываются с рецептором ТТГ на мембранах тиреоцитов и через активацию циклического аденозинмонофосфата постоянно стимулируют повышенную секрецию тиреоидных гормонов. Исследование антител к рецептору ТТГ (АТ-рТТГ) не только позволяет подтвердить диагноз ДТЗ, но и дифференцировать его с аутоиммунным тиреоидитом (АИТ).
Показания для определения АТ-рТТГ в клинической практике
В практике врача уже стало традиционным определение антител к тиреоглобулину (АТ-ТГ) и к тиреопероксидазе (АТ-ТПО). Выявление этих антител позволяет легко решить проблему диагностики либо в пользу АИТ, либо — ДТЗ. На этот факт следует обратить особое внимание, поскольку АТ-ТГ и АТ-ТПО могут обнаруживаться в достаточно большом количестве как у больных АИТ, так и у пациентов с ДТЗ. Более того, по данным исследований, эти антитела могут выявляться у части здоровых людей и у пациентов с заболеваниями щитовидной железы неаутоиммунного генеза. И наконец, не во всех случаях при АИТ и ДТЗ антитела можно обнаружить. Следовательно, проводить диагностику на основании только одного признака и тем более решать вопрос о целесообразности назначения лечения не представляется возможным. В диагностике АИТ помимо определения АТ-ТПО большое значение имеет ультразвуковое исследование щитовидной железы (УЗИ).
Неравномерное диффузное снижение эхогенности ткани служит надежным признаком АИТ, но тем не менее не позволяет дифференцировать его с ДТЗ, для которого характерным являются те же изменения по УЗИ. Таким образом, диагноз АИТ должен основываться на комплексе клинических и лабораторно-диагностических признаков. УЗИ щитовидной железы позволяет определить объем ткани, наличие узлового образования, что очень важно, поскольку у части пациентов эти показатели могут повлиять на выбор стратегии лечения.
Сцинтиграфия щитовидной железы у больных тиреотоксикозом проводится при подозрении на наличие функциональной автономии (токсическая аденома, многоузловой токсический зоб), загрудинный зоб, нефункциональные участки более 1–1,5 см.
Лечение ДТЗ (болезни Грейвса)
В настоящее время существуют три метода лечения ДТЗ: консервативный; радиоактивным йодом ( 131 I); хирургический.
Каждый из этих методов имеет свои показания, а также противопоказания и должен назначаться каждому пациенту индивидуально.
1. Консервативное лечение
Консервативную терапию назначают больным с небольшим диффузным увеличением щитовидной железы (по объему — 35–40 мл) без симптомов сдавления.
У пациентов с большим объемом щитовидной железы и/или узловыми образованиями по размерам более 1,0-1,5 см, а также с тяжелыми осложнениями тиреотоксикоза консервативную терапию используют в качестве медикаментозной подготовки к хирургическому лечению. При планировании радиойодтерапии пациентам также предварительно назначают консервативное лечение.
На фоне тиреостатической терапии эутиреоидное состояние наступает уже через 3–5 нед от начала лечения. В течение последующих 12–24 мес поддерживающей эутиреоз терапии примерно у 20–40% пациентов развивается ремиссия заболевания.
К сожалению, у части пациентов примерно через год вновь «расцветает» клиника тиреотоксикоза. Таким больным нецелесообразно назначать повторные длительные курсы консервативной терапии. Вероятнее всего, ТСИ продолжают вырабатываться в большом количестве и стимулировать щитовидную железу к избыточной продукции тиреоидных гормонов. В подобных случаях проводят курс медикаментозной подготовки, а затем, в зависимости от размеров и морфологических изменений ткани щитовидной железы, назначают либо терапию 131 I, либо оперативное лечение. Прогноз ремиссии или возможного рецидива тиреотоксикоза после проведения курса тиреостатической терапии можно определить по уровню АТ-рТТГ. Исследование антител проводится перед полной отменой препаратов. Риск рецидива тиреотоксикоза у пациентов возрастает при повышенном уровне АТ-рТТГ, чаще рецидивы наблюдаются в течение первого года после окончания лечения.
Для лечения ДТЗ на протяжении многих лет используются препараты из группы тионамидов: тиамазол (тирозол, мерказолил, тиамазол-филофарм, метизол, метимазол) и пропилтиоурацил (пропицил). C появлением дозировки тирозола 10 мг количество принимаемых таблеток можно уменьшить в 2 раза, что создает дополнительное удобство для пациентов. Механизм тиреостатического действия заключается в подавлении синтеза тиреоидных гормонов на стадиях органификации и комплексирования. Пропилтиоурацил частично подавляет превращение Т4 в Т3 за счет ингибирования 5’-монодейодиназы. Лечение тиреостатическими препаратами начинают с относительно высоких доз: 30–40 мг тиамазола или его аналогов 2–3 приема в день в течение дня или 300 мг пропилтиоурацила — 3–4 приема в день. После достижения эутиреоза дозу постепенно снижают до поддерживающей: тиамазол до 5–10 мг в день, пропилтиоурацил до 50–100 мг 1–2 приема в день (рис). Достижение эутиреоидного состояния оценивается по исчезновению клинических симптомов тиреотоксикоза и уровню св. Т4. Определять уровень ТТГ нецелесообразно, поскольку на протяжении нескольких месяцев он может оставаться подавленным. Дополнительно в лечении ДТЗ используют β-адреноблокаторы, которые подавляют тканевое превращение Т4 в Т3. Пропранолол назначают по 60–120 мг/сут 3–4 приема в день, атенолол — 50–100 мг/сут, конкор — 5–10 мг/сут однократно. В клинической практике существует два варианта назначения тиреостатических препаратов: в виде монотерапии или в комбинации с левотироксином (эутирокс, L-тироксин, тиро-4). В последнем варианте пациенту по достижению эутиреоидного состояния (оценивается по уровню Т4) подключают левотироксин в дозе 25–50 мкг. Исследования показывают, что на фоне комбинированной поддерживающей терапии в течение 18–24 мес достигается более стойкая блокада секреции тиреоидных гормонов.
При лечении тиреостатическими препаратами у пациентов могут развиться побочные эффекты в виде аллергических реакций (зуд, крапивница и др.). Одним из наиболее серьезных осложнений является агранулоцитарная реакция. Поэтому пациентам рекомендуется проводить общий анализ крови в первые 7–10 дней после начала лечения, а в дальнейшем — 1 раз в мес. К другим крайне редким тяжелым побочным эффектам относится тромбоцитопения, острый некроз печени.
2. Терапия радиоактивным йодом
Во многих странах мира радиойодтерапия — наиболее часто рекомендуемый метод лечения как ДТЗ, так и других форм токсического зоба, в частности функциональной автономии. Необходимо отметить, что 131 I назначают больным в любом возрасте (дети, пациенты молодого, среднего и пожилого возраста). Единственным противопоказанием для радиойодтерапии является беременность и грудное вскармливание. Спорным остается вопрос о лечении 131 I пациентов ДТЗ в сочетании с эндокринной офтальмопатией. Согласно результатам рандомизированного исследования, у части больных ДТЗ терапия 131 I способствовала прогрессированию эндокринной офтальмопатии. У пациентов, получающих радиойодтерапию, ремиссия тиреотоксикоза наступает в 90–95% случаев. Рецидив заболевания возможен у 3–5% больных, что требует проведения повторного курса радиойодтерапии. Радиоактивный йод принимают перорально в виде натриевой соли 131 I в растворе или капсулах: 131 I быстро поступает в щитовидную железу, вызывая деструкцию тиреоцитов посредством β-излучения. Чаще всего возникает вопрос о выборе больших или малых доз радиойода. Как известно, большие дозы неминуемо приводят к развитию гипотиреоза, использование же малых доз сопряжено с возможностью сохранения клиники тиреотоксикоза. Многолетние исследования за пациентами показали, что однократная доза радиоактивного йода, рассчитанная на полное разрушение щитовидной железы, излечивает тиреотоксикоз у 90% больных. Применение малых доз сохраняет эутиреоидное состояние в течение 10 лет после радиойодтерапии лишь у 25–30% больных. К сожалению, из-за дефицита 131 I нам довольно редко приходится пользоваться этим методом в лечении больных с тиреотоксикозом.
3. Хирургическое лечение
Показаниями для оперативного лечения больных с тиреотоксикозом служат большие размеры зоба, непереносимость тиреостатиков, рецидив тиреотоксикоза после проведенной консервативной терапии, загрудинно расположенный зоб. При наличии показаний возможно хирургическое лечение в I и II триместрах беременности, которое заключается в проведении субтотальной резекции щитовидной железы с оставлением минимального количества (объема) ткани. Однако нередко возникает проблема с определением этого минимального объема ткани. Если оставить меньше 4 г тиреоидной ткани, то неминуемо разовьется гипотиреоз, и тогда возникает необходимость в назначении заместительной терапии левотироксином. В тех случаях когда ткани оставляют больше 4–6 г, довольно часто после операции сохраняются клинические симптомы тиреотоксикоза, возможно, не столь выраженные. Это состояние иногда называют «ложный рецидив». Большой объем оставшейся после операции тиреоидной ткани создает условия для продолжения избыточной секреции тиреоидных гормонов под стимулирующим влиянием ТСИ. Подобная хирургическая тактика, с одной стороны, повышает риск развития осложнений, в частности мерцательной аритмии, а с другой — нередко заканчивается повторной операцией. Согласно вышеизложенному, если пациенту показано оперативное лечение, то целесообразно проводить максимально субтотальную резекцию щитовидной железы, оставляя не более 3 мл ткани. Безусловно, это требует высокой квалификации хирурга, поскольку, как известно, оперативное лечение сопряжено с развитием ряда осложнений, таких как парез возвратного нерва, удаление паращитовидных желез. Операцию следует проводить на фоне эутиреоидного состояния, достигнутого с помощью тиреостатической терапии. При непереносимости тиреостатиков используют β-адреноблокаторы или йод (насыщенный раствор калия йодида или раствор Люголя — 8–10 капель в день в течение 10–12 дней до операции).
Лечение аутоиммунного тиреоидита в фазе тиреотоксикоза
Довольно часто АИТ верифицируется как ДТЗ, поскольку клинические симптомы идентичны, а АТ-ТГ и АТ-ТПО выявляются почти с одинаковой частотой при одном и другом заболевании. Определение АТ-рТТГ в настоящее время пока еще доступно не во всех городах России. Лечение тиреотоксической стадии АИТ проводится чаще консервативно (при отсутствии аргументированных показаний в пользу оперативного вмешательства), при этом в терапии используют β-адреноблокаторы или же их комбинацию с тиреостатическими препаратами. Следует заметить, что тиреотоксикоз на фоне АИТ имеет некоторые особенности: быстрый эффект при приеме тиреостатических препаратов с развитием медикаментозного гипотиреоза; в ряде случаев волнообразное течение заболевания со сменой состояний тиреотоксикоза и эутиреоза.
Лечение функциональной автономии (токсическая аденома, узловой и многоузловой токсический зоб)
Пациентам с тиреотоксической формой функциональной автономии назначают тиреостатические препараты (тирозол, мерказолил, тиамазол-филофарм, метизол, метимазол, пропицил) с целью подготовки к оперативному лечению. В нашей стране из-за дефицита лечебного 131 I больных с функциональной автономией оперируют, хотя во многих странах мира основным методом лечения этих состояний является радиойодтерапия. Автономные участки тиреоидной ткани хорошо захватывают радиойод, который разрушает только эти участки ткани щитовидной железы. Большинство пациентов в дальнейшем переходят в эутиреоидное состояние. Радиойодтерапия предпочтительна особенно у больных пожилого возраста. К операции прибегают при большом объеме автономной ткани щитовидной железы (более 3 см в диаметре).
ТТГ-индуцированный тиреотоксикоз (резистентность к тиреоидным гормонам и ТТГ-продуцирующая аденома гипофиза)
Синдром генерализованной резистентности встречается довольно редко (в литературе описаны около 600 случаев). В связи с тем что у человека чувствительность органов и тканей к тиреоидным гормонам неодинакова, у одного и того же пациента могут развиваться как эутиреоидное, гипотиреоидное, так и гипертиреоидное состояния. Резистентность периферических тканей способствует компенсаторному повышению секреции тиреоидных гормонов, сохраняя, таким образом, эутиреоидное состояние. Если гипофиз оказывается более резистентным по сравнению с периферическими тканями, то развиваются клинические симптомы тиреотоксикоза, которые очень трудно поддаются медикаментозному лечению. Исследования показали, что лечебным эффектом обладает 3,5,3’-трийодтироуксусная кислота. Особенностью этого синдрома является отсутствие подавления ТТГ даже при использовании сверхбольших доз L-Т4, поэтому снижение ТТГ с помощью тиреоидных гормонов абсолютно неэффективно. При обнаружении ТТГ-продуцирующей аденомы гипофиза показано оперативное лечение.
Подострый тиреоидит (де Кервена) развивается спустя некоторое время (4–6 нед) после перенесенной вирусной инфекции. В течении подострого тиреоидита различают тиреотоксическую стадию, которая сменяется гипотиреоидной стадией, а затем в большинстве случаев тиреоидная функция полностью восстанавливается. Назначение β-адреноблокаторов (пропранолол, атенолол, бетаметазон) снимает симптомы тиреотоксикоза, применение препаратов из группы тионамидов не требуется. Пациентам рекомендуется лечение глюкокортикоидами. Преднизолон назначают по 30–40 мг ежедневно в течение 2–3 нед с последующим постепенным снижением дозы на 5 мг в нед. Возможен и другой вариант назначения глюкокортикоидов — 30–40 мг ежедневно в течение 10–12 дней с последующим переводом на прием через день в этой же дозе на протяжении 6–8 нед. Прогноз заболевания, как правило, благоприятный.
Нередко в кардиологической практике пациентам с нарушениями ритма назначают ритмиодарон, амиодарон, кордарон, седакорон. Следует отметить, что эти лекарственные средства способны изменять уровень тиреоидных гормонов у исходно эутиреоидных пациентов. Более чем у 50% больных, принимающих постоянно амиодарон, повышен уровень Т4 (в среднем на 44% по сравнению с базальным уровнем за счет нарушения превращения Т4 в Т3). Следовательно, изолированное повышение Т4 при терапии амиодароном нельзя интерпретировать как диагностический признак тиреотоксикоза. Тем не менее примерно у 5–20% пациентов эти препараты вызывают гипертиреоз, который обычно сопровождается дальнейшим повышением уровня Т4 на фоне значительного снижения уровня ТТГ с развитием симптомов тиреотоксикоза. Наиболее информативный контроль функции щитовидной железы при длительной терапии амиодароном или кордароном оказывается при условии определения ТТГ. Пациентам с «амиодароновым» тиреотоксикозом к терапии подключают β-адреноблокаторы.
Тиреотоксикоз при беременности повышает риск выкидыша, преждевременных родов и рождения плода с малой массой тела. У женщины при этом чаще развивается токсикоз, а в ряде случаев сердечная недостаточность. Одной из наиболее распространенных причин тиреотоксикоза у беременных женщин является ДТЗ. Оптимальным вариантом при его развитии на фоне беременности является ее прерывание. Однако если женщина настаивает на сохранении беременности, то обычно назначают пропилтиоурацил в дозе 25–50 мг в два приема, поскольку при приеме мерказолила у плода иногда наблюдается дефект кожи на голове. Кроме того, пропилтиоурацил имеет более короткий период полужизни и вызывает меньше осложнений по сравнению с тионамидами. В случае использования тионамидов следует назначать минимально эффективные дозы (5–10 мг тирозола в сут) с ежемесячным контролем свободных фракций тиреоидных гормонов. Большие дозы препаратов могут привести к развитию зоба и гипотиреоза у плода. Слабое стимулирующее действие на щитовидную железу оказывает хорионический гонадотропин (ХГ), концентрация в крови которого на ранних сроках беременности возрастает.
У незначительного числа беременных женщин именно ХГ способствует развитию транзиторного тиреотоксикоза. Это состояние не требует лечения. Относительно тяжелый тиреотоксикоз может наблюдаться при пузырном заносе или хориокарциноме.
В этих случаях пузырный занос удаляют или принимают меры, направленные на хориокарциному.
Послеродовый тиреоидит развивается спустя 1–3 мес после родов. Симптомы тиреотоксикоза носят транзиторный характер, сменяясь в дальнейшем гипотиреозом со спонтанной ремиссией через 6–8 мес. Транзиторная стадия тиреотоксикоза не требует лечения, а в гипотиреоидной стадии назначают левотироксин в дозе, которая способствует нормализации ТТГ.
Л. В. Кондратьева, кандидат медицинских наук, доцент
РМАПО, Москва