Для чего необходимо исследование минимальной остаточной болезни при остром лейкозе
| Минимальная остаточная болезнь |
|---|
При лечении рака, особенно лейкемии, тестирование MRD выполняет несколько важных функций: определение того, удалось ли лечить рак или остались ли следы, сравнение эффективности различных методов лечения, мониторинг состояния ремиссии пациента, а также обнаружение рецидива лейкемии или рака и выбор лечение, которое лучше всего удовлетворит эти потребности.
Эти тесты непростые, часто являются частью исследований или испытаний, а некоторые из них были приняты для рутинного клинического использования.
Содержание
Предпосылки: проблема минимальной остаточной болезни (MRD)
Большинство исследований MRD проводилось по лейкозам, особенно двум типам: хроническому миелоидному лейкозу у взрослых и остром лимфобластному лейкозу у детей (наиболее распространенному раку у детей).
Лейкоз представляет собой генетическую аномалию, которая может начаться в отдельной клетке, а затем быстро размножаться, что приводит к нарушению соотношения типов клеток в крови. Когда берется образец костного мозга, лейкозные клетки можно рассматривать под микроскопом. Лейкозные клетки выглядят как нормальные незрелые клетки крови, а здоровый костный мозг часто состоит на 1-2% незрелых ( бластных ) клеток. Однако при лейкозе наблюдается аномально большое количество незрелых клеток, составляющих 40–90% костного мозга. Дополнительное исследование костного мозга с помощью тестов, включая проточную цитометрию и FISH, необходимо для диагностики конкретного злокачественного новообразования.
Симптомы не проявляются до тех пор, пока болезнь не разовьется и в организме не будет 1 кг или 1 000 000 000 000 лейкозных клеток.
Первые пять недель лечения убивают большинство лейкемических клеток, и костный мозг начинает восстанавливаться. У пациента могут присутствовать незрелые лейкоциты, хотя они не обязательно являются злокачественными. В большинстве случаев небольшое количество лейкозных клеток (примерно 0,001%) выживают после этого лечения и сохраняются в костном мозге в течение месяцев или лет. Раковые клетки можно идентифицировать с помощью ДНК-тестов или иммунологических тестов, но они не могут быть идентифицированы как злокачественные при просмотре под микроскопом.
Около 30 лет назад лейкемия была смертельной. Пациентов лечили в течение нескольких недель (а не месяцев или лет, как в настоящее время), что привело к ремиссии, но почти у всех пациентов рецидив наступил через несколько недель или месяцев. Теперь известно, что минимальная остаточная болезнь может возобновиться после прекращения лечения. Генетические тесты могут подтвердить, что лейкозные клетки при рецидиве являются потомками тех, которые присутствовали при первом появлении болезни.
Тесты, которые выявляют минимальную остаточную болезнь (одна раковая клетка в популяции из миллиона нормальных клеток), полезны для направления лечения и предотвращения рецидивов. Одна оставшаяся лейкозная клетка может быть фатальной, поскольку злокачественные клетки бесконтрольно делятся. Режимы кондиционирования могут продолжаться до тех пор, пока пациент достаточно здоров, чтобы выдержать повреждения от цитотоксического лечения.
Методы измерения минимальной остаточной болезни при лейкемии
ДНК-тесты
Некоторые новые методы используют секвенирование следующего поколения для обнаружения MRD.
Тесты на основе РНК
Они основаны на обнаружении последовательности РНК, специфичной для лейкемии. Обычно это достигается за счет использования обратной транскрипции РНК с последующей полимеразной цепной реакцией. Тесты на основе РНК обычно используются, когда тест ДНК нецелесообразен. Например, транслокация t (9; 22) BCR-ABL может происходить на большой длине хромосомы, что делает тестирование на основе ДНК трудным и неэффективным. Однако РНК является гораздо менее стабильной мишенью для диагностики, чем ДНК, и требует осторожного обращения и обработки.
Индивидуальное тестирование пациента
Тесты на основе ДНК и РНК требуют, чтобы патолог исследовал костный мозг, чтобы определить, на какую лейкемическую последовательность воздействовать. После определения мишени получают образец крови или костного мозга, извлекают нуклеиновую кислоту и анализируют образец на лейкемическую последовательность. Эти тесты очень специфичны и обнаруживают лейкемические клетки на уровне до одной клетки на миллион, хотя обычно достигается предел от 1 на 10 000 до 1 на 100 000 клеток. Для сравнения, предел того, что можно обнаружить с помощью традиционных морфологических исследований с помощью микроскопа, составляет около 1 клетки из 100.
Иммунологические тесты
Использование и общие мишени для выявления различных лейкозов, лимфом и солидных опухолей
Острый лимфобластный лейкоз (ОЛЛ)
Мишени: t (9; 22) BCR-ABL, t (12; 21) ETV6-RUNX1 (TEL-AML1), специфические для пациента анализы на гены иммуноглобулинов и Т-клеточных рецепторов.
Использование: Обнаружение MRD хромосомной транслокации широко используется в качестве стандартной клинической практики. Анализы для конкретных пациентов получают все большее распространение, но все еще обычно используются только в исследовательских протоколах.
Острый миелоидный лейкоз (ОМЛ)
Цели: t (15; 17) PML-RARA, t (8; 21) AML1- RUNX1 T1 (AML-ETO), inv (16)
Использование: Выявление MRD хромосомной транслокации широко используется в качестве стандартной клинической практики.
Хронический лимфолейкоз
Мишени: белки клеточной поверхности, специфические для пациента анализы на иммуноглобулин и гены рецепторов Т-клеток.
Использование: Иммунологические методы получают все более широкое применение, поскольку для клинических испытаний используются более совершенные проточные цитометры. Специфические для пациента анализы по-прежнему обычно используются только в протоколах исследований.
Хронический миелолейкоз
Цель: t (9; 22) BCR-ABL
Использование: определение MRD t (9; 22) считается стандартом лечения для всех пациентов с CML и чрезвычайно ценно для пациентов, получающих мезилат иматиниба (Gleevec / Glivec).
Фолликулярная лимфома
Мишени: t (14; 18) IgH / BCL2, специфические для пациента анализы на гены иммуноглобулинов и Т-клеточных рецепторов.
Использование: t (14; 18) регулярно используется для обнаружения MRD. Специфические для пациента анализы по-прежнему обычно используются только в исследовательских протоколах.
Лимфома из клеток мантии
Мишени: t (11; 14) IgH / CCND1 (IgH / BCL1), специфические для пациента анализы на гены иммуноглобулинов и Т-клеточных рецепторов.
Использование: t (11; 14) регулярно используется для обнаружения MRD, но анализ может надежно обнаруживать только 40-60% транслокаций t (11; 14). Специфические для пациента анализы по-прежнему обычно используются только в исследовательских протоколах.
Множественная миелома
Цели: уровни М-белка в крови, специфические для пациента анализы на гены иммуноглобулинов и Т-клеточных рецепторов (высокие уровни соматической гипермутации часто мешают надежной работе этого анализа).
Использование: Уровень М-белка в крови является стандартом лечения и используется почти для всех пациентов с множественной миеломой. Специфические для пациента анализы по-прежнему обычно используются только в исследовательских протоколах.
Солидные опухоли
Виды животных, кроме человека
Лейкемии и лимфомы потенциально можно отслеживать аналогичным образом у животных, кроме человека, однако на сегодняшний день не существует известных доказательств такого применения в ветеринарии.
Значимость
Уровень MRD является ориентиром для прогноза или риска рецидива.
В некоторых случаях уровень MRD в определенный период лечения является полезным ориентиром для прогноза пациента. Например, при детской лейкемии врачи обычно берут образец костного мозга через пять недель и оценивают в нем уровень лейкемии. Даже с помощью микроскопа они смогли идентифицировать нескольких пациентов, у которых болезнь не исчезла, и эти пациенты получали другое лечение. Тесты MRD также используют это время, но тесты намного более чувствительны.
Есть также несколько научных исследований, показывающих, что уровень МОБ после трансплантации костного мозга показывает риск рецидива.
Наблюдение за людьми на предмет ранних признаков рецидива лейкемии
Индивидуализация лечения
Например, начальная пятинедельная индукционная терапия может быстро избавить некоторых пациентов от болезни. Для других такое же лечение может привести к значительному количеству заболеваний. Измерение уровня MRD помогает врачам решить, каким пациентам что нужно. Другими словами, он определяет индивидуальный риск рецидива у пациентов и теоретически может позволить им получить лечение, достаточное для его предотвращения.
лечение
Обычно подход состоит в том, чтобы сначала привести рак в состояние ремиссии (отсутствие симптомов), а затем попытаться уничтожить оставшиеся клетки (MRD). Часто методы лечения, необходимые для искоренения MRD, отличаются от тех, которые использовались изначально. Это область большого количества исследований.
Кажется разумной идеей уменьшить или искоренить MRD. Что необходимо, так это доказательства того, какой метод является лучшим и насколько хорошо он работает. Это появляется. Лечение, специально направленное на MRD, может включать:
Области текущих исследований и противоречий
Клиническая полезность тестов MRD
Методика тестирования и когда тестировать
Существуют разногласия по поводу лучшего времени для тестирования и лучшего метода тестирования. Существуют национальные и международные подходы к их стандартизации. В отношении детской лейкемии и хронического миелоидного лейкоза, похоже, возникает консенсус.
Есть ли безопасный уровень MRD?
Также существуют разногласия по поводу того, всегда ли MRD является плохим, неизбежно вызывающим рецидив, или иногда низкие уровни являются «безопасными» и не возобновляются. Обычно предполагается, что раковые клетки неизбежно разрастаются и, если они присутствуют, обычно развивается болезнь. Но есть некоторые свидетельства исследований на животных, что лейкемические клетки могут годами бездействовать в организме и не расти снова. По этой причине может оказаться, что целью лечения MRD может быть снижение его до «безопасного» уровня, а не полное его искоренение.
Полезно ли тестирование MRD для всех пациентов?
Некоторые виды лейкемии трудно поддаются лечению. В этих случаях не ясно, как может помочь тестирование MRD. Пациенты могут плохо себя чувствовать на текущем лечении, но иногда неясно, какое другое лечение может быть лучше. Таким образом, есть аргумент, что, поскольку в тесте нет необходимости: он может включать дополнительную процедуру для пациента; он не даст никакой полезной информации о лечении, в этом нет необходимости.
Тестирование в больницах и других лабораториях
Где сделано
Тестирование MRD еще не является рутинным тестом и проводится не повсеместно.
Стоимость
Проверка MRD технически сложна и требует много времени; тесты дорогие, поэтому обычно доступны только в специализированных центрах в рамках клинических испытаний.
Доступность тестирования
На момент написания (январь 2017 г.) тестирование MRD доступно в рамках некоторых клинических испытаний в Великобритании, Европе, Австралии, Китае и США.
Интерпретация результатов тестирования
Следствие: если пациент не включен в исследование, которое требует проведения теста, клиницисты, как правило, проявляют некоторую осторожность при его запросе и осторожно относятся к интерпретации результатов. Это, вероятно, изменится в будущем, поскольку тесты станут более рутинными.
Для чего необходимо исследование минимальной остаточной болезни при остром лейкозе
Лейкозные клетки, выжившие несмотря на успешное специфическое лечение и сохраняющиеся во время полной гематологической ремиссии, являются субстратом так называемой минимальной резидуальной болезни (МРБ). Именно эти клетки, размножаясь, могут привести к рецидиву.
Во время полной ремиссии не удается обнаружить злокачественные клетки с помощью обычных морфологических анализов крови и костного мозга, но их можно выявить, применяя такие чувствительные методики, как ОТ-ПЦР, проточная цитометрия, FISH и некоторые другие. Первый из названных методов обладает наибольшей чувствительностью. К сожалению, только у части пациентов возможно проведение мониторинга с помощью ПЦР, поскольку далеко не при всех лейкозах клетки имеют специфические хромосомные или молекулярные маркеры. В частности, ПЦР невозможно применить для мониторинга лейкозов с числовыми аномалиями кариотипа, а также с некоторыми делециями и транслокациями, при которых молекулярные перестройки пока точно не расшифрованы.
В настоящее время существует два способа отслеживать минимальную резидуальную болезнь:
1) молекулярный мониторинг, включая мониторинг по химерным генам, а также по некоторым другим маркерам, определяемым при анализе ДНК или РНК;
2) иммунофенотипический мониторинг (мультипараметрическая проточная флуорометрия).
В основе первого метода лежит выявление лейкозных клеток со специфическими химерными генами, например AML1-ЕТО, PML-RARa и др..
Далеко не все лейкозы можно мониторировать по известным химерным генам. Существуют другие молекулярные маркеры, позволяющие отслеживать остаточную болезнь. В частности, используются изменения генов FLT3/ITD, WT1, PRAME. Изменения двух последних генов наблюдаются в 60—70 % случаев острого миелобластного лейкоза.
Мультипараметрическая проточная флуорометрия, выявляющая так называемый аберрантный иммунофенотип, лежит в основе иммунофенотипического мониторинга. В качестве маркеров используется необычное («патологическое») сочетание антигенов на поверхности лейкозных клеток. Метод с успехом применяется для мониторинга минимальной резидуальной болезни при острых лейкозах, особенно лимфобластных. Оба метода могут применяться как в качественном, так и в количественном варианте.
Качественный вариант позволяет получить ответ «Да» или «Нет» на вопрос, имеются ли лейкозные клетки в исследуемом материале. Проведение количественной ОТ-ПЦР дает возможность получить сведения о снижении или повышении массы лейкозных клеток в организме больного в процессе лечения.
Изучение минимальной резидуальной болезни при самых различных лейкозах позволило сделать два важных вывода. Во-первых, частота рецидивов значительно выше в группе больных, у которых во время ремиссии удается обнаружить минимальную резидуальную болезнь, по сравнению с группой пациентов, у которых минимальная резидуальная болезнь не выявляется. Во вторых, применение методов количественной оценки позволило установить, что высокие показатели минимальной резидуальной болезни (количество оставшихся лейкозных клеток) после курсов интенсификации коррелируют со сроком от начала ремиссии до наступления рецидива.
Практическое значение минимальной резидуальной болезни до сих пор не совсем ясно. Возможно, что конкретные показатели МРБ, требующие изменения клинической тактики, различны при разных лейкозах.
Остановимся на результатах применения молекулярного мониторинга минимальной резидуальной болезни при остром миелобластном лейкозе.
Наиболее четкие данные получены при остром промиелоцитарном лейкозе (ОПЛ). Специфическим маркером лейкозных клеток является информационная РНК (мРНК, транскрипт) — продукт химерного гена PML-RARa, образующегося в результате характерной хромосомной t(15;17)(q22;q21). Использование второго специфического химерного гена — RARa-PML, образующегося при этой транслокации повышает чувствительность метода, но по ряду причин применяется редко.
Изменения экспрессии химерного гена PML-RARa под влиянием лечения, включающего препарат ATRA (all-transretinoic acid), изучают с начала 90-х годов XX в. На основании полученных результатов введены два новых понятия — «молекулярная ремиссия» и «молекулярный рецидив».
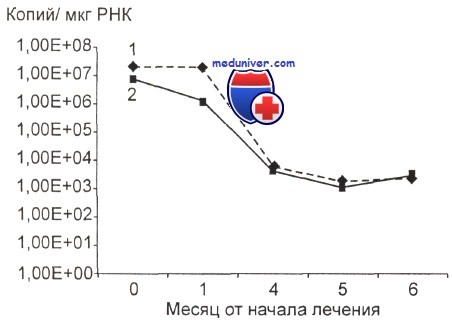
При наблюдении за большими группами пациентов регистрируется сходная динамика изменений транскрипта: в определенный срок от начала лечения химерный транскрипт PML-RARa исчезает и наступает молекулярная ремиссия — исчезновение из костного мозга и отсутствие при повторных анализах специфической РНК (ПЦР-негативность). В подавляющем большинстве случаев это происходит после 2—3-го курса консолидации. Запаздывание молекулярной ремиссии является показателем высокого риска рецидива. Появление химерного транскрипта после периода ПЦР-негативности, как правило, означает наступление молекулярного рецидива—появления специфической РНК (ПЦР-позитивность) после относительно стойкой молекулярной ремиссии.
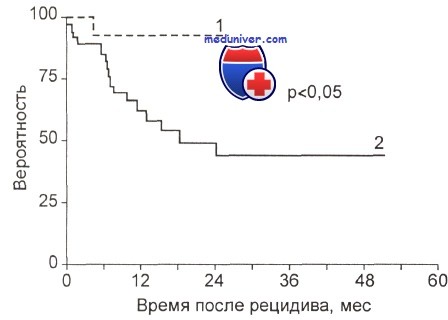
Вслед за этим в большинстве случаев следует гематологический рецидив в сроки от 2 до 6 мес, в среднем через 3 мес. Таким образом, полученные фактические данные диктуют необходимость проведения молекулярного мониторинга минимальной резидуальной болезни при ОПЛ с забором проб не реже чем через каждые 2—3 мес. При смене ПЦР-негативности на ПЦР-позитивность рекомендуется повторение анализа через 2—4 нед. Второй положительный результат считается свидетельством молекулярного рецидива, который итальянские гематологи рекомендуют лечить. В литературе есть сообщения о существенном увеличении продолжительности жизни больных ОПЛ с молекулярным рецидивом при интенсивном лечении. На рисунке показаны кривые выживаемости больных острым промиелоцитарным лейкозом (ОПЛ) с молекулярным и истинным рецидивами при лечении.
Применение молекулярного мониторинга при остром промиелоцитарном лейкозе (ОПЛ) в широкой клинической практике пока затруднено из-за отсутствия ответов на ряд конкретных вопросов, главными из которых являются следующие: какой именно срок сохранения химерного транскрипта после консолидации предвещает скорый рецидив и требует изменения терапевтической тактики? Какова должна быть продолжительность периода ПЦР-позитивности, сменившей ПЦР-негативность во время гематологической ремиссии, чтобы поставить диагноз молекулярного рецидива?
Результаты мониторинга минимальной резидуальной болезни при остром миелобластном лейкозе с t(8;21) показали, что транскрипт AML1-ЕТО обнаруживается у всех больных не только до лечения; у большинства пациентов транскрипт определяется на разных сроках полной гематологической ремиссии. В самые последние годы появились сообщения, что транскрипт AML1-ЕТО перестает обнаруживаться у отдельных больных в период длительной полной ремиссии, причем конверсия от ПЦР-позитивности к ПЦР-негативности во время гематологической ремиссии обычно сочетается с последующей стойкой длительной ремиссией.
Большинство авторов считают, что при остром миелобластном лейкозе с t(8;21) риск рецидива можно оценить только с помощью количественной модификации ПЦР (real-time или конкурентной), поскольку именно она позволяет предсказать гематологический рецидив по повышению уровня специфического молекулярного маркера— транскрипта химерного гена AML1-ЕТО. При изучении сравнительно небольших групп больных было показано, что гематологический рецидив обязательно следует за молекулярным рецидивом с задержкой не более чем на 4—6 мес. В крови уровень транскрипта обычно ниже, чем в костном мозге. Неясно, можно ли прогнозировать рецидивы, используя только данные об уровне транскрипта в крови, что было бы гораздо менее травматично для больных.
Установлено, что под влиянием лечения уровень транскрипта существенно снижается. Степень снижения имеет важное прогностическое значение: риск рецидива существенно выше для больных, у которых после первых 3—4 мес лечения экспрессия химерного гена снижалась менее чем на 3 1og.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Медицинские интернет-конференции
Языки
Острый лейкоз: клиническое наблюдение исходов заболевания. Осведомленность студентов и врачей-специалистов лечения острых лейкозов.
Хисматуллина Л.Р., Рахматуллина Г.Ф., Краснова Т.А., Старцев В.Ю.
Резюме
Анализ бессобытийной выживаемости больных ОЛ, оценка степени информированности специалистов о заболевании острым лейкозом и возможности выздоровления
Ключевые слова
Введение
Актуальность. Еще 50 лет назад острый лейкоз (ОЛ) считался неизлечимым заболеванием. Сегодня же при своевременно проведенном лечении от 45% до 80% пациентов выздоравливают.[1] Эти результаты достигнуты благодаря внедрению риск-оптимизированной высокодозной химиотерапии (ХТ), трансплантации гемопоэтических стволовых клеток (ТГСК) и сопроводительной терапии. Вероятность выздоровления от острого лейкоза (ОЛ) составляет 60-85% и зависит от возраста больного, варианта острого лейкоза, коморбидности, выполнения трансплантации костного мозга и других факторов. Фактически, интенсификация молекулярной терапии, введение в протоколы лечения и сопроводительного лечения доведены до максимума, выдвигая при этом на первый план необходимость поиска новых видов таргетной терапии различных вариантов ОЛ [4]. Специфические цитогенетические и молекулярно-генетические аномалии становятся ключевыми диагностическими или прогностическими критериями. По мнению Клинического наблюдательного комитета (2014), в состав которого входит около 100 ведущих специалистов-патологов, гематологов, онкологов, генетиков из многих стран мира, сегодня становятся реальными возможности их широкого применения в клинической практике.[8]
О полном выздоровлении говорят при отсутствии рецидива ОЛ в течение 5 лет после завершения курса терапии. Необходимо изучить информированность специалистов по данному вопросу, так как многие продолжают считать ОЛ смертельным приговором, что может привести к неправильным действиям со стороны врача и негативно сказаться на психике заболевших [2].
ОЛ – гетерогенное заболевание, ранее классифицируемое по морфологическим признакам (классификация острых лейкозов, созданная гематологами Франции, Америки и Британии, FAB), с 2008 г. – по классификации Всемирной организации здравоохранения (ВОЗ) [5], учитывающей кариотип и молекулярные аберрации опухолевых клеток.
Иммуногистохимия (ИГХ) – метод, позволяющий выявить точную локализацию как клеточного, так и тканевого антигена. Необходимо отметить, что в настоящее время исследование иммуногистохимических маркеров является процедурой, позволяющей определить наличие опухоли, ее злокачественный потенциал и прогноз, что является перспективным методом диагностики и определения в целесообразности проведения химиотерапии. В настоящее время иммуногистохимические методы являются одними из превалирующих в изучении патологоанатомических, морфофизиологических, онкоморфологических и биологических аспектов в случаях лейкозов и других онкологических заболеваний [6].
Цель работы: анализ бессобытийной выживаемости больных ОЛ, оценка степени информированности специалистов о заболевании ОЛ и возможности выздоровления.
Материал и методы
Материалы и методы: материалы для исследования выживаемости ОЛ предоставлены гематологическим отделением ГБУЗ «ООКБ». Обработаны статистические талоны медицинской карты стационарного больного, страдающего ОЛ, находящегося на лечениив период с 2007г. по 2010г. и сопоставлены с регистром живых больных ОЛ. Информированность специалистов изучена при помощи анкетирования. Опрос производился в социальной сети среди студентов ОрГМУ III (45 студентов), VI (40 студентов) курсов, 40 врачей различных специальностей на тему «Можно ли вылечить больного с острым лейкозом?». Также произведен обзор медицинской литературы о методах лечения при помощи молекулярных технологий.
Результаты
Результаты. За 4 года в гематологическом отделении на лечении находилось 159 пациентов с достоверным цитологическим диагнозом ОЛ. Иммунофенотипирование было проведено 24 (15%) пациентам. По возрасту на дебют ОЛ пациенты были распределены на группы: с 15 до 30 лет –25 пациентов, с 31 до 40 лет – 24, с 41 до 50 лет – 28, с 51 до60 лет – 29,с 61 до 70 лет – 31 и старше 70лет– 22 пациента. Из 159 больных с ОЛ у 14был верифицирован промиелоцитарный вариант ОЛ(ОПЛ), у 63 – миелобластный (ОМЛ), у 82 – лимфобластный (ОЛЛ).
Из 14 пациентов с ОПЛ в настоящее время живы 8 (57%) (2 мужчин, 6 женщин). Медиана возраста в дебюте заболевания составляла 38 лет (от 18 до 60 лет). Все пациенты получали стандартнуюполихимиотерапию (ПХТ). Продолжительность жизни после окончания курсов ПХТ составила у 3 больных 6 лет, у 2 – 5 лет, у 2 – 4 года, у одного – 3 года.
Из 82 пациентов с ОЛЛ на момент исследования живы 7 (9%) (3 мужчин, 4 женщин). Медиана возраста в дебюте ОЛ составляла 22 года (от 15 до 45 лет). Два пациента получали стандартную ПХТ, пять – высокодозную ПХТ. Длительность жизни после окончания терапии составила 5лет, 4 года, у троих 8 лет и у двоих – 3 года.
Из 63 пациентов с ОМЛ в настоящее время живы 3(4,7%) (1 мужчина, 2 женщин). Медиана возраста в дебюте ОЛ составила 43 года (от 20 до 56 лет). Все пациенты получали стандартную ПХТ. Длительность жизни после окончания терапии составила у двоих – 2 года и у одного 3 года.
Обсуждение
Возможности традиционной противоопухолевой терапии хорошо изучены. Ключевыми молекулярными процессами являются контакты факторов роста с рецепторами, сигнальная трансдукция, контроль транскрипционных генов, клеточных циклов, апоптоза, мутированных генов, ответственных за исправление ДНК, ангиогенез, метастазирование и инвазия — стали потенциальными мишенями набирающей силы таргетной терапии лейкозов [4].
Идентификация свойств экспрессированных генов дает возможность предсказать исход болезни, показание к хирургическому лечению, ответ на лучевую терапию, выбор лекарственных препаратов, ожидаемую токсичность и перейти к генетически обоснованному персонизированному методу лечения. Используются в практике ряда стран (Нидерланды, Бельгия, Великобритания, США и др.) 3 геномные технологии для лечения ОЛ и других онкологических заболеваний: анализ одиночных нуклеотидных полиморфизмов (single polymorphisms analysis), сравнительное чипирование геномной гибридизации (array — comparative genomic hybridization), характеристика профиля экспрессированных генов на основе метода микрочипирования (microarray — based gene expression profiling) [3].
При рецидивах в настоящее время используется трансплантация гемопоэтических стволовых клеток (ТГСК) как метод, позволяющий снизить риск рецидива.
В качестве вариантов ТГСК рассматривается трансплантация собственных гемопоэтических стволовых клеток (ГСК) пациента (ауто-ТГСК), ГСК родственного совместимого по HLA-системе донора (алло-ТГСК), ГСК неродственного HLA- совместимого донора (алло-ТГСК) и ГСК пуповинной крови. Каждый из вариантов имеет свои преимущества и недостатки, к которым можно отнести трудности с подбором донора и развитием реакции «трансплантат против хозяина» (РТПХ) тяжелой степени с летальным исходом в 20-30% при алло-ТГСК, возможность контаминации трансплантата лейкозными клетками при ауто-ТГСК и отсутствие при этом реакции «трансплантат против лейкоза». При алло-ТГСК стволовые клетки забирают от родственного HLA-совместимого донора [7].
Заключение
Заключение. В Оренбургской области общая выживаемость (от 2 до 13 лет) больных ОЛ, после проведения стандартной или высокодозной ПХТв 2007г. – 2010г.составляет 11,3%. Наиболее высокие показатели выживаемости – 57% отмечаются в группе больных с ОПЛ и у лиц моложе 60 лет – 17%.
Полученные данные анкетирования свидетельствуют о низкой осведомленности опрашиваемых студентов III курса (9 %) и врачей (15%) о возможности выздоровления больных с ОЛ. Студенты же VI курса более информированы в отношении данного вопроса: 70% считают, что ОЛ можно вылечить. Половина опрашиваемых в качестве источника получения информации поставили кинофильмы.
Достижения последних лет в области молекулярных технологий позволили повысить эффективность сочетанной терапии ОЛ, выражающейся в улучшении гематологических, иммунологических и эндокринологических параметров. Таргетная и эпигенетическая терапия в перспективе могут минимизировать побочные эффекты лечения, увеличить продолжительность жизни и снизить смертность.
Литература
Список используемой литературы и интернет-источники:
1. Бондаренко С. Н. Острый лейкоз // Клиническая онкогематология. Фундаментальные исследования и клиническая практика 2012, Т. 5. № 1 С. 75 – 77.
2. Цитогенетическая диагностика при онкогематологических заболеваниях : метод.пособие / сост. Т. А. Соколова, Ю. В. Котловский, Е. В. Дубынина, и др. Москва, 2012. 42 с.
3. Гарин А. М. Эволюция и революционные события в онкологической науке // РАМН, Москва 2013 с. 34-37
4. Pecorino L. Molecular biology of cancer. Oxford University Press. 2010
6. Иммуногистохимические и молекулярно-генетические методы диагностики онкологических заболеваний / Вестник Витебского государственного медицинского университета, 2017 г. 16-19 с.
7. Е. В. Зуховицкая Молекулярные механизмы лейкогенеза и проблемы терапии острых лейкозов: монография.2015, М. С. 46-51
8. Д.Ф. Глузман, Л.М. Скляренко Новое в классификации воз миелоидных новообразований и острых лейкозов (Пересмотр 2016 г.) / Вестник Института экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого