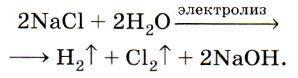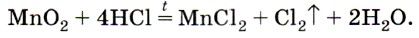Для чего нужен галоген
Для чего нужен галоген
К галогенам относятся пять основных неметаллических элементов, которые расположены в VII группе таблицы Менделеева. В эту группу входят такие химические элементы, как фтор F, хлор Cl, бром Br, иод I, астат At.
Свое название галогены получили от греческого слова, которое в переводе обозначает образующий соль или «солеобразующий», так как в принципе большая часть соединений, которые содержат галогены и носят названия солей.
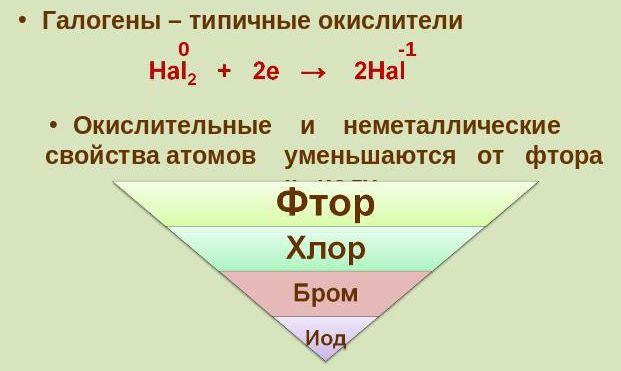
Галогены вступают в реакцию практически со всеми простыми веществами, за исключением только нескольких металлов. Они являются довольно таки энергичными окислителями, имеют очень сильный и резкий запах, прекрасно взаимодействуют с водой, а также имеют большую летучесть и высокую электроотрицательность. А вот в природе их можно встретить лишь в качестве соединений.
Физические свойства галогенов
1. Такие простые химические вещества, как галогены, состоят из двух атомов;
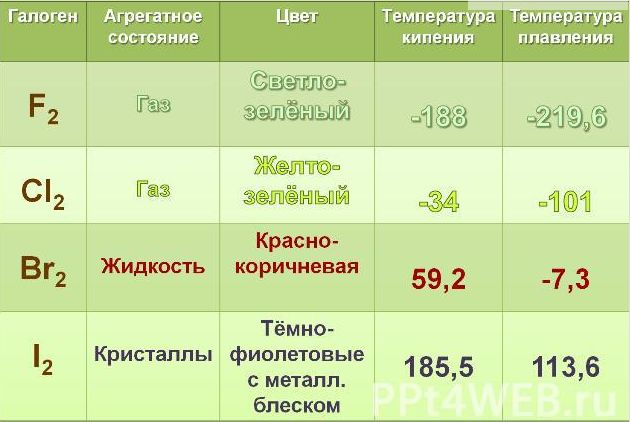
2. Если рассматривать галогены в обычных условиях, то следует знать, что фтор и хлор, находятся в газообразном состоянии, тогда как бром является жидким веществом, а йод и астат относятся к твердым веществам.
3. У галогенов температура плавления, кипения и плотность повышаются с увеличением атомной массы. Также при этом и меняется их окраска, она становиться более темной.
4. При каждом увеличении порядкового номера, уменьшается химическая активность, электроотрицательность и более слабыми становятся неметаллические свойства.
5. Галогены обладают способностью образовывать соединения между собой, как например BrCl.
6. Галогены при комнатной температуре могут находиться во всех трех состояниях материи.
7. Так же важно запомнить то, что галогены относятся к довольно таки токсичным химическим веществам.
Химические свойства галогенов
При химической реакции с металлами, галогены действуют, как окислители. Если, к примеру, взять фтор, то даже в обычных условиях он дает реакцию с большинством металлов. А вот алюминий и цинк воспламеняется даже в атмосфере: +2-1:ZnF2.
Получение галогенов
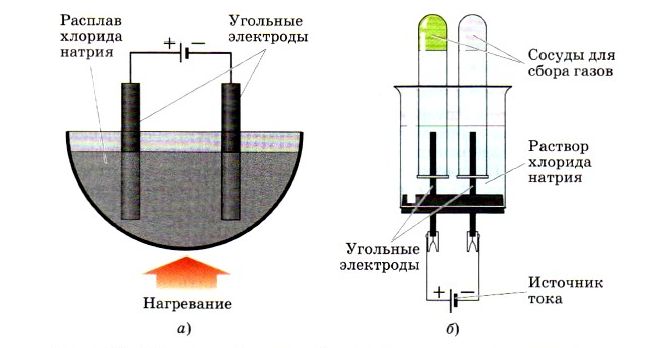
При получении фтора и хлора в масштабах промышленности используют электролиз или растворы солей.
Если вы внимательно рассмотрите рисунок, изображенный внизу, то увидите, как в лабораторных условиях с помощью установки для электролиза можно получить хлор:
На первом рисунке изображена установка для расплава хлорида натрия, а на втором уже для получения раствора хлорида натрия.
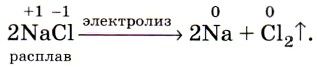
Такой процесс электролиза расплава хлорида натрия можно представить в виде даного уравнения:
При помощи такого электролиза, кроме получения хлора еще образуются также водород и гидроксид натрия:
Конечно же, водород получают более простым и дешевым способом, чего не скажешь об гидроксиде натрия. Его, так же, как и хлор получают практически всегда только с помощью электролиза раствора поваренной соли.
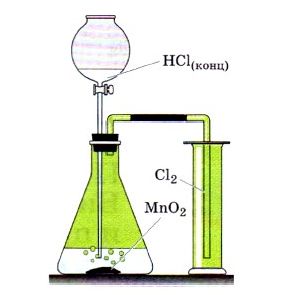
Если вы рассмотрите рисунок, изображенный вверху, то увидите, как лабораторным способом можно получить хлор. А получают его с помощью взаимодействия соляной кислоты с оксидом марганца:
В промышленности бром и йод получают с помощью реакции вытеснения этих веществ хлором из бромидов и йодидов.
Применение галогенов
Фтор или правильнее будет назвать фторид меди (CuF2) имеет довольно таки широкое применение. Его используют при изготовлении керамики, эмалей и различных глазурей. Имеющая в каждом доме тефлоновая сковородка и хладагент в холодильниках и кондиционере, также появились благодаря фтору.
Кроме бытовых нужд тефлон также используют в медицинских целях, так как его применяют при производстве имплантатов. Фтор необходим при изготовлении лизн в оптике и в зубных пастах.
Хлор также в нашей жизни встречается буквально на каждом шагу. Самым массовым и распространенным применением хлора, является, конечно же, поваренная соль NaCl. Она так же выступает в роли дезинтоксикационного средства и используется в борьбе с гололедом.
Кроме этого, хлор незаменим в производстве пластика, синтетического каучука и поливинилхлорида, благодаря которым мы получаем одежду, обувь и другие, нужные в нашей повседневной жизни вещи. Его используют при производстве отбеливателей, порошков, красителей, а также другой бытовой химии.
Бром, как правило, необходим, как светочувствительное вещество при печатании фотографий. В медицине он применяется, как успокаивающее средство. Также бром используют при производстве инсектицидов и пестицидов и т.д.
Ну, а всем известный йод, который имеется в аптечке у каждого человека, в первую очередь используется, как антисептик. Кроме своих антисептических свойств, йод присутствует в источниках света, а также является помощником для обнаружения отпечатков пальцев на бумажной поверхности.
Роль галогенов и их соединений для организма человека
Выбирая в магазине зубную пасту, наверное, каждый из вас обращал внимание на то, что на ее этикетке указывается содержание соединений фтора. И это неспроста, так как этот компонент участвует в построении зубной эмали и костей, повышает устойчивость зубов к кариесу. Также он играет важную роль в процессах обмена веществ, участвует в построении скелета костей и предупреждает появление такого опасного заболевания, как остеопороз.
Важная роль в организме человека отведена и хлору, так как он принимает активное участие в сохранении водно-солевого баланса и поддерживание осмотического давления. Хлор участвует в обмене веществ человеческого организма, построении тканей, ну и что тоже немаловажно – в избавление от лишнего веса. Соляная кислота, находящаяся в составе желудочного сока большое значение имеет для пищеварения, так как без нее невозможен процесс переваривания пищи.
Хлор необходим нашему организму и должен ежедневно в необходимых дозах поступать в него. Но если, же его норму поступления в организм превысить или резко снизить, то мы сразу же это ощутим в виде отеков, головных болей и других неприятных симптомов, которые способны не только нарушить обмен веществ, но и вызвать заболевания кишечника.
У человека в мозге, почках, крови и печени присутствует небольшое количество брома. В медицинских целях бром применяют, как успокоительное средство. Но при его передозировке могут быть неблагоприятные последствия, которые могут привести к угнетенному состоянию нервной системы, а в некоторых случаях и к психическим расстройствам. А недостаток брома в организме ведет к дисбалансу между процессами возбуждения и торможения.
Без йода наша щитовидная железа не может обходиться, так как он способен убивать микробы, поступающие в наше тело. При дефиците йода в организме человека может начаться заболевание щитовидной железы, под названием зоб. При этом заболевании появляются довольно неприятные симптомы. Человек, у которого появился зоб, чувствует слабость, сонливость, повышение температуры, раздражительность и упадок сил.
Из всего этого можно сделать вывод, что без галогенов человек мог бы не только лишиться многих необходимых в повседневной жизни вещей, но без них и не смог бы нормально функционировать наш организм.
Галогены
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Природные соединения
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
О галогенах и здоровье человека.
Галогены – это класс родственных элементов, которые включают йод, бром, фтор и хлор. С их соединениями, то есть с йодидом, бромидом, фторидом и хлористыми солями мы сталкиваемся в пищевых продуктах, лекарственных препаратах и окружающей среды. О йоде многие знают с детства, им обрабатывали сбитые коленки в детстве.
Позже мы узнали о том, что этот галоген необходим для синтеза гормонов щитовидной железы. Прочитать об этом можно в статье «Правда и мифы о йоде»
Да, йод необходим организму, его дефицит опасен для организма также как и его избыток.
Но почему, то мало говорят и пишут о токсичности галогенов. Более того, их добавляют в продукты питания, воду, средства по уходу за телом и с их помощью отравляют людей.
О токсическом действии галогенов.
1. Что надо знать о токсическом действии галогенов.
1) Йод и хлориды полезны в небольших количествах, другие являются токсичными.
2) Галогены могут связываться с рецепторами йода, блокировать действие йодида и гормонов щитовидной железы, и вызывать многие тяжелые заболевания.
3) Токсичные галогены очень медленно выделяются из организма, и не известны пути их детоксикации из печени.
4) Выведение токсичных галогенов может быть увеличено следующими способами:
2. Токсичность бромида/брома.
1) Бром является ядом и в пище не должен применяться.
2) Бром может связываться с рецепторами йода и блокировать их функцию.
3) Однако, этот галоген заменяет йодид во многих продуктах, лекарственных препаратах и в окружающей среде, несмотря на то, что это пестицид.
4) Он заменил йод при обработке белой муки и уменьшил потребление йода человеком на 726 мкг/день.
5) Симптомы интоксикации брома.
Эти симптомы включают:
6) Признаки тяжелой интоксикации бромом.
7) Некоторые лекарства содержат бром.
Есть и другие препараты. Будьте с ними осторожнее, до покупки препарата прочитайте его состав, инструкции есть в Интернете.
«8)» Продукты питания, содержащие бром.
3. Токсичность фторида/фтора.
Фтор известен как токсин и может привести к летальному исходу.
Но уже более 50 лет его добавляют в питьевую воду, чтобы не было кариеса у людей.
Это было сделано в законодательном порядке без всяких научных исследований.
Позднее было показано, что нет никакой разницы в заболевании зубов с фтором или без него.
Сразу после того, как в Америке стали фторировать водопроводную воду, многие страны также перешли на фторирование воду.
После того, как ученые установили, что фтор не сохраняет зубы от кариеса, многие страны перестали фторировать питьевую воду.
Сейчас широко известно вредное действие фтора на организм человека:
2) Фтор может содержаться в лекарствах.
Поэтому внимательно изучайте состав препарата до его покупки.
3) Фтор может содержаться в средствах гигиены.
Наиболее часто он содержится в зубной пасте, даже в детской.
Вам может быть полезна статья «Сделайте самую лучшую зубную пасту, рецепты»
4. Токсичность хлорида/ хлора.
1) Хлорид является важным элементом во внеклеточной жидкости, он необходим в виде соляной кислоты в желудке для пищеварения.
2) Но в больших количествах он токсичен и с его побочными продуктами он может вызвать:
3) Избыток натрия хлорида (соли) конкурирует с йодидом и может вызвать гипотиреоз.
4) Источники хлорида.
5. Перхлорат.
Перхлорат – это один атом хлора, окруженный 4 атомами кислорода. Является токсином.
Его наличие в организме может привести к:
1) гипотиреозу,
2) раку щитовидной железы,
3) зобу,
4) мастопатии,
5) нарушению менструального цикла,
6) дисфункции иммунной системы,
7) плохому развитию плода,
«8)» умственной отсталости новорожденных.
Дополнительно о перхлорате вы можете прочитать в статье «Йод, щитовидная железа, перхлорат и здоровье»
Будьте здоровы! И пишите комментарии.
Галина Лушанова
Галина Лушанова имеет высшее образование (окончила НГУ по специальности цитолог-генетик), к.б.н. по специальности фармакология. Прошла обучение по диетологии, является действительным членом сообщества «Диетологи России». Ведет блог «Пища и Здоровье» с 2011г. Организатор Первой в России онлайн школы «Пища и Здоровье»
Что такое галогенная лампа, где используется, как выбрать галогенную лампу для дома
С повышением цен на электрическую энергию потребители все больше и больше переходят на экономичные и энергосберегающие осветительные приборы. Большую роль в экономии играет и продолжительность работы лампы до выхода её из строя, а также качество её свечения. По этим характеристикам наибольшую популярность получили галогенные лампы.
Что такое галогенная лампа, устройство и принцип работы
Галогенная лампа – одна из разновидностей стандартных ламп накаливания. Главная отличительная черта её конструкции заключена в специальном газе – галогене, который закачан в колбу устройства.
Принцип работы такого осветительного прибора (как и у стандартных ламп накаливания) основан на прохождении через тело накала электрического тока и нагреве этого тела до свечения. Но благодаря парам галогенов (чаще всего для этих целей используется бром или йод) значительно повышается температура спирали из вольфрама и увеличивается светоотдача. Это происходит потому, что атомы вольфрама при нагревании испаряются и конденсируются на колбе, но йод или бром, вступают в химическую реакцию с вольфрамом и не дают ему оседать. При этом такие соединения при нагреве быстро распадаются и атомы вольфрама конденсируются обратно на спирали, а это повышает температуру тела накала.
В остальном вся конструкция лампы ничем не отличается от стандартных ламп накаливания: галогенная лампа имеет колбу, нить накала с проводниками и цоколь. При этом производители таких устройств выпускают лампы со всеми видами стандартных цоколей, поэтому потребитель может использовать такие лампы в любом осветительном приборе.
Где используются галогенные лампы?
Галогенные лампы – это долговечные и яркие осветительные устройства, которые стойки к перепадам температуры и напряжения. Колбы галогенных ламп выполнены из жаропрочного и стойкого к механическим повреждениям кварца, благодаря которому эта лампа выдерживает большие перепады температуры и может иметь различные размеры от больших до самых миниатюрных. Поэтому они получили широкое применение в осветительных приборах автомобилей и другого транспорта.
Галогенные лампы достаточно часто и широко применяют и в быту. Их встраивают в различные системы натяжных или подвесных потолков, а также используют при устройстве точечного освещения или организации различного рода подсветок, устанавливают в люстры и различные светильники. Наиболее часто применяют при проведении фото и видеосъемок используя галогенные прожектора и другие осветительные приборы на их основе.
Основные виды галогенных ламп
В зависимости от внешнего вида и способа применения галогенные лампы делятся на несколько основных видов:
С внешней колбой
С вынесенной или внешней колбой галогенная лампа ничем не отличается от стандартных «лампочек Ильича». Они могут подключаться непосредственно в сеть 220 вольт и иметь любую форму и размеры. Отличительной чертой является наличие в стандартной стеклянной колбе маленькой галогеновой лампочки с колбой, выполненной из жаропрочного кварца. Применяются галогенные лампы с вынесенной колбой в различных светильниках, люстрах и других приборах освещения с цоколем Е27 или Е14.
Капсульные
Капсульные галогенные лампы имеют миниатюрные размеры и применяются для организации подсветки интерьера. Они имеют небольшую мощность и часто используются с цоколями G4, G5 в сети постоянного тока с напряжением 12 – 24 вольт и G9 в сети переменного тока 220 вольт.
Конструктивно такая лампа имеет тело накала, расположенное в продольной или поперечной плоскости, а на задней стенке колбы нанесено отражающее вещество. Такие устройства ввиду малой мощности и размеров не требуют специальной защитной колбы и могут монтироваться в светильниках открытого типа.
С отражателем
Устройства с отражателем имеют конструкцию для направленного излучения света. Галогенные лампы могут иметь алюминиевый или интерференционный рефлектор. Самый распространённый из этих двух вариантов – алюминиевый. Он перераспределяет и фокусирует тепловой поток и световое излучение вперед, благодаря чему световой поток направляется в нужную точку, а лишнее тепло отводится, защищая пространство и материалы вокруг лампы от перегрева.
Интерференционный отражатель отводит тепло внутрь лампы. Галогенные лампы с отражателем могут иметь различные конфигурации формы и размеров, а также имеют разные углы излучения света.
Линейные
Самый старый вид галогенных ламп, который используется с середины 60-х годов 20 века. Линейные галогенные лампы имеют вид вытянутой трубки, на концах которой расположены контакты. Линейные лампы имеют различные размеры, а также высокую мощность и в основном применяются в различных прожекторах и уличных осветительных приборах.
Галогенные лампы с покрытием по технологии IRC
IRC-галогенные лампы – это специальный вид такого рода осветительных устройств. IRC означает «инфракрасное покрытие». Они имеют особое покрытие на колбе, которое свободно пропускает видимый свет, но препятствует прохождению инфракрасного излучения. Состав покрытия направляет это излучение обратно к телу накала в связи с чем повышается коэффициент полезного действия и эффективность работы галогенной лампы, улучшает равномерность свечения и светоотдачу.
Применение IRC-технологии позволяет снизить потребление электрической энергии такими устройствами до 50% и существенно влияет на энергоэффективность осветительного прибора. Ещё одним достоинством является увеличение срока службы практически в 2 раза, в сравнении со стандартными галогенными лампами.
Галогенные люстры
Галогенные люстры – это цельные устройства, которые основаны на множестве параллельно подключенных друг к другу галогенных ламп. Такие люстры имеют совершенно различные внешний вид и конфигурацию, а благодаря маленькому размеру галогенных ламп – имеют эстетичный вид и равномерное свечение.
В магазинах можно встретить галогенные люстры с питанием от 220 вольт переменного тока, а также низковольтные варианты для применения в системах постоянного тока или с использованием с блоками питания.
Технические характеристики галогенных ламп
Для правильного выбора лампы необходимо знать для чего она будет использоваться, куда монтироваться и в каких условиях работать. Как и любые другие лампы, галогенные имеют следующие важные характеристики:
Тип цоколя и форма колбы
Галогенные лампы выпускают с любым типом цоколя и формой колбы, поэтому затруднения с выбором устройства в этом плане не будет. Есть варианты как с цоколем E14 и E27, так и специфические цоколи G4, G9, R7s.
Напряжение
Производители таких ламп выпускают устройства как для сети переменного тока 220 В, так и для постоянного тока 12 – 24 В.
Мощность
Важная характеристика лампы, указывающая потребляемую мощность устройства. Мощные линейные лампы имеют значение от 100 до 1500 Вт, капсульные от 10 до 35 Вт, а лампочки с внешним цоколем или отражателем имеют мощность от 20 до 60 Вт.
Цветовая температура
Галогеновые лампы обычно имеют рабочую цветовую температуру от 2500 К до 3000 К.
Срок службы
Галогенные лампы достаточно долговечные устройства, в сравнении со стандартными лампами накаливания. Они служат от 2000 часов и более при соблюдении условий эксплуатации.
Достоинства и недостатки
Как и любые устройства галогенные лампы имеют как достоинства, так и недостатки.
Достоинства
Недостатки
Сравнение с другими типами ламп
Галогенные лампы, конечно, не сравнятся по энергоэффективности со светодиодными или люминесцентными лампами. В этом случае все зависит от сферы применения устройств. Как уже было сказано выше: галогенные лампы стойки к перепадам температур и напряжения, что в некоторых условиях явно ставит их выше светодиодных.
Но вот сравнивая их с обычными лампами накаливания достоинства этих ламп видны достаточно явно. Галогенные лампы имеют больший коэффициент полезного действия и световой поток при меньшей мощности. Они более долговечны и универсальны. Высокое качество передачи света – ещё один важный аргумент в пользу выбора галогенных ламп.
Как выбрать галогенную лампу
При выборе галогенных ламп в первую очередь стоит обратить внимание на производителя устройства: лучше приобретать устройства известных и распространенных производителей (они отвечают за качество выпускаемой продукции и контролируют его на всех этапах производства). Самые известные фирмы: Osram, Navigator и Camelion.
Что такое люминесцентная лампа и как она работает?
Сравнение основных параметров светодиодных ламп и ламп накаливания, таблица соответствия мощности и светового потока
Как подключить люминесцентную лампу — схемы с дросселем и балластом
Для чего нужен диммер, что это такое, схема подключения диммера и принцип его работы
Что измеряется в люменах и какие нормы освещенности на 1 квадратный метр?
Что такое светодиод, его принцип работы, виды и основные характеристики