Для чего нужен миоглобин
Миоглобин. Тест на миоглобин
Миоглобин – это специфический белок, содержащийся в скелетной и сердечной мышцах, заменяющий гемоглобин. Он отвечает за доставку кислорода тканям. Это позволяет обеспечить нормальное функционирование сердечной мышцы, поддерживать правильный ритм и частоту сокращений.
Определение уровня миоглобина в крови позволяет диагностировать различные заболевания.
Причины повышенного миоглобина
Небольшое повышение миоглобина возможно после длительных и интенсивных физических нагрузок.
Причины пониженного миоглобина
Показанием к проведению анализа на уровень миоглобина могут быть частое беспричинное повышение температуры тела, боли в мышцах, не связанные с физической активностью, появление судорог в различных частях тела.
Когда нужно проводить анализ миоглобина
Чаще всего определение уровня миоглобина требуется для подтверждения инфаркта миокарда. Основанием для проведения анализа являются следующие симптомы, которые испытывает пациент:
Сдача анализа крови на определение уровня миоглобина требует специальной подготовки. Следует исключить все факторы, которые могут повлиять на точность результата. Анализ крови сдают утром, натощак, последний прием пищи должен состояться не позже, чем за 8-9 часов до проведения анализа. Утром можно пить только обычную воду. Кофе, соки или чай настоятельно не рекомендуются, поскольку эти напитки могут исказить точность результатов.
Запрещен прием алкогольных напитков и курение. В день сдачи анализа пациент должен находиться в спокойном расслабленном состоянии.
Коррекция показателей
Для того, чтобы привести в норму уровень миоглобина, требуется лечение основного заболевания. Оно предусматривает купирование болевых ощущений, тромболитическую и антикоагулянтную терапию, прием сердечных гликозидов, диуретиков, седативных средств.
Если причиной повышения миоглобина являются механические травмы, главным методом лечения является хирургическая операция.
Сдать кровь на миоглобин можно в специализированных клиниках. Расшифровку результатов и коррекцию показателей осуществляет лечащий врач. Самостоятельный подбор медикаментозных средств, как и самолечение, могут быть опасными для организма человека.
Сдать кровь на миоглобин или полный биохимический анализ крови вы всегда можете в нашем медицинском центре «Евромедпрестиж» без очереди и записи.
Антитела к цитоплазме нейтрофилов, NSCA класса IgА
РПГА с сальмонеллёзным диагностикумом (О-антиген )(anti-Salmonella A,B,C1,C2,D,E )
Исследования основных параметров клеточного иммунитета: подсчет лейкоцитов, лимфоцитов, нетрофилов, CD3, CD4, CD8, CD16, CD20, CD56, CD4/CD8, CD19
Расширенное иммунологическое исследование клеточного иммунитета: подсчет лейкоцитов, лимфоцитов, нейрофилов, CD3, CD4, CD8, CD16, CD20, CD38, CD54, CD71, CD95, CD56, CD4/CD8, CD19, CD95
МИОГЛОБИН
МИОГЛОБИН (myoglobinum; греч, mys, my [os] мышца + лат. globus шарик; Mgb; син.: миогемоглобин, мышечный гемоглобин) — сложный белок красного цвета, относящийся к хромопротеидам; содержится в красных мышцах животных различных классов и видов. Основной функцией М. является накопление кислорода, поступающего в процессе дыхания в мышцы из крови и отдача кислорода по мере необходимости в нем (см. Газообмен).
Факторами, определяющими различия в содержании М., являются видовая принадлежность животных (см. табл.), особенности условий их существования, образ жизни, тип мышцы, степень ее активности, а также трофические влияния нервной системы. Очень высокое содержание М. (до 16—40 г на 100 г высушенной ткани) характерно для водных животных. Значительные количества М. содержатся в красных мышцах нек-рых беспозвоночных (моллюски), в гладких мышцах мускульного желудка птиц, в гладкой мускулатуре бронхов, сосудов, стенок кишечника, а также в паренхиматозных органах, причем последние участвуют в процессах синтеза (печень), распада (селезенка) и выделения пигмента. Однако еще не доказано, что пигмент, выделенный из паренхиматозных органов, идентичен М.
Таблица. Содержание миоглобина в сердечных и скелетных мышцах человека и некоторых классов позвоночных животных (в г на 100 г высушенной ткани)
Класс животных; человек
В крови и моче М. в норме отсутствует. Поэтому его появление в этих биол, жидкостях является признаком заболеваний, сопряженных с деструкцией тканей (инфаркт миокарда, травматические повреждения мышц, генетически обусловленная прогрессивная мышечная дистрофия и т. д.). Определение уровня М. в плазме крови может служить критерием обширности деструкции, динамики процесса и эффективности лечебных мероприятий.
Мол. вес (масса) М. составляет в среднем 17 500, содержание железа 0,34%, Изоэлектрическая точка находится при pH 6,99. М. характеризуется большой растворимостью и высокой устойчивостью к действию щелочей.
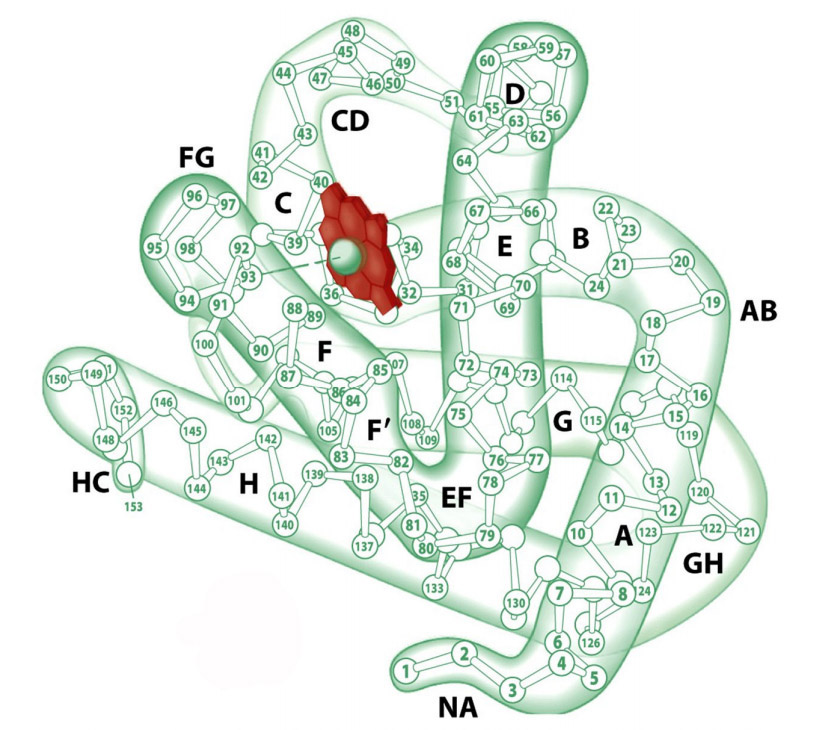
Изучена третичная структура М. и построена пространственная модель его молекулы (рис.). М. состоит из простого белка— глобина, представляющего собой одну полипептидную цепь, в состав к-рой входит 153 аминокислотных остатка, и простетической (небелковой) группы — гема (железопротопорфириновый комплекс, или протогем). Полипептидная цепь глобина М. на 77% представлена альфа-спиральными участками (всего 8 спиралей), к-рые перемежаются с участками неупорядоченной структуры, расположенными в области четырех изгибов полипептидной цепи. Все полярные группы, образованные лизином, аргинином, глутамином, аспарагином, гистидином, треонином, тирозином и триптофаном, находятся на поверхности и соединены с молекулами воды, а неполярные остатки сконцентрированы в центре. Поэтому молекула М. компактна и устойчива к изменениям pH и ионной силы р-ра.
По своим свойствам глобин М. близок к альбуминам. Гем М. расположен в углублении, находящемся на определенном изгибе полипептидной цепи вблизи поверхности молекулы. Это делает гем более доступным различным воздействиям. Одной координационной связью (пятой) гем соединен с гистидиновым остатком альфа-спирали, а шестая координационная связь железа гема может быть занята водой, кислородом, окисью углерода или другими соединениями. При взаимодействии с кислородом (оксигенации) в глобине молекулы М. не происходит структурных изменений. Пигмент мышц не способен соединяться с двуокисью углерода (CO2).
Доказано существование двух конформеров (А и В) нативного состояния М., к-рые отличаются по своим свойствам и структуре. Переход конформера А в конформер В протекает при повышении температуры от 20 до 40° и отражается на активности гема. Высокотемпературный конформер В является менее реакционноспособным.
М. человека и животных имеет неодинаковую форму кристаллов: тонкие, игловидные, собранные в пучки (человек), ромбические таблички (рогатый скот) и др. М. подобно гемоглобину (см.) образует различные производные, отличающиеся друг от друга по спектрам поглощения. При соединении с кислородом М. превращается в оксимиоглобин (MgbO2), в к-ром железо гема является двухвалентным. С помощью метода дифракции рентгеновских лучей показано, что оксигенация М. сопровождается пространственным смещением железа от середины порфиринового кольца по направлению к проксимальному гистидину (F-8) полипептидной цепи на 0,033 нм. В гемоглобине же оксигенация вызывает гораздо большее смещение атома железа (0,04— 0,05 нм) и изменения в четвертичной структуре всей молекулы пигмента крови.
Вдыхание животными воздуха, содержащего окись углерода в повышающихся концентрациях (0,01—0,2%), приводит не только к увеличению содержания карбоксигемоглобина в крови, но и к связыванию окиси углерода миоглобином с образованием карбоксимиоглобина (MgbCO), железо гема к-рого также находится в двухвалентном состоянии. Когда количество карбоксигемоглобина в крови достигает 60%, содержание карбоксимиоглобина в скелетных мышцах составляет 10—50%, а в мышце сердца — от 6 до 44%. MgbCO обнаружен и в мышцах людей, погибших от отравления: угарным газом. Воздействие на М. окислителей обусловливает возникновение метмиоглобина (метMgb). Превращение М. в метMgb при окислении происходит очень легко и при одинаковых условиях в 12—14 раз превышает скорость образовании метгемоглобина. В то же время в мышцах животных эта реакция после внутривенного вливания окисляющих ядов протекает более медленно, чем окисление гемоглобина.
Максимумы полос поглощения М. и его производных расположены при следующих значениях длин волн: для MgbO2 — 582, 542, 415 нм; для Mgb — 602, 560, 436 нм; для MgbCO — 585, 542, 423 нм; для метMgb — 630, 500, 409 нм. Известный другие производные пигмента: сульфмиоглобин, нитроксимиоглобин, цианмиоглобин и т. д. В реакциях сопряженного окисления М. переходит в зеленый пигмент — вердомиоглобин, а при более глубоком распаде — в желчные пигменты (см.).
Биосинтез М. происходит в мышцах со значительно меньшей скоростью по сравнению с гемоглобином. После введения животным меченого железа оно обнаруживается в гемоглобине уже спустя 6—8 дней, а в М. только через месяц. Продолжительность существования М. составляет 80 дней. В процессе эмбриогенеза М. раньше всего появляется в мышце сердца.
В мышцах позвоночных М. локализуется в саркоплазме на уровне диска А и связан электростатически с наружной мембраной митохондрий или саркоплазматического ретикулума (см. Мышечная ткань).
Создаваемый с помощью М. резерв кислорода в мышцах прежде всего определяется концентрацией в них пигмента и его способностью подвергаться оксигенации и деоксигенации. М. поддерживает постоянный уровень оксигенации во время мышечного сокращения, создавая определенный градиент напряжения кислорода между капиллярами и мышечными клетками, обеспечивая, т. о., возможность его утилизации при усилении окислительных процессов в работающих мышцах. Благодаря высокому сродству к кислороду полунасыщение им М. происходит менее чем за 0,1 сек. (при pO2 = 3,3 мм рт. ст.). При pO2, равном 5 мм рт. ст. (минимальное для деятельности цитохромоксидазы), диссоциирует до 40% оксимиоглобина, повышая, т. о., количество кислорода, растворенного в саркоплазме. М. участвует в молекулярном механизме его транспорта в клетку путем создания градиента и ускорения диффузии. Не исключена возможность непосредственного переноса кислорода М. при поступательном движении молекулы пигмента. Благодаря наличию пероксидазных свойств М. обладает ферментативной активностью. Доказана возможность включения М. в работу фосфорилирующей дыхательной цепи в качестве акцептора электронов от восстановленных коферментов пиридинового типа (НАД-H и в меньшей степени НАДФ-Н).
Существующие методы количественной оценки содержания М. включают электрофорез (см.) и ионообменную хроматографию (см.). Разделение М. и гемоглобина достигается благодаря их различной растворимости в 3 М фосфатном буфере при pH 6,6 (гемоглобин при этом значении pH нерастворим). Спектрофотометрическая регистрация количества М. основана на разнице в светопоглощении карбокси- и цианметсоединений М. и гемоглобина в видимой части спектра (см. Спектрофотометрия). Предложены также гистохимические методы определения М., основанные на бензидин-пероксидазной активности пигмента. Они позволяют с достаточной достоверностью выявлять М. в мышечной ткани и устанавливать закономерности в локализации и распределении М. в норме и их изменения при различных патол, состояниях.
Миоглобин в судебно-медицинском отношении
Миоглобин в судебно-медицинском отношении имеет значение в случаях прижизненного поражения скелетных мышц, сопровождающегося высвобождением М. При этом М. накапливается в плазме крови. При концентрации, превышающей 30 мг%, развивается миоглобинурия (см.), к-рая наряду с шоковым и коматозным состоянием, интоксикацией и пр. служит патогенетическим фактором развития миоглобинурийного нефроза (см. Нефротический синдром). Повреждение мышц, сочетающееся с обширными гематомами или внутрисосудистым гемолизом, кроме того, ведет к возникновению гемоглобинемии (см.), приводящей в последующем к миоглобинурии и миоглобинурийному нефрозу. Т. о., миоглобинемия и обусловленные ею процессы служат экспертным критерием поражения скелетной мускулатуры и доказательством его прижизненности.
Миоглобинемия может иметь место при механической травме (одномоментная травма обширных мышечных массивов, так наз. краш-синдром, или синдром раздавливания), отравлении миолитическими ядами, в т. ч. пищевыми (токсический миозит), при нарушении артериального или венозного кровообращения в конечностях (тромбоз или тромбоэмболия крупных артерий, тромбоз вен, синдром жгута, состояние после реплантации конечностей), при длительном пребывании человека в одной и той же позе (позиционное сдавление), при ожогах, обморожениях, при судорожных состояниях (эпилепсия, столбняк и т. д.).
Библиография: Атанасов Б. П. Модели конформеров нативного состояния миоглобина, Молек. биол., т. 4, в. 3, с. 348, 1970, библиогр. ; Верболович П. А. и Верболович В. П. Миоглобин и использование кислорода в животном организме, в кн.: Полярографическое определение кислорода в биол, объектах, под ред. В.А. Березовского, с. 123, Киев, 1974, библиогр.; Свадковский Б. С. Острый пигментный нефроз и его судебно-медицинская оценка, М., 1974, библиогр.; Троицкая О. В. Миоглобин, его химическое строение и функции в организме, Вопр, мед. хим., т. 17, в. 5, с. 451, 1971, библиогр.; Murray J. D. On the role of myoglobin in muscle respiration, J. theor. Biol., v. 47, p. 115, 1974, bibliogr.; Wittenberg J. B. Myoglobin — facilitated oxygen diffusion, role of myoglobin in oxygen entry into muscle, Physiol. Rev., v. 50, p. 559, 1970, bibliogr.
П. А. Верболович, В. П. Верболович; М. В. Кисин (суд.-мед.).
Миоглобин
Прием биоматериала по данному исследованию может быть отменен за 2-3 дня до официальных государственных праздников, в связи с технологической особенностью производства! Информацию уточняйте в контакт-центре.
Добавить в корзину
Миоглобин — кислородсвязывающий мышечный белок, содержится в миоцитах скелетной мускулатуры и клетках миокарда. Миоглобин является депо и переносчиком кислорода. При заболеваниях, связанных со снижением кислорода гемоглобина, утилизируется кислород миоглобина, что важно при поддержании постоянной концентрации кислорода в ритмически сокращающихся мышцах миокарда и скелетной мускулатуры.
Поскольку миоглобин содержится только в мышцах, его выявление в крови всегда обусловлено их повреждением (вследствие ишемии, травмы, воспаления).
Поступивший в системный кровоток миоглобин оказывает токсическое действие на клетки почечных канальцев (вплоть до их гибели), вызывает сужение почечных сосудов, приводит к почечной недостаточности. Свободный белок повреждает эндотелий сосудов и обладает сосудосуживающим действием на сосуды мозга. Миоглобин обладает в 6 раз большим сродством к кислороду, чем гемоглобин эритроцитов. В легких миоглобин конкурирует с гемоглобином за связывание кислорода, но не отдает его тканям, тем самым ухудшает их снабжение кислородном, что ведет к тканевой гипоксии.
Диагностическая значимость миоглобинемии достаточно высока. Тест позволяет выявить повреждение кардиомиоцитов. Через 2 часа после острого инфаркта миокарда уровень миоглобина повышается. Уровень мышечного белка в крови коррелирует с результатами лечения кардиохирургических больных. Прогностическая значимость повышения миоглобина выше, чем креатинфосфокиназы, при прогнозировании летальности.
Повышение уровня миоглобина
Появление миоглобина в крови является достоверным и ранним признаком нарушения целости клеток скелетных мышц. Рабдомиолиз (синдром повреждения поперечнополосатой мускулатуры, в основе которого лежит нарушение целости мембран мышечных клеток и выброс их содержимого в кровь). Причины развития рабдомиолиза многообразны: синдром длительного сдавления (), позиционная ишемия, мышечная дистрофия, дерматомиозит, полимиозит.
Уровень миоглобина повышается при СКВ, злокачественном нейролептическом синдроме (вследствие приема психотропных препаратов), гипокалиемии, ожогах, острой алкогольной интоксикации, судорогах, почечной недостаточности, у больных гриппом, лептоспирозом, легионеллезом, газовой гангреной.
Показания к назначению:
На результат анализа могут повлиять недавний приступ стенокардии и недавно выполненная кардиоверсия, чрезмерные физические нагрузки, гипотермия (сопровождающаяся длительной мышечной дрожью), злоупотребление алкоголем и амфетаминами, лекарственные препараты (нейролептики, статины), рентгенологическое и радиоизотопное исследование выполненное в пределах 1 недели до анализа.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К АНАЛИЗАМ КРОВИ
Кровь берется из вены. Необходимо соблюдать общие рекомендации:
Миоглобин (венозная кровь) в Москве
Исследование на определение миоглобина в крови для диагностики повреждений миокарда и скелетных мышц.
Приём и исследование биоматериала
Когда нужно сдавать анализ Миоглобин?
Подробное описание исследования
Миоглобин — специфический белок, который содержится в мышечных клетках скелетных мышц и сердца. Также небольшая часть белка может синтезироваться в сосудах, печени, головном мозге. Он обладает большим сродством к кислороду, чем гемоглобин. Это обусловливает две важные функции белка — накопление кислорода в тканях и использование его при критически малых уровнях кислорода в мышце. Кислород переносится к митохондриям, где происходят реакции для получения клетками энергии.
Миоглобин поступает в кровь при повреждении миокарда и скелетных мышц. Анализ на миоглобин наиболее часто используется для диагностики поражения сердца — инфаркта миокарда. Оно проявляется сильной болью в области груди, боль может отдавать в левую руку, челюсть, живот. Также иногда наблюдается потливость, одышка, тошнота, потеря сознания. Симптомы в основном возникают в покое.
К преимуществам миоглобина относится то, что данный белок является наиболее ранним маркером инфаркта миокарда. Он очень быстро выходит в кровоток при разрушении кардиомиоцитов (клеток сердечной мышцы) и может определяться уже через час после инфаркта. Наивысших значений показатель достигает через 4-12 часов и приходит в норму в течение суток. Однако данный анализ не является специфичным для инфаркта, поэтому для уточнения диагноза следует проводить анализ вместе с определением других маркеров поражения миокарда (тропонином и креатинкиназой-МВ).
Уровень миоглобина также повышается при повреждении скелетных мышц на фоне следующих заболеваний:
Нужно сказать, что миоглобин выводится в неизмененном виде почками. При нарушении их работы (почечной недостаточности) уровень белка в крови может быть повышен. Избыточное выделение белка также само по себе негативно сказывается на функции почек.
Таким образом, определение уровня миоглобина в сыворотке крови вместе с другими маркерами позволяет вовремя диагностировать инфаркт миокарда и заболевания, связанные с повреждением скелетных мышц, а значит своевременно назначить лечение и снизить риск развития осложнений.
Миоглобин скелетных мышц
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах человека и животных, а также в плазме крови человека. Приведен сравнительный анализ гемоглобина и миоглобина.
Миоглобин скелетных мышц
Определение
Структура миоглобина
Первичная структура миоглобина представлена одной полипептидной цепью, состоящей из 146-154 аминокислотных остатков. Вторичная структура — α-спираль. Третичная структура миоглобина представлена свернутой в шар α-спиралью (глобулой) и небелковой частью – гемом (рис.1). Присутствие гема придает миоглобину красный цвет. В геме имеется железо, которое связывает кислород. В 1957 году Джон Кендрю посредством рентгеновской кристаллографии впервые определил пространственное расположение полипептидной цепи в молекуле белка миоглобина, а в 1959 году установил его детальное строение, подтвердив наличие в нём α-спиралей, которое еще в 1951 году предсказал Лайнус Полинг.
Рис.1. Структура миоглобина. Красным цветом выделен гем (illustration I. Geis)
Функции миоглобина
В мышечных волокнах миоглобин выполняет следующие функции:
Концентрация миоглобина в мышечных волокнах
В мышечных волокнах скелетных мышц человека концентрация миоглобина составляет 0,4-0,5 мM (0,25 мг на 1 г ткани). Миоглобин присутствует во всех типах мышечных волокон, однако в разных концентрациях. В мышечных волокнах типа I его концентрация в 1,5 раза выше, чем в мышечных волокнах типа IIB. Именно поэтому мышечные волокна типа I имеют более красную окраску по сравнению с мышечными волокнами типа II. У морских млекопитающих концентрация миоглобина в мышечных волокнах может достигать 3,8 мM. Установлена значительная корреляция между концентрацией миоглобина в мышцах морских животных и глубиной ныряния. Установлено также, что концентрация миоглобина в мышечных волокнах коррелирует с объемной плотностью митохондрий и плотностью кровеносных капилляров.
Концентрация миоглобина в крови
В обычных условиях концентрация миоглобина в крови настолько низка (100 нг/мл), что он не определяется лабораторными методами. Однако при сильных повреждениях мышечных волокон скелетных мышц (краш-синдроме, синдроме позиционной ишемии) миоглобин может попасть в кровь. Так как молекулы миоглобина достаточно крупные, они могут закупоривать канальцы почек и приводить к их некрозу. В результате возникает острая почечная недостаточность и тканевая гипоксия. Это может привести к смерти человека.
При тяжелых силовых и аэробных тренировках (например при марафонском беге), также происходит частичное повреждение мышечных волокон скелетных мышц и миоглобин поступает в кровь.
При остром инфаркте миокарда концентрация миоглобина в крови повышается через 2-4 часа. Поэтому его относят к неспецифическим маркерам этого заболевания (Тереньев А.А., 2016).
Гемоглобин и миоглобин
Миоглобин похож на гемоглобин (Hb) – кислородсвязывающий белок в эритроцитах крови. Гемоглобин осуществляет транспорт кислорода от легких к тканям (в том числе и мышцам), а миоглобин – депонирование и транспорт кислорода внутри мышечных волокон. Структура гемоглобина более сложная, чем миоглобина. Молекула гемоглобина состоит из четырех полипептидных цепочек и гема, а молекула миоглобина – из одной полипепдиной цепочки и гема. Молекулярная масса гемоглобина человека 66,8 кДа. Миоглобин человека обладает большим сродством к кислороду, чем гемоглобин, и способен связывать до 14% от общего количества кислорода в организме.