Для чего нужен йод в организме ребенка
Препараты йода в коррекции когнитивного дефицита у младших школьников
В настоящее время йоддефицитные заболевания представляют собой глобальную проблему. В мире 2 млрд человек подвержено риску развития йоддефицитных заболеваний, 740 млн населения имеют эндемический зоб, 43 млн страдают умственной отсталостью вследствие йо
В настоящее время йоддефицитные заболевания представляют собой глобальную проблему.
В мире 2 млрд человек подвержено риску развития йоддефицитных заболеваний, 740 млн населения имеют эндемический зоб, 43 млн страдают умственной отсталостью вследствие йодного дефицита.
В России риску развития йоддефицитных заболеваний подвержены 98 млн человек (И. И. Дедов и соавт., 2001). Зоб диагностируется у 2% младенцев до 1 года, у 20–30% детей 7–10 лет, у 30–50% подростков и у 30–50% беременных женщин (Л. А. Щеплягина, 1999).
В настоящее время достаточно четко описан спектр йоддефицитных заболеваний.
Для внутриутробного периода могут быть следующие риски: аборты; мертворождение; повышение перинатальной смертности; повышение детской смертности; неврологический кретинизм (умственная отсталость, глухонемота, косоглазие); микседематозный кретинизм (умственная отсталость, гипотиреоз, карликовость);психомоторные нарушения; снижение слуха.
У новорожденных в результате дефицита йода может развиться неонатальный гипотиреоз, у детей и подростков — нарушения умственного и физического развития, нарушение когнитивных функций, нарушение речи, девиантные формы поведения, трудности социальной адаптации.
У взрослых вероятно развитие зоба и его осложнений, йодиндуцированного тиреотоксикоза. Независимо от возраста могут наблюдаться зоб, гипотиреоз, снижение интеллекта, повышение поглощения радиоактивного йода при ядерных катастрофах.
В структуре болезней, обусловленных недостаточным потреблением йода, выделяют умственную отсталость, которая является одним из наиболее тяжелых проявлений йодного дефицита. Умственная отсталость в районах йодного дефицита развивается вследствие поражения центральной нервной системы. Выделяют тяжелые формы умственной отсталости и пограничное снижение интеллекта (рис. 1). Тяжелые формы регистрируются у детей и взрослых со своевременно не пролеченным врожденным гипотиреозом (кретинизмом).
Кретинизм и сходные с ним неврологические нарушения являются наиболее тяжелыми проявлениями повреждения мозга на фоне йоддефицита.
Эндемический кретинизм характеризуется следующими чертами: эпидемиологической связью с выраженным дефицитом йода и эндемическим зобом, возможностью предотвращения этого тяжелого заболевания после устранения йодного дефицита. Частота встречаемости кретинизма в эндемических областях может достигать 15%. Чаще этот показатель колеблется от 5 до 8%. Различают неврологический и микседематозный кретинизм. Независимо от формы кретинизма, у всех больных наблюдаются неврологические расстройства, хотя тяжесть и преобладание отдельных симптомов, а также общая степень нарушений могут значительно варьировать. Клиника эндемического кретинизма широко представлена в специальной медицинской литературе.
Что касается пограничных форм нарушений интеллекта, то спектр их весьма разнообразен. Это чаще всего нарушения речи, снижение памяти, психологические проблемы, изменения эмоциональной сферы, трудности в сфере межличностных контактов, асоциальные формы поведения и др.
Степень повреждения мозга и степень нарушений интеллектуальной сферы зависят от того, на каком этапе онтогенеза ребенок испытывает йодный дефицит и, конечно же, от степени его тяжести.
При внутриутробном йодном дефиците в основном страдают слуховая, двигательная и другие функции головного мозга, что свидетельствует о поражении аппарата улитки, коры головного мозга и базальных ганглиев.
С точки зрения интеллектуального развития длительное время считалось, что йодный дефицит наиболее опасен во время внутриутробного периода развития (10–18-я неделя) и в первые три года жизни (завершение структурно-функционального созревания мозга).
В настоящее время доказано, что дефицит йода и тиреоидных гормонов неблагоприятно влияет на центральную нервную систему и интеллект во все возрастные периоды (Л. А. Щеплягина, Д. С. Надеждин, П. И. Храмцов, Е. Н. Сотникова, 2003–2004).
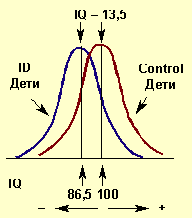
Приводятся данные о том, что коэффициент интеллекта (уровень IQ) у населения йоддефицитных регионов в среднем на 10–15%, а у детей — на 13,5% ниже, чем у лиц, проживающих на территориях с достаточным содержанием данного микроэлемента в биосфере (рис. 2).
 |
| Рисунок 2. Повреждение ЦНС в районах легкого и умеренного йодного дефицита (M. Escobar et al., 2002) |
В последнее время появились публикации, в которых описаны наиболее часто встречающиеся нарушения нервно-психического развития в раннем и дошкольном возрасте (табл.). Это снижение психомоторного и умственного развития, нарушение координации, нейромышечные, сенсорные нарушения, снижение зрительно-моторных реакций.
Большинство исследователей изучают показатели умственного развития с помощью вербальных методик или психологических тестов, что не позволяет дать полностью объективную, количественную характеристику основных составляющих познавательной сферы.
Создание оригинальной психофизиологической аппаратуры (тестовые компьютерные системы (ТКС) — «Ритмотест», «Мнемотест», «Бинатест» и «Психомат») позволило количественно охарактеризовать важнейшие составляющие процесса познания: восприятие, внимание, память, психомоторную деятельность, аналитико-синтетические процессы, мышление (Е. В. Матвеев, Д. С. Надеждин, 1994).
Разработанные в отделении психоневрологии НЦЗД РАМН возрастные нормативы (О. И. Маслова, В. М. Студеникин, С. В. Дзюба, Н. Д. Макулова, 2000) перечисленных показателей открыли возможность уточнить характер и структуру нарушений в познавательной сфере у детей, проживающих на йоддефицитных территориях (рис. 3).
При сравнении полученных нормативов с фактическим состоянием процессов познания у детей в эндемичных по зобу регионах было установлено, что на фоне йоддефицита отмечались существенно более низкие значения таких параметров, как внимание, восприятие, память, оперативность аналитико-синтетических процессов, мелкая моторика, мышление (см. рис. 3). Доказано, что йодный дефицит на 15–44% снижает познавательные функции (рис. 4) у дошкольников и на 9–38% — у школьников (Л. А. Щеплягина, Н. Д. Макулова, О. И. Маслова, 2002).
Поскольку познавательные способности ребенка тесно связаны с уровнем интеллекта человека в трудоспособном возрасте, перед нами встает вопрос о формах и методах эффективной профилактики нарушений когнитивных функций в условиях йодного дефицита.
Существуют массовая, групповая и индивидуальная, пищевая и медикаментозная формы йодной профилактики. Под массовой профилактикой обычно подразумевают пищевую профилактику (чаще с применением йодированной соли), под групповой или индивидуальной — медикаментозную. В соответствии с рекомендациями Всемирной организации здравоохранения (2001), суточная потребность человека в йоде следующая: у детей 0–6 лет — 90 мкг/сут, у детей 6–12 лет — 120 мкг/сут, у подростков (старше 12 лет) и взрослых — 150 мкг/сут, у беременных и кормящих женщин — 200 мкг/сут.
Можно выделить такие виды важной для нормального созревания мозга йодной профилактики, как антенатальная (в период внутриутробного развития) и постнатальная (ранний возраст).
Приводятся убедительные данные о том, что антенатальная профилактика дефицита йода оптимизирует рост, психомоторное развитие и снижает заболеваемость, в том числе обусловленную перинатальным поражением центральной нервной системы. Вопрос о необходимости профилактики и коррекции дефицита йода у детей школьного возраста до последнего времени дискутировался. Работы F. Delange (2002) позволили по-новому взглянуть на эту проблему. В них были представлены аргументы в пользу проведения йодной профилактики у детей любого, в том числе школьного, возраста.
Наш опыт касается оценки эффективности применения йодида калия у младших школьников (100 человек 8–9 лет), проживающих в условиях легкой степени йоддефицита.
Всего было обследовано две группы детей. В основную группу (50 человек) вошли дети с дефицитом потребления йода (медиана йодурии для группы равнялась 58 мкг/л).
В группу сравнения были включены школьники (50 человек) с нормальной обеспеченностью йодом (медиана йодурии по группе — 105 мкг/л). Исследование высших психических функций обследованных детей предусматривало многостороннюю количественную оценку психофизиологических параметров в зависимости от приема йодида калия.
В результате тестирования было установлено, что на фоне дефицита йода в среднем 85% детей имели отклонения тех или иных показателей интеллектуально-мнестической сферы. У школьников младших классов выявлялся выраженный дефицит основных познавательных функций. Дети имели дефицит внимания (40%), восприятия (30%), проблемы в тонкой моторной сфере (30%). Темп мышления по сравнению с нормой был ниже на 20%.
Степень когнитивных нарушений оказалась тем более выражена, чем ниже у детей была йодурия.
После обследования детям основной группы с пониженной экскрецией йода с мочой назначали фармакологический препарат, содержащий йодид калия по 1 таблетке (100 мкг йода) 1 раз в день в течение 6 мес.
После проведенного шестимесячного курса установлено, что прием 100 мкг йода привел к нормализации йодной обеспеченности детей основной группы (медиана составила 120 мкг/л по группе в целом). В группе сравнения показатели йодурии практически не изменились, хотя у некоторых детей было выявлено умеренное снижение экскреции йода с мочой.
У детей, получавших дотацию йода, заметно улучшились все изучаемые показатели высших психических функций. По таким параметрам, как внимание, оперативность мышления, тонкая моторика, реакция на слово, звук, дети основной группы стали существенно опережать школьников из группы сравнения.
Таким образом, в настоящее время имеются клинические наблюдения, свидетельствующие об эффективности профилактики и коррекции йодного дефицита препаратами йода у детей младшего школьного возраста.
Л. А. Щеплягина, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Йод и интеллектуальное развитие ребенка
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Научный центр здоровья детей РАМН, Москва
З аболевания, обусловленные недостатком йода в окружающей среде, являются серьезной медико–социальной проблемой во многих регионах мира в связи с высокой распространенностью и широким спектром клинических проявлений и последствий (Щеплягина Л.А., 1995; Краснов В.М., 1999; Delange F., 2000). Согласно данным ВОЗ, 30% населения в мире имеют риск развития йоддефицитных заболеваний, в том числе более 40 млн. человек страдают умственной отсталостью вследствие дефицита йода.
Современные представления позволяют выделить целый ряд заболеваний, связанных с влиянием йодной недостаточности на рост и развитие организма. Дефицит тиреоидных гормонов у плода и в раннем детском возрасте может привести к необратимому нарушению умственного развития, вплоть до кретинизма. В йоддефицитных районах у женщин нарушается репродуктивная функция, увеличивается количество выкидышей и мертворожденных. Недостаток йода может сказаться на работе жизненно важных органов и привести к задержке физического развития. В этих регионах повышается перинатальная и детская смертность. Диапазон проявлений йоддефицитных заболеваний весьма широк и зависит от периода жизни, в котором эти заболевания проявляются. Очевидно, что наиболее неблагоприятные последствия возникают на ранних этапах становления организма, начиная от внутриутробного периода, завершая возрастом полового созревания (Hetzel, 1989).
Наиболее изученное проявление тяжелого йодного дефицита – эндемический кретинизм, характеризующийся сочетанием умственной отсталости, мутизма, глухоты, спастической диплегии. Второй, менее известный вариант – микседематоз или гипотиреоидный кретинизм, характеризуется тяжелым гипотиреозом в сочетании с карликовостью. Встречаются также и смешанные формы. Неврологический вариант типичен для большинства эндемичных районов, в то время как микседематозный вариант преобладает в странах Африки.
На каждый случай клинически выраженного кретинизма в популяции имеется гораздо большее число людей, страдающих от субклинических эффектов йодного дефицита. В прогностических исследованиях в популяции Папуа Новая Гвинея (1966–1970) показаны различия в моторном и интеллектуальном развитии детей, рожденных от матерей, получавших йод до наступления беременности и получавших плацебо. Важным наблюдением в контролируемых исследованиях явилось то, что назначение йода эффективно только до наступления беременности. Частота кретинизма среди детей, рожденных от матерей, получавших йод после наступления беременности, достоверно не отличается от таковой в контрольной группе.
В исследовании Boyages и Collins в Китае было показано, что 72% молодых людей в возрасте 30–35 лет, рожденных в перод тяжелого йодного дефицита, имели IQ ниже 70 баллов; в то же время среди детей 7–14 лет, чьи матери получали йодированную соль, частота аналогичных нарушений составила уже 44%.
Помимо выраженных форм умственной отсталости, дефицит йода обусловливает снижение интеллектуального потенциала всего населения, проживающего в зоне йодной недостаточности. Исследования, выполненные в последние годы в разных странах мира, показали, что средние показатели умственного развития населения (IQ–индекс), проживающего в регионах йодной недостаточности, достоверно (на 15–20%) ниже таковых в регионах без дефицита йода. Умеренный дефицита йода подчас не выражается, поэтому он наиболее четко определяется, как «скрытый голод». В этой связи медико–социальное и экономическое значение йодного дефицита состоит в существенной потере интеллектуального, образовательного и профессионального потенциала нации.
Механизмы влияния йода на развитие нервной системы
Механизмы влияния йода на интеллект и развитие ребенка обусловлены его эссенциальной ролью в формировании, созревании и функционировании ЦНС.
Йод играет центральную роль в физиологии щетовидной железы (ЩЖ), являясь основной составляющей тиреоидных гормонов (тироксина и трийодтиронина).
Тироксин (Т4) является своего рода «прогормоном», и его дейодинация, происходящая в целом ряде тканей, является решающим моментом для поддержания локального уровня трийодтиронина (Т3) – активной формы. Развитие мозга ребенка преимущественно зависит от уровня сывороточного Т4, поскольку нейроны коры головного мозга около 80% необходимого им Т3 получают при дейодизации Т4 in situ 5–дейодиназой 2–го типа (D2) в глиальных клетках, таниоцитах третьего желудочка и астроцитах, которые захватывают T4 из крови и выделяют Т3 для использования его нейронами. Активность D2 является важным компонентом контроля за воздействиями Т4, поскольку она возрастает в случае недостатка T4, поддерживая концентрацию ТЗ в головном мозге. Концентрация D2 мРНК у гипотиреоидных животных в постнатальном периоде возрастает в несколько раз по сравнению с нормальными значениями в релейных ядрах и корковых мишенях первичных соматосенсорных и аудиторных путей. Возможно, эти пути специфически защищены от недостатка Т4, что свидетельствует об участии Т3 в формировании этих структур. Дефицит йода приводит к характерным изменениям гормонального профиля: прежде всего отмечается снижение уровня T4, при этом уровень Т3 долгое время остается в пределах нормальных значений, так что клинически диагностируется эутиреоидное состояние. Только при тяжелом и длительном воздействии йодного дефицита наблюдается снижение Т3. Таким образом, поскольку достаточный уровень циркулирующего Т4 является решающим для развития и функционирования нервной системы, в условиях умеренного йодного дефицита даже при отсутствии клинических признаков гипотиреоидного состояния ЦНС уже испытывает состояние «тиреоидного голода».
Молекулярный механизм действия тиреоидных гормонов заключается в регуляции экспрессии генов через ассоциацию со специфическими хроматин–связанными рецепторами. Кроме того, тиреоидные гормоны могут связываться другими внутриклеточными структурами, участвовающими в регуляции поступления Т3 к нуклеарным рецепторам. Ассоциация Т3–рецепторов с хроматином обладает способностью к изменению структурной организации специфических генов и, в некоторых случаях, хроматина в целом. Связываясь в клетках–мишенях с нуклеарными рецепторами, тиреоидные гормоны регулируют экспрессию некоторых нейрональных генов, обеспечивающих синтез ряда специфических белков (микротубулин–ассоциированные протеины, изотубулины b–4, основной протеин миелина, миелин–связанный гликопротеин, калбиндин, протеин–2 клеток Пуркинье, фактор роста нервов, синапсин I, RC–3 протеин и др.)
Идентификация нескольких форм нуклеарных Т3–рецепторов, локально–специфическая экспрессия изоэнзимов дейодиназы в мозге и гипофизе, молекулярный анализ тироид–зависимых генов в головном мозге плода, новорожденного и взрослого открыли новую эру в понимании механизмов действия тиреоидных гормонов.
При исследовании нейроэндокринных взаимодействий на трансгенных линиях мышей было обнаружено, что недостаточность тиреоидных гормонов приводит к повреждениям, отличным от таковых при простом уменьшении числа тиреоидных рецепторов. По многим аспектам, экспрессия мутантных тиреоидных рецепторов оказывает худшее воздействие, чем недостаточность рецепторов «дикого» типа.
Интегрированные сети рецепторов, дейодиназ и тироид–зависимых генов требуют строгой регуляции концентрации гормонов щитовидной железы «в нужное время и в нужном месте». Эффект трийодтиронина опосредуется через контроль специфических генов в различных типах клеток с целью экспрессии соответствующего фенотипа в соответствующее время в строго синхронизированной последовательности этапов развития, что привело к формированию представления о тиреоидных гормонах, как о своеобразном «таймере», обеспечивающем строгую последовательность событий в процессе формирования, созревания и функционирования головного мозга.
Таким образом, достаточный уровень циркулирующего Т4 является решающим для нормального функционирования и созревания нервных клеток и развития нейрональных связей (Р. Pharoah, К. Connolly, 1995). При дефиците тиреоидных гормонов у плода наблюдается уменьшение массы головного мозга и содержания в нем ДНК, а также ряд гистологических изменений [Hetzel B.S., 1994]. Экспериментальный гипотиреоз у крыс приводит к изменению паттернов экспрессии и снижению на 25–30% уровня протеин–G–связанных рецепторов киназы2 и бета–аррестина! – ключевых протеинов, влияющих на чувствительность широкого круга протеин–G–связанных рецепторов в коре головного мозга. Эксперименты, проведенные на крысах, мартышках и овцах, показали влияние тяжелого гипотиреоза на созревание коры и мозжечка: уменьшение массы мозга с уменьшением числа нейронов, увеличение плотности клеток в коре головного мозга и снижение числа собственных клеток в мозжечке. Mussa G.C., Zaffaroni М. в экспериментах на гипотиреоидных крысах продемонстрировали гипоплазию нейронов, уменьшение ветвления дендритов и образования межнейрональных связей; а также нарушение структуры и организации нейрональных интрацитоплазматических микротубул, биохимические дефекты синаптосом и повреждение нуклеарных и цитоплазматических Т3–рецепторов.
Доказано влияние тиреоидных гормонов на деление нейробластов, нейрональную миграцию, созревание и дифференциацию нейронов, дифференциацию олигодендроглиоцитов, пролиферацию нейрональных отростков, формирование цитоскелета астроцитов, выработку нейротрофинов и образование рецепторов к ним, дифференциацию питуитарных лактотрофов и соматотрофов, синаптогенез, миелинизацию, процессы апоптоза. (Ph. de Nayer, В. Dozin, 1999).
Кроме основных эффектов Т3, опосредуемых через нуклеарные рецепторы, Т4 имеет собственные эффекты в нервной системе, не вовлекающие систему нуклеарных Т3–рецепторов.
При рассмотрении взаимосвязей между степенью йодной обеспеченности и функционированием нервной системы необходимо учитывать не только различие эффектов Т3 и Т4, но и периоды их воздействия на развивающийся мозг. Созревание нервной системы может быть нарушено вследствие недостаточного поступления материнских гормонов или нарушения синтеза гормонов щитовидной железой плода.
С точки зрения роли тиреоидных гормонов в развитии нервной системы можно выделить три периода:
1) Период до начала синтеза щитовидной железой плода собственных гормонов (до 10–12 недели гестации). В течение этого периода уже происходит активный нейрогенез, возможно повреждение коры головного мозга вследствие тяжелого йодного дефицита и материнской гипотироксинемии.
2) Период, связанный с внутриутробным воздействием гормонов щитовидной железы и плода, и матери. В период до рождения тиреоидные гормоны влияют на продолжающиеся процессы созревания нейронов, нейрональной миграции и синаптогенеза; возрастает число Т3–рецепторов в ткани головного мозга.
3) Постнатальный период, когда уровень обеспеченности тиреоидными гормонами зависит от активности щитовидной железы новорожденного. В течение этого периода продолжаются процессы, начавшиеся во 2–м периоде: созревание нейронов, глиогенез, миелинизация.
В экспериментах выявлено значительное влияние фетальной тироидэктомии (на поздних сроках гестации) и выраженный эффект материнской тироидэктомии (в середине гестации). Сочетание фетальной и материнской тироидэктомии приводит к схожему, но более выраженному эффекту по сравнению с йодным дефицитом. В свете современных представлений об эмбриогенезе головного мозга считается, что критическим периодом воздействия дефицита йода является второй триместр (14–18 неделя) гестации, когда нейроны коры и базальных ганглиев сформированы и могут быть повреждены вследствие влияния дефицита йода на функцию материнской щитовидной железы. Последние исследования доказали перенос материнского тироксина через плацентарный барьер на ранних сроках беременности. При нарушении этого процесса развивается неврологический кретинизм. Нарушение функции щитовидной железы плода проявляется в 3–м триместре и усугубляет эффект материнской тироидной недостаточности. Изолированное нарушение функции ЩЖ плода может привести к гипотироидной форме кретинизма.
Таким образом, эффект йодного дефицита опосредуется через сочетание материнского и фетального гипотироидизма, причем воздействие материнского гипотироидизма предшествует началу тироидной секреции плода.
Большинство исследователей считают «критическим» в отношении зависимости головного мозга от уровня тиреоидных гормонов период от поздних сроков гестации до 1–2 лет. Последние открытия в области физиологии и молекулярной биологии привели к расширению представлений о периоде чувствительности головного мозга к специфическому воздействию тиреоидных гормонов от раннего эмбриогенеза до зрелого возраста.
Большинство исследователей отмечают эффективность назначения препаратов йода только до наступления беременности. Попытки повлиять на интеллектуальное развитие ребенка школьного возраста путем назначения различных форм препаратов йода не дали положительных результатов.
Так, в исследовании Bautista A., Barker P.A. 100 школьников с зобом в йоддифицитном районе получали 475 мг йодированного масла per os в течение 22 мес. Группа сравнения (100 детей) получали минеральное масло. В обеих группах отмечено уменьшение размеров зоба и повышение уровня йодурии. Различий по результатам тестов Стэнфорда–Бине и Бендера не было выявлено. Однако была выявлена достоверная взаимосвязь между уменьшением размера зоба и повышением IQ, преимущественно у девочек. (Bautista A., Barker P.A. et al., 1982). Fu L.X., Chen Z.N., Deng L.Q. обследовали группу детей, не получавших йодной поддержки в течение пренатального и раннего детского периода (для оценки уровня интеллекта использовались тесты Бине–Стэнфорда). После 2–х лет стабильного йодного обеспечения не было отмечено положительной динамики в интеллектуальном развитии. Авторы пришли к выводу о необратимости нарушения интеллекта ребенка, связанного с йодной недостаточностью во внутриутробном и неонатальном периоде (Fu LX, Chen ZN, Deng LQ, 1994).
Разработка адекватных мер профилактики и коррекции интеллектуальных нарушений у детей требует знания структуры и характера дефицита познавательных функций. Однако систематизированные обобщающие исследования, посвященные особенностям интеллектуального развития ребенка в условиях умеренного и легкого йодного дефицита, на настоящий момент практически отсутствуют. Единичные отечественные и зарубежные исследования в этой области в основном базируются на методах исследования интеллекта, дающих его общую характеристику, и лишены возможности многосторонней количественной оценки высших психических функций, таких как восприятие, внимание, память, аналитико–синтетические процессы, сенсомоторная деятельность. Появление новых инструментальных методов оценки познавательной сферы ребенка (тестовых компьютерных систем «Ритмотест», «Мнемотест», «Бинатест», «Психомат») открывает реальные возможности для объективного детального изучения основных процессов познавательной деятельности. Их использование приобретает особое значение для исследования состояния когнитивных функций у детей в районах экологического неблагополучия, где экологический фактор усугубляет действие других факторов риска нарушений интеллектуального развития. Объективная количественная оценка когнитивной сферы позволит прогнозировать интеллектуальное развитие ребенка, даст возможность дифференцировать вклад различных факторов риска в развитие интеллектуальной недостаточности и определить методы профилактики и коррекции интеллектуальных нарушений у детей в районах зобной эндемии.
Материалы и методы исследования
Обследовано 90 детей (50 детей младшего школьного возраста 7–9 лет и 40 дошкольников 5–7 лет), проживающих в районе с умеренной степенью тяжести зобной эндемии – основная группа.
Группу сравнения (ГС) составили 52 практически здоровых ребенка 5–9 лет, проживающих в районе с удовлетворительным содержанием йода в окружающей среде и имеющих нормальные индивидуальные показатели обеспеченности йодом.
Для исследования когнитивного статуса использовались новые инструментальные методы психофизиологического обследования – тестовые компьютерные системы «Ритмо–, Мнемо–, Бинатест», разработанные во ВНИИ медицинского приборостроения РАМН и адаптированные к применению у детей в НИИ педиатрии НЦЗД РАМН, позволяющие осуществить многостороннюю количественную оценку познавательной сферы и отдельных ее составляющих: внимания, слухового и зрительного восприятия, памяти, сенсомоторной деятельности, аналитико–синтетических процессов, оперативности принятия решений. Преимуществами метода являются его объективность, получение количественного результата, возможность динамического мониторинга состояния исследуемых функций.
Результаты и обсуждение
Отклонения по тем или иным показателям интеллектуально–мнестической сферы выявлены у 85% детей в изучаемом районе, причем 30% детей имели грубые нарушения по большинству исследованных функций, 55,5% – парциальный когнитивный дефицит различной степени выраженности.
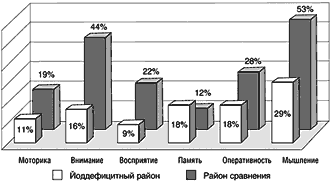
У школьников младших классов в изучаемом районе выявлена выраженная недостаточность по основным познавательным функциям (рис. 1). Даже хорошо успевающие дети имели «задолженность» в сфере внимания на 56%, восприятия – 30%, в тонкой моторной сфере – на 17%, темп мыслительной деятельности был снижен у них на 20% по сравнению с нормой. Можно предположить, что в этих случаях достижение удовлетворительной успеваемости связано с мобилизацией всех компенсаторных возможностей организма, что безусловно является фактором риска состояний нарушенного развития, в т.ч. психоэмоциональных и соматических расстройств.
Рис.1. Показатели когнитивных функций детей младшего школьного возраста (показатели группы сравнения приняты за 100%)
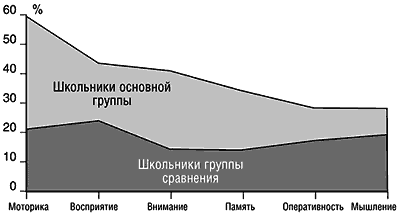
В поисках истоков школьной неуспеваемости мы обратились к изучению группы детей дошкольного возраста и оценке динамики показателей когнитивной сферы в возрастном периоде 6–9 лет, т.е. в критический период, соответствующий переходу ребенка к школьному обучению. Были получены динамические показатели познавательных функций детей в йоддефицитном районе и в районе сравнения (рис. 2).
Рис. 2. Динамика когнитивных функций при переходе к школьному обучению
Было отмечено замедление формирования процессов познания у детей в йоддефицитном районе: внимания – в 3 раза, восприятия и мелкой моторики – в 2 раза, мышления – в 1,8 раза (р Рис. 3. Вклад дефицита йода в формирование когнитивных нарушений у дошкольников (по показателям атрибутивного риска)
Рис. 4. Вклад дефицита йода в формирование когнитивных нарушений у школьников (по показателям атрибутивного риска)
С помощью метода пошаговой множественной регрессии, помимо дефицита йода, выделен еще ряд факторов, оказывающих воздействие на формирование познавательных способностей ребенка. Среди таких факторов отмечены: наличие перинатальной патологии, малая продолжительность грудного вскармливания, низкий социально–экономический статус семьи, наличие у ребенка хронических соматических заболеваний (табл. 1).
Показано, что в условиях дефицита йода основными факторами, нарушающими формирование процессов восприятия, внимания и памяти являются наличие хронических заболеваний и низкий социально–экономический статус семьи. Для развития памяти и аналитико–синтетических способностей решающее значение имеет продолжительность грудного вскармливания. На оперативность мыслительной деятельности оказывают отрицательное влияние патология перинатального периода и состояние хронической интоксикации, обусловленное инфицированием микробактериями туберкулеза (МБТ).
Подобный анализ позволяет более детально проанализировать истоки формирования когнитивных нарушений у детей, родившихся и развивающихся в условиях йодного дефицита. Полученные данные являются предпосылкой для формирования комплексной системы профилактики нарушений познавательной деятельности у детей в йоддефицитных районах, включающей наряду с мероприятиями по групповой йодной профилактике ряд мер, направленных на улучшение акушерско–гинекологической помощи, ранних этапов выхаживания новорожденных, социального обеспечения семей, укрепление соматического здоровья.
Дефицит йода – одна из главных причин умственной отсталости в мире. «Скрытый йодный голод» приводит к необратимой потере интеллектуального потенциала нации за счет «скрытого» когнитивного дефицита. Дети с выраженными интеллектульными нарушениями (умственной отсталостью) – только верхушка айсберга. Число детей, имеющих парциальные и пограничные нарушения интеллекта вследствие йодной недостаточности, огромно.
Более 80% детей в районе умеренного йодного дефицита имеют ту или иную степень недостаточности основных познавательных функций, при этом в большей степени страдают функции внимания, восприятия и тонкой моторики. Кроме того, воздействие йодного дефицита приводит к задержке формирования основных познавательных функций в критические возрастные периоды. Показатели когнитивной сферы достоверно связаны с уровнем йодного обеспечения, недостаточностью функции щитовидной железы и увеличением ее объема. Наиболее значимыми прогностическими показателями для формирования когнитивной сферы ребенка являются уровень тиреотропина и тироксина в сыворотке крови. Взаимосвязь обеспеченности йодом с познавательными функциями находится в основном в диапазоне тенденций, что обусловлено опосредованным воздействием йода на развитие ЦНС через систему тиреоидных гормонов. Согласно последним исследованиям, нарушения интеллекта вследствие внутриутробного воздействия йодной недостаточности не поддаются коррекции постнатальным назначением йода. Ликвидация йодного дефицита, как причины интеллектуальной недостаточности, возможна только при проведении профилактических мероприятий в цепочке «мать – новорожденный – ребенок – подросток». Оценка состояния здоровья в йоддефицитных регионах должна предусматривать диагностику состояния когнитивной сферы ребенка с использованием современных диагностических методик (в т.ч. компьютерных тест–систем), динамический возрастной мониторинг когнитивных функций с целью своевременного выявления отклонений в формировании познавательных процессов. Такой подход позволит при необходимости дополнять специфическую йодную профилактику адекватными мерами социально–педагогической и медикаментозной (ноотропной) коррекции в комплексе мероприятий, направленных на сохранение интеллектуального потенциала в районах зобной эндемии.
Работа выполнена при содействии компании Мерк КГаА
1. Баранов А.А., Щеплягина Л.А., Римарчук Г.В., Корюкина И.П. и соавт. Медико–социальные аспекты проблемы йоддефицитных состояний: пособие для врачей. М., 1998. 31 с.
2. Дедов И.И., Герасимов Г.А., Свириденко Н.Ю. Йоддефицитные заболевания в Российской Федерации // Методическое пособие. М., 2000. 30с.
3. Краснов В.М., Григорьева М.Н. Особенности формирования личности и интеллектуального развития детей, страдающих эндемическим зобом // Современные проблемы педиатрии: Материалы VIII съезда педиатров. М., 1998: 121.
4. Утенина В.В., Боев В.М., Барышева Е.С., Карпенко И.Л. Характеристика умственной работоспособности детей с эндемическим зобом, проживающих в йоддефицитном районе // Российский педиатрический журнал, 2000; 1: 17–20.
5. Щеплягина Л.А. Проблемы йодного дефицита // Русский медицинский журнал, 1999; 11: 523–7.
6. Bautista A., Barker P.A., Dunn J.T., Sanchez M., Kaiser D.L. The effects of oral iodized oil on intelligence, thyroid status, and somatic growth in school–age children from an area of endemic goiter // Am. J. Clin. Nutr., 1982; 35(1): 127–32.
7. Bernal J., Nunez J. Thyroid hormones and brain development // Eur. J. Endocrinology, 1995; 133(4): 390–8.
8. Fu L.X., Chen Z.N., Deng L.Q. Effects of iodine nutritional status of fetuses, infants and young children on their intelligence development in the areas with iodine–deficiency disorders // 1994; 28 (6): 330–2
9. Glinoer D., De Nayer P., Delange F. et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects. // J. Clin. Endocrinol. Metab., 1995; 80 (1): 258–69.
10. Hetzel B.S. Iodine and neuropsychological development // J. Nutr., 2000; 130 (28 Suppl): 493–5.
11. Mussa G.C., Zaffaroni M., Mussa F. Thyroid and growth: thyroid hormones and development of the nervous system // J. Endocrinol Invest,1989; 12 (Suppi 3): 85–94.
12. Pharaoah P., Connolly K. Iodine and brain development // Developmental Medicine and Child Neurology, 1995; 38: 464–9.