Для чего нужно тельце барра
Тельце Барра
У людей и животных с анеуплоидией, имеющих в геноме 3 и более X-хромосом (см., напр., синдром Клайнфельтера), число телец Барра в ядре соматической клетки на единицу меньше числа X-хромосом.
Источники
Полезное
Смотреть что такое «Тельце Барра» в других словарях:
тельце Барра — тельце Барра. См. половой хроматин. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
тельце барра — ЭМБРИОЛОГИЯ ЖИВОТНЫХ ТЕЛЬЦЕ БАРРА – во всех соматических клетках генетически женского организма одна из Х хромосом инактивирована и известна как половой хроматин … Общая эмбриология: Терминологический словарь
Тельце Барра — интенсивно красящаяся структура, наблюдающаяся в ядрах разных типов клеток у самок млекопитающих. Представляет собой сильно спирализованную и поэтому неактивную Х хромосому. Инактивация одной из Х хромосом происходит случайным образом … Словарь по психогенетике
Тельце Барра Хроматиновое (Barr Body) — см. Хроматин половой. Источник: Медицинский словарь … Медицинские термины
Барра тельце — (М. L. Barr, род. в 1908 г., канадский гистолог) см. Хроматин половой … Большой медицинский словарь
Инактивация Х-хромосомы — Черепаховая окраска самок кошек является видимым примером инактивации Х хромосомы. Черный и оранжевый аллели гена окраски меха располагаются на Х хромосоме. Окраска конкретного участка меха определяется тем, какой из аллелей гена активен в данном … Википедия
половой хроматин — тельце Барра Гетерохроматинизированная в процессе лайонизации и интенсивно прокрашиваемая при анализе интерфазных ядер Х хромосома самок млекопитающих; выявление П.х. лежит в основе экспресс метода (т.е. без культивирования клеток и получения… … Справочник технического переводчика
Половой хроматин — плотное окрашивающееся тельце, обнаруживаемое в недслящихся (интерфазных см. Интерфаза) ядрах клеток у гетерогаметных (имеющих Х и Y Половые хромосомы) животных и человека. П. х. подразделяют на Х хроматин, или тельце Барра (открыт в 1949 … Большая советская энциклопедия
Гетерохроматин — Ядро фибробласта женщины с гетерохроматином, помеченным флуоресцентным красителем. Стрелкой указано положение тельца Барра Гетерохроматин участки … Википедия
Пол — I совокупность генетически детерминированных признаков особи, определяющих ее роль в процессе размножения. Развитие признаков мужского (обозначают знакома Марса ♂ ) и женского (знак Венеры ♀ ) полов определяется хромосомными наборами (см.… … Медицинская энциклопедия
Для чего нужно тельце барра
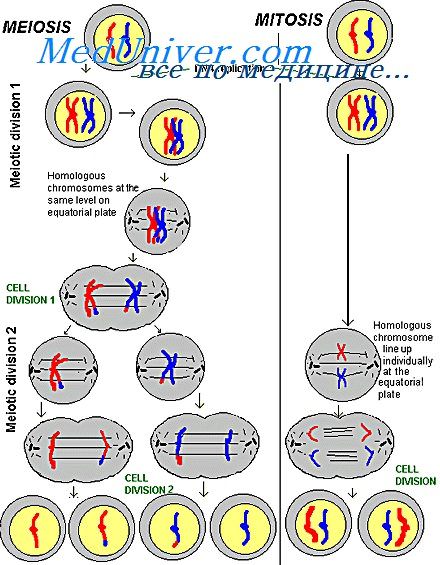
Х-хроматин (тельце Барра) представляет собой хромоцентр величиной около 1 мкм, красящийся всеми основными ядерными красителями более интенсивно, чем остальные хроматиновые структуры ядра. Фельген-положительная реакция свидетельствует о большой концентрации в нем ДНК.
Локализация Х-хроматина в ядре различна. В большинстве тканей он находится на внутренней поверхности ядерной оболочки и может иметь треугольную, плоско-выпуклую, трапециевидную, U-образную или гантелевидную форму. Иногда Х-хроматин имеет вид утолщения или зубца ядерной мембраны, соединенного с ядрышком тонкой хроматиновой нитью. В веретеновидных и палочковидных ядрах Х-хроматин располагается на одном из полюсов ядра.
Реже Х-хроматин располагается на ядрышке или в нуклеоплазме, при этой локализации он обладает сферической формой и трудно отличим от других хромоцентров, имеющих такой же размер, но неспецифических для пола. Поэтому в целях диагностики половой принадлежности клеток большинство исследователей учитывают хромоцентры, расположенные только у ядерной мембраны.
Положение Х-хроматина может меняться в одних и тех же клетках в зависимости от их функционального состояния, а также в процессе онтогенеза.
Х-хроматин обнаружен в клетках различных тканей у многих млекопитающих; у грызунов (хомяки, крысы, мыши, морские свинки) хроматиновые структуры ядер представлены большим количеством хромоцентров, затрудняющих выявление Х-хроматина. У человека половые различия в строении ядер установлены практически во всех тканях и органах.
Происхождение Х-хроматина. В процессе клеточного цикла хромосомы претерпевают закономерные преобразования, которые состоят в спирализации и деспирализации хромосом и их репродукции. В интерфазе максимально деспирализованные хромосомы образуют ядро с относительно гомогенным содержимым. Репродукция (синтез ДНК) хромосом происходит только в деспирализованном состоянии в период S-интерфазы.
Спирализуясь, хромосомы вступают в профазу митоза и достигают наибольшей спирализации в метафазе митоза и мейоза. При этом они обладают минимальной специфической активностью. Вместе с тем установлено, что хромосомы всегда неравномерно спирализованы по длине и разделяются на гетерохроматические и эухроматические районы. Морфологически эти районы различаются по интенсивности окраски и структурной организации.
Эухроматические районы в интерфазном ядре деспирализуются, в то время как гетерохроматические имеют тенденцию оставаться в спирализованном компактном состоянии в виде хромоцентров с высоким содержанием ДНК. Спирализованность гетерохроматических районов сопровождается неактивным состоянием генов, содержащихся в них. Эта особенность свойственна также некоторым эухроматнческим районам с высоко функционально дифференцированными генами. Будучи спирализованными в стадии интерфазного ядра, эухроматические районы становятся также генетически неактивными.
Гетерохроматизация — универсальный механизм генетической инактивации хромосомных участков независимо от того, относятся ли они к гетерохроматическим или к эухроматнческим районам. Следовательно, хромоцентры, обнаруживаемые в интерфазном ядре, могут быть образованы как гетерохроматином, так и эухроматином. Одним из таких хромоцентров является Х-хроматин.
Еще Ваrr и Bertram высказали предположение о связи феномена Х-хроматина с Х-хромосомами. С тех пор Х-хромосомная природа Х-хроматина подтверждена и уточнена данными многочисленных исследователей.
Х-хроматин образован одной из Х-хромосом женской клетки, находящейся в гетерохроматизированном состоянии. Будучи спирализованной, эта хромосома генетически неактивна. В разных клетках сомы у женских особей, по принципу случайности, Х-хроматнн образует Х-хромосома, полученная либо от отца, либо от матери. Следовательно, клетки женского организма мозаичны по функции Х-хромосомы: в одних активна отцовская, в других материнская хромосома. Образование полового хроматина в женских клетках обусловлено генетически.
Это подтверждается тем, что в раннем периоде развития эмбриона человека, когда по виду гонад еще нельзя определить пол, яйцевые оболочки зародыша мужского пола не имеют Х-хроматина, несмотря на воздействие гормонов матери. У зародыша женского пола Х-хроматин появляется на 16-й день развития, когда в эмбрионе насчитывается 2500—5000 клеток.
Ученые разгадали главную «женскую» загадку человеческого генома
МОСКВА, 18 июл – РИА Новости. Генетики выяснили, как «лишняя» женская Х-хромосома сворачивается в так называемое тельце Барра и остается неактивной в организме здоровых женщин и самок млекопитающих, говорится в статье, опубликованной в журнале Proceedings of the National Academy of Sciences.
Одной из главных генетических загадок жизни является то, как организм «узнает» о наличии лишней копии Х-хромосомы и отключает одну из них, превращая ее в так называемое тельце Барра – туго закрученный «сверток» ДНК, хорошо видный под микроскопом.
Мириам Хантли (Miriam Huntley) из Гарвардского университета (США) и ее коллеги выяснили, что заставляет лишнюю Х-хромосому свернуться в клубок и как его формой можно гибко управлять, изучив строение тельца Барра на молекулярном уровне.
Наблюдая за структурой этого клубка ДНК при помощи технологий компьютерного моделирования, ученые выяснили, что нити генома в тельце Барра заплетены в гигантские петли, содержащие в себе десятки миллионов «букв»-нуклеотидов. Если смотреть на этот клубок в трехмерном виде, нити в этих петлях были расположены очень близко друг к другу, несмотря на то, что в «двумерной» проекции их отделяли сотни тысяч и миллионы нуклеотидов.
Для чего нужно тельце барра
Определение половой принадлежности, а также своевременное выявление аномалий полового развития, наследование болезней, сцепленных с полом, представляет огромный интерес не только для врачей разных специальностей, но востребовано и в спорте, судебной медицине [2].
С самого раннего периода развития гистологии и цитологии в ядре были замечены интенсивно окрашивающиеся структуры. Их назвали прохромосомами, хромоцентрами, и считалось, что в этих местах хроматин проявляет положительный гетеропикноз. В настоящее время данные структуры определяются как гетерохроматин, в отличие от слабо окрашивающегося эухроматина. Впервые эти названия были предложены в 1933 году Гейтцем [11]. В 1937 году Гейтлер сообщал о половом ядерном диморфизме у насекомых, наблюдая двойное тело гетерохроматина у женских особей и одинарное тело у мужских особей, предполагая, что открытый им механизм может найти применение при определении пола [11]. Впоследствии, в 1949 году, в журнале «Nature» была опубликована работа Бара и Бертрама, в которой ученые описали морфологические различия в нейронах самок и самцов [4]. Открытие особых образований – глыбок гетерохроматина в интерфазных ядрах соматических клеток (телец Барра) позволило в дальнейшем использовать половой хроматин для решения некоторых диагностических вопросов медицинской генетики. Тельце Барра соответствует одной из двух Х-хромосом в клетках особей женского пола. В клетках у мужчин половой хроматин практически отсутствует, хотя некоторые авторы указывают на обнаружение 2–3 % подобных глыбок [5].
Первоначально для определения полового хроматина применяли биопсию кожи, но вскоре был описан метод исследования мазка слизистой оболочки ротовой полости. Исследование эпителия полости рта – это попытка избежать хирургической биопсии, заменить ее простым методом взятия материала и тем самым расширить возможность клинического применения метода. Так, у женщин-спортсменок проводят половой контроль перед олимпийскими играми [1]. Спортсменки, чей генетический пол не соответствует габитусу, имеющие морфологические признаки мужского соматотипа, имеют преимущество перед женщинами-спортсменками с женским кариотипом [1]. Безусловно, данный метод нашел применение и в медицине. Скрининговый тест, не требующий глобальных материальных затрат, применяется для быстрой диагностики количественных нарушений в половых хромосомах, таких как синдром Шерешевского – Тернера, Клайнфельтера, полисомии Х [7].
В настоящее время все больше и больше авторов придерживаются мнения о том, что половой хроматин все-таки изменяется. Интересны и труднообъяснимы наблюдения Sohval и Casselman, которые установили, что величина и окраска полового хроматина может изменяться под влиянием антибиотиков [9]. Другие исследователи показывают, что в ротовой полости происходит снижение полового хроматина при некоторых видах аллергии, а также при стрессе [12, 15]. У индивидуумов женского пола половой хроматин в ротовой полости снижается при приеме глюкокортикоидов [9, 15]. В опухолях различных локализаций обнаружена четкая обратно пропорциональная зависимость между уменьшением числа ядер с половым хроматином и увеличением митотического индекса [10]. Так, при раке молочной железы значительная часть клеток показала потерю полового хроматина в значительной части клеток опухолей. Положительная корреляция между количеством полового хроматина в клетках и частотой метастазирования опухоли была описана в некоторых работах [6].
Учитывая совершенно противоположные литературные данные по содержанию и изменчивости полового хроматина в ядрах клеток буккального эпителия от 90 % [8] до 28 % [1], мы предприняли попытку определения телец Барра у женщин в онтогенезе, используя различные методы окраски клеток.
Цель исследования – изучить динамику полового гетерохроматина в различные периоды онтогенеза женщины.
Материал и методы исследования
Материалом для настоящего исследования послужили клетки буккального эпителия, полученные при обследовании 100 женщин трех возрастных категорий: I – 18–20 лет, II – 38–55 лет, III – 56–75 лет. Соскоб эпителия производился с внутренней поверхности щеки. Ротовая полость предварительно прополаскивалась 2 % содовым раствором, что несколько уменьшало примесь слизи и микробов к исследуемому материалу. Эпителий слизистой полости рта снимался закругленным стеклом с намеченного места слизистой, выпяченной при надавливании пальцем снаружи. Соскоб слизистой после равномерного распределения по стеклу немедленно фиксировался в смеси равных частей спирта и эфира в течение 24 часов. Препараты окрашивались несколькими способами:
1) крезил-виолетом или по методу Папаниколау;
3) окраской по Фельгену, при фиксации материала в смеси Дэвидсона.
Микроскопирование осуществлялось с использованием светового микроскопа с иммерсионной системой, увеличение х1000 (Микроскоп Carl Zeiss Axioscope A1, камера для документирования AxioCam ICc5). Для более достоверной картины подсчет количества телец Барра проводился в 100 ядрах клеток буккального эпителия.
Результаты исследования и их обсуждение
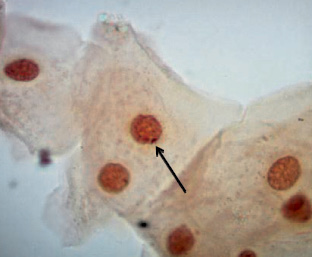
Тельце Барра имеет вид маленькой темной массы овальной формы, примыкающей к внутренней поверхности ядерной оболочки (рисунок). Диаметр такого тельца равен примерно 1 мкм, поэтому его легко увидеть с помощью иммерсионного объектива. Надо заметить, что обнаружить во всех исследуемых ядрах данные структуры нам не удалось.
Иногда ядра клеток здоровых мужчин содержат дискретные массы конденсированного хроматина, которые примыкают к ядерной оболочке и выглядят как тельца Барра. Итак, тельце Барра нельзя увидеть в каждом ядре, в котором оно имеется, и поскольку в ядрах, в которых этих телец нет, иногда можно видеть похожие на них дискретные массы хроматина, заключение о наличии или отсутствии телец Барра нельзя делать на основании беглого осмотра отдельных клеток.
Содержание полового гетерохроматина в I группе (молодые женщины) составило 35,7 ± 3,1 % клеток, во II (женщины среднего возраста) – 33,2 ± 2,5 % клеток, в III (женщины старшей возрастной категории) – 25,75 ± 1,7 % клеток. Следовательно, с возрастом количество Х-полового хроматина у женщин в интерфазных ядрах буккального эпителия уменьшается.
Все процессы, протекающие в организме человека, контролируются генетическим аппаратом клеток. Но механизм специфической активации определенных генов в отдельно взятой клетке или клеточной популяции остается не изученным до конца. Исследование структур интерфазного ядра и специфических изменений в нем дает возможность в какой-то мере судить о супрессии или репрессии генов в зависимости от состояния организма. Возрастные функциональные особенности репродуктивной системы женщин находятся в тесной зависимости от изменений нейроэндокринного гомеостаза, которые регулируются определенными генами. Активность этих генов, в свою очередь, зависит от степени компактизации хромосом и связана с участками гетеро- и эухроматина [5, 9].
Тельце Барра в ядре клетки буккального эпителия женщины. Окраска ацетоорсеином, 1000х
Существование полов, а особенно то обстоятельство, что пол животного задается различиями по половым хромосомам, ставит перед системами регуляции экспрессии генов проблему: если гены, сцепленные с Х-хромосомой, будут экспрессироваться с разными интенсивностями у особей обоих полов, то количество продуктов экспрессии в клетках самки будет в 2 раза больше, чем в клетках самца. Чтобы избежать такой ситуации, существует явление компенсации доз генов [5, 9]. Суть явления состоит в выравнивании интенсивности экспрессии генов, расположенных на Х-хромосоме, между полами. У млекопитающих этот механизм представлен полной инактивацией одной из двух Х-хромосом в женском организме, в результате чего у самок активна только одна Х-хромосома, что эквивалентно ситуации с самцами. Мишенью для регуляции служит вся хромосома в целом, т.е. затрагиваются все промоторы на хромосоме. Хромосома переходит в состояние гетерохроматина [2, 3].
Возможный механизм инактивации Х-хромосомы связан с локусом Xic, где содержится ген, названный Xist. Ген Xist служит матрицей для синтеза Xist РНК (X inactive specific transcript), в которой нет открытых рамок считывания (она не является кодирующей). РНК Xist «обволакивает» данную Х-хромосому, тем самым ее инактивируя. Xist РНК синтезируется на обеих Х-хромосомах, но после инактивации такую РНК дает только неактивная Х-хромосома (где ее и можно встретить). Интенсивность же транскрипции Xist остается прежней, следовательно, перемена состояния хромосомы зависит не от нее, а от каких-то посттранскрипционных событий [11, 14].
Содержимое локуса Xic оказывает свое действие в цис-манере и несет в себе информацию, достаточную для того, чтобы «подсчитать» Х-хромосомы и инактивировать их все, кроме одной (правило n – 1). Правило n – 1 предполагает, что стабилизация РНК Xist происходит по умолчанию и что некий блокирующий механизм предотвращает такую стабилизацию лишь на одной из Х-хромосом, которой предстоит остаться активной. Это означает, что хотя наличие Xic необходимо (и достаточно), чтобы хромосома оказалась инактивирована, для установления активного состояния Х-хромосомы могут быть необходимы продукты других локусов [14].
Инактивация распространяется от Xic по всей Х-хромосоме. Если Xic присутствует в хромосоме-химере, возникшей в результате транслокации между Х-хромосомой и аутосомой, инактивация распространяется и на аутосомные участки (хотя этот эффект не всегда отличается полнотой). У нормальных самок Х-хромосом, конечно же, две, но в тех редких случаях, когда неправильное расхождение хромосом приводит к генотипу с тремя или более Х-хромосомами, активной останется лишь одна из них [13]. Это обстоятельство наводит на общую модель, в соответствии с которой с одной и только одной из Х-хромосом происходит некое особенное событие, охраняющее ее от воздействия инактивирующего механизма, который тем временем применяется по отношению ко всем остальным Х-хромосомам клетки. Для активности же Х-хромосомы необходимо «погасить» на ней экспрессию Xist. Сайленсинг Xist можно предотвратить делецией гена ДНК-метилтрансферазы; скорее всего, эффект обусловлен тем, что метилирование промотора Xist необходимо для прекращения его транскрипции [13]. Таким образом, метилирование ДНК в геноме является специфической формой клеточной памяти (эпигенетическая память), которая играет ключевую роль в развитии благодаря специфическому кодированию генной экспрессии в разных клетках. Несмотря на единый геном клетки организма имеют разные эпигеномы, что обеспечивает дифференциальную экспрессию, разные клеточные фенотипы и функции [2].
Заключение
В самом начале изучения полового хроматина считалось, что процент клеток, содержащих тельца Барра, является постоянным и не изменяется ни под влиянием возраста, ни под воздействием других внутренних или внешних факторов. Тем самым диагностика пола на основании оценки полового хроматина должна быть надежной. Эта точка зрения была основана на многочисленных наблюдениях [1, 7, 15]. Возможно, неизменность полового хроматина можно было бы связать с постоянной пропорцией клеток в организме, содержащих и не содержащих половой хроматин. Это означает, что каждая ткань имеет свой процент содержания полового хроматина, чему пока нет доказательств.
Удивительно низкие результаты получаются с эпителием ротовой полости, несмотря на то, что исследуемым материалом служат мазки, т.е. целые клетки. Число ядер, в которых присутствует гетерохроматин, зависит от степени пролиферации клеток в различных тканях, в частности в клетках буккального эпителия, а также от гормонального статуса организма. Можно предположить, что угасание функции половых желез посредством определенных факторов приводит к частичной деконденсации факультативного хроматина в некоторых клетках с целью усиления экспрессии генов Х-хромосомы для поддержания уровня гормонов в женском организме.
Рецензенты:
Матвеева Н.Ю., д.м.н., профессор, зав. кафедрой гистологии, эмбриологии и цитологии, ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Министерства здравоохранения РФ, г. Владивосток;
Калиниченко С.Г., д.м.н., ст. научный сотрудник, ЦНИЛ ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Министерства здравоохранения РФ, г. Владивосток.
Для чего нужно тельце барра
Хромосомные заболевания — это клинические состояния, обусловленные нарушением числа или структуры хромосом.
Если первоначально хромосомная этиология была установлена для ряда довольно распространенных клинически очерченных синдромов (синдром Дауна, Клайнфельтера, Шерешевского — Тернера), то в настоящее время разработка клинических вариантов хромосомных аномалий идет не от клинической картины к этиологии, а от этиологии к клинической картине. Развитие цитогенетики позволяет дифференцировать все большее и большее число хромосомных нарушений, а клиницисты имеют возможность тщательно изучать клинические проявления, сопутствующие этим перестройкам, и выделять комплексы аномалий, более или менее характерные для различных хромосомных нарушений.
К настоящему времени описано уже несколько десятков клинически различающихся хромосомных синдромов, и процесс этот продолжается [Бочков Н. П., 1978].
Наиболее характерными клиническими проявлениями аутосомных аномалий являются признаки психического и физического недоразвития, дисплазии и более грубые врожденные аномалии развития (пороки). При заболеваниях, обусловленных нарушениями в системе половых хромосом, слабоумие не является обязательным признаком. Для этих нарушений, как правило, более характерны недоразвитие половых желез и аномалии развития вторичных половых признаков.
Различные хромосомные аберрации встречаются с разной частотой. По сводным данным многих исследований, распространенность наиболее частых хромосомных аберраций среди новорожденных следующая: 21-трисомия (синдром Дауна) — 1:700; XXX (трисомия Х) — 1:1000 (девочки); XYY (синдром дубль- Y) — 1:1000 (мальчики); XXY (синдром Клайнфельтера) — 1:1400 (мальчики); ХО (синдром Шерешевского — Тернера) — 1:3300 (девочки); 46.5р (синдром «кошачьего крика») — 1:4000; 18-трисомия (синдром Эдвардса) — 1:6800; 13-трисомия (синдром Патау) — 1:7600.
Наиболее часто встречаются изменения модального числа хромосом. Это отсутствие в хромосомном наборе какой-либо хромосомы (моносомия) или появление добавочной хромосомы (трисомия, тетрасомия и т. д.). Примером таких аномалий являются хорошо известные клиницистам четко очерченные клинические синдромы — синдром Дауна (21-трисомия), синдром Эдвардса (18-трисомия), синдром Патау (13-трисомия), синдром Клайнфелтера (XXY), синдром Шерешевского — Тернера (ХО). К другим хромосомным аберрациям относятся такие нарушения, при которых общее число хромосом может оставаться нормальным, а изменяется структура самой хромосомы: транслокации (обмен сегментами между хромосомами), делеции (отсутствие части хромосомы), кольцевые хромосомы и т. д. Число возможных перестроек практически неисчислимо. К 1977 г. в специальном международном банке, куда стекаются данные о выявленных вариантах хромосомных аберраций, насчитывалось 161 836 вариантов аномалий [ Borgaunkar С., 1978].
Причины возникновения хромосомных аберраций пока еще недостаточно изучены. К факторам, способствующим возникновению хромосомных аберраций, относят ионизирующую радиацию, тяжелые инфекции и интоксикации, эндокринные нарушения, психические травмы, воздействие ряда химиопрепаратов и некоторых физиотерапевтических методов лечения. Наиболее точно установленным является возраст родителей, особенно матерей. Важную роль в возникновении хромосомных синдромов играет факт скрытого носительства хромосомных нарушений у родителей (сбалансированные транслокации, мозаицизм).
Перспективным методом профилактики хромосомной патологии является антенатальная диагностика, т. е. исследование клеток амниотической жидкости на 16—18-й неделе беременности или клеток хориона в более ранние сроки. Внедрение антенатальной диагностики в широкую практику с охватом контингентов повышенного риска позволит значительно сократить частоту рождения детей с хромосомными заболеваниями, в первую очередь с болезнью Дауна.
Синдром Дауна. Заболевание впервые описано L. Down в 1866 г. Частота болезни Дауна среди новорожденных составляет в среднем 1:700.
Клинические проявления характеризуются выраженной умственной отсталостью, сочетающейся с типичными аномалиями строения, которые делают больных поразительно похожими друг на друга. Заболевание распознается уже при рождении. Дети рождаются с низкой массой тела, слабо кричат, плохо сосут. Рост ниже нормы, отмечаются непропорциональность коротких конечностей и относительно длинного туловища, своеобразное строение черепа и лица. Череп микробрахицефальной конфигурации со скошенным затылком. Ушные раковины обычно небольших размеров, деформированные, низко расположенные. Характерны косой разрез глаз с кожной складкой во внутреннем углу (эпикант), наличие участков депигментации на периферии радужки. Нос короткий с широкой уплощенной переносицей. Часто отмечаются недоразвитие верхней челюсти, прогнатизм, неправильный рост зубов, высокое «готическое» небо. Язык вследствие гипертрофии сосочков увеличен, имеет складчатую поверхность. К типичным признакам относятся также аномалии строения конечностей: кисть плоская, пальцы широкие, короткие, укороченный искривленный кнутри мизинец. Часто бывает выражена поперечная ладонная борозда. На стопах увеличен промежуток между I и II пальцами, иногда наблюдается синдактилия. В более старшем возрасте к характерным внешним проявлениям заболевания относятся своеобразная осанка, опущенные плечи, неуклюжая походка, неловкие движения.
Почти у 50 % больных обнаруживаются пороки сердечно-сосудистой системы и других внутренних органов. Во всех случаях отмечаются нарушения эндокринной системы: недоразвитие половых желез и вторичных половых признаков, снижение основного обмена, ожирение. Следствием этого часто являются сухость и шелушение кожи, ломкость ногтей, волос, участки облысения. У пациентов с синдромом Дауна обнаружена также повышенная частота лейкозов.
При дерматоглифике в большинстве случаев отмечаются характерные изменения рисунка кожного рельефа: непрерывная кожная поперечная складка ладони, наличие одной сгибательной складки на мизинце вместо двух, увеличение числа ульнарных петель, увеличение угла atd (превышающего 57°).
Неврологически при болезни Дауна обычно выявляются мышечная гипотония, слабость конвергенции, косоглазие, нарушения вестибулярного аппарата, признаки вегетативной недостаточности. У 9—10 % больных наблюдается судорожный синдром.
Умственная отсталость является постоянным признаком: в 75 % случаев она достигает степени имбецильности, в 20 % — идиотии и только в 5 % — дебильности [Сухарева Г. Е., 1965]. Резко страдают активное внимание, смысловая память.
Большинство детей с болезнью Дауна не способны к обучению даже по программе вспомогательной школы. В структуре психического недоразвития имеется определенное своеобразие. У большинства больных отмечаются позднее появление и резкое недоразвитие речи: недостаточное понимание, бедный запас слов, дефект звукопроизношения в виде своеобразной дизартрии. Особенностью психического дефекта является относительная живость и сохранность эмоциональной сферы по сравнению с тяжестью интеллектуального недоразвития. Больные большей частью ласковы, добродушны, послушны. Им не чужды чувства симпатии, смущения, стыда, обиды, хотя иногда они бывают раздражительными, упрямыми. Большинство из них любопытны и обладают хорошей подражательной способностью, что служит привитию навыков самообслуживания и несложных трудовых процессов. Однако, как правило, дети с болезнью Дауна не достигают удовлетворительного уровня социальной адаптации и нуждаются в постоянной опеке. Им может быть оформлена инвалидность детства с момента точной диагностики заболевания.
Особенностью возрастной динамики болезни Дауна является позднее половое созревание и раннее появление признаков инволюции (в 30—40 лет). При инволю ции больные утрачивают приобретенные навыки, у них нарастают бездеятельность, безразличие [Русских В. В., 1963; Benda С., 1960]. Исследования последних лет показали большую частоту раннего развития при синдроме Дауна болезни Альцгеймера. Иногда случаи быстро развивающейся тяжелой деменции наблюдаются и в пубертатном возрасте.
Патогенез. Заболевание обусловлено наличием лишней 21-й хромосомы. При цитогенетическом исследовании выявляются три варианта аномалий кариотипа: регулярная трисомия, мозаицизм и несбалансированная транслокация.
При регулярной трисомии, составляющей около 95 % всех случаев болезни Дауна, в кариотипе имеется 47 хромосом. Риск повторного рождения ребенка с болезнью Дауна при трисомии очень ненамного превышает популяционный риск и увеличивается с возрастом родителей. A. Stivenson, B. Davison (1972) приводят следующие данные о величине риска при разном возрасте матерей: если у женщин до 30 лет частота рождения ребенка с болезнью Дауна составляет 1 на 500, то в возрасте 44 года и выше эта частота равна 1 на 25.
Работами последних лет показано также, что играет роль не только возраст матери, но и возраст отца: частота нерасхождения 21-й хромосомы в сперматогенезе повышается с возрастом, как и в овогенезе [Stene J., 1976].
Транслокационные формы болезни Дауна отмечаются в 3,4 % случаев. При этом варианте заболевания общее число хромосом в кариотипе 46, так как дополнительная 21-я хромосома транслоцирована на другую аутосому. При транслокационном варианте синдрома Дауна один из фенотипически здоровых родителей может быть носителем сбалансированной транслокации при нормальном фенотипе. Именно за счет этих форм повышается риск повторного рождения ребенка с болезнью Дауна у молодых матерей. Еще 3—4 % случаев болезни Дауна составляют мозаичные варианты, при которых в организме одновременно обнаруживаются и трисомные, и нормальные клетки.
При морфологических исследованиях обнаруживаются некоторое уменьшение размера и массы мозга, недостаточная дифференциация борозд и извилин, иногда недоразвитие лобных долей, мозжечка и диэнцефальных отделов мозга, малое количество и неправильное расположение ганглиозных клеток коры, нарушение миелинизации. С различным постоянством выявляются изменения в железах внутренней секреции: гипофизе, щитовидной железе, половых железах и в надпочечниках.
Механизмы развития умственной отсталости при синдроме Дауна остаются неясными. Есть работы, свидетельствующие об отрицательной возрастной динамике показателей интеллектуального развития. Так, по данным H. Chen, P. Wooley (1978), обследовавших 96 детей с синдромом Дауна, воспитывающихся дома, до 1 года коэффициент развития составлял в среднем 61 ед., а после 3 лет — 43 ед. Сходные данные приводятся в работе M. Ramsay, M. Piper (1980). Это свидетельствует о влиянии на мозг нарушенного клеточного биохимизма не только в пре-, но и постнатальном периоде. Чрезвычайный интерес в этой связи представляют данные об уменьшении аномального клона клеток у детей с мозаичным вариантом болезни Дауна и параллельном повышении уровня интеллекта [Wilson M. et ah, 1980].
Лечение. Специфических методов лечения болезни Дауна нет. Показано применение общеукрепляющей и стимулирующей терапии (препараты кальция, железа, алоэ, апилак, поливитамины и др.). Из препаратов стимулирующего действия рекомендуется курсовое лечение большими дозами витаминов, глутаминовой кислотой, липоцеребрином, церебролизином, аминалоном, ноотропами в дозах, соответствующих возрасту. При гормональной недостаточности необходимо длительное лечение малыми дозами тиреоидных гормонов. Показано назначение префизона. Очень важна правильная организация педагогического процесса с раннего возраста.
Синдром Шерешевского — Тернера. Синдром описан Н. А. Шерешевским в 1925 г. и H. Turn er в 1938 г. Распространенность его составляет 0,3 на 1000 новорожденных девочек и резко возрастает среди низкорослых женщин с недоразвитием вторичных половых признаков и первичной аменореей.
Клинические проявления синдрома Шерешевского — Тернера могут быть выявлены уже с рождения. Отмечаются малая масса и длина тела, лимфатический отек на кистях и стопах вследствие аномалий развития лимфатических сосудов. На коже нередко имеются витилиго, пигментные пятна, гемангиомы. Шея короткая с избыточной кожей на заднебоковой поверхности, которая примерно у половины больных выступает в виде шейной складки. Нередко обнаруживаются аномалии развития внутренних органов: пороки сердца (коарктация аорты, стеноз легочной артерии), аномалии почек и др.
Врожденные аномалии строения придают больным своеобразный вид — так называемое лицо сфинкса (антимонголоидный разрез глаз, эпикант, низкое расположение ушей, короткая и широкая шея с низким уровнем роста волос). Отмечаются также нарушения строения скелета: деформация грудной клетки, широкая ладонь, клинодактилия мизинцев, укорочение пальцев с поперечной исчерченностью ногтей, валыусное положение коленных суставов, деформация стоп, реже синдактилия и полидактилия. Нередко обнаруживаются сращение и укорочение позвонков и spina bifi da.
С возрастом появляется значительное отставание в росте, который у взрослых больных, как правило, не превышает 150 см. Нарастают диспропорции телосложения: преобладание верхней части туловища, широкие плечи, узкий таз, укорочение нижних конечностей. Строение тела девочек приближается к мужскому.
В препубертатном и пубертатном возрасте выявляются признаки полового инфантилизма. Наружные половые органы недоразвиты, иногда отмечается гипертрофия клитора. Молочные железы не развиты. Оволосение лобка и подмышечных впадин отсутствует или скудное. Патогномоничным признаком являются аномалии строения внутренних половых органов и гонадальный дисгенез. Один из важных признаков заболевания — первичная аменорея. Однако у некоторых больных могут отмечаться редкие и скудные менструации. В пубертатном периоде обнаруживаются повышенное содержание гонадотропинов и снижение уровня эстрогенов.
Неврологически при синдроме Шерешевского — Тернера патологических симптомов обычно не выявляется. При рентгенологическом исследовании отмечаются задержка окостенения, нарушение слияния эпифизов с метафазами, остеопороз трубчатых костей. На электроэнцефалограмме нередко наблюдаются признаки задержки коркового электрогенеза, дизритмия.
Умственное недоразвитие выявляется у незначительной части больных: чаще оно выражено нерезко, но изредка достигает степени имбецильности. Обычно больные трудолюбивы и благодушны. Описан своеобразный инфантилизм со склонностью к домовитости, стремлением опекать и поучать младших. У многих больных с возрастом появляются критика к своему состоянию и переживание дефекта: они становятся более замкнутыми, раздражительными, склонны к невротическим реакциям [Райская М. М., 1968; Давиденкова Е. Ф., 1973, и др.].
Диагноз может быть заподозрен клинически и окончательно ставится при цитогенетическом исследовании. В типичных случаях в хромосомном наборе больных выявляется 45 хромосом (45/ХО) — 22 пары аутосом и только одна Х-хромосома. Но могут выявляться мозаичные варианты, в том числе и сложные формы мозаицизма (45, ХО/46, XY; 45, ХО/47, XYY). Экспресс-диагностика показывает отсутствие или очень низкий процент полового хроматина (телец Барра) в клетках слизистой оболочки щеки. Существует так называемый хроматинположительный тернеровский фенотип, а также «синдром Тернера у лиц мужского пола». В этих случаях речь идет о другом синдроме со сходным фенотипом — синдроме Ульриха—Нунан, который имеет аутосомно-доминантный тип наследования.
Лечение при синдроме Шерешевского — Тернера состоит в применении гормональных препаратов (эстрогенов) в пубертатном возрасте.
Синдром Клайнфелтера. Этот синдром (47, XXY) впервые описан H. Klinefelter, E. Reifenstein, F. Abbright в 1942 г. Его частота в мужской популяции составляет в среднем 0,2 %, среди умственно отсталых — 1—2 %, а среди мертворожденных — 3,4 % [Бочков Н. П., 1966; Бадалян Л. О. и др., 1971; Марничева Г. С., 1971; Давиденкова Е. Ф., Либерман И. С., 1975].
Клинические проявления синдрома Клайнфелтера очень варьируют от внешне нормального физического и интеллектуального развития до выраженного евнухоидизма и глубокой дебильности. В ряде случаев уже в раннем возрасте отмечаются отдельные симптомы своеобразия физического развития: узкий и низкий лоб, густые и жесткие волосы, узкая плоская грудная клетка, высокое стояние таза, недоразвитие половых органов, евнухоидные пропорции. Однако, как правило, типичные симптомы заболевания отчетливо начинают обнаруживаться в пубертатном возрасте. Для фенотипа больных характерны высокий рост, астеническое сложение, узкие плечи, удлиненные конечности, слаборазвитая мускулатура. Примерно у 50 % больных отмечаются гинекомастия и евнухоидные признаки, скудная растительность на лице и в подмышечных впадинах, широкий таз, ожирение и оволосение на лобке по женскому типу. Выделяются два типа телосложения: для одних больных характерен высокий рост и астенические черты телосложения, для других — евнухоидные пропорции и гинекомастия, которая может быть одно- или двусторонней. Постоянные признаки синдрома Клайнфелтера — недоразвитие половых органов и бесплодие. В неврологическом статусе иногда имеются мышечная гипотония и диэнцефально-вегетативные расстройства, в том числе приступообразные. У многих больных наблюдается моторная недостаточность.
Умственное недоразвитие встречается примерно у 25 % больных, чаще оно выражено нерезко, но в отдельных случаях достигает степени значительной дебильности и выявляется уже в раннем детском возрасте. В качестве особенностей структуры интеллектуального дефекта в детском возрасте у большинства больных можно отметить сочетание интеллектуальной недостаточности с глубокой незрелостью эмоционально-волевой сферы, которая приближается к психическому инфантилизму. У этих больных наряду с недостаточностью внимания, восприятия, памяти и абстрактного мышления более резко и рельефно обнаруживаются чрезмерная внушаемость, подражательность, подчиняемость, несамостоятельность, чрезмерная привязанность к близким, нередко с элементом назойливости. Настроение обычно повышенное, с эйфорическим оттенком, имеет тенденцию к беспричинным колебаниям, иногда отмечается склонность к эксплозивным аффективным вспышкам. У этих больных выявляются недостаточное чувство долга, ответственности, активности, а также неспособность к длительному волевому усилию и напряженной деятельности. Эти особенности эмоционально-волевой сферы как бы выступают на первый план в структуре дефекта и утяжеляют общую клиническую картину психического недоразвития.
При легкой форме психического недоразвития с началом обучения в школе и особенно в пубертатном и постпубертатном возрасте у больных часто появляется сознание своей неполноценности, которое становится источником внутреннего конфликта. Начинает преобладать гипотимный фон настроения, нередко с раздражительностью, легко возникают невротические и патохарактерологические реакции. В литературе также описываются случаи синдрома Клайнфелтера с депрессивными, ипохондрическими, навязчивыми, нарколептическими и шизофреноподобными расстройствами [Райская М. М., 1972; Forssman H., Hambert G., 1963].
При электроэнцефалографическом исследовании у больных выявляются задержки формирования основных корковых ритмов, преобладание медленных высокоамплитудных колебаний в передних отделах коры.
Лечение. Специфического лечения не существует. В качестве симптоматической терапии применяют гормональные препараты (прогестерон, эстрадиола пропионат, тестостерона пропионат и др.), которые влияют на усиление проявлений вторичных половых признаков. В комплекс лечебных мероприятий входит медикаментозная терапия психических нарушений, а также рациональная психотерапия для устранения вторичных невротических и патохарактерологических реакций.
Трисомия-Х. Трисомия-Х впервые описана P. Jacobs и соавт. в 1959 г. Частота трисомии-Х составляет среди новорожденных девочек и женщин 1:1000 (0,1 %), а среди умственно отсталых — 0,59 % [Давиденкова Е. Ф., Либерман И. С., 1975]. Большинство девочек и женщин с трисомией-Х выявлены среди больных психиатрических больниц.
Трисомию-Х иногда называют синдромом трипло-Х, однако это не является обоснованным: трисомия-Х не обусловливает четкого постоянного симптомокомплекса.
Клинические проявления весьма полиморфны, а у части пациентов с трисомией-Х вообще не обнаруживается каких-либо отклонений в физическом и психическом развитии. Вместе с тем одним из частых проявлений трисомии-Х является неглубокая умственная отсталость, которая отмечается у 75 % больных [Давиденкова Е. Ф., Либерман И. С., 1975]. Особое внимание привлекает частота заболевания шизофренией [Филиппов Ю. И., 1971; Raphael Т., Sha w M., 1963].
У многих больных с трисомией-Х наблюдаются задержка физического развития, негрубые диспластические признаки: эпикант, высокое твердое небо, клинодактилия мизинцев. Реже встречаются больные высокого роста. У некоторых пациентов отмечается бесплодие, обусловленное недоразвитием фолликулов.
Диагноз ставят только при цитогенетическом исследовании: выявляют 47 хромосом (47, XXX) и двойной половой хроматин. Описано также много случаев так называемой полисомии-Х: тетрасомия (ХХХХ) и пентасомия (ХХХХХ) с соответствующим увеличением количества телец полового хроматина. В этих случаях степень психического недоразвития выражена грубее и коррелирует с количеством дополнительных Х-хромосом.
Синдром XYY характеризуется кариотипом 47, XYY. Он впервые описан в 1960 г. Частота синдрома по среднестатистическим данным составляет среди новорожденных около 1:1000. Иногда приводятся значительно более высокие данные— 1:250 [Segrovich F. et al., 1969].
Лечение. Специфического лечения не существует. Проводят симптоматическую, в частности седативную, терапию. Основное же значение имеет коррекционно-воспитательная работа, а в более старшем возрасте — рациональная психотерапия.
Синдром «лицо эльфа» (идиопатическая инфантильная гиперкальциемия, синдром Вильямса, синдром Вильямса — Бойрена). Впервые синдром был описан G. Fanconi и соавт. в 1952 г. у 2 детей раннего возраста из неродственных семей. У больных отмечались высокий уровень кальция в сыворотке крови (16—18 ммоль/л), специфическое лицо, порок сердца и умственная отсталость. Частота заболевания 1 на 20 тыс. рождений. Поражаются оба пола.
Клиническая картина характеризуется выраженным своеобразием. Прежде всего обращает на себя внимание специфическое лицо: полные отвислые щеки, плоское переносье с однотипной для всех больных закругленной формой носа, большой рот с полными губами, особенно нижней, сходящееся косоглазие, эпикант, низко посаженные уши, выступающий затылок. Очень характерна отечность верхних и нижних век. Глаза, как правило, голубые с характерной искрящейся «звездчатой» радужкой, склеры синеватого цвета. Имеется стойкое содружественное косоглазие. Отмечается также мышечная гипотония и связанные с ней изменения скелета; опущенные плечи, впалая грудь, круглая спина, Х-образные ноги, плоскостопие. Часто встречаются паховая и пупочная грыжи, иногда врожденный вывих бедра. Для старших детей характерны длинные, редкие зубы. В большинстве случаев при выслушивании сердца определяется грубый систолический шум. Диагностируются врожденные пороки сердца, наиболее часто надклапанный стеноз аорты, стеноз легочной артерии, иногда оба порока одновременно. Описаны и другие пороки. Голос у больных низкий и хрипловатый.
Длина и масса тела детей отстают во все возрастные периоды; рождаются они также со сниженной массой тела.
С возрастом лицо больных несколько меняется: появляется массивность надбровных дуг, меньше выражена пастозность лица, нет плоского переносья и эпиканта. Обращает на себя внимание увеличенное расстояние от основания носа до верхней губы.
Рентгенография во многих случаях дает возможность выявить костные изменения: более плотные стенки орбит, зоны уплотнения в метафизах трубчатых костей. Иногда можно отметить уменьшение тени аорты, гипертрофию левого желудочка. Неврологически постоянно отмечаются мышечная гипотония, особенно выраженная в раннем возрасте, и гиперрефлексия с расширенной рефлексогенной зоной. Изменения на ЭЭГ неспецифичны. Степень интеллектуального дефекта обычно довольно значительна, однако бывают случаи более легкой интеллектуальной недостаточности, средние IQ=56 с колебаниями от 40 до 80 [Jo nes К., 1998].
Можно отметить большое сходство психопатологической картины дефекта у всех больных при значительном снижении интеллекта речь у детей довольно хорошая, больные имеют относительно большой словарный запас, очень словоохотливы, склонны к подражанию Вместе с тем всегда страдают пространственные представления, организация и планирование деятельности. Очень характерны и постоянны особенности личности этих детей: добродушие, приветливость, послушание. Практически всегда имеется хороший музыкальный слух даже при выраженном интеллектуальном дефекте. Судорожный синдром практически не встречается. Нередко выявляются неврозоподобные нарушения — энурез, страхи, навязчивые действия. Характерно, что практически не наблюдается такая форма неврозоподобных расстройств, как заикание, что коррелирует с хорошим развитием речи, большим словарным запасом, легким усвоением речевых штампов, большой словоохотливостью. При данном поражении отсутствует также психопатоподобный синдром, хотя в пубертатном возрасте иногда отмечаются аффективные реакции дисфорического характера.
Некоторые больные могут учиться во вспомогательной школе, они овладевают чтением и письмом, но им недоступны действия, связанные с организацией даже простейших трудовых операций.
Диагноз в большинстве случаев сложностей не представляет: он основан на большой специфичности клинической картины.
Патологоанатомические данные свидетельствуют о диффузном поражении сосудов: отмечается кальцификация крупных артериальных стволов, почечных клубочков, общей капиллярной сети. В ткани мозга находят локальные изменения цитоархитектоники коры, которые коррелируют с особенностями интеллектуального дефекта [Galaburda A. et al., 1994].
Этиология и патогенез. Этиология синдрома долго оставалась неясной: большинство случаев были спорадическими, хотя описывались и единичные семьи с передачей заболевания от родителей к ребенку. В последние годы новые методики молекулярно-генетических исследований позволили выявить при этом синдроме микроделецию в длинном плече хромосомы 7 (7ql l.23). Один из вовлеченных в данную патологию генных локусов вызывает нарушение продукции эластина—важного вещества соединительной ткани [Ewart A. R. et al., 1993].
Лечение. Специфической терапии не существует. Поэтому основное место занимают симптоматическое лечение и коррекционно-воспитательная работа.