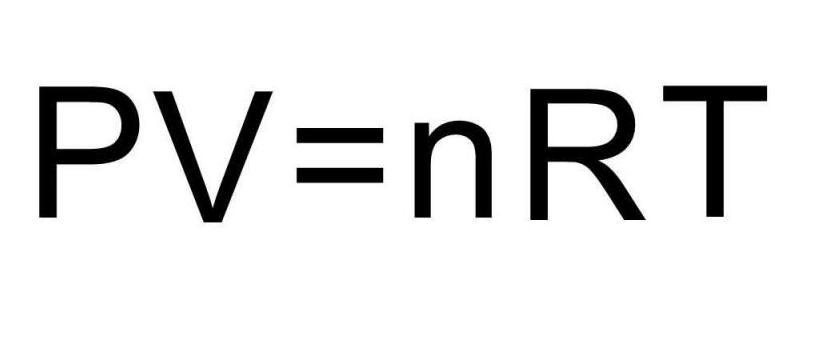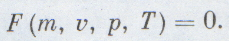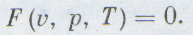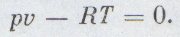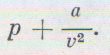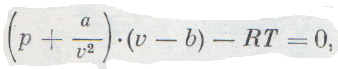Для чего нужно уравнение состояния
Для чего нужно уравнение состояния?
Знать уравнение состояния необходимо при исследовании тепловых явлений. Оно позволяет полностью или частично ответить сразу на три группы различных вопросов.
1. Уравнение состояния позволяет определить одну из величин, характеризующих состояние, например температуру, если известны две другие величины. Это, например, используют в термометрах.
2. Зная уравнение состояния, можно сказать, как протекают в системе различные процессы при определенных внешних условиях: например, как будет меняться давление газа, если увеличивать его объем при неизменной температуре, и т. д. Этому посвящен следующий параграф.
3. Наконец, зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной: R=8,314
Для закрепления материала предлагаю вам

10.1. В стальном баллоне объемом 40 л находится водород под давлением 60 атм и температуре 25 °С. Сколько молей водорода в баллоне? Сколько граммов? Какой объем займет водород из баллона при н.у.?
10.2. В замкнутом сосуде объемом 1 л, из которого откачан воздух, нагрели образец известняка CaCO3, который разлагается по уравнению: CaCO3 = CO2 + CaO. После того, как сосуд остыл до 20 о С, давление в нем составило 2,4 атм. Какова была масса образца CaCO3, если он разложился полностью? Объемом твердых веществ в сосуде можно пренебречь.
10.3. В химической реакции, проводимой в замкнутом сосуде, из которого откачан воздух, должно образоваться 2,24 л кислорода (н.у.). Каким нужно выбрать объем сосуда, чтобы при температуре 30 о С давление в нем не превысило
Дата добавления: 2015-07-11 ; просмотров: 739 | Нарушение авторских прав
Уравнение состояния идеального газа и смысл абсолютной температуры
Каждый человек в течение своей жизни сталкивается с телами, которые находятся в одном из трех агрегатных состояний вещества. Самым простым для изучения агрегатным состоянием является газ. В статье рассмотрим концепцию идеального газа, приведем уравнение состояния системы, а также уделим некоторое внимание описанию абсолютной температуры.
Газовое состояние вещества
Каждый школьник хорошо представляет, о каком состоянии материи идет речь, когда слышит слово «газ». Под этим словом понимают тело, которое способно занимать любой предоставленный ему объем. Оно не способно сохранять форму, поскольку не может сопротивляться даже самому незначительному внешнему воздействию. Также газ не сохраняет и объем, что его отличает не только от твердых тел, но и от жидкостей.

Как и жидкость, газ является текучей субстанцией. В процессе движения твердых тел в газах последние препятствуют этому движению. Появившуюся силу называют сопротивлением. Ее величина зависит от скорости движения тела в газе.
Яркими примерами газов является воздух, природный газ, который используется для отопления домов и приготовления пищи, инертные газы (Ne, Ar), которыми заполняют рекламные трубки тлеющего разряда, или которые используют для создания инертной (неагрессивной, защитной) среды при сварке.
Идеальный газ

Прежде чем переходить к описанию газовых законов и уравнения состояния, следует хорошо разобраться с вопросом, что собой представляет идеальный газ. Это понятие вводится в молекулярно-кинетической теории (МКТ). Идеальным называется любой газ, который удовлетворяет следующим характеристикам:
Естественно, что любой газ является не идеальным, а реальным. Тем не менее, для решения многих практических задач указанные приближения являются вполне справедливыми и ими можно пользоваться. Существует общее эмпирическое правило, которое гласит: независимо от химической природы, если газ имеет температуру выше комнатной и давление порядка атмосферного или ниже, то его с высокой точностью можно считать идеальным и применять для его описания формулу уравнения состояния идеального газа.
Закон Клапейрона-Менделеева
Переходами между различными агрегатными состояниями вещества и процессами в рамках одного агрегатного состояния занимается термодинамика. Давление, температура и объем являются тремя величинами, которые однозначно определяют любое состояние термодинамической системы. Формула уравнения состояния идеального газа объединяет в единое равенство все три указанные величины. Запишем эту формулу:
Другие формы записи уравнения
Выше мы записали уравнение состояния идеального газа Менделеева-Клапейрона в общепринятом и удобном виде. Однако в задачах по термодинамике часто может потребоваться несколько иной вид. Ниже записаны еще три формулы, которые непосредственно следуют из записанного уравнения:
Эти три уравнения также являются универсальными для идеального газа, только в них появляются такие величины, как масса m, молярная масса M, плотность ρ и число частиц N, которые составляет систему. Символом kB здесь обозначена постоянная Больцмана (1,38*10-23 Дж/К).
Закон Бойля-Мариотта
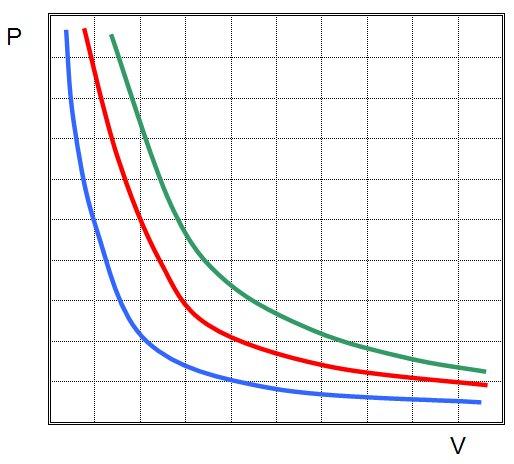
Когда Клапейрон составлял свое уравнение, то он основывался на газовых законах, которые были открыты экспериментально несколько десятилетий ранее. Одним из них является закон Бойля-Мариотта. Он отражает изотермический процесс в закрытой системе, в результате которого изменяются такие макроскопические параметры, как давление и объем. Если положить T и n постоянными в уравнении состояния идеального газа, газовый закон тогда примет вид:
Это и есть закон Бойля-Мариотта, который говорит о том, что произведение давление на объем сохраняется во время произвольного изотермического процесса. При этом сами величины P и V изменяются.
Если изображать график зависимости P(V) или V(P), то изотермы будут представлять собой гиперболы.
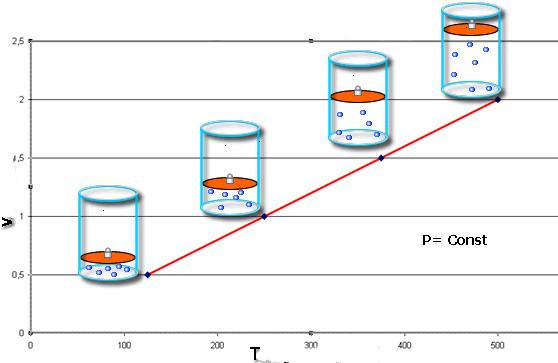
Законы Шарля и Гей-Люссака
Эти законы математически описывают изобарный и изохорный процессы, то есть такие переходы между состояниями газовой системы, при которых сохраняются давление и объем, соответственно. Закон Шарля математически можно записать следующим образом:
V/T = const при n, P = const.
Закон Гей-Люссака записывается так:
P/T = const при n, V = const.
Если оба равенства представить в виде графика, то мы получим прямые линии, которые под некоторым углом наклонены к оси абсцисс. Такой вид графиков говорит о прямой пропорциональности между объемом и температурой при постоянном давлении и между давлением и температурой при постоянном объеме.
Отметим, что все три рассмотренных газовых закона не принимают во внимание химический состав газа, а также изменение его количества вещества.
Абсолютная температура
В быту мы привыкли пользоваться температурной шкалой Цельсия, поскольку она является удобной для описания окружающих нас процессов. Так, вода кипит при температуре 100 oC, а замерзает при 0 oC. В физике эта шкала оказывается неудобной, поэтому применяют так называемую абсолютную шкалу температур, которая была введена лордом Кельвином в середине XIX века. В соответствии с этой шкалой температура измеряется в Кельвинах (К).
Помимо приведенного выше физического смысла абсолютной температуры, существуют другие подходы к пониманию этой величины. Одним из них является упомянутый газовый закон Шарля. Запишем его в следующей форме:
Последнее равенство говорит о том, что при определенном количестве вещества в системе (например, 1 моль) и определенном давлении (например, 1 Па) объем газа однозначно определяет абсолютную температуру. Иными словами, возрастание объема газа при указанных условиях возможно только за счет увеличения температуры, а уменьшение объема свидетельствует об уменьшении величины T.
Напомним, что в отличие от температуры по шкале Цельсия, абсолютная температура не может принимать отрицательные значения.
Принцип Авогадро и газовые смеси
Помимо изложенных выше газовых законов, уравнение состояния для идеального газа также приводит к открытому Амедео Авогадро в начале XIX века принципу, который носит его фамилию. Этот принцип устанавливает, что объем любого газа при постоянных давлении и температуре определяется количеством вещества в системе. Соответствующая формула выглядит так:
n/V = const при P, T = const.
Записанное выражение приводит к известному в физике идеальных газов закону Дальтона для газовых смесей. Этот закон гласит, что парциальное давление газа в смеси однозначно определяется его атомной долей.
Пример решения задачи
В закрытом сосуде с жесткими стенками, содержащем идеальный газ, в результате нагревания давление увеличилось в 3 раза. Необходимо определить конечную температуру системы, если ее начальное значение было равно 25 oC.
Сначала переведем температуру из градусов Цельсия в Кельвины, имеем:
T = 25 + 273,15 = 298,15 К.
Поскольку стенки сосуда являются жесткими, то процесс нагревания можно считать изохорным. Для этого случая применим закон Гей-Люссака, имеем:
Таким образом, конечная температура определяется из произведения отношения давлений и начальной температуры. Подставляя в равенство данные, получаем ответ: T2 = 894,45 К. Эта температура соответствует 621,3 oC.
Уравнение состояния вещества
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
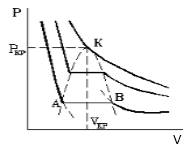
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
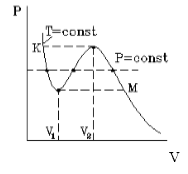
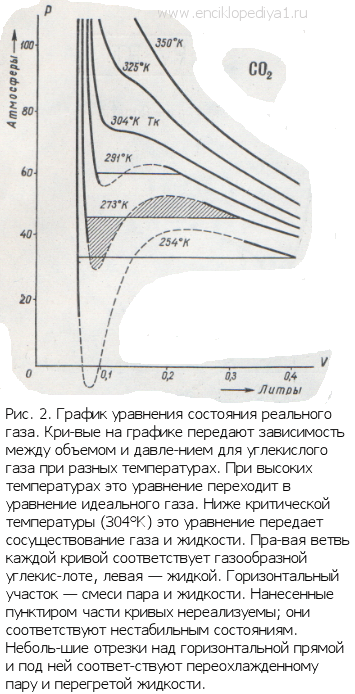
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Из уравнения Ван-Дер-Ваальса имеем:
Для идеального газа:
Уравнение состояния
И химику, и теплотехнику, и физику, и конструктору новых космических кораблей мало знать общие закономерности поведения системы вообще. Им нужно рассчитывать совершенно конкретные задачи: один хочет знать, с помощью какой химической реакции он сможет получить новое соединение дешевле и проще; другому необходимо еще более повысить коэффициент полезного действия у двигателя; физик, например, мечтает достичь настолько высоких температур, чтобы можно было осуществить начало термоядерной реакции; космонавтам необходимы еще более тяжелые космические корабли, и им нужно новое топливо, еще более мощное и с большим тяговым усилием.
Это примеры очень важных, имеющих огромное значение процессов, в них принимают участие определенные реальные вещества. И свойства этих веществ должны входить в термодинамические расчеты.
Для этого нужно знать уравнение состояния вещества. Его нельзя получить при помощи термодинамики. Оно должно быть найдено другим, независимым путем — либо точными измерениями, либо теоретически.
Уравнение состояния необходимо термодинамике знать заранее, без него она ничего не может рассчитать. Оно позволяет рассчитать для определенного вещества любую из четырех важнейших величин — количество вещества (т), его объем (v), давление (р) или температуру (Т), если известны три остальные величины:
Удобнее рассматривать всегда один моль газа, тогда уравнение состояния будет проще:
Каждый школьник знает уравнение состояния идеальных газов, его вывел впервые петербургский профессор француз Клапейрон:
Такое допущение определяет область, в которой применяется это уравнение: при низком давлении газ занимает настолько большой объем, что объемом самих молекул можно смело пренебречь, а при высокой температуре молекулы обладают такой большой энергией и такой большой скоростью, что взаимное притяжение не влияет на их движение.
Конечно, в действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением. 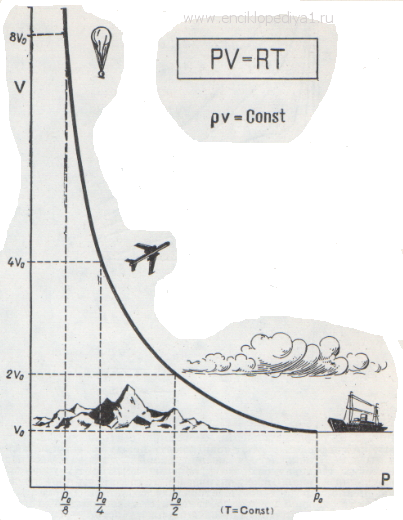
Эти поправки ввел в уравнение идеального газа голландский ученый Ван-дер-Ваальс. Он предложил уравнение
Таким образом, в совокупности свойств, характеризующих состояние системы, нельзя
произвольно менять значения всех свойств. Эти значения связаны между собой уравнением. Уравнение состояния обязательно нужно знать, только при этом условии возможно успешно использовать замечательный математический аппарат термодинамики.
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза |  |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул |  |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы |  |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.