Для чего нужны буферные растворы
Буферный раствор
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 


См. также
Полезное
Смотреть что такое «Буферный раствор» в других словарях:
БУФЕРНЫЙ РАСТВОР — БУФЕРНЫЙ РАСТВОР, раствор, к которому можно добавить умеренное количество сильной кислоты или сильного основания без существенных изменений его рН (кислотности или щелочности). Обычно состоят из смеси либо слабой кислоты с одной из ее солей,… … Научно-технический энциклопедический словарь
Буферный раствор — Раствор с определенной устойчивой концентрацией водородных ионов, представляющий собой смесь слабой кислоты и ее соли или слабого основания и его соли и используемый для воспроизведения и поддержания числовых значений рН в растворах различного… … Словарь-справочник терминов нормативно-технической документации
буферный раствор — buffer буфер, буферный раствор. Pаствор, обеспечивающий сохранение показателя рН (или каких либо других его показателей) на постоянном уровне; Б. широко применяются в большинстве генетических и цитогистологических методик, имеющих дело с жидкими… … Молекулярная биология и генетика. Толковый словарь.
Буферный раствор — Buffer Буферный раствор. (1) Вещество, которое при добавлении или присутствии имеет тенденцию минимизировать физические и химические эффекты тех или иных количеств материалов в смеси. Часто свойства, оказывающие буферное действие, включают рН,… … Словарь металлургических терминов
буферный раствор — buferinis tirpalas statusas T sritis chemija apibrėžtis Tirpalas, palaikantis tam tikrą pH, redokso potencialą, metalo jono koncentraciją ar kitą terpės charakteristiką. atitikmenys: angl. buffer; buffer solution rus. буфер; буферный раствор… … Chemijos terminų aiškinamasis žodynas
БУФЕРНЫЙ РАСТВОР — поддерживает при изменении состава среды постоянство значения к. л. характеристики, напр. рН (кислотно основной Б. р.) или окислит. восстановит. потенциала (окислит. восстановит. Б. р.). Значение рН кислотно основного Б. р. зависит от… … Химическая энциклопедия
буферный раствор — буферная смесь, буфер … Cловарь химических синонимов I
буферный раствор для корректировки общей ионной силы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN total ionic strength adjustment buffer solution … Справочник технического переводчика
буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС) — 3.6 буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС): Буферный раствор с высокой ионной силой, добавляемый к анализируемому и контрольным растворам для выравнивания их ионной силы. Примечание Для некоторых электродов состав… … Словарь-справочник терминов нормативно-технической документации
Буфер буферный раствор — Буфер, буферный раствор * буфер, буферны раствор * buffer раствор, содержащий смесь слабой кислоты и щелочи, который препятствует изменению концентрации ионов водорода (рН) в растворе при добавлении кислоты или щелочи, а также поддерживает… … Генетика. Энциклопедический словарь
БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЕ РАСТВОРЫ (буферные смеси, буферы) — растворы, содержащие буферные системы и обладающие вследствие этого способностью поддерживать pH на постоянном уровне. Б. р. применяются для сохранения активной реакции среды (см.) на определенном неизменном уровне, если тот или иной процесс (напр., выращивание культуры бактерий, проведение ферментативной реакции и т. п.) должен быть проведен при постоянном pH; для определения водородного показателя (см.) — в качестве стандартных растворов с известными и устойчивыми значениями pH и в других случаях лабораторной практики.
Б. р. обычно готовят путем растворения в воде взятых в соответствующих пропорциях слабой кислоты и ее соли, образованной щелочным металлом, частичной нейтрализацией слабой кислоты сильной щелочью или слабого основания сильной кислотой, растворением смеси солей многоосновной кислоты. Величины pH приготовленных таким образом Б. р. незначительно меняются с температурой. Б. р., представляющие собой смеси слабых оснований с их солями, образованными сильными кислотами, ввиду значительной зависимости их pH от температуры, как правило, применяются на практике редко. Общая концентрация компонентов Б. р., употребляемых для практических целей, в большинстве случаев находится в пределах 0,05— 0,2 н. Такого рода Б. р. проявляют буферное действие, если отношение концентраций составляющих их слабых кислот к концентрациям соответствующих солей не меньше 0,1 и не больше 10. Интервал значений pH, в к-ром Б. р. обладает устойчивыми буферными свойствами, лежит в пределах рК±1 (рК — отрицательный десятичный логарифм константы диссоциации слабой кислоты, входящей в состав Б. р., т. е. рК= —lgK). Т. о., для приготовления Б. р., проявляющего буферное действие, напр, в области pH=3—5, следует взять кислоту с рК=4.
СОСТАВ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ БУФЕРНЫХ РАСТВОРОВ, ПРИМЕНЯЕМЫХ В ЛАБОРАТОРНОЙ ПРАКТИКЕ
1. Глициновый буфер Серенсена
Соляная кислота — у
2. Ацетатный буфер Вальполя
Уксусная кислота — х
3. Фосфатный буфер Серенсен
4. Боратный буфер Палича
5. Вероналовый буфер Михаэлиса
Соляная кислота — y
6. Карбонатный буфер Кольтгоффа
Соляная кислота — х
7. Универсальный вероналовый буфер Михаэлиса
Соляная кислота — х
Соляная кислота — х
Количества компонентов, необходимых для приготовления определенного Б. р., рассчитывают по уравнению соответствующей буферной системы или находят с помощью специальной таблицы (см. выше).
При пользовании таблицей следует иметь в виду: В левом вертикальном столбце перечислены наименования Б. р. и их составных частей (x, y).
Во всех горизонтальных рядах, соответствующих тому или иному Б. р., верхняя цифра обозначает искомые значения pH, нижние цифры (или цифра) — объем (в мл) составных частей (части) Б. р. (z, у). Значения х и у соответствуют объемам (в мл) каждого из компонентов Б. р. Напр., для получения Б. р. с pH 1,15 (второй цифровой столбец вверху) следует взять 1,0 мл раствора глицина и 9,0 мл HCl (из расчета приготовления 10,0 мл смеси).
Глициновый буфер Серенсена представляет смесь соответствующих объемов 0,1 М раствора глицина в 0,1 М растворе NaCl и 0,1М раствора HCl. Ацетатный буфер Вальполя — это смесь 0,2 М раствора уксусной к-ты и 0,2М раствора ее натриевой соли. Фосфатный буфер Серенсена готовят смешиванием М/15 растворов NaH2PO4 и Na2HPO4. Боратный буфер Палича — смесь соответствующих объемов 0,2 М раствора борной к-ты и 0,05 М раствора буры. Для приготовления вероналового буфера Михаэлиса используют 0,1 М раствор Na-веронала и 0,1 М раствор HCl.
Для приготовления карбонатного буфера Кольтгофа на каждые 50 мл 0,1 М раствора углекислого натрия берут х мл 0,1 М раствора HCl и доводят объем полученной смеси до 100 мл.
Для приготовления универсального вероналового буфера Михаэлиса растворяют в воде 9,714 г ацетата натрия (CH3COONa-3H2O) и 14,714 г диэтил барбитурата натрия. Объем раствора доводят дистиллированной водой до 500 мл. На каждые 5 мл раствора добавляют 2 мл 8,5% раствора хлорида натрия, х мл 0,1 М соляной к-ты и (18—х) мл дистиллированной воды.
Для приготовления трис-буфера используют раствор а — 24,3 г трис-(гидроксиметил)-аминометана в 1 л дистиллированной воды и раствор б — 0,1 н. HCl.
При приготовлении любых Б. р. следует употреблять очень чистые исходные вещества. Способность Б. р. сопротивляться изменению pH определяется его буферной емкостью, измеряемой количеством грамм-эквивалентов сильной кислоты или сильной щелочи, к-рое необходимо добавить к 1 л Б. р., чтобы изменить его pH на единицу. При неизменной величине отношения концентраций компонентов Б. р. его буферная емкость возрастает с увеличением концентрации этих компонентов.
Значение Б. р. для мед. практики — см. Буферные системы.
Библиография: Калинин Ф. Л., Лобов В. П. и Жидков В. А. Справочник по биохимии, с. 882, Киев, 1971; Швабе К. Основы техники измерения pH, пер. с нем., М., 1962.
Буферный раствор – химический реактив с постоянным pH
Буферный раствор – химический реактив с постоянным pH
Лабораторная посуда, лабораторное оборудование, приборы и химические 
В практике проведения лабораторных работ сотрудники часто сталкиваются с такими химическими растворами, которые имеют или должны обладать определенным показателем величины pH. Именно для этих целей изготавливают специальные буферные растворы.
Что представляет собой данный раствор?
Буферные растворы – химические реактивы с определенным стабильным показателем концентрации водородных ионов; смесь слабо концентрированной кислоты и ее соли. Данные растворы практически не изменяют свою структуру при концентрировании, разбавлении ее другими химическими реагентами или при добавлении в него в малом количестве высококонцентрированных щелочей или кислот. Чтобы получить буферный раствор с различным показателем pH, необходимо изменять концентрацию и соотношение используемых химических растворов.
Данный химический реактив способен сохранять определенный показатель pH до определенного уровня, в зависимости от конкретного количества агрессивных сред, щелочей и кислот. У каждой буферной смеси есть определенная буферная вместимость – эквивалентное соотношение количества элементов щелочи и кислоты.
К сожалению, сами кислоты и щелочи нельзя отнести к буферным смесям, так как при разбавлении их с водой уровень pH данных агрессивных сред изменяется.

Для работы как в лабораторных условиях, так и в частной практике, рекомендуется использование буферных смесей высокой стабильности, приготовленные в специализированных лабораториях с использованием лабораторной посуды из стекла на специальном лабораторном оборудовании и приборах. Самостоятельное приготовление данного химического реактива может быть получено с большой погрешностью.
Из чего состоит буферный раствор?
В состав этого химического реактива входит вода – растворитель и в равной степени 
Такие химические реактивы вместе с современным лабораторным оборудованием и приборами нашли широкое применение в исследованиях аналитической химии, биологии и микробиологии, генетике, медицине, фармацевтике, исследовательских центрах и других научных областях.
Важность буферного раствора для человека
Естественная буферная смесь очень важна и для нормальной жизнедеятельности организма, так как благодаря ей поддерживается постоянный уровень pH биологических жидкостей тканей, органов, лимфы и крови.
Хранить данный химический реактив необходимо в герметически закрытой емкости (стеклянных или пластиковых флаконах).
Где приобрести лабораторное оснащение высокого качества по доступной цене?
Химреактивы, приборы, оборудование, лабораторную посуду купить в Москве выгодно в современном специализированном магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». Именно здесь Вы найдете широкий ассортимент товаров высокого качества от известных торговых марок по приемлемым ценам. Также у нас возможна доставка как по городу, так и по области.
“Prime Chemicals Group” –лабораторное оснащение от перчаток смотровых до весов электронных лабораторных со знаком качества.
Буферные растворы
Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении.
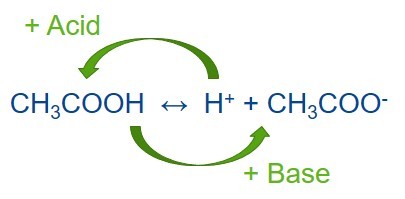
C точки зрения протонной теории простейший буферный раствор состоит из слабой кислоты и сопряженного ей основания или слабого основания и его сопряженной кислоты. В этом случае буферное действие растворов характеризуется наличием кислотно-основного равновесия:
Образуемые сопряженные кислотно-основные пары НА/А– и В/ВН+ называют буферными системами.
Классификация буферных систем
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa ), гидрокарбонатная буферная система (H2CO3 +NaHCO3 ).
2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3⋅H2O + NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3 ), фосфатная буферная система (КН2PO4 + К2НPO4).
Расчет рН буферных систем
Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга.
Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты:
CH3COONa → Na+ + CH3COO–
CH3COO– + HOH ⇄ CH3COOH + OH–
Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени:
Слабая диссоциация СН3СООН еще более подавляется в присутствии СН3СООNa, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:
С другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты:
Согласно закону действующих масс, равновесие между продуктами диссоциации уксусной кислоты и недиссоциированными молекулами подчиняется уравнению:
Кд = 
Подставив общую концентрацию кислоты и соли в уравнение константы диссоциации, получим: [Н+] = Кд
отсюда для кислотных буферных систем: рН = рК(кислоты) + lg 
После аналогичного вывода для основных буферных систем:
рОН = рК(основания) + lg 
Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
Следует отметить, что буферные системы эффективно поддерживают рН в диапазоне: рК(кислоты)± 1 для кислотных систем; 14 – (рК(основания)± 1) для основных систем.
Механизм действия буферных систем:
1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73 (это ничтожное изменение рН при разбавлении буферного раствора в 100 раз обусловлено некоторым изменением коэффициента активности соли). Следовательно, разбавление в конечном итоге мало изменяет рН буферных систем.
2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер:
кислотный компонент – основной компонент–
слабая кислота сопряженное основание
а) При добавлении к ацетатному буферу небольшого количества HCl, происходит взаимодействие ионов Н+ с основным компонентом буферного раствора:
Степень диссоциации СН3СООН мала и концентрация [H+] практически не меняется. рН буферного раствора уменьшится, но незначительно.
Таким образом, если к ацетатному буферу добавить Х моль/л HCl, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
б) При добавлении небольшого количества NaOH, 

В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно.
Таким образом, если к ацетатному буферу добавить У моль/л NaOH, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
Способность буферного раствора сохранять значение рН при добавлении сильной кислоты или щелочи приблизительно на постоянном уровне характеризует буферная емкость.
Буферная емкость системы определяется по отношению к добавляемым кислоте (Вкисл.) или основанию (щелочи) (Восн.) и рассчитывается по формулам:
Вкисл.= 
Буферная емкость по отношению к кислоте (Вкисл.) определяется концентрацией (количеством эквивалентов) компонента с основными свойствами; буферная емкость по отношению к основанию (Восн.) определяется концентрацией (количеством эквивалентов) компонента с кислотными свойствами в буферном растворе.
Максимальная буферная емкость при добавлении сильных кислот и оснований достигается при соотношении компонентов буферного раствора равном единице, когда рН = рК, при этом Восн.= В кисл. (рис.1).Поэтому, применение любой буферной смеси ограничено определенной областью рН (областью буферирования), а именно:
рН = рК(кислоты)± 1 для кислотных систем, или
рН= 14 – (рК(основания)± 1) для основных систем.
Буферная емкость зависит не только от отношения концентраций компонентов буферного раствора, но и от общей концентрации буферной смеси.
Рис.1. Изменение буферной емкости в зависимости от величины отношения [соль]/[кислота].
Пусть, например, даны два буферных раствора, один из которых содержит по 100, а другой – по 10 миллимолей уксусной кислоты и ацетата натрия. Сравним, как изменяются их рН при добавлении к 1 л каждого раствора 5 миллимолей соляной кислоты.
Добавляемая кислота вступит в реакцию с ацетатом натрия, и это отношение в первом растворе станет равным 0,9, а во втором 0,33. В итоге у первого раствора отношение соль/кислота и, следовательно, величина рН изменились меньше. Отсюда видно, что первый буферный раствор обладает большей буферной емкостью.
Таким образом, буферная емкость в основном зависит от соотношения концентраций компонентов и их абсолютных концентраций, а следовательно, от разбавления.
Буферные системы организма
Главным источником ионов водорода в организме является углекислый газ, образующийся в результате метаболизма (обмена веществ) ≈ 15000 ммоль/сутки.
Гидратация углекислого газа приводит к образованию угольной кислоты:
СО2 + Н2О ⇄ Н2СО3⇄ 
В меньшей степени количество ионов Н+ (30–80 ммоль/сутки) обусловлено поступлением в организм, а также образованием в нем таких кислот как серной (в результате обмена серусодержащих аминокислот), фосфорной (при метаболизме фосфорсодержащих соединений), органических кислот, образующихся при неполном окислении липидов и углеводов.
Организм освобождается от кислот благодаря процессам дыхания и мочевыделения, т. е. в организме существует взаимосвязь между метаболическими процессами и газообменом. В оценке кислотно-основного состояния организма важно не только определение значения рН, но и характеристика механизмов, обеспечивающих регуляцию этого параметра.
Если бы в организме не было немедленных буферных механизмов и респираторной (дыхательной) компенсации, то тогда даже обычные, ежедневные нагрузки кислотами сопровождались бы значительными колебаниями величины рН.
Постоянство рН жидких сред организма поддерживается в живых организмах буферными системами. Главным из них являются гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Действие всех буферных систем в организме взаимосвязано, что обеспечивает биологическим жидкостям постоянное значение рН. В организме человека и животных буферные системы находятся в крови (плазме и эритроцитах), в клетках и межклеточных пространствах других тканей.
Буферные системы крови представлены буферными системами плазмы крови и буферными системами эритроцитов. Буферные системы плазмы – гидрокарбонатная, белковая и фосфатная, роль последней незначительна. На их долю приходится ≈ 44% буферной емкости крови. Буферные системы эритроцитов – гемоглобиновая, гидрокарбонатная, система органических фосфатов (фосфатная). На их долю приходится ≈ 56% буферной емкости крови.
Приготовление буферных растворов
Почему точность взвешивания так важна для качества буферного раствора?
Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы.
Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз.
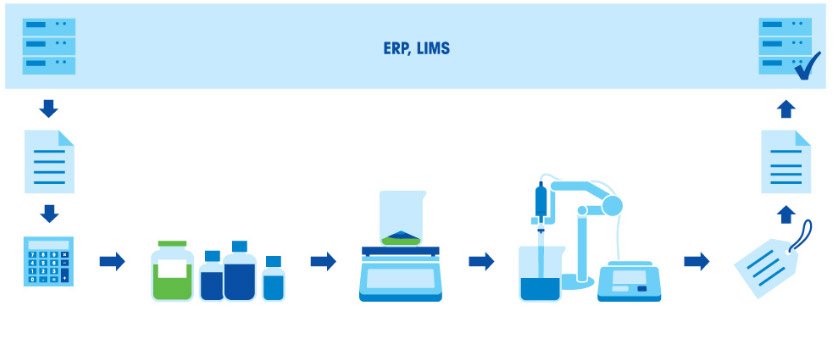
Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность.
Buffer Preparation
Видео: приготовление буферного раствора — простота, удобство и точность
Для приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы.
Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО.
Перейдите в один из следующих разделов, чтобы узнать больше:
Как готовить буферные растворы? Стандартная процедура
Приготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
Буферный раствор — это раствор, сохраняющий свой показатель pH при добавлении небольшого количества кислоты или основания. Буферный раствор состоит из слабой кислоты и сопряженного с ней основания. Постоянный уровень pH в буферном растворе поддерживается благодаря поглощению протонов, которые высвобождаются в ходе реакции, или высвобождению протонов, если в ходе реакции они поглощаются. К созданию буферных растворов привело открытие того, что частично нейтрализованные растворы слабых кислот или оснований не меняют pH при добавлении к ним небольшого количества сильной кислоты или основания.
Сопряженная кислота — это основание, которое приобрело протон.
A + H + ↔ H + A
Основание + протон ↔ сопряженная кислота
Что происходит после добавления кислоты в буферный раствор?
Когда к равновесной смеси слабой кислоты и ее сопряженного основания добавляется сильная кислота (с большим количеством H+), точка равновесия смещается влево в соответствии с принципом Ле Шателье.
Что происходит после добавления основания в буферный раствор?
Аналогичным образом, если в смесь добавляется сильное основание, то концентрация ионов водорода снижается меньше, чем ожидалось с учетом количества добавляемого основания. Это происходит потому, что точка равновесия смещается вправо, чтобы компенсировать потерю H + в реакции с основанием.
Разновидности буферных растворов
Буферные растворы, состоящие из слабой кислоты и ее сопряженного основания, считаются кислыми и имеют рН 7. Примером щелочного буфера может служить водный раствор гидроксида аммония (слабое основание) и хлорида аммония (сопряженная кислота), имеющий рН 9,25.
На что следует обращать внимание при приготовлении буферного раствора
Буферы работают наиболее эффективно, если их pH примерно равен pH исследуемой системы или раствора. При изучении энзимов в биологии человека необходима система, соответствующая pH крови (7,35–7,45), в противном случае энзимы будут функционировать неправильно. Если у буферной системы pH выходит за пределы требуемого диапазона, это также отрицательно повлияет на анализ.
Поэтому необходимо знать, как приготовить буферные растворы с заданным pH. Это можно сделать несколькими способами:
где pKa — константа диссоциации слабой кислоты;
[A-] — концентрация сопряженного основания в точке равновесия;
[HA] — концентрация кислоты в точке равновесия.
Если в точке равновесия концентрации сопряженного основания и кислоты одинаковы, то pH равно константе диссоциации. В этой точке буферный раствор обладает максимальной буферной емкостью.
Уравнение Гендерсона — Гассельбаха также используется для определения константы диссоциации слабых кислот посредством прямых измерений pH.
Преимущества универсальных буферных растворов
Универсальные буферные растворы состоят из нескольких комбинаций кислотно-основных пар. Это позволяет использовать универсальные буферные растворы для поддержания уровня pH раствора в более широком диапазоне и, следовательно, в более широком круге задач.
Дополнительные советы по приготовлению и использованию буферных растворов