Для чего нужны фолликулы в яичниках
Фолликулы и процессы их созревания
Евграфова Ольга Николаевна
Для того чтобы яйцеклетка достигла состояния, готового к оплодотворению, ей предстоит несколько этапов созревания, которые происходят в фолликулах – округлых образованиях с оболочкой, состоящей из двух слоев эпителия и слоя соединительной ткани. К моменту полового созревания в женских яичниках количество фолликул достигает пятисот. Это примерно в тысячу раз меньше, чем заложено в организме девочки еще на стадии эмбриона. В процессе созревания фолликула внутри него формируется яйцеклетка. Даже сегодня этот процесс не до конца изучен и таит в себе немало темных пятен.
Этапы созревания фолликула
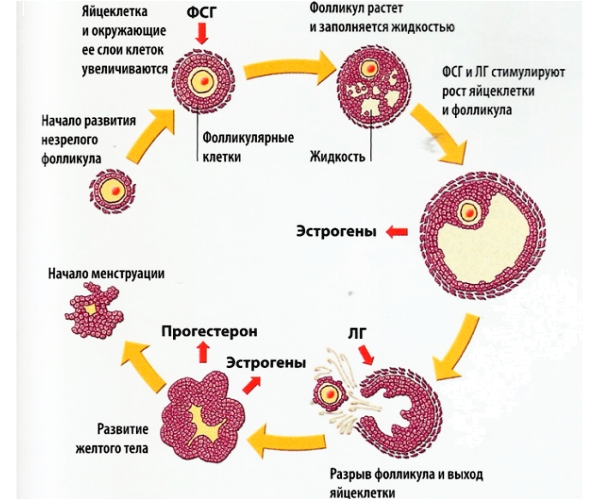
Нормальный менструальный цикл является признаком отсутствия проблем с созреванием фолликулов. Перед овуляцией женщины могут ощущать тянущие боли внизу живота, перевозбуждение или раздражительность, перепады настроения; выделения влагалища могут стать более обильными и густыми. Одним из признаков созревания фолликула также является незначительное снижение температуры за сутки или за 12 часов до момента овуляции. Затем ректальная температура повышается на несколько десятых градуса Цельсия. Отследить выход яйцеклетки из фолликула можно также и при помощи гормональных тестов: перед овуляцией уровень прогестерона повышается.
Обычно менструальный цикл сопровождается созреванием одного единственного фолликула, но бывают случаи, когда одновременно созревают два и более. Это не является патологией, но результатом созревания нескольких фолликул нередко оказывается многоплодная беременность.
Проблемы при созревании
Нарушения могут быть спровоцированы множеством факторов:
Если вследствие нарушения репродуктивной функции фолликул не созревает, то необходимо обратиться к врачу, который установит причины и назначит эффективное лечение.
Преждевременное или запоздалое созревание фолликула также является явлением ненормальным. Если УЗИ обнаруживает множество пузырьков, то такая ситуация ведет к затруднению вызревания доминантного фолликула, что может быть причиной бесплодия.
Диагностика и лечение
Овуляция тесно связана с менструальными циклами. Сигнализировать о проблемах могут даже небольшие задержки, означающие, что фолликул не созревает в отведенное для этого природой время. Отсутствие беременности при нормальной половой жизни без контрацепции на протяжении года говорит о том, что вероятность бесплодия со стороны женщины в данном случае высока. Но обследование необходимо пройти обоим партнерам, так причиной может служить и мужской фактор.
Существует множество методик диагностики бесплодия. Стратегию обследования выбирает лечащий врач. Он может назначить анализы гормонов, УЗИ, а также различные исследования, результаты которых могут косвенно указывать на причины неправильной работы женской репродуктивной системы.
Чаще всего задержка или отсутствие процесса созревания фолликул объясняется гормональными расстройствами. Недостаточный уровень женских гормонов приводит к тому, что коммуникация между фолликулами и организмом практически исчезает. Им как бы не поступает команда к действию. Именно поэтому данную проблему можно решить в частности путем ввода недостающих гормонов.
Но беременность при стимуляции созревания фолликула может наступить. Будущих рожениц, проходивших курс гормональной терапии, врачи ведут весь период вынашивания, а также постродовой.
Смотрите видео о созревании фолликулов и овуляции
Супружеские пары, вовремя обратившиеся к специалистам по причине невозможности зачатия ребенка при регулярной половой жизни в течение одного года, направляются на обследование. Врачи назначают стандартные анализы, позволяющие обнаружить истинную причину бесплодия. Одним из обязательных исследований является фолликулометрия. В ходе этой процедуры удается наблюдать фоллиакулогенез и отследить момент овуляции, если он имеет место. В случае наличия овуляции фолликулометрия позволяет обозначить менструальный цикл и определить наиболее благоприятные для зачатия дни.
Наблюдение фолликулогенеза в рамках диагностики бесплодия дает возможность отследить поведение доминирующего фолликула и дать общую оценку репродуктивных способностей женщины.
В случае отсутствия овуляции, определяемой в ходе фолликулометрии, назначается ряд анализов, среди которых и гормональный. Не стоит отчаиваться, если овуляции нет. Гормональная терапия очень часто помогает созреванию фолликула и выходу готовой к оплодотворению яйцеклетки. Но причины могут быть не только в недостатке гормонов. Целый ряд различных заболеваний, причем многие и них не являются гинекологическими, способен сдерживать созревание фолликул. Даже банальная простуда очень часто приводит к нарушению нормального менструального цикла. Лечащий врач принимает во внимание все факторы, имеющие отношение к фолликулогенезу.
Психологическое состояние, в частности нервозность и страх не наступления беременности, почти всегда влияют на созревание фолликул отрицательно. Абсолютное большинство женщин, обратившихся за помощью в Клинику репродуктивной медицины, приходят со своими страхами. И в этом нет ничего предосудительного, ведь для женщины нет ничего важнее, чем реализоваться как мать. Несостоятельность в плане деторождения для них является сильнейшей психологической проблемой.
Задача врача уже на этапе обследования – максимально снять у женщин страх отсутствия беременности. Этому помогает доброжелательная обстановка в клинике, а также общение с благодарными клиентами, у которых благодаря квалифицированным врачам клиники все получилось.
Следует заметить, что современная репродуктология продвинулась за последнее десятилетие колоссально. Сегодня, если врач считает, что шансы на материнство имеются, то это означает действительно высокую вероятность успеха.
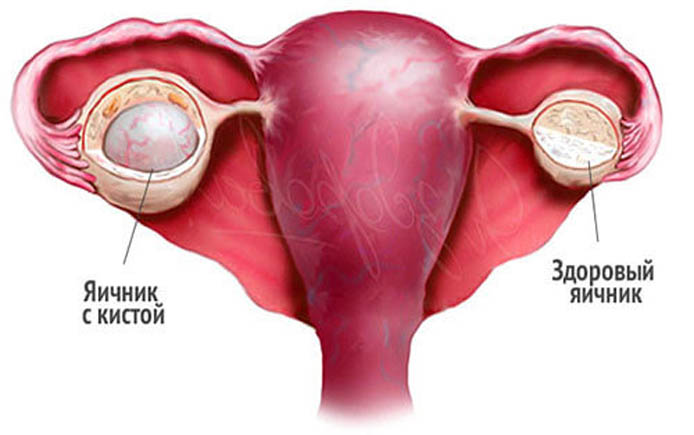
Одним из самых распространенных видов обследования фолликул является УЗИ. Ультразвуковые датчики способны зафиксировать доминантный фолликул. Если же он фиксируется постоянно (независимо от фазы менструального цикла), то ставится диагноз персистенция. Данное заболевание в большинстве случаев излечимо. Но в то же время существует немалая вероятность превращения граафового пузырька в кистозное образование.
Поскольку поведение фолликулов формируется гормонами, именно эндокринные нарушения в организме женщины чаще всего становятся причиной отсутствия овуляцию. Второй по распространенности причиной является киста, в которую трансформировался фолликул, из которого не вышла яйцеклетка. Если графов пузырек превышает в диаметре 25 мм, то врач имеет все основания заподозрить кистозное образование. Если диаметр меньше указанного выше, то речь идет о персистенции либо о так называемой лютеинизации. Подобные кисты диаметром до 50 мм рассасываются без какого-либо лечения от одного до четырех месяцев. Бее крупные кисты требуют гормонотерапии или хирургического вмешательства.
Ответы на популярные вопросы
Почему не лопается фолликул?
По разным, как временным физиологическим так и патологичным причинам.
Какие гормоны нужно проверить, если плохо созревает фолликул?
Перечень гормонов необходимых для сдачи определяет врач, после сбора анамнеза. Если есть подозрения на нарушение фолликулогенеза обязательно сдается ФСГ, ЛГ, тестостерон свободный, эстрадиол, гормоны щитовидной железы, пролактин и кортизол в начале менструального цикла.
Влияние размера фолликула на качество яйцеклетки
Вероятно, Вы могли раньше не слышать о фолликулах яичников и не ожидать, что они будут иметь такое значение для Вас и Вашей фертильности. Однако фолликулы являются одной из самых неотъемлемых составляющих репродуктивной системы женщины, и количество имеющихся фолликулов часто является прямым фактором, который влияет на зачатие, как естественным путем, так и с помощью ЭКО.
Что такое фолликул?
Фолликул яичника – это наполненный жидкостью мешочек, в котором растет яйцеклетка. Когда яйцеклетка достигает зрелости, она высвобождается из фолликула. Это то, что мы называем овуляцией.
Распространенное заблуждение состоит в том, что каждый фолликул выпускает несколько яйцеклеток. Однако на вопрос, сколько яйцеклеток в фолликуле, ответ – один.
Овуляция обычно происходит у большинства женщин каждый месяц в период между половым созреванием и менопаузой. Несколько фолликулов начинают развиваться каждый цикл, но обычно только один из них высвобождает ооцит. Фолликулы, не выделяющие яйцеклетку, распадаются. Этот процесс известен как атрезия и может произойти на любой стадии развития фолликула.
Сколько фолликулов должно быть в яичнике?
В фертильном периоде жизни у женщины оптимально должно быть не менее 6 четких фолликулов в одном срезе при проведении УЗИ.
Пока фолликул не начинает развиваться, он известен как примордиальный фолликул. Эти примордиальные фолликулы микроскопические, их размер составляет всего 25 микрометров (0,025 миллиметра). Они слишком малы, чтобы их можно было увидеть невооруженным глазом, и их нельзя обнаружить с помощью УЗИ.
Однако, как только гормональные сигналы запускают развитие фолликулов, и они начинают созревать и расти, они становятся антральными фолликулами и имеют размер до 10 мм. Они видны на УЗИ и могут быть подсчитаны.
Фолликулы и фертильность
Ультразвуковое исследование (фолликулометрия) антральных фолликулов проводится при первом визите к репродуктологу, для оценки запаса яйцеклеток (овариального резерва).
Затем первым важным этапом программы ЭКО является стимуляция роста фолликулов, чтобы получить большее количество ооцитов для оплодотворения (оптимально 10-15). Он состоит из использования ежедневных инъекций в течении 11-12 дней, которые поддерживают яичники вместо дозревания одной яйцеклетки (что они делают естественным образом каждый месяц) и производят больше ооцитов для их оплодотворения, культивирования и получения большего количества эмбрионов. Такая стимуляция, конечно, увеличивает шансы на наступление беременности.
Размер фолликула, очень важен для нас.
Когда фолликулы достигают оптимального размера (около 18–22 мм) мы планируем аспирацию фолликулов через 36 часов после введения инъекции триггера овуляции. Это поддерживает созревание ооцитов таким же образом, как и в естественном цикле. Оптимальное время для получения ооцитов в программе ЭКО (14-15 день цикла, при условии диаметра фолликулов 18-22 мм)
Как размер фолликула влияет на качество яйцеклетки и оплодотворение?
Очень интересное исследование провели McCulloh et al. (2020), тщательно измеряя каждый фолликул перед аспирацией и отделяя полученные яйцеклетки друг от друга. Затем эти ооциты оплодотворяли и контролировали развитие эмбрионов.
Считается, что более крупные фолликулы с большей вероятностью обеспечивают зрелые ооциты хорошего качества в сравнении с более мелкими фолликулами.
Вот краткие результаты этого исследования, относящиеся к соотношению размера фолликула и зрелости ооцитов:

Было получено 317 яйцеклеток от 22 доноров ооцитов в возрасте 24.5 года± 3.5 с диаметром фолликула:
Есть две стадии незрелости перед завершением созревания ооцита (GV – зародышевый пузырек и MI).
MII – это зрелые ооциты.
Эти 255 зрелых ооцита были оплодотворены методом ICSI:
Оплодотворены 228 (89,4%).


Размер фолликулов соответствовал разным яйцеклеткам. Каждую оплодотворенную яйцеклетку культивировали индивидуально, чтобы за ними можно было наблюдать во время культивирования эмбрионов.
Данные по среднему размеру фолликулов и зрелости яйцеклетки
Пропорции этих ооцитов, исходя из диаметра фолликула:
Выводы
Ооциты из фолликулов размером менее 12 мм с большей вероятностью будут GV (незрелые), а яйцеклетки из фолликулов размером > 17 мм с большей вероятностью будут MII (зрелыми).
В Reprolife мы понимаем важность точного диагноза. Мы используем научно обоснованный подход для создания индивидуального плана лечения, начиная с тщательной диагностической оценки каждого пациента. Эти тесты предоставляют важную информацию, которая поможет нам составить персонализированную и наиболее эффективную для Вас программу лечения.
Наш диагностический пакет «Прогноз овариального резерва» включает в себя тесты на подсчет антральных фолликулов (AFC) и Антимюллеров гормон (AMH), а также консультацию опытного репродуктолога. Понимание уровня овариального резерва яичников поможет Вам спланировать лечение.
Оценка функционального резерва яичников
Овариальный резерв яичников — так можно назвать предполагаемое количество яйцеклеток в яичниках женщины, которые могут в перспективе дать беременность
Что такое овариальный резерв яичников?
Если Вы когда-нибудь были на приеме у врача репродуктолога, то наверняка слышали это словосочетание, в оптимистичной интонации: «ну, резерв яичников у Вас вполне перспективный» или же с негативным оттенком: «низковат резерв яичников».
Овариальный резерв или функциональный резерв яичников — так можно назвать предполагаемое количество яйцеклеток в яичниках женщины, которые могут в перспективе дать беременность.
Этот потенциал закладывается в яичниках девочки еще в утробе матери, после ее рождения в яичниках остается около 400 000 клеток. В дальнейшем же нас ждет печальная участь, в отличие от мужского репродуктивного резерва, который периодически обновляется всю жизнь, наш, женский запас в течение жизни только тратится, без возможности восстановления. Ежемесячно мы теряем не менее 20 клеток, независимо от образа жизни, наличия или отсутствия беременностей, приема контрацептивов и проч.
Таким образом, с возрастом в норме у всех женщин снижается количество клеток, способных дать беременность.
Кроме того, в течение жизни яичники подвергаются негативному воздействию множества факторов, которые снижают качество этих клеток (воспалительные реакции, новообразования, воздействие различных токсичных веществ и проч.). Оперативные вмешательства на яичниках (удаление кист яичников, резекция яичников и т. п.) может преждевременно уменьшить фолликулярный резерв до 0 у молодых женщин.
Как узнать, каков Ваш функциональный резерв яичников?
При помощи УЗИ органов малого таза
УЗИ органов малого таза делают на 5-7 день цикла. С его помощью можно посчитать количество антральных фолликулов — пузырьков, в которых созревают яйцеклетки.
Возраст женщины — самый важный независимый прогностический фактор, влияющий на фолликулярный запас, а следовательно — на вероятность достижения беременности и эффективность лечения бесплодия.
У женщин в возрасте 35-38 и старше 40 лет по сравнению с 25-летними способность к зачатию снижается до 50 %, 25 % и менее 5 % соответственно. Но изменения фолликулярного резерва у всех женщин индивидуальны. У кого-то уже к 30 годам в яичниках не остается фолликулов, содержащих клетки (это называется преждевременным истощением яичников), а у кого-то после 40 лет сохраняется достаточный фолликулярный запас.
Биологический репродуктивный возраст женщины отражает количество фолликулов размером менее 10 мм при УЗИ, проведенном на 5-7 день менструального цикла. У женщин в активном репродуктивном возрасте (до 35 лет) должно быть не менее 5-6 фолликулов в одном срезе в каждом яичнике по результатам УЗИ.
Менее 8 антральных фолликулов в яичниках — это уже снижение фолликулярного резерва, по которому можно предполагать слабый ответ на стимуляцию овуляции и необходимость повышения дозы препаратов в программе ЭКО.
При наличии менее 5 фолликулов в обоих яичников прогноз адекватного ответа на стимуляцию овуляции очень сомнителен.
При помощи анализа крови на гормоны
Кроме УЗИ фолликулярный резерв яичников может помочь определить анализ крови на гормоны. В первую очередь исследуют уровень ФСГ — фолликулостимулирующего гормона гипофиза. Он вырабатывается в специальной железе, которая находится в головном мозге — гипофизе и стимулирует рост фолликулов в яичниках. Если в яичниках достаточного количества фолликулов нет и они не реагируют на его «требования» адекватным ответом, гормон повышается, чтобы заставить яичники работать.
Уровень ФСГ исследуется на 2-5 день менструального цикла. Повышение концентрации гормона выше 10-12 МЕ/л говорит о снижении фолликулярного резерва яичников.
Другие гормоны, показывающие уровень фолликулярного резерва — это АМГ (антимюллеров гормон) и ингибин В. Они вырабатываются в ткани яичников. Концентрация ингибина В менее 45 пг/мл сопровождается уменьшением количества яйцеклеток.
Уровень АМГ наиболее точный прогностический фактор исхода лечения, низким считается его показатель менее 1 нг/л. Но для получения достоверной оценки фолликулярного резерва яичников нужно учитывать в целом все показатели — малое число антральных фолликулов на узи, высокие концентрации ФСГ, низкие уровни АМГ и ингибина В.
Многие пациентки, получив результаты обследования на гормоны, задают вопрос: Как повысить уровень АМГ? Можно ли снизить уровень ФСГ?
Изменить уровень этих гормонов в крови можно. Для этого существует так называемая заместительная гормональная терапия, например, можно пропить курс гормональных препаратов, которые «обманут» гипофиз и он уменьшит выработку ФСГ, т. к. будет получать сигнал о мнимой активности яичников. Но, к сожалению, как я уже говорила выше, восстановить таким образом фолликулярный резерв яичников не удастся.
Снижение уровня ФСГ не улучшит результативность ЭКО и не повысит вероятность получения беременности, поэтому делать этого перед ЭКО не нужно.
Что же делать, если по результатам обследования констатировано снижение фолликулярного резерва яичников?
В этом случае для достижеия беременности необходимо обратиться к врачу репродуктологу. Получить беременность у женщин позднего репродуктивного возраста или со сниженным фолликулярным резервом можно с помощью лечения методом ЭКО.
При выборе клиники ЭКО при этом факторе бесплодия очень важно обратить внимание на качество эмбриологической службы, ведь от ее работы зависит львиная доля успеха.
Также важным является такой, казалось бы, на первый взгляд не слишком существенный момент, как режим работы клиники. Если у Вас снижен фолликулярный запас, оптимально выбрать для лечения клинику, работающую без выходных. Именно такой режим позволяет производить своевременный забор клеток, даже если их мало, всего 1-2, без риска допустить их овуляцию.
Также сейчас широко применяются новые эффективные методики получения большего количества ооцитов в циклах ЭКО у пациенток с низким фолликулярным резервом. Например, так называемая «двойная стимуляция» яичников, суть которой заключается в том, что в течение одного цикла ЭКО собирается двойной «урожай» клеток. Повышение количества клеток увеличивает шансы на наступление беременности, ведь так получается большее количество эмбрионов, из которых можно с большей вероятностью выбрать перспективные эмбрионы на перенос.
Имеет ли значение особенность проведения программы ЭКО?
Безусловно. Схема стимуляции яичников подбирается врачом индивидуально в каждом конкретном случае, с учетом возраста женщины, ее веса, гормонального фона, результатов УЗИ, предыдущих протоколов ЭКО. Если за плечами у пациентки со сниженным фолликулярным резервом уже были неэффективные протоколы ЭКО, например такие, при которых не было получено яйцеклеток при пункции яичников, врач использует альтернативные подходы, чтобы изменить ситуацию.
Например, есть теория, что у пациенток со сниженным фолликулярным резервом в программе ЭКО можно использовать специальную технику пункции фолликулов, с промыванием содержимого фолликулов специальным раствором, что якобы повышает вероятность получения ооцитов. Правда исследования, которые проводились у таких пациенток, не подтвердили, что пункция, проведенная таким образом, способствует увеличению общего числа полученных яйцеклеток и повышению частоты наступления беременности, а методика при этом существенно удлиняет время процедуры и требует большей дозы анестетиков во время операции, поэтому целесообразность ее спорна (данные исследования 2010 г.).
Истощение фолликулярного резерва у женщин до 40 лет называется преждевременной недостаточностью яичников или, в прежней классификации болезней — синдром истощения яичников.
Яичники перестают продуцировать женские гормоны — эстрогены, что сопровождается нарушениями работы всего организма — повышение артериального давления, учащенное сердцебиение, появлении симптомов «приливов», жара, повышенной потливости, сухости кожи, ломкости волос, плаксивости и раздражительности, снижения либидо, сухости влагалища и как следствие — болезненности при половых контактах, нарушении мочеиспускания (учащенное мочеиспускание, недержание мочи при напряжении) и проч. Конечно же при этом страдает и репродуктивная функция — при синдроме преждевременного истощения яичников яйцеклеток, пригодных для оплодотворения практически не остается.
Преждевременное истощение яичников часто носит наследственный характер (у 25 % матерей женщин с такими проблемами менопауза также наступила до 40 лет)
Другие причины истощения яичников — воздействие на яичники повреждающих факторов, от аутоиммунных до внешних, например, интоксикации, радиации или воспалительного процесса. Также такая проблема может возникнуть у женщин с резким снижением массы тела из-за неправильного питания (анорексии).
Диагностировать преждевременную недостаточность яичников у женщин младше 40 лет кроме указанных выше жалоб помогает УЗИ, на котором определяется уменьшение размеров матки, истончение слизистой оболочки матки (эндометрия), уменьшение яичников, а также отсутствие в них фолликулов.
При исследовании гормонального профиля выявляется существенное повышение фолликулостимулирующего гормона, уменьшения эстрадиола, выраженное снижение АМГ и ингибина В.
Восстановление репродуктивной функции у женщин с преждевременной недостаточностью яичников перспективно только в случаях, когда она вызвана интоксикаций или нарушением веса вследствие анорексии — устранение повреждающего фактора в этой ситуации может помочь яичникам вновь заработать.
В большинстве же случаев единственный способ забеременеть при такой проблеме — это ЭКО с использованием донорских ооцитов.
Если у молодых девушек (20-25 лет) поздно начинается и долго устанавливается менструальный цикл, можно предположить риск возникновения преждевременной недостаточности яичников в будущем, особенно, если у мамы девушки отмечалась ранняя менопауза. В этом случае нужно обратиться к врачу репродуктологу — его своевременное вмешательство может помочь решить проблему бесплодия до ее возникновения.
Например, на сегодняшний день существует возможность сохранить яйцеклетки при повышенном риске их преждевременной утраты с помощью программы криоконсервации (заморозки) ооцитов, которая позволяет хранить их в течение десятков лет без повреждения их структуры, а при планировании беременности — безопасно разморозить, оплодотворить спермой партнера и получить эмбрионы, которые после переноса в подготовленную полость матки помогут обрести паре долгожданного здорового малыша.
Прорыв в лечении бесплодия
Прорыв в лечении бесплодия
Овуляция и дальнейшее оплодотворение возможны при наличии в яичниках женщины абсолютно жизнеспособных фолликулов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Процент женщин, лишенных радости материнства, с каждым годом возрастает. Среди причин бесплодия всё чаще выделяют первичную недостаточность яичников (ПНЯ). Данная патология заключается в отсутствии фолликулов или нарушении их созревания в ответ на гормональную стимуляцию. Решение проблемы эндокринного бесплодия вследствие синдрома истощения яичников предложили ученые из США и Японии. Им удалось активировать фолликулы яичников в условиях in vitro и имплантировать фрагменты ткани в верхний отдел фаллопиевых труб, что дает женщине шанс стать матерью.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Корни проблемы
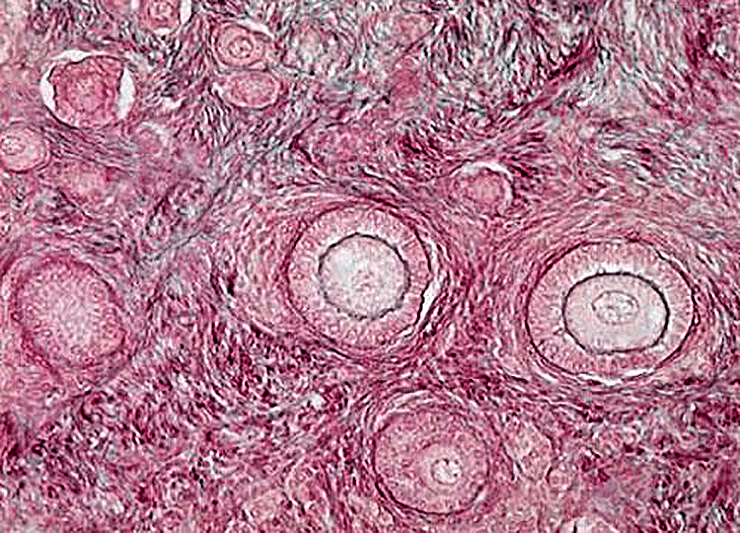
Яичник — уникальная эндокринная система, в которой ежемесячно возникает новая секреторная структура — граафов фолликул (рис. 1). Он развивается из микроскопического примордиального фолликула, потенциальная функциональность которого и определяет регулярность менструального цикла женщины.
Рисунок 1. Фолликулы яичников
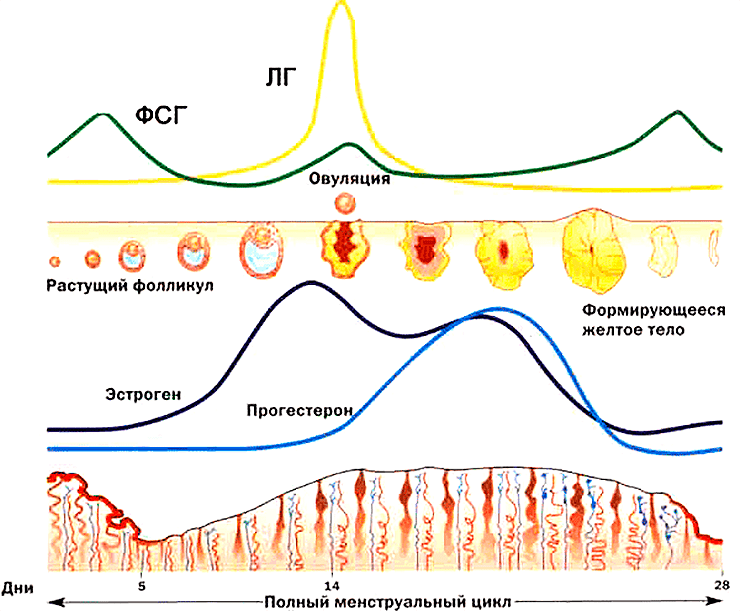
Функция яичников регулируется двумя гормонами гипофиза: фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) (рис. 2). В свою очередь, яичники продуцируют гормоны, регулирующие секрецию ФСГ и ЛГ по принципу отрицательной обратной связи: эстрогены, ингибины и прогестерон [1].
Рисунок 2. ФСГ стимулирует рост и созревание фолликула в яичнике. ЛГ стимулирует выход созревшей яйцеклетки из фолликула (овуляцию).
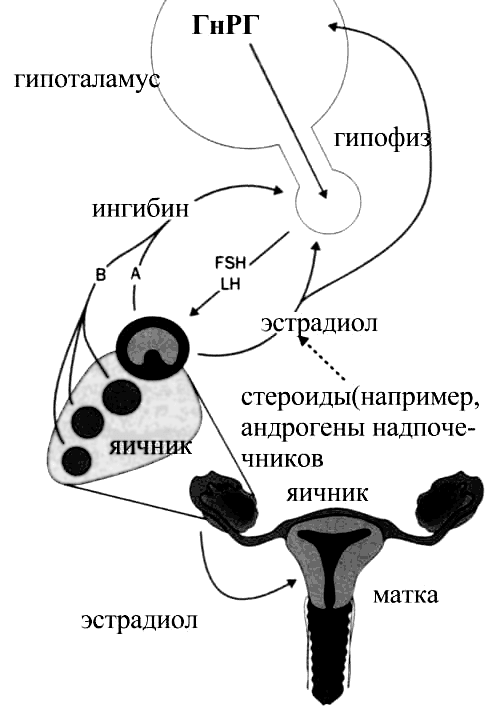
При недостаточности функции яичников для поддержания снижающейся концентрации яичниковых гормонов происходит резкое повышение секреции гонадотропинов. За их выработку отвечает гипоталамус (рис. 3).
Рисунок 3. Связь функционирования яичников с эндокринной системой
Причины, приводящие к развитию первичной недостаточности яичников (ПНЯ), весьма гетерогенны: генетические, ферментативные, аутоиммунные, инфекционно-токсические, психогенные. Кроме того, в эту группу относят и дефекты в структуре гонадотропинов. В последние годы большое внимание исследователей уделяется молекулярно-генетическим аспектам этой патологии яичников, поскольку выявлен определенный набор генов, который может отвечать за развитие ПНЯ.
Стоит отметить, что термин «первичная недостаточность яичников» в настоящее время применяется для определения состояния, которое ранее называли «преждевременной менопаузой». Ключевое различие заключается в том, что термин «ПНЯ», предложенный еще в 1942 году, характеризует нарушение функции яичников в динамике, а не конечное состояние, что наблюдается при менопаузе [1].
Диагностика
Яичниковая недостаточность диагностируется по повышенному уровню ФСГ и ЛГ в крови при сниженном уровне эстрогенов. Самый чувствительный гормон — ФСГ; он является самым ранним маркером преждевременного старения яичников. При двукратном превышении уровня ФСГ (20 Ед/л) наступление и благополучный исход беременности маловероятны.
Клинические характеристики состояния: аменорея (отсутствие менструации) ≥4 месяцев у женщин моложе 40 лет, бесплодие и повышение уровня ФСГ до менопаузальных значений (дважды с промежутком не менее 1 месяца).
Частота спонтанной недостаточности яичников у женщин с хромосомным набором 46 ХХ составляет около 1%; при этом эпидемиологические исследования указывают на тесную связь данного нарушения с возрастом. Так, у женщин в возрасте до 20 лет ПНЯ встречается с частотой 1:10000, а в возрасте от 30 до 40 — 1:1000.
Что происходит на гормональном уровне
Один из половых гормонов — 17β-эстрадиол (рис. 4), который играет важную роль в выполнении репродуктивной функции женщины, — вырабатывается преимущественно в яичниках из мужских половых гормонов — андростендиона и тестостерона [2]; небольшое количество этого гормона также вырабатывается надпочечниками. В процессе угасания функций яичников количество растущих фолликулов в них уменьшается, что приводит к значительному понижению выработки 17β-эстрадиола. Поэтому у женщин с так называемым синдромом истощения яичников наблюдается нехватка этого гормона, которая частично компенсируется большей выработкой 17β-эстрадиола в надпочечниках. Так как менструации становятся нерегулярными, уровень 17β-эстрадиола начинает колебаться, и с прекращением менструаций резко понижается, что приводит к повышению фолликулостимулирующего гормона (ФСГ).
Рисунок 4. β-эстрадиол (кристаллы). Поляризация LM X100.
Механизм активации незрелых фолликулов
Для женщин, страдающих бесплодием по причине рассмотренного заболевания, существует единственная возможность материнства — имплантация оплодотворенной донорской яйцеклетки. Однако группа специалистов из Стэнфордского университета (США) и Медицинского факультета Университета им. Святой Марианны (Япония) предложили альтернативу — метод, позволяющий исключить известные хирургические вмешательства для стимуляции овуляции, такие как клиновидная резекция яичников или лазерное сверление. Врачи удалили яичники у участниц исследования, поделили их на несколько частей, а затем воздействовали на фрагменты яичников препаратами, стимулирующими рост. Спустя несколько дней некоторые из фрагментов ткани были имплантированы в фаллопиевы трубы женщин. Затем специалисты наблюдали за развитием фолликулов. У некоторых участниц исследования сформировались зрелые яйцеклетки, что позволило провести им стандартную процедуру экстракорпорального оплодотворения (ЭКО [3]). Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences [4].
Важно отметить, что возможность провести подобное лечение возникла благодаря изучению сигнального клеточного пути под названием Hippo [5], который представляет собой один из ключевых компонентов регуляции таких важных процессов, как контактное ингибирование роста клеток и связанного с ним контроля размера внутренних органов [6]. Первоначально белковый комплекс Hippo был открыт у дрозофил. Мухи, у которых его функционирование было нарушено, буквально увеличивались в размерах (из-за чего регулятор и получил своё название: «Hippo» происходит от слова «гиппопотам»). Затем его обнаружили и у млекопитающих.
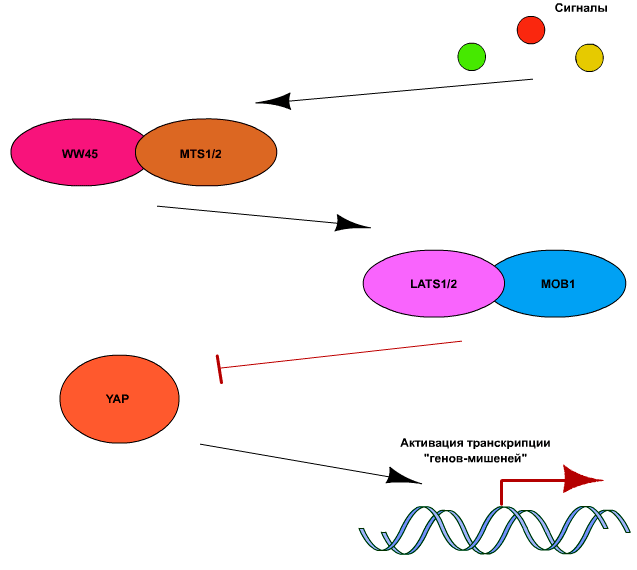
Ключевым компонентом пути Hippo является киназа Yap (Yes-activated protein), которая в активном состоянии способна связывать ряд факторов транскрипции, таких как p73, p53-binding protein-2 (p53BP2), RUNX2, SMAD7, ERBB4, PEBP2а и TEAD/ТЕF [7]. Регуляция активности YAP осуществляется в основном за счет ингибирующего действия киназ LATS1 и 2 (large tumor supressor-1 и −2). Они, в свою очередь, активируются киназами МSТ1 и МSТ2 (mammalian sterile-20-like kinases). Для полной активации LATS и МSТ необходимо также, чтобы они были связаны с адапторными белками WW45 и МОB1, соответственно. Вышеописанная часть сигнального пути Hippo является высококонсервативной у млекопитающих, в то время как сигналы активации или ингибирования LATS и МSТ могут быть достаточно разнообразными. В общих чертах сигнальный путь Hippo представлен на рис. 5.
Рисунок 5. Схематичное изображение работы сигнального белкового регулятора Hippo
Развитие эмбриона, деление эмбриональных клеток и рост тканей и органов эволюционно контролируются работой различных регуляторов. По словам одного из авторов исследования Арона Сюэ (Aaron Hsueh) — акушера-гинеколога из Стэнфордского Университета в Калифорнии — у женщин с синдромом истощения яичников наблюдается повышенная активность регулятора Hippo [8]. Другими словами, он блокирует созревание практически всех фолликулов яичника, что минимизирует возможность наступления овуляции и дальнейшего оплодотворения.
Ученые нарушили работу сигнального пути Hippo в удаленных яичниках и, таким образом, предотвратили преждевременную остановку развития фолликулов. Далее специалисты стимулировали активность другого сигнального пути, называемого Akt, что способствовало ускорению роста фолликулов [9], [10].
Клинические исследования проводились сначала на лабораторных животных. На следующем этапе в эксперименте согласились принять участие 27 женщин, страдающих от первичной дисфункции яичников. В ходе исследования выяснилось, что у некоторых женщин в яичниках не было фолликулов. В яичниках 13 пациенток обнаружили незрелые фолликулы; из них у восьми женщин применение нового метода лечения способствовало росту жизнеспособных фолликулов. Для 14 женщин лечение оказалось неэффективным.
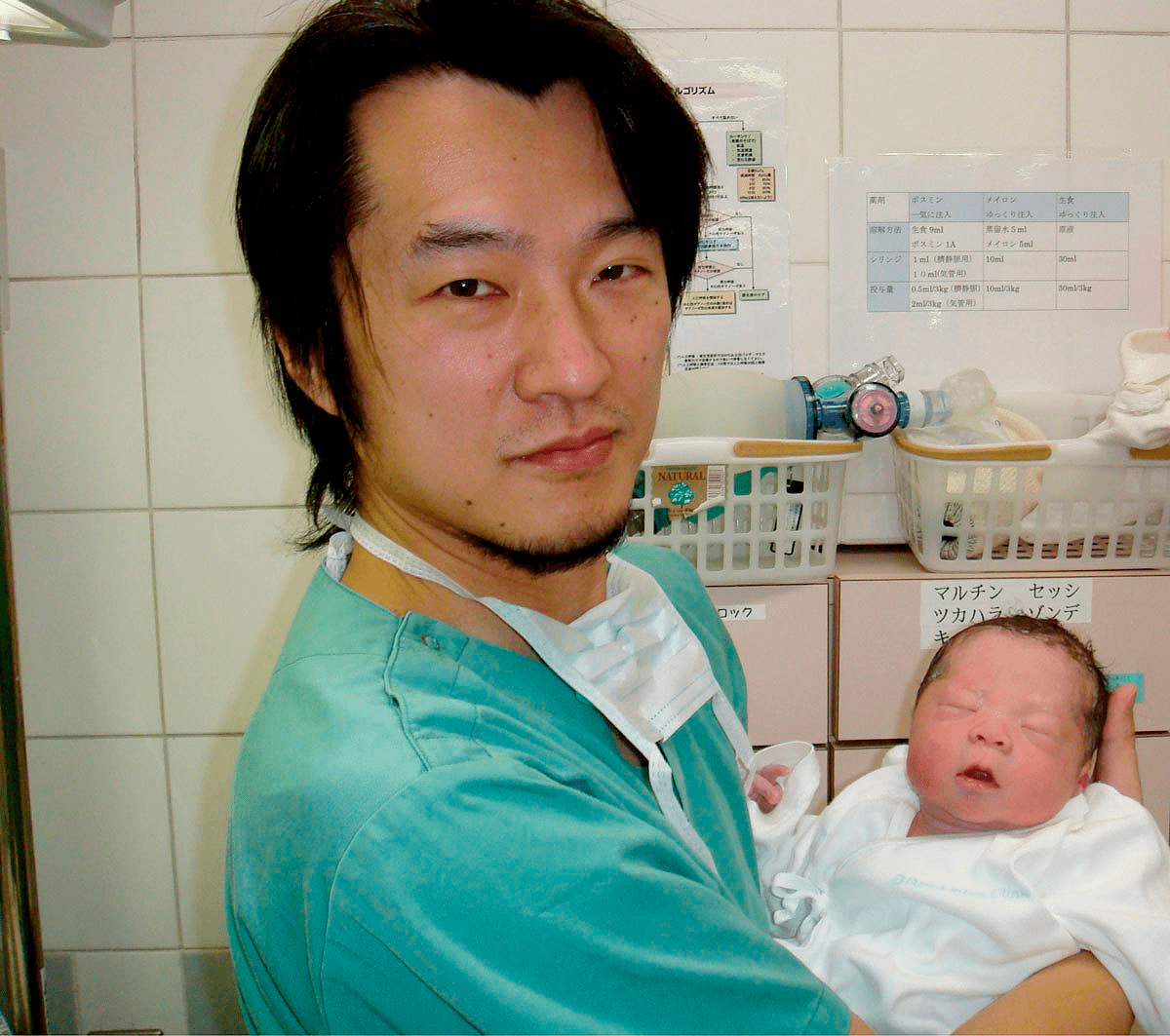
В результате зрелые яйцеклетки были получены у пяти женщин и использованы для ЭКО. Одна из пациенток в возрасте 29 лет во время курса лечения на 37 неделе беременности родила ребенка весом 3,3 кг (рис. 6). Научная группа надеется, что эффективность нового метода лечения достигнет 30%. И, более того, по их словам, этот метод может также помочь женщинам, перенесшим лучевую или химиотерапию, и пациенткам в возрасте лет с нерегулярным менструальным циклом [11].
Рисунок 6. Казухиро Кавамура (Kazuhiro Kawamura) — один из ученых, участвовавший в исследовании — держит на руках новорожденного мальчика, которого родила первоначально бесплодная женщина
Мнения и прогнозы
По мнению Марчелле Цедарса (Marcelle Cedars) — специалиста в области репродуктивной онкологии из Университета Калифорнии в Сан-Франциско — исследователи поторопились апробировать новый метод лечения бесплодия на человеке: «Ученые продемонстрировали рождение здорового потомства при проведении предварительных исследований на мышах, но не было получено доказательств роста, развития и/или плодовитости этого поколения» [12].
Авторы исследования полагают, что метод подходит бесплодным женщинам среднего возраста, а также тем, кому диагностировали первичную недостаточность яичников, вследствие которой в более чем 50% случаев беременность не наступает. Однако не все эксперты разделяют их оптимизм. Руководитель врачебной группы, изучающей оплодотворение, из Университета Южной Калифорнии Ричард Паульсон (Richard Paulson) убежден, что ключевое условие эффективности разработанного механизма лабораторной «активации» фолликула — наличие в нем здоровой яйцеклетки. Кроме того, Паульсон заостряет внимание на том, что неразумно сопоставлять результаты лечения женщины в возрасте 29 лет с результатами лечения женщины в 40 лет, поскольку гормональная стимуляция роста и развития фолликулов в разные возрастные периоды происходит с различной интенсивностью.
Рассмотренный консервативный метод стимуляции овуляции путем блокировки сигнального пути Hippo в отдельных фрагментах ткани яичников может быть полезен женщинам, больным раком или проходящим процедуры стерилизации. Но все же главное достижение ученых — это рождение ребенка у женщины, которая без их участия никогда не смогла бы стать матерью.