Для чего нужны гистоны
Гистоны
Гистоны — основной класс нуклеопротеинов, ядерных белков, необходимых для сборки и упаковки нитей ДНК в хромосомы. Существует пять различных типов гистонов, названных H1/Н5, H2A, H2B, H3, H4. Последовательность аминокислот в этих белках практически не различается в организмах различного уровня организации. Гистоны — небольшие, сильно основные белки, связывающиеся непосредственно с ДНК. Гистоны принимают участие в структурной организации хроматина, нейтрализуя за счёт положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК, что делает возможной плотную упаковку ДНК в ядре.
Благодаря этому 46 молекул ДНК диплоидного генома человека общей длиной около 2 м, содержащих в сумме 6·10 9 пар оснований (п.о.), могут поместиться в клеточном ядре диаметром всего 10 мкм.
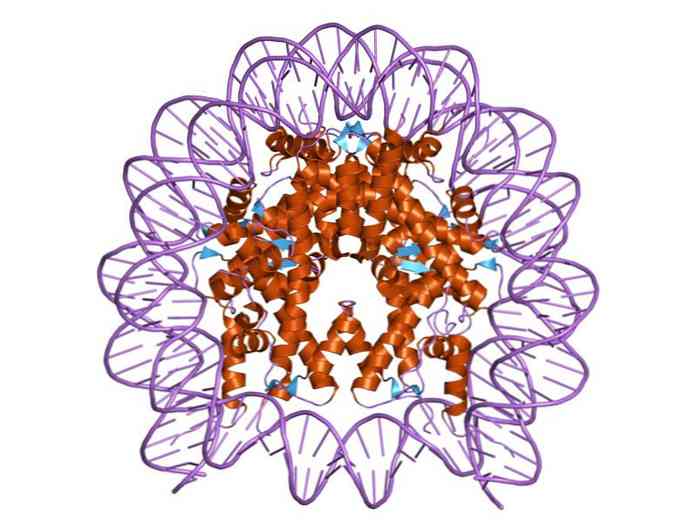
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 п.о., образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой. Участок ДНК (линкерная ДНК), непосредственно не контактирующий с гистоновым октамером, взаимодействует с гистоном Н1.
Группа негистоновых белков высоко гетерогенна и включает структурные ядерные белки, множество ферментов и факторов транскрипции, связанных с определёнными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
Гистоновые белки интересны со многих точек зрения. Благодаря высокому содержанию лизина и аргинина они, как уже упоминалось, проявляют сильно основные свойства. Кроме того, последовательность аминокислот гистонов, то есть их первичная структура, мало изменилась в процессе эволюции. Это хорошо видно при сравнении аминокислотной последовательности гистонов млекопитающих, растений и дрожжей. Так, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами. К тому же размер молекулы белка и её полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы ещё в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точковые мутации, все они, очевидно, приводили к вымиранию мутантных организмов.
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосом и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, например, формирование (конденсация) хромосом связано с фосфорилированием гистонов, а усиление транскрипции — с ацетилированием в них остатков лизина. Детали механизма регуляции до конца не выяснены.
Некоторые детали механизма регуляции смотри: Белки группы polycomb
Характеристики, структура, типы и функции гистонов
гистоны являются основными белками, которые взаимодействуют с ДНК для образования нуклеосом, которые составляют цепи хроматина, составляющие хромосомы у эукариотических организмов.
Нуклеосомы, комплексы, образованные ДНК и белками, были открыты в 1974 году, и именно гистоны собирают этот базальный уровень организации хроматина. Однако существование гистоновых белков известно еще до 1960-х годов..
Гистоны организованы таким образом, что двойная полоса ДНК обернута вокруг белкового центра, состоящего из этих белков, которые тесно взаимодействуют друг с другом. Гистоновый центр имеет форму диска, и ДНК совершает около 1,7 оборота вокруг него..
Множественные водородные связи позволяют связывать ДНК с белковым центром, образованным гистонами в каждой нуклеосоме. Эти связи образуются, в основном, между аминокислотными скелетами гистонов и сахарофосфатным остовом ДНК. Некоторые гидрофобные взаимодействия и ионные связи также участвуют.
Белки, известные как «комплексы ремоделирования хроматина», ответственны за разрушение и образование связывающих связей между ДНК и гистонами, позволяя проникать транскрипционному механизму в ДНК, содержащуюся в нуклеосомах..
Несмотря на близость нуклеиновых кислот к белковому центру, образованному гистонами, они расположены таким образом, что при необходимости они позволяют вводить факторы транскрипции и другие белки, связанные с экспрессией или генетическим молчанием..
Гистоны могут подвергаться различным модификациям, которые генерируют множество вариантов, делая возможным существование множества различных форм хроматина, которые обладают способностью модулировать экспрессию генов различными способами..
черты
Они являются наиболее консервативными эукариотическими белками в природе. Например, было показано, что гистон гороха H4 отличается только двумя из 102 аминокислотных положений белка коровы H4..
Гистоны представляют собой относительно небольшие белки, содержащие не более 140 аминокислот. Они богаты основными аминокислотными остатками, поэтому они имеют положительный суммарный заряд, который способствует их взаимодействию с нуклеиновой кислотой, отрицательно заряженной, с образованием нуклеосом..
Известны нуклеосомные и соединительные или мостиковые гистоны. Нуклеосомными гистонами являются H3, H4, H2A и H2B, в то время как связывающие гистоны принадлежат к семейству гистонов H1..
Во время сборки нуклеосомы первоначально образуются специфические димеры H3-H4 и H2A-H2B. Два димера H3-H4 затем соединяются с образованием тетрамеров, которые впоследствии объединяются с димерами H2A-H2B, образуя октамерный центр.
Все гистоны синтезируются в основном во время S-фазы клеточного цикла, а нуклеосомы собираются в возникающие спирали ДНК сразу после репликационной вилки..
структура
Общая структура гистонов включает основную аминокислотную область и высококонсервативную глобулярную карбоксильную область среди эукариотических организмов..
Структурный мотив, известный как «гистоновая складка», состоящий из трех альфа-спиралей, соединенных двумя вилками и образующих небольшой гидрофобный центр, отвечает за белок-белковые взаимодействия между гистонами, составляющими нуклеосому..
Именно эта складка гистонов составляет глобулярный карбоксильный домен указанных нуклеосомных белков у всех эукариот.
Гистоны также имеют небольшие «хвосты» или аминоконцевые и другие карбоксилконцевые области (доступные для протеаз) длиной не более 40 аминокислот. Обе области богаты основными аминокислотами, которые могут подвергаться множественным посттрансляционным ковалентным модификациям.
Союз гистонов
У эукариот есть два семейства гистонов объединения, различающихся по строению. Некоторые имеют трехстороннюю структуру, причем описанный выше глобулярный домен окружен N- и C-концевыми «неструктурированными» доменами; в то время как другие имеют только C-терминал домена.
Хотя большинство гистонов являются консервативными, некоторые специфические варианты могут возникать во время эмбриогенеза или созревания специализированных клеток в некоторых организмах. Некоторые структурные изменения связаны с посттрансляционными модификациями, такими как:
—фосфорилированияСчитается, что это связано с изменением степени конденсации хроматина и обычно встречается в сериновых остатках..
—ацетилирование: связано с хромосомными областями, которые транскрипционно активны. Обычно это происходит в боковых цепях остатков лизина. При появлении на этих остатках положительный заряд уменьшается, уменьшая сродство белков с ДНК.
—метилирование: может быть представлен как моно-, ди- или триметилация остатков лизина, выступающих из ядра белка.
Специфические ферменты ответственны за внесение этих ковалентных модификаций в гистоны. Эти ферменты включают гистонацетилтрансферазы (HAT), гистондеацетилазные комплексы (HDAC) и гистонметилтрансферазы и деметилазы..
Характеристика гистонов была проведена различными биохимическими методами, среди которых выделяются хроматографии, основанные на слабых катионообменных смолах..
Некоторые авторы устанавливают метод классификации, при котором у эукариот выделяются 5 основных типов гистонов: FI с белками 21 кДа; F2A1 или FIV, плюс или минус 11,3 кДа; F2A2 или FIIbI, 14,5 кДа; F2B или FIIb2 с молекулярной массой 13,7 кДа и F3 или FIII 15,3 кДа.
Все эти типы гистонов, за исключением группы FI, обнаруживаются в эквимолярных количествах в клетках..
Другая классификация, с той же валидностью и, возможно, наиболее используемой в настоящее время, предполагает существование двух различных типов гистонов, а именно: те, которые являются частью нуклеосомного октамера, и гистоны соединения или моста, которые соединяют нуклеосомы между да.
Некоторые варианты могут также встречаться между видами и в отличие от ядерных гистонов, варианты синтезируются во время границы раздела и вставляются в предварительно образованный хроматин посредством процесса, зависящего от энергии, выделяемой при гидролизе АТФ..
Нуклеосомные гистоны
Ядро нуклеосомы состоит из пары каждого из четырех конститутивных гистонов: H2a, H2b, H3 и H4; поверх которых обернуты сегменты ДНК около 145 пар оснований.
Гистоны H4 и H2B в принципе неизменны. Однако некоторые изменения очевидны в гистонах H3 и H2A, биофизические и биохимические свойства которых изменяют нормальную природу нуклеосомы..
Вариант гистона H2A у человека, белок H2A.Z, имеет большую кислотную область и может способствовать стабильности нуклеосомы в зависимости от вариантов гистона H3, с которыми он связан..
Эти гистоны показывают некоторую изменчивость между видами, являясь особым случаем гистона H2B, для которого первая треть молекулы сильно варьирует.
Союз гистонов
Гистоны соединения или моста являются гистонами класса H1. Они ответственны за объединение между нуклеосомами и защитой ДНК, которая выступает в начале и в конце каждой частицы..
В отличие от нуклеосомных гистонов, не все гистоны типа H1 обладают глобулярной областью «складки» гистонов. Эти белки связываются с ДНК между нуклеосомами, способствуя изменению баланса хроматина в сторону более конденсированного и менее активного состояния, транскрипционно говоря.
Исследования связывают эти гистоны со старением, репарацией ДНК и апоптотическими процессами, поэтому считается, что они играют решающую роль в поддержании целостности генома.
функции
Все аминокислотные остатки гистонов так или иначе участвуют в их взаимодействии с ДНК, что объясняет тот факт, что они так консервативны среди царств эукариотических организмов..
Участие гистонов в упаковке ДНК в форме хроматина имеет большое значение для сложных многоклеточных организмов, в которых различные клеточные линии могут специализироваться только путем изменения доступности их генов для транскрипционного механизма..
Транскрипционно активные геномные области плотны в нуклеосомах, что позволяет предположить, что ассоциация ДНК с гистоновыми белками имеет решающее значение для негативной или позитивной регуляции их транскрипции..
Аналогично, в течение всей жизни клетки ответ на большое количество стимулов, как внутренних, так и внешних, зависит от небольших изменений в хроматине, которые обычно связаны с посттрансляционным ремоделированием и модификацией гистонов, обнаруженных в тесная связь с ДНК.
Множественные гистоновые переменные выполняют разные функции у эукариот. Один из них связан с участием варианта гистона Н3 в формировании центромерных структур, ответственных за сегрегацию хромосом во время митоза..
Было показано, что аналог этого белка у других эукариот необходим для сборки белкового кинетохора, с которым связываются микротрубочки веретена во время митоза и мейоза..
Гистоны: характеристика, строение, виды и функции
Содержание:
В гистоны являются основными белками, которые взаимодействуют с ДНК для образования нуклеосом, составляющих нити хроматина, из которых состоят хромосомы у эукариотических организмов.
Нуклеосомы, комплексы, состоящие из ДНК и белков, были открыты в 1974 году, и именно гистоны собирают этот базальный уровень организации хроматина. Однако о существовании гистоновых белков было известно еще до 1960-х годов.
Гистоны организованы таким образом, что двухполосная ДНК обвивает белковый центр, состоящий из этих белков, которые тесно взаимодействуют друг с другом. Гистоновый центр имеет форму диска, а ДНК повторяется в 1,7 раза.
Множественные водородные связи позволяют ДНК связываться с белковым центром, образованным гистонами в каждой нуклеосоме. Эти связи образуются по большей части между аминокислотными скелетами гистонов и сахарно-фосфатным скелетом ДНК. Также участвуют некоторые гидрофобные взаимодействия и ионные связи.
Белки, известные как «комплексы ремоделирования хроматина», ответственны за разрыв и образование соединений между ДНК и гистонами, позволяя транскрипционному аппарату проникать в ДНК, содержащуюся в нуклеосомах.
Гистоны могут подвергаться различным модификациям, которые генерируют множество вариантов, что делает возможным существование множества различных форм хроматина, которые обладают свойством модулировать экспрессию генов различными способами.
характеристики
Они являются одними из наиболее консервативных эукариотических белков в природе. Например, было показано, что гистон H4 гороха отличается только двумя из 102 положений аминокислот белка H4 коровы.
Во время сборки нуклеосом сначала образуются специфические димеры H3-H4 и H2A-H2B. Затем два димера H3-H4 соединяются вместе с образованием тетрамеров, которые позже объединяются с димерами H2A-H2B, образуя октамерный центр.
Все гистоны синтезируются в основном во время S-фазы клеточного цикла, а нуклеосомы собираются в зарождающихся спиралях ДНК сразу после репликационной вилки.
Состав
Общая структура гистонов включает область основной аминокислоты и область глобулярного карбоксила, высоко консервативную среди эукариотических организмов.
Структурный мотив, известный как «гистоновая складка», состоящий из трех альфа-спиралей, соединенных двумя шпильками и образующих небольшой гидрофобный центр, отвечает за белок-белковые взаимодействия между гистонами, составляющими нуклеосому.
Именно эта складка гистонов составляет глобулярный карбоксильный домен этих нуклеосомных белков у всех эукариот.
Гистоны также имеют небольшие аминоконцевые и другие карбоксиконцевые «хвосты» или участки (доступные для протеаз) длиной не более 40 аминокислот. Обе области богаты основными аминокислотами, которые могут подвергаться множественным посттрансляционным ковалентным модификациям.
Связывание гистонов
У эукариот есть два семейства связывающих гистонов, отличающихся друг от друга своей структурой. Некоторые из них имеют трехчастную структуру с описанным выше глобулярным доменом, фланкированным «неструктурированными» N- и C-концевыми доменами; в то время как другие имеют только C-концевой домен.
Хотя большинство гистонов консервативны, специфические варианты могут возникать во время эмбриогенеза или созревания специализированных клеток у некоторых организмов. Некоторые структурные вариации связаны с посттрансляционными модификациями, например следующие:
–Фосфорилирование: Считается, что это связано с изменением степени конденсации хроматина и обычно встречается в остатках серина.
–Ацетилирование: связаны с транскрипционно активными участками хромосом. Обычно это происходит на боковых цепях остатков лизина. Когда это происходит на этих остатках, их положительный заряд уменьшается, тем самым уменьшая сродство белков к ДНК.
–Метилирование: это может происходить как моно-, ди- или триметилирование остатков лизина, которые выступают из ядра белка.
За эти ковалентные модификации гистонов отвечают определенные ферменты. Эти ферменты включают гистонацетилтрансферазы (HAT), гистоновые деацетилазные комплексы (HDAC) и гистоновые метилтрансферазы и деметилазы.
Типы
Характеристика гистонов была проведена с помощью различных биохимических методов, среди которых выделяются хроматографии, основанные на слабых катионообменных смолах.
Некоторые авторы устанавливают форму классификации, в которой различают 5 основных типов гистонов у эукариот: FI с белками 21 кДа; F2A1 или FIV плюс-минус 11,3 кДа; F2A2 или FIIbI, 14,5 кДа; F2B или FIIb2 с молекулярной массой 13,7 кДа и F3 или FIII с 15,3 кДа.
Все эти типы гистонов, за исключением группы IF, обнаруживаются в клетках в эквимолярных количествах.
Другая классификация, с такой же достоверностью и, возможно, наиболее широко используемая сегодня, предполагает существование двух разных типов гистонов, а именно: тех, которые являются частью октамера нуклеосомы, и связывающих или мостиковых гистонов, которые соединяют нуклеосомы между да.
Некоторые варианты также могут встречаться между видами, и в отличие от гистонов ядра, варианты синтезируются во время интерфазы и вставляются в предварительно сформированный хроматин посредством процесса, зависящего от энергии, высвобождаемой при гидролизе АТФ.
Нуклеосомные гистоны
Центр нуклеосомы состоит из пары каждого из четырех составляющих гистонов: H2a, H2b, H3 и H4; на котором намотаны сегменты ДНК примерно из 145 пар оснований.
Гистоны H4 и H2B в принципе инвариантны. Однако очевидны некоторые вариации в гистонах H3 и H2A, биофизические и биохимические свойства которых изменяют нормальную природу нуклеосомы.
Вариант гистона H2A у человека, белок H2A.Z обладает большой кислотной областью и может способствовать стабильности нуклеосом в зависимости от вариантов гистона H3, с которыми он связан.
Эти гистоны демонстрируют некоторую вариабельность между видами, особым случаем является гистон H2B, для которого первая треть молекулы сильно вариабельна.
Связывание гистонов
Связывающие или мостиковые гистоны представляют собой гистоны класса H1. Они несут ответственность за объединение нуклеосом и защиту ДНК, которая выступает в начале и в конце каждой частицы.
В отличие от нуклеосомных гистонов, не все гистоны H1-типа обладают глобулярной областью гистоновой «складки». Эти белки связываются с ДНК между нуклеосомами, облегчая смещение баланса хроматина в сторону более конденсированного и менее активного состояния, говоря транскрипционно.
Исследования связывают эти гистоны со старением, репарацией ДНК и процессами апоптоза, поэтому считается, что они играют решающую роль в поддержании целостности генома.
Характеристики
Все аминокислотные остатки гистонов тем или иным образом участвуют в их взаимодействии с ДНК, что объясняет тот факт, что они столь консервативны среди царств эукариотических организмов.
Участие гистонов в упаковке ДНК в хроматиновой форме имеет большое значение для сложных многоклеточных организмов, в которых различные клеточные линии могут специализироваться только за счет изменения доступности их генов для транскрипционного аппарата.
Транскрипционно активные области генома плотно расположены в нуклеосомах, что позволяет предположить, что ассоциация ДНК с гистоновыми белками имеет решающее значение для отрицательной или положительной регуляции их транскрипции.
Аналогичным образом, на протяжении всей жизни клетки ответ на большое количество стимулов, как внутренних, так и внешних, зависит от небольших изменений хроматина, которые обычно связаны с ремоделированием и посттрансляционной модификацией гистонов, обнаруженных в тесная связь с ДНК.
Множественные гистоновые переменные выполняют разные функции у эукариот. Один из них связан с участием варианта гистона H3 в формировании центромерных структур, ответственных за сегрегацию хромосом во время митоза.
Аналог этого белка у других эукариот, как было показано, важен для сборки кинетохоры белка, с которой микротрубочки веретена связываются во время митоза и мейоза.
Ссылки
Что такое делитель напряжения? (с примерами)
Катится, катится к ДНК гистон
Asf1 подвозит гистоны — блоки для «строительства» хромосом
иллюстрация автора статьи
Автор
Редакторы
Каждый раз, когда клетки делятся митозом или мейозом, их ДНК расплетается и удваивается, умудряясь при этом сохранять свою структуру и целостность. Ювелирная упаковка ДНК (обеспечиваемая гистонами) жизненно важна, ведь именно от неё зависит, какие гены будут считываться и работать в той или иной клетке. Подробности того, как ДНК удаётся упаковаться каждый раз правильным образом и как происходит транспортировка нужных гистонов к месту сборки, выясняла команда биологов из Биотехнологического центра исследований и инноваций Университета Северной Дании и Университета Копенгагена. Эта работа вошла в кандидатскую диссертацию Илназ Климовской, сейчас — менеджера медицинских и научных проектов в «Новартис Фарма» в Москве. Результаты исследования опубликованы в журнале Nature Communications.
«Биология — наука 21 века»
Эта работа публикуется в рамках конкурса научно-популярных статей, проведенного на конференции «Биология — наука 21 века» в 2014 году.
Речь идёт о гистонах Н3-Н4
Разные, как две капли воды
Известно, что все клетки многоклеточного организма имеют одинаковый геном. Впрочем, данное утверждение не совсем точно — столь длинный код не может триллионократно копироваться без единой ошибки, чтобы все копии были абсолютно идентичны, но большинство «опечаток» всё же остаются незамеченными из-за избыточности генетического кода. Одно «слово» — код одной аминокислоты, или триплет, — может быть заменено другим, синонимичным ему, и такого рода «опечатка» не приведёт к смысловой замене в кодируемом белке.
Выходит, сотни и тысячи типов клеток, различающихся в зависимости от местоположения и функции, развиваются из одной и той же зиготы. Значит, один набор хромосом формирует и округлый со вмятинкой посередине безъядерный эритроцит, и многоядерную веретенообразную клетку поперечнополосатой мышечной ткани, и тянущие друг к другу руки отростков нейроны, и секреторную клетку поджелудочной железы, и все остальные клетки, в которых производятся специфические, только им необходимые белки и проходят такие разные химические реакции?
Клетки, на которые поделится зигота, несмотря на свою видимую идентичность, имеют огромный потенциал вариабельности. Так и две капли воды, кажущиеся абсолютно одинаковыми, могут иметь совершенно разный состав примесей, разное микробное «население» и ещё множество недоступных невооружённому глазу отличий. Но если с каплями всё понятно (они могут быть неразличимы на вид, но взяты из разных водоёмов или содержать разные добавки), то оплодотворённая яйцеклетка одна, и никто не добавляет вещества в поделившиеся клетки извне. Как же так получается? Если геном одинаков, а клетки все разные, — здесь явно задействованы какие-то механизмы, не связанные с последовательностью нуклеотидов в цепочке. Такие изменения иногда называют «надгеномными». Они происходят в течение жизни организма и могут передаваться потомству, хотя не влияют на последовательность ДНК (см. «Рыбки Danio rerio наследуют модификации ДНК от отца» [3]). Изучением таких изменений занимается наука эпигенетика, рассказывающая про три основных способа надгеномного регулирования:
Рисунок 1. Клетки одного и того же организма — самые непохожие близнецы, хотя и являются, по сути, копиями
иллюстрация автора статьи
Драгоценное кружево и узелковое письмо: зачем и как ДНК упаковывают в хроматин
Рисунок 2. Узелковое письмо кипу
Если бы мы смогли посмотреть на молекулу ДНК, мы увидели бы, что она похожа на очень длинную (примерно 1 метр — а ведь она умещается в клеточном ядре!) тонкую нить, плавающую, на первый взгляд, спутанным, но на деле — организованным комком в ядре клетки. Но простота такой модели обманчива (потому что в действительности всё намного интереснее) — перед тем, как клетка делится, нить упаковывается ещё плотнее, определённым образом «наматываясь на катушку», состоящую из белков-гистонов, образуя нуклеосому (структурную единицу хроматина).
Зачем вообще образуется хроматин? Во-первых, упаковка ДНК в организованную структуру даёт широкий простор для регуляции считывания информации, заложенной в ней. Какие-то участки можно оставить более открытыми, какие-то — более закрытыми, влияя тем самым на то, какая информация будет считываться. Во-вторых, нить в развёрнутом виде длинная, тонкая, может легко запутаться, порваться, а повреждение её чревато серьёзными последствиями (вплоть до гибели клетки). Нить ДНК уязвима для веществ, растворённых в цитоплазме клетки (туда она попадает после того, как в процессе деления защитный «сейф» ядерной оболочки, где клетка хранит своё главное богатство, растворяется), её запросто может без всякого злого умысла покромсать на кусочки какой-нибудь фермент. Оставить тонкую нить ДНК без защиты никак нельзя.
Вот представьте: вы купили в магазине большой моток дорогого прелестного и невероятно тонкого кружева ручной работы. Что будет, если вы его в размотанном виде начнёте протаскивать его сквозь терновые заросли? Правильно, оно порвётся в клочки. Но если его красиво, аккуратно и компактно упаковать, этого не произойдёт. Наша ДНК — творение куда более сложное, ценное, прекрасное и, не побоюсь этого слова, грандиозное, потому что ещё и несет на себе важное послание — нуклеотидный текст, ошибки в котором могут стать причиной серьёзных заболеваний, в том числе онкологических. Поэтому эволюция позаботилась о создании эффективного механизма упаковки такого бесценного сокровища — это и есть хроматин, о котором говорилось выше.
В генах нити ДНК, как в узелковом письме инков (кипу), записаны инструкции по сборке белков из аминокислот. От плотности «обмотки» вокруг гистонов зависит, какие гены будут «видны» транскрипционным факторам (ТФ) [5], прочитаны ими, и, следовательно, какие гены будут работать. Когда клетки делятся самым распространённым — митотическим — способом, внутри родительской клетки удваиваются и затем делятся между двумя дочерними все их составные компоненты, в том числе и ДНК. Для упаковки удвоенного количества ДНК в хроматин клетке нужно в два раза больше гистонов, этих строительных блоков, создающих каркас архитектуры хроматина.
Производство гистонов и производство ДНК в клетке чётко скоординированы. Эти два процесса похожи на циркачей, выполняющих совершенно синхронные трюки. Гистоны не возникают в нужное время и в нужном месте сами собой. Они производятся в цитоплазме клетки, поэтому им надо ещё как-то добраться до ядра, где спрятана клеточная ДНК. Транспортирует эти «кирпичики» на стройку специальный белок Asf1. Он относится к классу шаперонов — вспомогательных белков, которые отвечают за целостность и эффективность различных белков-партнёров. Именно Asf1 занимается высокоточной доставкой гистонов — то есть, является поставщиком строительного материала к месту возведения очередного шедевра природной архитектуры — хроматина.
Эй, прибавь-ка ходу, машинист!
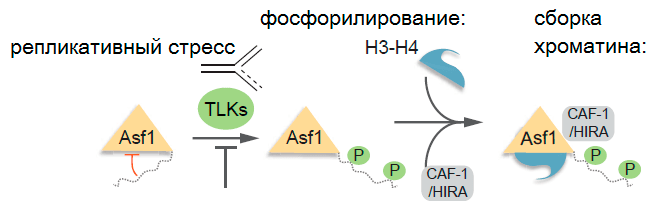
Asf1, который занимается перевозкой димера (объединения из двух молекул) гистонов H3—H4, может фосфорилироваться (присоединять остаток фосфорной кислоты) ферментом TLK1 (tousled-like kinase). Исследователи нашли сайты фосфорилирования — «крючочки», куда фермент может «повесить» фосфатную группу. С помощью метода масс-спектрометрии их нанесли на карту, показав, что фосфорилирование происходит во многих точках «хвостика» молекулы, содержащего сериновые и треониновые аминокислотные остатки. TLK1 особенно активен в тот промежуток времени, когда удваивается ДНК и синтезируются гистоны, — в S-фазе интерфазы (синтетического периода в промежутке между клеточными делениями), — затем его количество в клетке уменьшается. Фосфорилируя белок Asf1, TLK1 превращает его в высокоскоростной и сверхточный товарный поезд, обеспечивающий немедленную доставку «строительных материалов» к месту удвоения ДНК и сборки хроматина. Таким образом, учёные вышли на новый уровень понимания того, как регулируется развитие клеток. Верные и стоящие на своём месте гистоны определяют судьбу клетки: правильно ли она делает, если хочет стать непохожей на других? Стимулирует ли она рост и развитие организма, или встала на кривую дорожку, которая приведёт к онкологическому заболеванию?
Рисунок 3. TLK-1 (как и другие человеческие TLK) активен в синтетическом периоде интерфазы и подавляется действием репликативного стресса (нарушения правильного удвоения ДНК, что как раз и приводит к повреждению молекулы и может стать причиной онкологических заболеваний). Возможно, фосфорилирование Asf1 играет ключевую роль в транспортировке гистонов и сборке хроматина как во время нормального течения S-фазы (синтетического периода интерфазы), так и в ответ на репликативный стресс. Отсюда — надежды исследователей найти способ воздействия на раковые клетки, чтобы снизить их устойчивость к лечению. CAF-1 (chromatin assembly factor 1) и HIRA — ещё два из множества гистоновых шаперонов, участвующих в сборке хроматина.
В дальнейшем команда исследователей собирается глубже вникнуть в процесс дупликации хроматина и найти методы воздействия на деление и развитие опухолевых клеток с помощью TLK1 (например, нарушить поставки к ним гистонов при удвоении ДНК), постаравшись сделать раковые клетки менее устойчивыми.
Словарик терминов
Статья написана на основе пресс-релиза [1] и оригинальной публикации [2].