Для чего нужны клетки иммунологической памяти
Для чего нужны клетки иммунологической памяти
Вслед за праймированием антигеном и клональной экспансией лимфоцитов образуется популяция долгоживущих клеток иммунологической памяти, персистирующей неопределенно долго без деления до стимуляции последующей реинфекцией или реиммунизацией. Т-клетки памяти характеризуются особыми поверхностными маркерами (СД4/5RO) и хоминг-молекулами, связанными с определенным путем рециркуляции. При повторной встрече с тем же антигеном, даже много лет спустя, Т- и В-клетки отвечают более быстро и более интенсивно, чем при первичной встрече.
Клетки памяти на повторное введение того же антигена также реагируют анамнестическим (вторичным) ответом с продукцией большого количества специфических антител.
Немного известно о механизме продолжительной иммунологической памяти Т- и В-лимфоцитов в отсутствии выраженной хронической инфекции. Возможной причиной иммунологической памяти является продолжительная антигенная индукция, исходящая от фолликулярных дендритных клеток-ловушек в терминальных центрах лимфатических узлов, где происходит индукция В-клеток памяти. Опыты на кроликах, вакцинированных против бешенства, убеждают, что соматическая мутация В-клеток является результатом антигенспецифического иммунного ответа.
Так как соматические мутации не происходят в генах, кодирующих Т-клеточные рецепторы, а роль персистенции вирусного антигена не подтверждена, развитие иммунологической памяти Т-клеток зависит от размера клональной экспансии на первую встречу с антигеном. В этой связи при разработке новых, более эффективных вакцин следует обращать внимание на длительное поддержание Т-клеточной памяти.
Важно знать возникновение памяти у различных компонентов иммунной системы, а также ее персистенцию после иммунизации инактивированными и живыми вирусными вакцинами при различных путях введения.
Известны примеры, когда Тц-клетки памяти способны длительно персистировать в организме иммунизированных животных. После энтеральной иммунизации мышей реовирусом Тц-лимфоциты и клетки памяти, продуцирующие IgA, способны длительное время персистировать в лимфоидной ткани, особенно в пейеровых бляшках. В легких мышей, инфицированных вирусом гриппа, клетки, секретирующие специфические IgG и IgA, сохранялись в течение 11 мес, а время полужизни Тц клеток иммунологической памяти при гриппе человека составляет 2—3 года. Введение повышенной дозы вирусных антигенов способствовало ранней индукции Тц-клеток, оказывающих протективный эффект in vivo при бешенстве и ускоренному наступлению иммунитета при гепатите В.
Клон Тц-клеток памяти, способных реагировать на повторную иммунизацию, формируется к 30-му дню после введения антигена вируса бешенства. У мышей-реконвалесцентов Тц-клетки могут сохраняться в течение года, а у человека—в течение нескольких лет. Антитела к вирусу гепатита В после буферизации сохраняются в течение трех лет, а после иммунизации вакциной 17D против желтой лихорадки нейтрализующие антитела сохранялись 30—35 лет.
Существует мнение, что живые и инактивированные вакцины индуцируют В- и Тц-лимфоциты и клетки иммунологической памяти не столь эффективно, как естественное инфицирование. Так, иммунитет у переболевших корью людей сохраняется пожизненно, а после первичной иммунизации живой вакциной — около 15 лет.
Хотя инактивированные вирусные вакцины обычно индуцируют выработку антител и В-клеток памяти, тем не менее, они по-разному влияют на индукцию двух типов эффекторных клеток. Препараты инактивированного вируса гриппа вызывали у мышей длительную память Т-хелперов, но слабовыраженную память цитотоксических клеток. В то же время инактивированные препараты вируса парагриппа-1 типа Сендай, антигены которого эффективно включаются в структуру клеточных мембран, индуцируют образование Тц-клеток.
При одних заболеваниях (оспа человека, оспа животных, полиомиелит, чума крупного рогатого скота, классическая чума свиней) имеются живые вакцины, создающие длительный или пожизненный иммунитет, при других — разработаны высокоэффективные инактивированные или компонентные вакцины (ящур, болезнь Ауески, гепатит В и др.). Вакцинальный иммунитет во многих случаях по всем или основным компонентам иммунного ответа практически не уступает или немногим уступает состоянию реконвалесценции.
Таким образом, можно констатировать, что время появления, интенсивность образования антиген-стимулированных В- и Тц-клеток и персистенция клеток иммунологической памяти при прочих равных условиях зависит не столько от вида примененной вакцины (живой или инактивированной), сколько от ее антигенного воздействия на различные компоненты иммунной системы привитого организма. Реализация потенциальной антигенной активности вакцинных препаратов в значительной мере может зависеть от способа их введения, схемы применения, а в случае использования инактивированных вакцин также и от качества иммунологических адъювантов.
Характерным примером, демонстрирующим индукцию клинического иммунитета, могут служить вакцинные препараты против простого герпеса, предотвращающие заболевание, но не персистентную вирусную инфекцию. Указанная особенность присуща вакцинальному иммунитету при ряде других инфекций и, прежде всего, вызванных герпесвирусами.
Трехкратная парентеральная иммунизация обезьян инактивированной вакциной против полиомиелита предотвращала заболевание и экскрецию вируса с фекалиями после контрольного заражения. Однако у таких обезьян в ответ на введение вируса наблюдали бустерный антительный ответ, свидетельствующий о приживляемости вируса на вакцинальном фоне. У поросят с материнским иммунитетом ротавирус размножался в кишечнике и выделялся с фекалиями при отсутствии клинических признаков болезни. Подобные явления имеют место в случаях, когда переболевание, а тем более вакцинация, сопровождаются развитием относительно слабовыраженного иммунитета. Инфекции, при которых ре-конвалесценция сопровождается напряженным и длительным иммунитетом, теоретически могут контролироваться биологическим вакцинальным иммунитетом.
К ним, прежде всего, относятся остропротекающие инфекции, с выраженным системным иммунитетом, такие как корь, классическая чума свиней, чума крупного рогатого скота и др. Поросята, вакцинированные живой культуральной вакциной против классической чумы свиней, вскоре после парентерального контрольного заражения были свободны от вирулентного штамма вируса. При контакте с больными у вакцинированных животных не отмечали появления вторичных антител.
В заключение следует сказать, что эффективный гуморальный или клеточный иммунитет имеет поликлональную природу. В подтверждение сказанного можно привести два примера. Адоптивный перенос 4х107 Т-лимфоцитов двух субпопуляций (CD4 и CD8) от иммунизированных вирусом Раушера мышей полностью защищал реципиентов от виремии и спленомегалии после заражения вирусом. Перенос клеток одной из этих субпопуляций обеспечивал лишь частичную защиту мышей. Протективный иммунитет к вирусу японского энцефалита у мышей, коз и обезьян значительно усиливался после смешивания различных моноклональных вируснейтрализующих антител.
Существуют тесные взаимоотношения между резистентностью, клеточным и гуморальным иммунитетом. В реакциях клеточного иммунитета принимают участие как Тц-лимфоциты, так и антитела (например, в зависимой от антител клеточной цитотоксичности). Главные эффекторы резистентности — макрофаги — также играют важную роль эффекторов клеточного иммунитета. Активность их в известной мере зависит от комплемента, антител и лимфокинов.
Следует отметить, что иммунокомпетентные клетки не всегда играют положительную роль. Способность цитотоксических лимфоцитов разрушать зараженные вирусом клетки также может быть причиной развития иммунопатологических поражений органов и тканей. Кроме того, дендритные и макрофагальные клетки способны захватывать иммунные комплексы и сохранять их длительное время, что способствует развитию персистентной инфекции, обусловленной лентивирусами и вирусом алеутской болезни норок. А лимфоциты, являясь местом первичной латентной инфекции вирусом Эпштейн-Барр, способствуют распространению его в организме.
— Вернуться в оглавление раздела «Микробиология.»
Когда появляется иммунологическая память?
Человеческий эмбрион, находясь в утробе матери, не только взаимодействует с ее иммунными клетками, но и сам имеет различные популяции иммунных клеток, в том числе клеток памяти.
Автор
Редакторы
Когда B- и T-лимфоциты активируются в результате вторжения в организм какого-то патогенна, те из них, что способны распознавать антигены этого патогена, начинают размножаться, причем часть новых лимфоцитов не вступает непосредственно в схватку с врагом, а становится хранителем информации о его антигенах. Такие лимфоциты называют клетками памяти; они могут циркулировать в организме еще многие годы после столкновения с патогеном, и благодаря им при повторном заражении развивается молниеносный иммунный ответ, не оставляющий никаких шансов захватчику. Казалось бы, иммунные клетки памяти должны появляться в организме после рождения, когда он начинает сталкиваться с разнообразными бактериями и вирусами. Однако, как показало недавнее исследование, в кишечнике человеческого эмбриона имеется популяция CD4+ (то есть несущих на своей поверхности гликопротеин CD4) T-клеток, которые по молекулярным свойствам соответствуют клеткам памяти. Наша статья посвящена этому открытию.
О Т-клетках, обитающих в органах, не относящихся к иммунной системе, можно прочесть в статье «Т-лимфоциты: путешественники и домоседы» [1], а об особенностях иммунной системы новорожденных — в статье «Сказочка не для взрослых, или Об иммунитете новорожденных» [2].
Т-клетки были выявлены в кишечнике плода, небольшие их популяции также имеются в зародышевых лимфоузлах, тимусе и селезенке. Кроме того, CD4+ T-клетки, обладающие свойствами клеток памяти и эффекторных T-клеток, были обнаружены в крови, взятой из пуповины. Большая международная группа исследователей, провела всесторонний анализ T-клеток из кишечника человеческих эмбрионов и пришла к неожиданному выводу: в популяции кишечных T-клеток плода имеются CD4+ T-клетки памяти [3]! В состав исследовательской группы вошли и российские специалисты, работающие в Институте биоорганической химии и Сколковском институте науки и технологий: Софья Касацкая, Евгений Егоров, Марк Израэльсон, Ольга Британова и Дмитрий Чудаков. Как отмечает Софья, «лаборатория профессора Чудакова много лет сотрудничает с лабораторией Дэвида Прайса в Кардиффе по разным проектам, связанным с фундаментальными и медицинскими вопросами в иммунологии человека. Именно профессор Прайс решил позвать нас в этот проект, и так мы сделали для этой коллаборации подготовку ДНК-библиотек для высокопроизводительного секвенирования и провели анализ данных».
О проточной цитофлуориметрии, секвенировании ДНК и РНК, а также анализе индивидуальных репертуаров клеточных рецепторов можно прочесть в статьях на «Биомолекуле» [4–6].
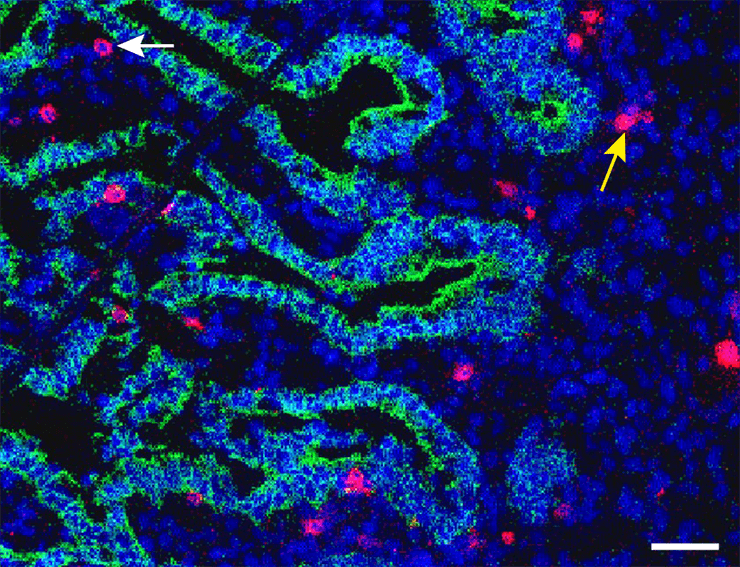
Конечно, Т-лимфоциты не находятся непосредственно в просвете кишки: они залегают в lamina propria (ресничном слизистом эпителии) (рис. 1); помимо лимфоидной ткани их можно найти в более глубоких слоях. В тонком кишечнике, клетки которого и исследовались в обсуждаемой работе, есть небольшие скопления лимфоцитов и В-клеточные фолликулы прямо под lamina propria, а также в более близком к поверхности (подслизистом) слое стенки кишечника.
Рисунок 1. Препарат тонкой кишки эмбриона. ДНК окрашена синим цветом, красным — CD3 (корецептор Т-клеток), зеленым — белок межклеточной адгезии E-кадгерин. Желтая стрелка указывает на наивные CD4+ T-лимфоциты, а белая — на CD4+ T-клетки памяти.
Всего выявили 22 группы Т-клеток, различающихся по экспрессии определенных белков-мáркеров; в их числе имеются наивные (то есть еще не сталкивавшиеся с антигенами) T-клетки и регуляторные T-клетки, а также T-клетки памяти. Среди них обнаружили CD4+ клетки памяти, в которых наблюдалась повышенная экспрессия белка Ki-67, служащего индикатором делящихся клеток. Кроме того, они секретировали провоспалительные цитокины интерферон-γ (INF-γ) и интерлейкин-2 (IL-2). Таким образом, исследователи показали, что разделение Т-клеток на наивные, регуляторные и клетки памяти, а также формирование обособленных популяций «оседлых» Т-клеток происходят очень рано — еще в период эмбрионального развития организма.
Стоит отметить, что популяция наивных Т-клеток в кишечнике плода гораздо больше популяции Т-клеток памяти, в то время как у взрослого человека бóльшая часть Т-клеток кишечника, напротив, приходится на клетки памяти. Ученые предполагают, что Т-клетки памяти плода формируются при локальном столкновении наивных T-клеток с чужеродными антигенами в зародышевых лимфоузлах, в которые мигрирующие из тимуса наивные Т-клетки заходят перед тем, как окончательно «осесть» в кишечнике. Антигенами, которые запускают образование эмбриональных T-клеток памяти, могут быть молекулы лейкоцитарных антигенов матери или фрагменты молекул патогенов, которые попали в амниотическую жидкость. Исследователи отмечают, что образование разнообразных иммунных клеток в кишечнике плода подготавливает его к столкновению с множеством бактерий, которое ждет его сразу же после рождения. Таким образом, формирование популяций специализированных иммунных клеток, в том числе и клеток памяти, начинается еще в период внутриутробного развития.
Как работает иммунитет. Основные понятия
Механизм иммунного ответа и иммунные клетки. Основные понятия.

(краткий обзорный материал)
СОДЕРЖАНИЕ:
Цитокины
«Азбука Морзе» организма
Подробнее о цитокинах см. по кнопке-ссылке:
Упомянутая выше условность классификации означает, что цитокин, входящий в одну из перечисленных групп, при определенных условиях в организме может сыграть диаметрально противоположную роль — например, из провоспалительного превратиться в противовоспалительный.
Без налаженной связи между видами войск любая хитроумная военная операция обречена на провал, поэтому клеткам иммунной системы очень важно, принимая и отдавая приказы в виде цитокинов, правильно их интерпретировать и слаженно действовать. Если цитокиновые сигналы начинают вырабатываться в очень большом количестве, то в клеточных рядах наступает паника, что может привести к повреждению собственного организма. Это называется цитокиновым штормом: в ответ на поступающие цитокиновые сигналы клетки иммунной системы начинают продуцировать всё больше и больше собственных цитокинов, которые, в свою очередь, действуют на клетки и усиливают секрецию самих себя. Формируется замкнутый круг, который приводит к разрушению окружающих клеток, а позже и соседних тканей.
Иммунные клетки
По порядку расчитайсь!
Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении условно разделяют на четыре группы.
Врожденный иммунитет
Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркерам — так называемым образам патогенности [4]. Эти маркеры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с чужаками. Для нашего организма подобными маркерами могут служить фрагменты клеточной стенки и жгутиков бактерий, двухцепочечная РНК и одноцепочечная ДНК вирусов, и т.д. При помощи специальных рецепторов врожденного иммунитета, таких как TLR (Toll-like receptors, Толл-подобные рецепторы) и NLR (Nod-like receptors, Nod-подобные рецепторы), клетки взаимодействуют с образами патогенности и приступают к реализации своей защитной стратегии.
Теперь подробнее рассмотрим некоторые клетки врожденного иммунитета.
Адаптивный иммунитет
«спецподразделения вооруженных сил организма»
Видео 2. Кратковременные взаимодействия Т-клеток с дендритной клеткой ( ДК ) (обозначена зеленым ). Видео снято при помощи прижизненной двухфотонной микроскопии. →
T-лимфоциты
Видео 3. Движение Т-хелперов ( красные ) и Т-киллеров ( зеленые ) в лимфоузле. Видео снято при помощи прижизненной двухфотонной микроскопии. →
Всё вышесказанное относится к αβ-Т-лимфоцитам, однако существует еще один тип Т-клеток — γδ-T-лимфоциты (название определяет состав белковых молекул, образующих TCR) [7]. Они относительно малочисленны и в основном заселяют слизистую оболочку кишечника и другие барьерные ткани, играя важнейшую роль в регуляции состава обитающих там микробов. У γδ-T-клеток механизм распознавания антигенов отличается от αβ-Т-лимфоцитарного и не зависит от TCR [8].
B-лимфоциты
Схема иммунного ответа
Когда организм атакуют патогены, в бой в первую очередь вступают клетки врожденного иммунитета — нейтрофилы, базофилы и эозинофилы. Они выделяют вовне содержимое своих гранул, способное повредить клеточную стенку бактерий, а также, например, усилить кровоток, чтобы как можно больше клеток поспешило в очаг инфекции.
Одновременно с этим дендритная клетка, поглотившая патоген, спешит в ближайший лимфоузел, где передает информацию о нём находящимся там Т- и В-лимфоцитам. Те активируются и путешествуют до местонахождения патогена (рис. 2). Битва разгорается: Т-киллеры при контакте с зараженной клеткой убивают ее, Т-хелперы помогают макрофагам и В-лимфоцитам осуществлять их механизмы защиты. В итоге патоген гибнет, а победившие клетки отправляются на покой. Бόльшая их часть погибает, но некоторые становятся клетками памяти, которые поселяются в костном мозге и ждут, когда их помощь снова понадобится организму.
Так выглядит схема любого иммунного ответа, однако она может заметно видоизменяться в зависимости от того, какой именно патоген проник в организм. Если мы имеем дело с внеклеточными бактериями, грибами или, скажем, глистами, то основными вооруженными силами в этом случае будут эозинофилы, В-клетки, продуцирующие антитела, и Th2-лимфоциты, помогающие им в этом. Если же в организме поселились внутриклеточные бактерии, то на помощь в первую очередь спешат макрофаги, которые могут поглотить инфицированную клетку, и Th1-лимфоциты, помогающие им в этом. Ну а в случае вирусной инфекции в бой вступают NK-клетки и Т-киллеры, которые уничтожают зараженные клетки методом контактного киллинга.
Как мы видим, многообразие типов иммунный клеток и механизмов их действия неслучайно: на каждую разновидность патогена у организма припасен свой эффективный способ борьбы (рис. 3).
Рисунок 3. Основные типы патогенов и клетки, принимающие участие в их уничтожении.
А теперь все вышеописанные иммунные перипетии — в коротком видео.
Видео 5. Механизм иммунного ответа. →
Аутоиммунитет
громыхает «гражданская война».
К сожалению, ни одна война не обходится без потерь среди гражданского населения. Долгая и интенсивная защита может дорого стоить организму, если агрессивные высокоспециализированные войска выйдут из-под контроля. Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом [2]. Заболеваниями этого типа страдает около 5% человечества.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани в соответствии со своей специфичностью.
За аутоиммунные поражения организма могут быть ответственны как Т-, так и В-клетки. Первые осуществляют непосредственное убийство безвинных клеток, несущих на себе соответствующий антиген, а также помогают аутореактивным В-клеткам в продукции антител. Т-клеточный аутоиммунитет хорошо изучен при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
В-лимфоциты действуют куда более изощренно. Во-первых, аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги. Во-вторых, мишенями для антител могут стать рецепторы на поверхности клетки. При связывании такого антитела с рецептором тот может или блокироваться, или же активироваться без реального гормонального сигнала. Так происходит при болезни Грейвса : В-лимфоциты производят антитела против рецептора к ТТГ (тиреотропному гормону), мимикрируя действие гормона и, соответственно, усиливая продукцию тиреоидных гормонов. При миастении гравис антитела против рецептора к ацетилхолину блокируют его действие, что приводит к нарушению нейромышечной проводимости. В-третьих, аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность — наличие определенного варианта какого-либо гена.
Кроме того, на развитие болезни может влиять уровень экспрессии аутоантигена в тимусе. Например, продукция инсулина и, соответственно, частота презентации его антигенов Т-клеткам различается от человека к человеку. Чем она выше, тем ниже риск развития сахарного диабета первого типа, так как это позволяет удалить специфичные к инсулину Т-лимфоциты.
Заключение
Как мы уже убедились, иммунитет — это сложнейшая сеть взаимодействий как на клеточном, так и на молекулярном уровнях. Создать идеальную систему, надежно защищающую организм от атак патогенов и одновременно ни при каких условиях не повреждающую собственные органы, не смогла даже природа. Аутоиммунные заболевания — побочный эффект высокой специфичности работы системы адаптивного иммунитета, те издержки, которыми нам приходится платить за возможность успешно существовать в мире, кишащем бактериями, вирусами и другими патогенами.
Гемопоэтическая стволовая клетка
Кем быть? Как гемопоэтическая стволовая клетка «выбирает профессию «
Часть ГСК находится в состоянии покоя: такие клетки неактивны и не участвуют в клеточном цикле. Но проснувшись, гемопоэтическая стволовая клетка делает очень важный выбор. Уникальным свойством всех стволовых клеток является способность к самообновлению — так называют симметричное деление с образованием идентичных копий материнской клетки. Так гемопоэтическая стволовая клетка может практически бесконечно продлять свое детство.
* — По современным данным, гемопоэтическая стволовая клетка «взрослеет», постепенно теряя способность к самообновлению и приобретая способность к дифференцировке. А решение выбрать «рабочую специальность», то есть мегакариоцитарное и эритроцитарное направление дифференцировки, клетка принимает еще до того, как рассмотрит варианты с «учебой» и «армией» (миелоидным или лимфоидным ростками) [11].
Общие лимфоидные предшественники дают начало клеткам иммунной системы — NK-клеткам, T- и B-лимфоцитам, — которые защищают организм от вторжения. NK-клетки (большие гранулярные лимфоциты) убивают чужаков, T-лимфоциты могут распознавать эпитоп (участок антигена ) врага и организовывать наступление (T-хелперы) или атаковать самостоятельно (цитотоксические лимфоциты), а B-лимфоциты, тоже после знакомства с антигеном, могут превращаться в плазматические клетки, вырабатывать специфические антитела и поражать ими врага на расстоянии.
Каким же образом гемопоэтическая стволовая клетка решает, оставаться ей вечно юной или встать на путь дифференцировки и превратиться в зрелую клетку крови? И как она выбирает свою будущую профессию? Результаты большого количества исследований доказывают, что важную роль играет окружение гемопоэтической стволовой клетки*. В первую очередь, это различные виды клеток, формирующие гемопоэтическую нишу костного мозга.
Однако выбор профессии — непростой процесс. И огромную роль в нём, помимо внешнего воздействия, играют личные предпочтения и склонности. Как и у человека, у гемопоэтической стволовой клетки богатый и сложный внутренний мир, который представлен транскрипционными факторами. Именно их взаимодействия приводят в конечном итоге к принятию решения, кем же ей быть [17, 18].
Конечно, представление работы транскрипционных факторов в виде механических блоков — чрезвычайное упрощение. Кроме того, описанные взаимодействия — лишь малая часть огромной сети транскрипционных факторов. В настоящее время ведутся масштабные исследования, чтобы составить представление о внутренних факторах, участвующих в регуляции дифференцировки гемопоэтической стволовой клетки, и об их взаимосвязи с внешними факторами, такими как влияние других клеток и растворимых факторов. Все эти знания помогут лучше понять процессы, лежащие в основе кроветворения в норме и при различных заболеваниях, разработать подходы к лечению этих заболеваний, а также научиться управлять судьбой гемопоэтических стволовых клеток in vitro и in vivo.
Дополнительная информация:
К разделу:
Дополнительно см.:
Источник (по материалам): А. Боголюбова. Иммунитет: борьба с чужими и… своими. / Спецпроект: аутоиммунные заболевания / biomolecula 26.01.2017
Литература:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ