Для чего нужны нуклеиновые кислоты в организме человека
Нуклеиновые кислоты
Что такое жизнь? – вопрос, который неоднократно задает себе каждый человек. На это можно ответить по-разному и один из ответов может звучать так: жизнь — это способ существования белковых тел. А главные составляющие последних – нуклеиновые кислоты. Нуклеиновые кислоты – важнейшие биополимеры, которые содержатся во всех без исключения живых организмах и являются не только хранителем и источником генетической информации, но и выполняют ряд других жизненно важных функций — активно поддерживают и стимулируют процессы синтеза белковых веществ в организме, что необходимо для обновления клеточных структур, составляющих основу всех тканей и органов. Актуальность данного процесса нельзя переоценить при терапии для людей, страдающих хроническими заболеваниями, а также при реабилитации больных после хирургических операций, особенно на мягких тканях. Используют нуклеиновые кислоты и для снижения скорости старения клеток и тканей, что улучшает общеоздоравливающее воздействие при комплексной терапии, особенно в возрасте после 45-50 лет.
Существует два типа нуклеиновых кислот – дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). ДНК представляет собой генетический материал большинства организмов. Основная масса ДНК расположена в клеточном ядре, где она связана с белками в хромосомах.
Что же касается РНК, то по выполняемым ими функциям различают информационные РНК, в которых записана информация о первичной структуре белка; рибосомные РНК — входят в состав рибосом; транспортные РНК — обеспечивают доставку аминокислот к месту синтеза белка.
Минимальные информационные фрагменты нуклеиновых кислот — нуклеотиды, состоящие из остатков азотистого основания, пентозы и фосфорной кислоты. Нуклеиновые кислоты играют важную структурную роль в клетке, являются компонентами рибосом, митохондрий и других внутриклеточных структур.
Интерес к нуклеиновым кислотам, как средству, используемому при различных патологических состояниях, появился более ста лет назад. И.Горбачевский (1883) и М. Морек (1894) использовали нуклеиновые кислоты с лечебной целью при волчанке. Позднее А. Косеель сообщил, что нуклеиновые кислоты обладают выраженным бактерицидным действием. Начиная с конца 19 века некоторые российские и зарубежные исследователи, еще задолго до открытия антибиотиков, используют нуклеиновые кислоты для борьбы с такими возбудителями инфекционных заболеваний, как холерный вибрион, кишечная и бугорчатая палочки, стафилококк, стрептококк, диплококк и др.
Полученные данные в 70-х годах прошлого столетия показывают эффективность введения нуклеиновых кислот в организм человека: их доставка к клетке происходила без разрушения. Активно размножающиеся ткани (костный мозг, эпителий тонкого кишечника, селезенка) интенсивно поглощали ДНК, а при стрессовом воздействии клетки и ткани органов активно захватывали ДНК.
Достаточно долгое время считалось, что организм способен самостоятельно синтезировать необходимое количество нуклеиновые кислоты. Новые научные данные свидетельствуют о том, что это не совсем корректно. В ряде случаев, при интенсивном росте, стрессе, ограниченном питании потребности организма могут значительно превосходить возможности синтеза нуклеиновых кислот. В этом случае иммунитет человека снижается. Расстройства нуклеинового обмена являются одной из причин индукции патологических процессов вообще и иммунопатологических в частности.
Борьба за иммунитет стала первым, но не единственным направлением по использованию нуклеиновых кислот в клинической практике. Было установлено, что они являются важным компонентом интегрального иммунологического гомеостаза организма. Расстройства нуклеинового обмена являются одной из причин индукции патологических процессов вообще и иммунопатологических в частности. То есть, можно сказать, что нуклеиновые кислоты обладают «многозадачностью».
Наиболее чувствительны к дефициту нуклеиновых кислот быстро делящиеся клетки — эпителий, клетки кишечника, печени и лимфоидная ткань, отвечающая за иммунитет и детоксикацию. Процессы деления клетки со временем сопровождаются постепенным укорачиванием ее ДНК, что приводит к разрушению клетки и возникновению патологических процессов во всем организме. Именно укорачивание ДНК лежит в основе теории старения. А поступающие в организм фрагменты нуклеиновых кислот (ДНК) способствуют замедлению уменьшения структуры ДНК. Это позволяет предотвратить либо замедлить патологические процессы. Происходит обновление старых и восстановление поврежденных клеток, качественно повышаются регенеративные способности тканей. Результат сказывается на состоянии внутренних органов и систем, их функционирование.
Существует несколько типов препаратов на основе нуклеиновых кислот: препараты микробного происхождения, препараты животного происхождения, синтетические препараты.
Натуральный комплекс « Артемия Голд » — это источник нуклеиновых кислот (ДНК, РНК) и дополнительный источник йода из икры (яиц) рачка артемия (Artemia sp.).
Бесспорно, что организм является саморегулирующей системой. Однако в каждой системе может произойти сбой. Именно в этот момент важно, чтобы организм получил именно те вещества, которые смогут компенсировать потери и наладить работу системы. По мнению исследователей из НИИ эпидемиологии и микробиологии СО РАМН э тими веществами могут быть препараты нуклеиновых кислот различного происхождения, которые являются перспективными терапевтическими и иммуномодулирующими агентами.
— Агаджанян Н. А., Баевский Р. М., Берсенева А. П. Проблемы адаптации и учение о здоровье. — М.: Изд-во РУДН, 2006. — 284 с.
— Аппель Б., Бенеке Б.И. Бененсон Я. Нуклеиновые кислоты. От А до Я. – Москва: Изд-во: Бином. Лаборатория знаний, 2013
— Бенджамин С. Фрэнк. Лечения старения и дегенеративных заболеваний нуклеиновой кислотой. — Нью-Йорк, Психологическая библиотека, 1974 г.
— Коровина Н.А., Захарова И.Н., Малова Н.Е., Лыкина Е.В. Роль нуклеотидов в питании ребенка первого года жизни. Педиатрия. 2004, — Т.83. — № 5, С.65-68.
— Мамонова Л.Г. Значение нуклеотидов в питании детей раннего возраста. Вопросы современной педиатрии. 2007, 6 (6), С.113-116.
— Тутельян В.А., Суханов Б.Н., Австриевских А.Н., Позняковский В.М. Биологически активные добавки в питании человека (оценка качества и безопасности, эффективность, характеристика, применение в профилактической и клинической медицине). – Томск: Изд-во НТЛ, 1999. – 296 с.
— Федянина Л.Н., Беседнова Н.Н., Эпштейн Л.М., Каленик Т.К., Блинов Ю.Г. Лекарственные препараты и биологически активные добавки к пище на основе нуклеиновых кислот различного происхождения. – Владивосток: Тихоокеанский медицинский журнал, 2007, №4. – С. 9-12.
Биологическая роль ДНК и РНК
ДНК – самая важная молекула для всех живых существ, даже растений. Она определяет наследование, кодирования белков и содержит инструкции для развития и размножения всего организма и каждой его клетки в отдельности. Достижения генетики позволили раскрыть информацию, содержащуюся в ДНК, и использовать ее с пользой для людей. Теперь каждый может сделать конфиденциальный ДНК-тест, чтобы получить ответы на самые сложные вопросы. Давайте узнаем больше, как работает и какова биологическая роль ДНК.
Какие функции выполняет ДНК в организме
ДНК несет ответственность за рост и поддержание жизни, что выражается в выполнении этой молекулой трех функций.
Таким образом, на что влияет ДНК в организме? Размеры ее влияния огромны – эта молекула содержит инструкции, необходимые организму для развития, жизни и размножения. Эти инструкции находятся внутри каждой клетки и передаются от обоих родителей их детям.
ДНК помогает синтезу РНК
Матричная РНК, или мРНК, – это одноцепочечная промежуточная молекула, которая переносит генетическую информацию от ДНК в ядре к цитоплазме, где она служит шаблоном в образовании полипептидов. мРНК синтезируется в ядре с использованием нуклеотидной последовательности ДНК в качестве матрицы.
Процесс создания мРНК из ДНК называется транскрипцией и происходит в ядре. мРНК направляет синтез белков, который происходит в цитоплазме. мРНК, образованная в ядре, транспортируется из ядра в цитоплазму, где она присоединяется к рибосомам. Белки собираются на рибосомах с использованием нуклеотидной последовательности мРНК в качестве инструкции. Таким образом, мРНК несет «сообщение» от ядра к цитоплазме. Сообщение закодировано в нуклеотидной последовательности мРНК, которая комплементарна нуклеотидной последовательности ДНК, служившей матрицей для синтеза мРНК. Создание белков из мРНК называется трансляцией. В этом заключается биологическая роль РНК.
Молекулярные болезни и связь молекул ДНК
Молекулярное, или генетическое, заболевание – это любое заболевание, вызванное сбоем на молекулярном уровне, то есть в молекуле ДНК. Генетическая аномалия может варьироваться от незначительной до крупной – от одной мутации в единственном основании в ДНК до грубой хромосомной аномалии, включающей изменение количества или набора хромосом. Мутации могут происходить либо случайно, либо из-за воздействия окружающей среды.
Существует ряд различных типов генетических нарушений обмена, в том числе:
Однако далеко не все мутации в генах – это приговор. Гены могут включаться и выключаться при определенных условиях среды. Поэтому даже имея предрасположенность к тому или иному заболеванию, для предупреждения их развития человек может соблюдать назначенный врачом план питания и тренировок, отказываясь от вредных привычек.
Строение и действие гена РНК
ДНК – дезоксирибонуклеиновая кислота, а РНК – рибонуклеиновая кислота. Хотя и ДНК, и РНК несут генетическую информацию и имеют связь между собой, между ними довольно много различий. Что общего между ДНК и РНК и в чем отличия?
Функции ДНК и РНК в организме разные. ДНК отвечает за хранение и передачу генетической информации, в то время как РНК непосредственно кодирует аминокислоты и выступает в качестве посредника между ДНК и рибосомами для производства белков.
Преимущества проведения анализов в лаборатории Медикал Геномикс Украина
Лаборатория Медикал Геномикс Украина – крупнейшая в стране английская лаборатория генетических исследований. Здесь вы можете пройти любой генетический тест, в том числе для установления родственных отношений, а также медицинские, генеалогические исследования.
Мы работаем быстро и качественно, гарантируя конфиденциальность и высокую точность результата, поскольку используем передовое оборудование, а каждый тест проверяется двумя независимыми группами ученых.
Позвоните нам, если у вас есть вопросы – наши консультанты ответят на них и помогут оформить заказ. Сдать биоматериалы можно в одном из наших 78 пунктов приема образцов по всей Украине или заказав набор для домашнего забора материала.
Возможность использования нуклеиновых кислот как лекарственного средства
Интерес к нуклеиновой кислоте, как лекарственному средству, по протяженности укладывается в столетний период. Публикации об особой способности нуклеиновой кислоты повышать общую сопротивляемость организма стали появляться в 1892 году. Горбачевский в 1883 г., и Морек в 1894 г., использовали нуклеиновую кислоту для лечения волчанки. А. Косеель сообщил, что нуклеиновая кислота обладает выраженным бактерицидным действием, поэтому играет основную роль в борьбе с заразным началом.
Г. Воген в 1894 г., Е. Вард в 1910 г., Б и Ф.Г.Буткевич в 1912 г., успешно лечили легочный и костный туберкулез, впрыскивая под кожу нуклеиново-кислый натрий. Исаев в 1894 г., Милке в 1904., Лейн в 1909 г., Писарев в 1910 г., Абелуа и Бадье в 1910 г., расценивали нуклеиновую кислоту как специфически действующее вещество в процессе сопротивляемости организма против таких вредных бактерий, как холерный вибрион, кишечная и бугорчатая палочки, стафилококк, стрептококк, диплококк, сибирская язва, а также против дифтерии и столбнячного токсинов. С. Штерн заменил ртутное лечение сифилиса лечением нуклеиновой кислотой и достиг у больных полного исчезновения всех проявлений сифилиса.
В последующем, открытие роли ДНК, как главного носителя генетической информации, надолго отвлекло исследователей от дальнейшего исследования нуклеиновых кислот как лекарственных средств. Кроме того, недооценка интенсивности обмена нуклеиновых кислот привела к тому, что длительное время нуклеиновые кислоты и нуклеотиды вообще не рассматривались как незаменимые питательные вещества, или нутриенты. Считалось, что организм способен самостоятельно синтезировать необходимое количество нуклеотидов для физиологических потребностей.
Новые научные данные свидетельствуют о том, что это не совсем корректно. В ряде случаев, при интенсивном росте, стрессе, ограниченном питании потребности организма могут значительно превосходить возможности синтеза нуклеотидов.
Каковы же главные источники нуклеотидов? Их три:
1. Нуклеотиды в составе пищи.
2. Утилизация нуклеотидов, высвобождаемых в процессах внутриклеточного метаболизма.
3. Синтез необходимых нуклеотидов из аминокислот и углеводов.
После долгого перерыва вновь началось исследование возможности использования экзогенной ДНК для лечения различных патологий. Так, еще в 1959 году Каназир с сотрудниками опубликовали работу по увеличению выживаемости облученных крыс при введении им изологичной натриевой соли ДНК, полученной из селезенки и печени. При этом выживаемость облученных животных возрастала от 2,6% в контроле до 30-40% в опытной группе.
Таким образом, стимуляция ради стимуляции исключитель- нд вредна. Какой выход из этого тупика? Можно ли поддержать иммунную систему на протяжении всей жизни? Ведь не секрет, что большинство заболеваний имеет инфекционную природу. Даже синдром хронической усталости является вирусным заболеванием.
Нуклеиновые кислоты настолько ценный материал, что все клетки моментально стараются захватить части ДНК или РНК, появляющиеся после распада отживших клеток. Захватывают, и вставляют в свою структуру даже без разбора на составные части. Этот механизм хорошо исследован на бактериях, которые обмениваются генетической информацией с помощью выделенных фрагментов ДНК и РНК.
Высокая, но все еще недостаточная эффективность существующих схем лечения влечет за собой необходимость поиска альтернативных технологий, способных восстанавливать функцию миокарда, таких, например, как использование стволовых клеток. Перспективным представляется также разработка препаратов блокирующих процессы программируемой гибели клеток сердечной мышцы.
Высокий метаболизм клеток сердца делает их чрезвычайно уязвимыми при ишемии, в условиях дефицита энергетических и пластических субстратов. В моделях на животных было показано, что ишемия приводит к уменьшению содержания в сердечной мышце нуклеиновых кислот. Аналогичный дисбаланс нуклеотидов при ишемии отмечается в субэндокардиальных слоях человеческого сердца. Подтверждением тому является исследование Ludith L. соавт., которые изучили содержание нуклеотидов в биопсийных материалах, полученных во время операций на открытом сердце у пациентов, страдающих ишемической болезнью сердца. Исследователи обнаружили, что содержание нуклеиновых кислот в глубоких слоях миокарда было снижено на 20%. Они предположили, что восстановление баланса нуклеотидов с использованием препаратов ДНК и нуклеиновых кислот может оказать защитное влияние на клетки сердца и препятствовать развитию апоптоза.
Эта гипотеза была подтверждена японскими исследователями Satoh К. и соавт. в 1993 году в эксперименте на собаках.
В опытах было показано значительное улучшение сократительной способности сердечной мышцы животных в условиях после внутривенного введения «коктейля» из нуклеиновых кислот. В экспериментах на животных препараты на основе натриевой соли ДНК показали эффективность при аритмиях, возникающих при восстановлении кровотока после ишемии.
Проведенные клинические испытания с препаратами на основе натриевой соли ДНК показали, что препараты способны улучшать клиническое состояние, уменьшать частоту, продолжительность и интенсивность приступов стенокардии, улучшать сократительную способность сердца, увеличивать переносимость физических нагрузок у пациентов, страдающих ишемической болезнью сердца. Несмотря на то, что в эти исследования было включено относительно небольшое количество пациентов, а многие из выявленных различий не имеют статической значимости, полученные данные позволяют предполагать, что исследование препаратов ДНК является перспективным направлением в кардиологии и требует проведения более масштабных клинических исследований.
Старение вызывается вырождением клеток. Наш организм построен из миллионов клеток, каждая из которых живет около двух лет или меньше. Но, прежде чем погибнуть, клетка воспроизводит себя. Почему мы не выглядим так же, как десять лет назад? Причина в том, что при каждом успешном воспроизводстве клетка претерпевает определенное изменение, в сущности, вырождение. Так что, по мере того, как наши клетки меняются или вырождаются, мы стареем.
Доктор Фрэнк рекомендует диету, согласно которой морепродукты едятся семь раз в неделю, с двумя стаканами снятого молока, стаканом фруктового или овощного сока и четырьмя стаканами воды ежедневно. Уже после 2 месяцев дополнительного приема ДНК-РНК и диеты доктор Фрэнк обнаружил, что у пациентов появилось больше энергии, как свидетельство, значительно сократилось количество сладок и морщин, и кожа выглядела более здоровой, розовой и помолодевшей.
Однако важно заметить, что СОД быстро теряет активность при отсутствии таких важных минеральных веществ как цинк, медь и марганец. Дегидроэпиандростерон (ДГЭА), натуральный гормон, вырабатываемый надпочечниками, сегодня тоже стал применяться против старения, так как одним из его свойств является способность «снижать возбуждение» в процессах в организме и, таким образом, замедлять образование способствующих старению жиров, гормонов и кислот.
Область применения нуклеотидов в гастроэнтерологии охватывает широкий спектр заболеваний, которые объединены общими патогенетическими звеньями: воспаление, когда имеется дефицит потребления клеток иммунной системы; дефекты эпителия, когда требуется репарация поврежденных тканей; гормональный дисбаланс и интоксикационный синдром вследствие различных поражений печени, когда требуется пластический материал для восстановления клеток печени и их синтетической функции.
Адекватное питание у тяжелых больных призвано решать следующие задачи:
• Поддержание структуры и функции клеток кишечника (энтероцитов)
• Восстановление барьерной и иммунной функции кишки
• Снижение возможности проникновения патогенных бактерий и токсинов в кровь.
Использование питания, обогащенного нуклеотидами, показано при следующих состояниях:
• Ожоги, травмы, большие операции
• Трансплантация костного мозга
• Инфекции/сепсис
• Воспалительные заболевания кишки
• Некротизирующий энтероколит
• Синдром короткой кишки
• Повреждение слизистой оболочки при критическом состоянии, а также при лучевой и химиотерапии
• Дисфункция иммунной системы, связанная с критическим состоянием, трансплантацией костного мозга.
Так, при использовании иммунопитания у больных с указанными заболеваниями наблюдалось:
• Значительное (в 2 раза) снижение частоты инфекционных осложнений
• Снижение продолжительности госпитализации, в среднем, на 3,86 дня
• Снижение летальности на 30%.
Таким образом, к настоящему времени накоплено большое количество данных, свидетельствующих об эффективности использования фрагментированной ДНК в качестве диетического компонента при самой разнообразной патологии. Имеются доказательства пользы от использования фрагментированной ДНК в качестве стимулятора гемопоэза и иммуномодулятора у пациентов с лучевой болезнью, а также у ослабленных больных. Использование фрагментированной ДНК способствует восстановлению барьерной и иммунной функции кишечника у пациентов, находящихся в критическом состоянии, что позволяет значительно снизить смертность у крайне тяжелых пациентов. Перспективным направлением является использование фрагментированной ДНК в гастроэнтерологии и кардиологии, что диктует необходимость проведения более крупных исследований в этих областях. Мечта о сохранении молодости не оставляла человечество с давних времен. Возможно, что нуклеиновые кислоты окажутся одним из таких «чудо-средств», способных замедлить процессы старения человеческого организма.
Рибосомальная 16S РНК, полимеразная цепная реакция (ПЦР) и секвенирование биополимеров
ОБЩИЕ СВЕДЕНИЯ О СЕКВЕНИРОВАНИИ БИОПОЛИМЕРОВ
16S рРНК, полимеразная цепная реакция (ПЦР) и секвенирование биополимеров (ДНК и РНК)
Содержание:
Важнейшее правило, которое необходимо было четко уяснить после изучения структуры и свойств ДНК, и которое является одной из основ молекулярной биологии, является правило (или принцип) комплементарности:
Такое взаимодействие играет ключевую роль в ряде фундаментальных процессов хранения и передачи генетической информации: репликации ДНК, обеспечивающей передачу генетической информации при делении клетки, транскрипции ДНК в РНК при биосинтезе белков, хранении генетической информации в двухцепочечной ДНК и процессах репарации ДНК при ее повреждении. Таким образом, принцип комплементарности лежит в основе различных взаимодействий, удвоения либо репликации молекул ДНК, по нему образуется дочерняя цепочка. При последующем делении материнской клетки каждая дочерняя получает по 1 копии молекулы ДНК. Многие методы секвенирования ДНК основаны на взаимной комплементарности цепей этой молекулы. Этот принцип лежит в основе амплификации (см. ПЦР ) целевых фрагментов ДНК и их последующего секвенирования.
Итак, нуклеотидный состав ДНК подчиняется правилам Э. Чаргаффа:
А = Т, Г = Ц
2. Количество пуринов равно количеству пиримидинов:
А + Г = Т + Ц
Нуклеотидный состав РНК подобным правилам не подчиняется.
Новый взгляд на микромир
Развитие методов молекулярной биологии вывело ученых на новый уровень понимания процессов симбиоза человека и его микрофлоры, которые казались хорошо изученными и от дальнейшего изучения которых не ждали особых сюрпризов. Стремительный рост скорости и падение стоимости методов секвенирования ДНК (определения ее нуклеотидной последовательности) и параллельный рост мощности персональных компьютеров и развитие интернета дали возможность анализировать информацию о крупных участках геномов. После того как были расшифрованы хромосомы сотен видов отдельных бактерий, в генетике микроорганизмов появился новый подход — популяционный: анализ генов сразу всех бактерий, населяющих определенный ареал. Разумеется, население «человеческого биореактора» оказалось одной из наиболее важных для изучения микробных популяций.
Первая работа, заставившая совершенно по-новому взглянуть на кишечную микробиоту, была опубликована в 1999 году группой ученых из Национального института агрономических исследований (Франция) и Университета Ридинга (Великобритания). Авторы решили применить для исследования микробной популяции кишечника метод секвенирования генов 16S РНК.
16S рPHK — удостоверение личности бактерии
Идентификация любого штамма начинается с описания физиологических характеристик микроорганизмов. Однако, не всегда знание данных признаков позволяет с уверенностью определить систематическую принадлежность к тому или иному роду и виду.
Чтобы избежать ложноположительных результатов при первичной идентификации штаммов, для окончательной идентификации выделенных бифидобактерий (и др. прокариот) необходим анализ секвенирования гена рибосомной 16S РНК.
Современные методики
Идеальный маркер
Новая систематика
В последнее время идет интенсивный пересмотр старой, фенотипической классификации бактерий, основанной на плохо формализуемых критериях — от внешнего вида колоний до пищевых предпочтений и способности окрашиваться разными красителями. Новая систематика опирается на молекулярные критерии (16S РНК) и только отчасти повторяет фенотипическую.
Что у нас внутри
СЕКВЕНИРОВАНИЕ БИОПОЛИМЕРОВ

ATGCAGAACAGACGATCAGCGACACTTTA
TACGTCTTGTCTGCTAGTCGCTGTGAAAT
Было бы, конечно, удобно, если бы нам удалось аккуратно «вытянуть» одну нить ДНК и спокойно, нуклеотид за нуклеотидом, «прочесть» эту нить от начала до конца. При таком идеальном методе секвенирования (чтения ДНК) никаких хитрых алгоритмов не понадобилось бы. К сожалению, на данном этапе такое невозможно, и приходится довольствоваться результатами того секвенирования, которое есть.
Секвенирование РНК
Метод секвенирования РНК становится основным методом определения того, какие гены и на каком уровне экспрессируются в клетке. С помощью РНК секвенирования можно определять различия в экспрессии генов на различных стадиях развития организма или в разных тканях.
Секвенирование ДНК
Секвенирование ДНК – это общее название методов, которые позволяют установить последовательность нуклеотидов в молекуле ДНК. В настоящее время нет ни одного метода секвенирования, который бы работал для молекулы ДНК целиком; все они устроены так: сначала готовится большое число небольших участков ДНК (клонируется молекула ДНК многократно и «разрезается» её в случайных местах), а потом читается каждый участок по отдельности.
Рис. 5. Схематическое изображение процесса репликации ДНК: (1) Отстающая цепь (запаздывающая нить), (2) Ведущая цепь (лидирующая нить), (3) ДНК-полимераза α ( Polα ), (4) ДНК-лигаза, (5) РНК-праймер, (6) Праймаза, (7) Фрагмент Оказаки, (8) ДНК-полимераза δ ( Polδ ), (9) Хеликаза, (10) Однонитевые ДНК-связывающие белки, (11) Топоизомераза.
На следующем этапе полимераза копирует ДНК, после чего процесс можно повторять: после новой денатурации отдельных нитей будет уже вдвое больше, на третьем цикле – вчетверо, и так далее.
Все эти эффекты достигаются в основном с помощью изменений температуры смеси из ДНК, праймеров и полимеразы; для наших целей важно, что это достаточно точный процесс, и ошибки в нём редки, а на выходе получается большое число копий участков одной и той же ДНК. Разные методы секвенирования отличаются друг от друга не методами клонирования, а тем, как потом прочесть получившийся «суп» из многочисленных копий одной и той же ДНК.
Если имеется желание ознакомиться с темой секвенирования более детально, а не в обзорном порядке, то в данном разделе предусмотрен т.н. » материал в помощь «, где в трех литературных источниках и в видеолекциях можно найти всю интересующую информацию к темам этой страницы.
СЕКВЕНИРОВАНИЕ ОТ А ДО Я
1. Выделение ДНК и РНК
Выделение нуклеиновых кислот
Практически все научные исследования в области молекулярной биологии на той или иной стадии включают этап выделения нуклеиновых кислот. Выделенные нуклеиновые кислоты затем используют в ПЦР, секвенировании и для множества других задач, причем технологии выделения различаются не только по принципу своего действия, но и в зависимости от типа биоматериала и последующего применения экстракта.
Впервые нуклеиновые кислоты пытались выделить в середине XIX века, когда ещё практически ничего не было известно об этих молекулах. Однако с момента открытия структуры и свойств ДНК технологии её выделения непрерывно модифицируются и совершенствуются. В данной статье рассматриваются самые распространенные, а также прогрессивные методики, используемые для экстракции нуклеиновых кислот.
На сегодняшний день имеется множество специализированных методик, которые могут использоваться для выделения нуклеиновых кислот с высокой степенью очистки. Наиболее известные из них относятся к методикам осаждения НК на суспензионный носитель и выделения НК на колонках. Однако набирают популярность и другие методы, о которых будет сказано позднее.
1. В зависимости от того, из какого организма выделяют НК используют различные методы разрушения клеток:
Часто используют обработку детергентами, растворяющих мембраны клеток, и хелатирующими агентами, подавляющих действие клеточных нуклеаз за счѐт связывания двухвалентных катионов.
2. Отделение нуклеиновых кислот от белков
Когда нуклеиновые кислоты остаются в водном растворе:
ДНК осаждают из раствора этанолом и после центрифугирования растворяют осадок в буферном растворе. Вместе с ДНК частично выделяется и РНК, от которой избавляются с помощью фермента РНКазы.
Концентрацию полученной нуклеиновой кислоты, а также наличие примесей (белки) обычно определяют спектрофотометрически по поглощению на А260 нм. Максимум поглощения белка приходится на 280 нм. Одна (каждая) оптическая единица соответствует концентрации ДНК в 50 мкг/мл.
Для оценки чистоты препарата ДНК, свободного от РНК, проводят измерения оптической плотности раствора при длинах волн 260, 280 и 235 нм, т.е. на максимумах поглощения растворов ДНК, белков и полисахаридов, соответственно. Значение соотношения А260/280 для чистой ДНК должно быть больше 1,8. Значение А260/235 должно быть больше, чем 2,2.
Пять популярных методик выделения нуклеиновых кислот
Выделение фенол-хлороформом
Рис. 7. Схема протокола выделения фенол-хлороформным методом.
Первое упоминание об использовании этого метода встречается в статье 1967 года, и с тех пор эта технология является одним из самых распространённых способов выделения нуклеиновых кислот.
Суть методики заключается в смешивании клеточного лизата с фенолом, хлороформом и изоамиловым спиртом в пропорции 25:24:1 и последующем перемешивании и центрифугировании смеси. После проведения этих манипуляций получается раствор с двумя фазами: водной и органической, причем все липиды и жиры находятся в органической (нижней) фазе, белки — на границе фаз, а нуклеиновые кислоты — в водной (верхней) фазе (Рис.7). Для повышения чистоты экстракта эти действия повторяют несколько раз. Если раствор будет иметь низкий pH, то ДНК перейдёт в органическую фазу, а РНК останется в водной фазе, что позволяет выделять РНК отдельно от ДНК.
Данный метод используется повсеместно, поскольку он не требует дополнительного сложного оборудования и имеет невысокую стоимость. Однако нуклеиновые кислоты, полученные таким образом, обладают невысоким качеством и зачастую требуют дополнительной очистки. Также эта технология имеет существенно меньший выход нуклеиновых кислот в сравнении с другими методиками.
Помимо качества экстракта, этот метод обладает ещё несколькими недостатками: он требует сложных манипуляций, которые могут привести к контаминации и потере образца, а сам процесс трудно автоматизировать. Также весь протокол занимает достаточно много времени.
Выделение на спин-колонках
Рис. 8. Схема протокола выделения на спин-колонках.
Технология выделения на спин-колонках — это усовершенствованный метод экстракции на частичках силики, предложенный американскими учёными в 1979 году. Они продемонстрировали, что в щелочных условиях и при повышенных концентрациях соли ДНК связывается с силикатами, и это позволяет отделить все остальные компоненты клетки от частиц силики со связанной ДНК. Спин-колонки сконструированы таким образом, что при нанесении клеточного лизата на колонку и последующем центрифугировании ДНК остаётся на колонке, а всё лишнее проходит сквозь неё (Рис.8). Затем ДНК промывают несколько раз и элюируют в пробирку для сбора образца.
Преимущества такого метода заключаются в повышенной чистоте и хорошем качестве выделенных нуклеиновых кислот, высокой воспроизводимости и простоте по сравнению с выделением фенол-хлороформом. Однако также большое количество манипуляций может привести к контаминации, а выделение коротких фрагментов ДНК на спин-колонках может быть затруднено.
Экстракция на спин-колонках может занять от 20 минут в зависимости от биоматериала и сложности его лизиса.
На рынке этот метод представлен большим разнообразием наборов от таких производителей, как Qiagen, Analytik Jena, NEB, ThermoFisher и других. Стоимость одного выделения здесь значительно выше, чем у предыдущего метода, поскольку на каждую реакцию необходима своя колонка, несколько пробирок для сбора фильтрата и элюата и, конечно, реагенты.
Выделение на магнитных частицах
Рис. 9. Схема протокола выделения на магнитных частицах.
Этот метод имеет те же преимущества, что и выделение на спин-колонках, но для экстракции на магнитных частицах не требуется сложное лабораторное оборудование (например, центрифуга). Более того, процесс выделения на магнитных частицах легко автоматизировать, и многие автоматические станции выделения основаны именно на этой методике. Однако здесь также присутствует риск контаминации и потерь образца.
Данный протокол выделения займет немного меньше времени благодаря отсутствию этапов центрифугирования, но количество манипуляций будет примерно таким же. Также стоимость одной реакции обычно выше, чем при выделении на колонках, а панели наборов предоставляют Qiagen, Analytik Jena, ThermoFisher и другие.
Умное выделение (Smart Extraction)
Рис. 10. Схема протокола умного выделения. Протокол основан на принципе работы наборов для выделения компании Analytik Jena.
Методики выделения нуклеиновых кислот не перестают совершенствоваться: в 2005 году специалисты из компании Analytik Jena доказали, что для связывания нуклеиновых кислот с неорганической твёрдой фазой можно использовать не только хаотропные соли, но и смесь из хаотропных и нехаотропных солей с низкой ионной силой, эту технологию они назвали Dual Chemistry.
Позднее они усовершенствовали технологию Dual Chemistry при помощи немагнитных частиц с «умной» поверхностью. Для выделения используются специальные наконечники с этими частицами, которые надеваются на дозатор. При заборе клеточного лизата в наконечник нуклеиновая кислота из раствора связывается с частицами, затем следуют этапы промывки и элюции, в результате чего получается очищенная нуклеиновая кислота высокого качества (Рис.10).
Эта технология значительно ускоряет процесс выделения, а благодаря особенностям «умной» поверхности выход и качество нуклеиновых кислот значительно превосходит все предыдущие методы. Данный способ экстракции очень легко автоматизировать, ведь носики со связывающими частицами подходят как для обычных лабораторных дозаторов, так и для различных автоматических станций выделения нуклеиновых кислот.
Ферментативное температурно-зависимое выделение
Рис. 11. Схема протокола ферментативного температурно-зависимого выделения. Протокол основан на принципе работы наборов для выделения компании MicroGEM. * — несмотря на невысокую степень очистки, образец отлично подходит для дальнейшего использования в ПЦР, секвенировании и STR.
Все вышеперечисленные методики имеют общую лимитирующую стадию — этап лизиса. Во всех технологиях используется SDS и протеиназа K для разрушения клеточных стенок и высвобождения нуклеиновых кислот. SDS является ингибитором ПЦР, именно поэтому необходимы множественные стадии промывки, которые повышают риск контаминации и приводят к потерям образца. Также более сложные для лизиса образцы могут требовать дополнительную долгую и трудозатратную пробоподготовку.
Специалисты из новозеландской компании MicroGEM ликвидировали проблемы, связанные с длительным и сложным лизисом и использованием вредных химикатов, благодаря применению очень эффективной термофильной протеиназы EA1 вместе с мезофильными гидролазами.
Процесс ферментативного температурно-зависимого выделения начинается со смешивания буфера и ферментов с образцом. При последующей инкубации при комнатной температуре гидролазы деградируют клеточные стенки. После этого пробирку нагревают до 75°C, что активирует работу протеиназы EA1, которая разрушает все белки и высвобождает нуклеиновые кислоты. Последующее нагревание до 95°C дезактивирует EA1, и после этого образец готов для дальнейшего исследования (Рис.11). Для особо загрязненных образцов вроде почвы или растений можно добавить этап очистки на колонке для избавления от ингибиторов.
Данная технология оптимальна для работы с малым количеством биоматериала, поскольку нет потерь нуклеиновых кислот. Также эту методику легко автоматизировать, она самая быстрая среди всех упомянутых способов выделения (от 7 минут) и включает меньше всего манипуляций. Стоимость одной реакции невысока, поскольку кроме реагентов не требуется никаких специальных расходных материалов.
2. Разрезание и сшивание ДНК
Рестрикция и рестриктазы
Разрезание ДНК с помощью рестрикционных эндонуклеаз

Итак, рестриктазы – это группа ферментов, относящихся к классу гидролаз, катализирующих гидролиз фосфодиэфирных связей чужеродных ДНК в большинстве прокариотических и некоторых других организмах и выполняющие тем самым «иммунную» функцию – системы рестрикции-модификации. Для исследований их выделяют преимущественно из прокариотических клеток.
Данные ферменты, «узнающие» определенные последовательности (сайты рестрикции) в двухцепочечной ДНК, расщепляют нуклеиновые кислоты в середине молекулы. При этом каждая рестриктаза узнаѐт определѐнный участок ДНК длиной от четырѐх пар нуклеотидов и расщепляет нуклеотидную цепь внутри участка узнавания или вне него.
Различают 3 класса рестриктаз:
Также рестриктазы делят на мелко- и крупнощепящие. Мелкощепящие рестриктазы узнают тетрануклеотид (последовательность из 4-х пар оснований) и вносят в молекулы гораздо больше разрывов, чем крупнощепящие, узнающие последовательность из шести нуклеотидных пар.
Рестрикционный анализ ДНК
Для каждого фермента рестрикции существуют оптимальные условия реакции, которые приводятся в описании, прилагаемом фирмой-изготовителем. Основные переменные параметры – это температура инкубации и состав буфера. К температурному режиму предъявляются достаточно жесткие требования, тогда как различия между буферами чаще всего лишь незначительны.
Рестрикционный анализ ДНК широко используется в молекулярно-биологических исследованиях и прикладных работах и является одним из наиболее важных инструментов при изучении ДНК. При помощи эндонуклеаз рестрикции можно исследовать ДНК различных вирусов, бактерий, животных, растений.
Как правило, продукты расщепления ДНК анализируются с помощью гель-электрофореза в агарозном или акриламидном геле, а полученная таким образом картина разделения фрагментов ДНК в виде определенного, отличающегося для разных ферментов, набора полос и является результатом рестрикционного анализа той или иной ДНК.
Короткие фрагменты мигрируют намного быстрее, чем длинные. При сравнительно высокой концентрации агарозы большие фрагменты вообще не могут проникнуть в гель. В процессе миграции рестрикционные фрагменты не деградируют, их можно вымывать в виде биологически активных двухцепочечных молекул. При окрашивании гелей красителями, связывающимися с ДНК, выявляется набор полос, каждая из которых отвечает рестрикционному фрагменту, молекулярную массу которого можно определить, проведя калибровку с помощью ДНК с известными молекулярными массами (подробнее см. об электрофорезе).
Метод рестрикционного картирования позволяет увидеть крупные генетические изменения, такие как делеции или инсерции. При этом происходит уменьшение или увеличение рестрикционных фрагментов, а также исчезновение или возникновение сайтов рестрикции.
Лигирование
Сшивание молекул ДНК посредством ферментов ДНК-лигаз
Рисунок 14. Реакция Т4 ДНК-лигазы
3. Разделение молекул ДНК и белков
Метод гель-электрофореза
Часто приходится иметь дело со смесью молекул ДНК разной длины. Например, при обработке химически выделенной из организма ДНК рестриктазами как раз получится смесь фрагментов ДНК, причем их длины будут различаться.
Поскольку любая молекула ДНК в водном растворе отрицательно заряжена, появляется возможность разделить смесь фрагментов ДНК различных размеров по их длине с помощью электрофореза. ДНК помещают в гель (обычно, агарозный для относительно длинных и сильно отличающихся молекул или полиакриламидный для электрофореза с высоким разрешением), который помещают в постоянное электрическое поле. Из-за этого молекулы ДНК будут двигаться к положительному электроду (аноду), причем их скорости будут зависеть от длины молекулы: чем она длиннее, тем сильнее ей мешает двигаться гель и, соответственно, тем ниже скорость. После электрофореза смеси фрагментов разных длин в геле образуют полосы, соответствующие фрагментам одной и той же длины. С помощью маркеров (смесей фрагментов ДНК известных длин) можно установить длину молекул в образце
Физический принцип метода заключается в следующем. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, величина и знак которого зависят от рН среды. Если через этот раствор, заключенный в канал из изолирующего материала начать пропускать электрический ток, то вдоль канала установится определенный градиент напряжения, т.е. сформируется электрическое поле. Его напряженность измеряется разностью потенциалов по концам рабочего канала (или его участка), отнесенной к его длине (В/см). Под действием поля макромолекулы в соответствии со своим суммарным зарядом мигрируют в направлении катода или анода, причем их трение об окружающую среду ограничивает скорость миграции. В зависимости от величины заряда и размеров молекулы приобретают разные скорости, и в этом – сущность процесса электрофореза. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны одинаковых молекул, мигрирующих с одной и той же скоростью. Со временем эти зоны распределяются по длине канала.
В современных приборах рабочий канал заполняют гелем. Достаточно чистая и хорошо смачиваемая (гидрофильная) пространственная сетка геля удерживает жидкость от вытекания и препятствует конвекции. Вместе с тем, используемые гели содержат очень много жидкости (80-99,5%), в которой (т.е. в рабочем буфере) и мигрируют макромолекулы. Наличие сетки геля вносит важную дополнительную деталь в картину электрофоретической миграции. Теперь фракционируемые макромолекулы любых размеров неизбежно сталкиваются с нитями полимера, образующего сетку геля, что увеличивает эффективное трение о среду, а следовательно, снижает скорость движения молекул. Очевидно, что препятствия для миграции становятся особенно серьезными, если средний диаметр пространственных ячеек геля оказывается соизмерим с размерами макромолекул. В этом случае решающее влияние на электрофоретическую подвижность различных макромолекул и степень разделения оказывает соотношение их линейных размеров. Возможна даже такая ситуация, когда особенно крупные молекулы нуклеиновых кислот вообще не смогут «протиснуться» через поры геля и их миграция прекратится.
В настоящее время почти исключительно используются полиакриламидные гели (ПААГ) и гели агарозы. Варьируя концентрацию полимера, можно получать гели с очень широким диапазоном размеров пор. Кроме того, можно изменять электрические заряды макромолекул путем вариации рН буфера, а их конфигурацию путем введения в буфер денатурирующих агентов или детергентов. Все это придает методу электрофореза исключительную гибкость. Но есть, разумеется, и свои проблемы. Разделяемые макромолекулы все же находятся в растворе, поэтому возможна их диффузия, приводящая к размыванию зон. Это тем более серьезно, что протекание через жидкость электрического тока неизбежно связано с выделением тепла. К счастью, крупные молекулы нуклеиновых кислот диффундируют не слишком быстро.
Для визуализации результатов электрофореза проводят окрашивание зон путем вымачивания геля в растворе красителя, прочно связывающегося с нуклеиновой кислотой. Излишек красителя удаляют, а гель облучают ультрафиолетом, под действием которого связавшийся с двунитевой ДНК краситель флуоресцирует.
А) Электрофорез в полиакриламидном геле
Как и во всех формах гель-электрофореза, молекулы могут работать в своем естественном состоянии, сохраняя структуру молекул более высокого порядка, или может быть добавлен химический денатурант, чтобы удалить эту структуру и превратить молекулу в неструктурированную линейную цепь, подвижность которой зависит только от ее длины и отношение массы к заряду.
Таким образом, разделяют т.н. нативный ПААГ-электрофорез (при котором разделяемые биологические макромолекулы в процессе электрофореза остаются в нативном состоянии) и денатурирующий ПААГ-электрофорез (при котором пробы предварительно денатурируют, в случае нуклеиновых кислот используют непродолжительное нагревание пробы с формамидом либо глиоксалем, для денатурации белков обычно используют кипячение пробы в буфере, содержащем сильный ионный детергент (обычно додецилсульфат натрия SDS).
Базовые приготовления
Приготовление акриламидных гелей
Гели обычно состоят из акриламида, бисакриламида, необязательного денатурирующего вещества (SDS) и буфера с отрегулированным pH. Раствор можно дегазировать под вакуумом, чтобы предотвратить образование пузырьков воздуха во время полимеризации. Источник свободных радикалов и стабилизатор, такой как персульфат аммония и TEMED, добавляются для инициирования полимеризации.
Реакция полимеризации создает гель из-за добавленного бисакриламида, который может образовывать поперечные связи между двумя молекулами полиакриламида. Гели, как правило, полимеризуются между двумя стеклянными пластинами в гелеобразователе, с гребнем, вставленным вверху для создания лунок для образца. После того, как гель полимеризован, «расческа» может быть удалена, и гель готов для электрофореза.
Электрофорез
В PAGE используются различные буферные системы в зависимости от природы образца и цели эксперимента. Буферы, используемые на аноде и катоде, могут быть одинаковыми или разными. Электрическое поле воздействует на гель, заставляя отрицательно заряженные белки мигрировать через гель от отрицательного электрода (катода) к положительному электроду (аноду). В зависимости от их размера каждая биомолекула движется по-разному через матрицу геля: маленькие молекулы легче проникают через поры в геле, в то время как более крупные имеют большую сложность. Гель обычно работает в течение нескольких часов, хотя это зависит от напряжения, приложенного к гелю; Миграция происходит быстрее при более высоких напряжениях, но эти результаты обычно менее точны, чем при более низких напряжениях. По истечении заданного времени биомолекулы мигрируют на разные расстояния в зависимости от их размера. Меньшие биомолекулы движутся дальше вниз по гелю, в то время как более крупные остаются ближе к точке происхождения. Следовательно, биомолекулы могут быть разделены примерно в соответствии с размером, который зависит в основном от молекулярной массы в денатурирующих условиях, но также зависит от конформации высшего порядка в нативных условиях.
Результаты: ПААГ чаще всего окрашивают с помощью кумасси бриллиантового синего R-250 или серебряного красителя), что позволяет визуализировать отделенные белки, или подвергают дальнейшей обработке (например, Вестерн-блоттингом ). После окрашивания биомолекулы разных видов появляются в виде отдельных полос внутри геля. Для калибровки геля и определения приблизительной молекулярной массы неизвестных биомолекул путем сравнения пройденного расстояния относительно маркера обычно используют маркеры размера молекулярной массы с известной молекулярной массой на отдельной дорожке в геле.
Кроме «обычного» электрофореза в пластине из геля, в некоторых случаях используют капиллярный электрофорез, который проводят в очень тонкой трубочке, наполненной гелем (обычно полиакриламидным). Разрешающая способность такого электрофореза значительно выше: с его помощью можно разделять молекулы ДНК, отличающиеся по длине всего на один нуклеотид. Об одном из важных приложений такого метода читайте в описании метода секвенирования ДНК по Сэнгеру.
Б) Электрофорез ДНК в агарозном геле
Рис. 17. Элекрофорез в агарозном геле
Самым популярным методом электрофореза с гелем является использование агарозного геля. Именно этот гель, как среду с определенным рН, используют в целях разделения, очищения и идентификации отдельных фрагментов ДНК. Почему эта методика стал столь популярна в современной генетике? Не все лабораторные методы могут разделить некоторые фрагменты ДНК, что мешает получить 100 %-нтный результат исследования. Гель электрофорез помогает выделить и разделить фрагменты дезоксирибонуклеиновой кислоты. За счет трений материалов, образующих гель, формируется «молекулярное сито», что помогает дифференцировать молекулы в соответствии с размером и зарядом. Скорость движения заряженных частиц ДНК через образованные поры в электрическом поле зависят от нескольких факторов:
Выявление определенной последовательности ДНК в смеси. Саузерн блоттинг
Рис. 19. Саузерн—блоттинг (от англ. Southern blot) — метод, применяемый в молекулярной биологии для выявления определённой последовательности ДНК в образце. Метод Саузерн-блоттинга сочетает электрофорез в агарозном геле для фракционирования ДНК с методами переноса разделённой по длине ДНК на мембранный фильтр для гибридизации.
Сначала необходимо синтезировать ДНК-зонд, комплементарный той последовательности, которую мы ищем. Он обычно представляет собой одноцепочечную молекулу ДНК длиной 10–1000 нуклеотидов. Из-за комплементарности зонд свяжется с необходимой последовательностью, а за счет флуоресцентной метки или радиоизотопов, встроенных в зонд, результаты можно увидеть.
Рис. 20. Схема проведения Саузерн-блоттинга
Адаптация этой методики для определения специфических последовательностей РНК называется, в противоположность Саузерн-блоттингу, норзерн-блоттингом ( northern blotting : southern по-английски означает «южный», а northern — «северный»). В этом случае проводят электрофорез в геле с молекулами мРНК, а в качестве зонда выбирают одноцепочечную молекулу ДНК или РНК.
Денатурирующий градиентный гель-электрофорез (DGGE)
Выше мы рассмотрели основные принципы работы гель-электрофореза. Однако все чаще в литературе, посвященной исследованиям по секвенированию ДНК, можно встретить информацию об использовании метода ДГЭ или денатурирующего градиентного гель-электрфореза. В частности упоминается о т.н. ПЦР-ДГЭ. По существу, ПЦР-ДГЭ включает амплификацию ДНК с помощью родоспецифических праймеров, которые нацелены на последовательности 16S рДНК, и последующую дифференцировку этой ДНК на денатрурирующем геле.
Денатурирующий градиентный гель-электрофорез (DGGE или Denaturation Gradient Gel Electrophoresis) работает путем нанесения небольшого образца ДНК (или РНК) на электрофорезный гель, содержащий денатурирующий агент. Обнаружено, что определенные денатурирующие гели способны индуцировать расплавление ДНК на различных стадиях. В результате этого плавления ДНК распространяется по гелю и может быть проанализирована на отдельные компоненты, даже такие небольшие, как 200-700 пар оснований.
Уникальность метода DGGE заключается в том, что по мере того, как ДНК подвергается все более экстремальным условиям денатурации, расплавленные нити полностью распадаются на отдельные нити. Процесс денатурации на денатурирующем геле очень резкий (большинство фрагментов плавятся в пошаговом процессе). Дискретные части или домены фрагмента внезапно становятся одноцепочечными в очень узком диапазоне денатурирующих условий. Это позволяет различать различия в последовательностях ДНК или мутации различных генов: различия в последовательности фрагментов одинаковой длины часто приводят к тому, что они частично плавятся в разных положениях градиента и поэтому «останавливаются» в разных положениях геля.
Градиент денатурации достигается разницей температур, различной концентрацией мочевины или формальдегида в гелях. При этих условиях одинаковые по величине двухнитевые молекулы ДНК, отличающиеся по нуклеотидной последовательности, денатурируют по-разному. Разработан компьютерный алгоритм, позволяющий предсказывать характер плавления в зависимости от нуклеотидной последовательности.
При электрофорезе амплифицированных двухнитевых фрагментов ДНК в геле с линейно возрастающим градиентом концентраций денатурирующих агентов плавление нитей ДНК происходит в строго специфичной для данной последовательности области, эквивалентной температуре плавления, т. е. такой температуре, при которой каждая пара оснований с 50 % вероятностью может соединиться или разойтись. После начала плавления продвижение двухнитевого фрагмента ДНК в геле резко замедляется вследствие сложной пространственной конфигурации молекул, причем эта задержка будет длиться до тех пор, пока не наступит полная денатурация ДНК. В результате происходит разделение фрагментов ДНК, различающихся по нуклеотидному составу.
4. Клонирование ДНК
Процесс клонирования ДНК включает следующие этапы:
Изображение этапов клонирования
Рис. 22. Схема клонирования участка ДНК (гена) в бактериях
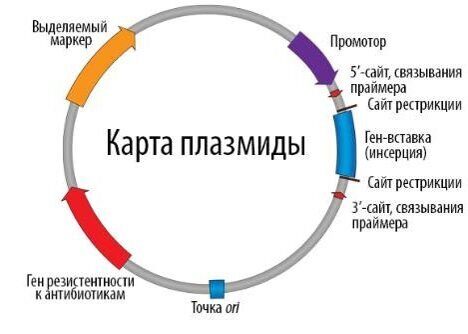
Плазмидная карта может быть прочитана путем понимания ее особенностей, таких как название и размер плазмиды, тип элементов в плазмиде и их относительное положение, а также ориентация промотора.
В плазмиду с помощью рестриктаз и лигаз встраивают необходимый фрагмент ДНК, после чего добавляют ее в культуру бактерий при специальных условиях, обеспечивающих трансформацию – процесс активного захвата бактерией ДНК из внешней среды ( риc. 22.B ). После этого проводят отбор бактерий, трансформация которых прошла успешно, добавляя соответствующий гену в плазмиде антибиотик: в живых остаются только клетки, несущие ген устойчивости (а, следовательно, и плазмиду). Далее, после роста культуры клеток, из нее выделяют плазмиды, а из них с помощью рестриктаз выделяют «наш» фрагмент ДНК (или используют плазмиду целиком). Если же ген вставили в плазмиду для того, чтобы получить его белковый продукт, необходимо обеспечить культуре условия для роста, а потом просто выделить требуемый белок.
На этом месте сразу же должен возникать вопрос: как же все это возможно было использовать до того, как были расшифрованы геномы, да и чтение последовательности ДНК было еще дорогим и малораспространенным? Положим, с помощью рестрикции и клонирования полученных фрагментов мы получим библиотеку ДНК, то есть набор бактерий, несущих различные плазмиды, содержащие суммарно весь геном (или заметную его часть). Но каким образом мы сможем понять, в каком из фрагментов содержится необходимый ген? Для этого использовали метод гибридизации. Сначала необходимо было выделить белок нужного гена. После чего отсеквенировать его фрагмент, обратить генетический код и получить последовательность нуклеотидов. В соответствии с ней химически синтезировали короткую молекулу ДНК которую, и использовали в качестве зонда для гибридизации.
Стратегии ПЦР-клонирования

Клонирование ПЦР-продуктов (ампликонов)
Традиционное клонирование основано на методах рекомбинантных ДНК, которые начинаются с подготовки вектора для получения ДНК-вставки путем расщепления каждого из них ферментами рестрикции. Затем расщепленные фрагменты сращиваются вместе ферментом, называемым лигаза, в процессе, известном как лигирование, с образованием нового вектора, способного экспрессировать интересующий ген. Это может быть самый простой и самый старый метод традиционного клонирования, который заложил основу для исследователей в разработке новых методов клонирования, таких как TA-клонирование, клонирование TOPO ® (два из самых простых методов ПЦР- клонирования — ред.), независимое от лигирования клонирование и сборка генов, которые используют уникальные характеристики других модифицирующих ферментов.
При ПЦР-амплификации этот метод клонирования требует гораздо меньше исходных шаблонных материалов, которые включают кДНК, геномную ДНК или другую плазмиду, несущую вставку. Кроме того, клонирование ПЦР обеспечивает более простой рабочий процесс, обходя требование о наличии подходящих сайтов рестрикции и их совместимости между вектором и вставкой. Тем не менее, существует ряд соображений, касающихся: праймеров для ПЦР и условий амплификации, выбора метода клонирования и используемых векторов клонирования и, наконец, подтверждения успешного клонирования и трансформации.
Что касается ПЦР-амплификации интересующей последовательности, необходимо разработать праймеры и оптимизировать условия ПЦР (компоненты и циклы) для эффективной и специфической амплификации матрицы (шаблона). Инструменты для конструирования праймеров доступны для биоинформационной оценки и выбора подходящих специфичных для мишени (целевых) последовательностей праймеров для амплификации.
ТА-клонирование и клонирование по тупым концам
ТА-клонирование и клонирование по тупым концам представляют собой два самых простых метода ПЦР-клонирования. Их выбор зависит от природы вектора и типа ПЦР-ферментов, используемых при клонировании.
Клонирование по тупым концам ( клонирование тупого конца ) включает в себя лигирование вставки в линеаризованный вектор, где оба фрагмента ДНК не имеют выступов. Тупые концевые вставки могут быть получены с использованием высокоточных ДНК-полимераз с 3’→5 ‘ экзонуклеазной или коррекционной активностью. Их корректорская активность улучшает точность последовательности амплифицированных продуктов. Так, например, в отличие от Taq ДНК-полимеразы, Pfu ДНК-полимераза обладает 3′—>5′ экзонуклеазной коррекционной активностью, что означает, что по мере сборки ДНК с 5′ конца до 3′ конца, экзонуклеазная активность немедленно удаляет нуклеотиды, неправильно корорпорированные на 3′ конце растущей нити ДНК. Следовательно, фрагменты ПЦР, генерируемые Pfu ДНК-полимеразой, будут иметь меньше ошибок, чем ПЦР вставки, генерируемые Taq-полимеразой. Однако здесь есть и ограничения, которые включают более низкую эффективность лигирования при вставке в тупые векторы клонирования и невозможность клонирования в прямом направлении. Эффективность лигирования может быть повышена путем инкубации ампликонов с Taq ДНК-полимеразой и dATP в процедуре, называемой «3 ‘dA tailing» (инкубация 20-30 минут при 72°C), а затем очистки продуктов с 3’ dA-хвостом (Рис.24).
Технология, стоящая за клонированием TOPO ®
Для дальнейшего упрощения и оптимизации рабочего процесса клонирования были разработаны специализированные векторы для размещения вставки в вектор, например, без использования лигазы.
Для примера: Один из таких классов векторов включает в себя векторы клонирования Invitrogen TOPO (одного из брендов известной биотехнологической корпорации Thermo Fisher Scientific), которые содержат ковалентно связанную ДНК-топоизомеразу I, которая функционирует как фермент рестрикции, так и лигазу.
Рис. 24. Клонирование TOPO ® продуктов ПЦР
если видео не отображается см. по ссылке →
Независимо от выбора метода клонирования, эффективность клонирования значительно повышается за счет очистки ампликонов ПЦР перед реакцией лигирования. Очистка ПЦР помогает удалить соли, нуклеотиды, неспецифические ампликоны и праймеры-димеры. После лигирования и превращения в соответствующие компетентные клетки полученные колонии необходимо тщательно проверить на наличие правильной вставки, а также ее правильную структуру и ориентацию для последующих исследований с целью анализа слияния генов и/или экспрессии белка.
Основы библиотечного строительства
Создание библиотек гДНК и кДНК имеет много общих черт, но также и некоторые важные различия. Обе стратегии включают извлечение нуклеиновых кислот, подготовку образцов (например, рестрикционное расщепление), клонирование вектора, введение вектора в подходящего хозяина (например, трансформацию или трансдукцию) и клональный отбор. Поскольку исходные материалы различны между библиотекой гДНК и библиотекой кДНК, их выделение и подготовка используют различные подходы; однако после того, как фрагменты гДНК или кДНК будут клонированы в нужный вектор, можно следовать тому же рабочему процессу.
Для подготовки геномной библиотеки, гДНК извлекается из организма, тканей или клеток, представляющих интерес. Извлеченную гДНК затем расщепляют, выделяют и лигируют в представляющий интерес вектор с совместимыми концами. Частичное расщепление генома часто осуществляется с помощью фермента рестрикции с преобладанием режущих участков, чтобы обеспечить перекрытие последовательности между фрагментами для картирования клонированных вставок (Рис. 25.1).
Выбор вектора для библиотек гДНК является важным фактором, поскольку фрагменты генов, используемые в конструкциях библиотек, часто бывают большими (например, > 20 kb). Выбор вектора клонирования, в свою очередь, определяет способ доставки векторов, несущих вставку, в хозяина (таблица 1)
Таблица 1. Общие типы векторов, длины клонированных фрагментов и методы доставки векторов при создании библиотеки.
Продукты лигирования или рекомбинантную ДНК можно вводить непосредственно в бактериальные клетки путем трансформации или упаковывать в бактериофаг для инфицирования или “трансдукции” клеток-хозяев (рис. 25.2). Преобразованные или трансдуцированные клетки предназначены для последующего архивирования, расширения и секвенирования в последующих экспериментах. Последовательности всего генома многих организмов, включая первую последовательность всего человеческого генома, были определены с использованием этой базовой стратегии в начале 2000 года.
Рис. 25.2. Схематичный рабочий процесс подготовки геномной библиотеки с использованием фагового вектора λ. Образец геномной ДНК частично расщепляется с помощью Sau3AI, после чего выделяются
20-килобайтные фрагменты (идеальный размер для вирусной упаковки) для лигирования с фрагментами вирусного гена.
Для подготовки библиотеки кДНК общая РНК извлекается из биологического источника (например, клетки, ткани и т.д.), после чего мРНК обратно транскрибируется в комплементарную ДНК (кДНК). Этот процесс известен как синтез первой цепи кДНК. Затем синтезируется вторая нить для получения двухцепочечных кДНК. Получающиеся в результате двухцепочечные фрагменты могут быть лигированы непосредственно в вектор клонирования с тупым концом (случайное клонирование) или «помечены» на концах сайтами рестрикции для направленного клонирования (рис. 25.3).
Библиотеки кДНК, которые обеспечивают хорошее и точное представление о экспрессированном геноме, зависят от нескольких факторов, включая качество и целостность исходной популяции мРНК. Для этапов обратной транскрипции также важно, чтобы обратная транскриптаза была способна синтезировать кДНК из смешанной и сложной популяции, включая длинные матрицы РНК и редкие транскрипты РНК, для адекватного охвата в библиотеках. Используя базовую стратегию, представленную на рисунке, многие препараты библиотеки кДНК были использованы для создания комплексных коллекций, включая коллекцию генов млекопитающих (MGC), крупнейшую спонсируемую NIH публичную коллекцию библиотек клонов кДНК видов млекопитающих, включая человека, мышь и крысу.
Рис. 25.3. Стратегии клонирования кДНК с использованием мРНК с поли(А)-хвостом (остатками аденозинмонофосфата ). При случайном (ненаправленном) клонировании двухцепочечные кДНК связываются непосредственно с тупым концом вектора клонирования. При направленном клонировании адаптеры с редкими сайтами рестрикции (например, NotI и SalI) лигируют с двухцепочечными концами кДНК для клонирования в вектор с совместимыми концами.
Способ клонирования и секвенирования Дробовика
Метод ШОТГАН ( Shotgun ) или Метод Дробовика
После построения библиотеки одна из целей состоит в том, чтобы охарактеризовать клоны путем секвенирования вставок. Размеры вставок, представленных в этих библиотеках, часто могут варьироваться от 25 до 300 Кб ( килобаз ), в зависимости от типа векторов и размера генома интересующего организма. Для секвенирования по Сэнгеру, когда-то самого распространенного метода секвенирования ДНК, верхний предел реакции секвенирования с хорошим качеством считывания обычно составляет менее 1 Кб (
Рисунок 25.4. Схематичный рабочий процесс клонирования дробовика.
Секвенирование дробовика играет важную роль в секвенировании всего генома многих организмов, начиная от вирусов и бактерий до человека. Этот метод может быть использован для секвенирования генома de novo, а также для улучшения качества уже секвенированного генома путем проверки считывания и заполнения пробелов. Во время первого секвенирования человеческого генома финансируемый проект «Геном человека» («Human Genome Project») использовал дробовое секвенирование больших фрагментов генов, которые были клонированы в бактериальную искусственную хромосому (или BAC-вектор от bacterial artificial chromosome – см. табл.1. ). Геномные позиции клонированных фрагментов были определены до клонирования дробовика, что облегчило сборку их последовательности дробовика. Следовательно, этот метод известен как иерархическое секвенирование дробовика (рис.25.5-А). Он также называется секвенированием clone-by-clone («клон за клоном») из-за использования клонов BAC в качестве источника.
Параллельно с проектом «Геном человека» другой финансируемый частным образом проект секвенирования всего генома, возглавляемый Крейгом Вентером (John Craig Venter), использовал стратегии секвенирования дробовика непосредственно на ДНК генома человека (вместо клонированных фрагментов, которые уже были нанесены на карту). Этот процесс известен как цельногеномный подход дробовика (рис.25.5-B). В теории секвенирование дробовика не требует предварительной информации о геноме или генетических картах и сэкономит время и ресурсы. Тем не менее, полезно иметь справочные генетические карты при сборке последовательностей, поскольку для полногеномного дробового подхода требуется большое количество вычислительной мощности, особенно для организмов с большими геномами.
Рисунок 25.5. Схематичный рабочий процесс двух подходов к секвенированию дробовика, используемых при секвенировании всего генома человека.
См. дополнительное видео по теме: Алгоритмы сборки
Геномные библиотеки и картирование генома
(продолжение темы с некоторыми дополнениями)
Даже такие небольшие геномы, как у фагов или вирусов, оказываются слишком велики для прямого секвенирования. Для изучения структуры генома его расщепляют на мелкие фрагменты, определяют нуклеотидную последовательность фрагментов путем секвенирования, а затем с помощью компьютерных методов создают полную ДНК- или РНК-карту генома. Генетический код избыточен, поэтому для изучения структуры генома (генетического картирования) необходимо иметь соответствующие маркерные участки (маркеры), как правило, это – ДНК-маркирующие сайты STS (sequence—tagged sites).
ГЕНОМНАЯ БИБЛИОТЕКА. Геномная библиотека – это множество клонированных фрагментов ДНК, в совокупности охватывающих весь геном. Для получения библиотеки геном расщепляют на фрагменты, а затем полученные фрагменты встраивают в векторы. Для облегчения процедуры упорядочивания фрагменты должны быть достаточно крупными, поэтому для ферментативного расщепления используют такие рестриктазы, сайты которых встречаются в геноме относительно редко. Примером может служить рестриктаза Not I, узнающая последовательность 5′-GCGGCGC-3. Необходимо учитывать, что частота встречаемости той или иной последовательности в геноме зависит от GC состава ДНК и от частоты повторяемости участков ДНК.
ВЕКТОРЫ. При создании геномной библиотеки фрагменты ДНК встраивают в векторы, а затем полученные ДНК-конструкции вводят в клетки. В таком виде фрагменты ДНК доступны для выделения, анализа и амплификации. Чем крупнее геном, тем большим количеством клонов представ лена полная геномная библиотека. Для больших эукариотических геномов наиболее подходящими векторами являются космиды или дрожжевые/бактериальные искусственные хромосомы YAC/BAC (yeast/bacterial artificial chromosomes). В эти векторы можно встраивать фрагменты ДНК размером до 2 млн п.н., однако для прямого секвенирования такие фрагменты слишком велики. Субклонирование осуществляют, используя векторы на основе генома фага λ, например космиды, позволяющие встраивать фрагменты ДНК размером 30–45 т.п.н.
КАРТИРОВАНИЕ ГЕНОМА. Классический метод картирования генома основан на наблюдении за наследованием сцепленных фенотипических признаков. Так, для представителей аскомицетов Neurospora crassa и дрожжей Saccharomyces cerevisiae можно построить физическую карту генома, анализируя тетрады: уэтих организмов споры в аске располагаются в том порядке, в котором они образовались при мейозе, поэтому изучение распределения фенотипическихпризнаков облегчается. Методы генетической инженерии значительно расширили возможности картирования генома. Результаты секвенирования фрагментов генома, полученных после ферментативного расщепления, позволяют определить полную структуру небольшого генома или выделить уникальные маркерные последовательности больших геномов. С помощью хорошо подобранных праймеров для ПЦР или зондов для гибридизации можно получать специфичные маркеры для больших фрагментов ДНК, на- пример для флуоресцентной гибридизации in situ (FISH – fluorescence in situ hybridization). «Причесывание» ДНК – способ упорядочивания ДНК для маркировки. Для этого в раствор, содержащий крупные фрагменты ДНК (около 10 т.п.н.), погружают обработанный полилизином носитель. При медленном удалении носителя из раствора (со скоростью примерно 0,3 мм/с) ДНК-фрагменты располагаются на нем параллельно друг другу, что значительно облегчает процесс их маркировки. Для анализа больших эукариотических геномов ранее создавали хромосомо-специфичные библиотеки. Их сохраняют посредством окрашивания флуоресцентными красителями и клеточной сортировки, зависящей от интенсивности флуоресценции (FACS), так как количество красителя, связанного с отдельными хромосомами, меняется.
ДНК-МАРКИРУЮЩИЕ САЙТЫ (STS) – это специфические участки ДНК размером 100–500 п.н., которые встречаются в геноме всего один раз. Изначально предполагается, что STS не содержат повторяющихся последовательностей. STS часто получают из больших фрагментов генома, содержащихся в клонотеке (библиотеки BAC или YAC). Если при секвенировании генома удалось получить коллекцию таких ДНК-маркеров, то, создав на их основе праймеры для ПЦР, можно определить их взаиморасположение в геноме: размер продукта ПЦР зависит от расстояния между маркерами в геноме. В банке данных можно найти более крупные последовательности ДНК, несущие два соседних ДНК-маркера. ДНК-маркеры представляют собой очень удобный инструмент для анализа сцеп ленных генов.
Геном прокариот
ВВЕДЕНИЕ. При создании генетических карт прокариот анализируют изменения фенотипических признаков, происходящие в результате процессов конъюгации (перенос ДНК из одной контактирующей клетки в другую), трансдукции (передача ДНК между двумя бактериальными клетками с помощью фага) или трансформации (введение очищенной ДНК в клетку). Первая физическая карта генома (полная нуклеотидная последовательность) была получена в 1995 г. Для построения карты генома используют метод выстраивания клонированных фрагментов в контиги и метод «дробовика» (shotgun).
ГЕНЕТИЧЕСКИЕ КАРТЫ. За изменением многих фенотипических признаков можно наблюдать при размножении бактерий. В качестве маркеров можно использовать способность бактерии образовывать жгутики или споры, а также устойчивость к антибиотику. Для изучения путей биосинтеза используют мутантные штаммы, в которых блокирована одна из стадий биосинтеза. Для роста таких мутантов необходимо наличие в среде веществ, которые бактерия сама больше не может синтезировать. Немаловажным преимуществом бактерий является короткий жизненный цикл (время между образованием клетки и ее делением), часто он занимает менее 1 ч. Сопоставление фенотипических изменений и времени проникновения тех или иных участков ДНК в клетку-реципиент при конъюгации позволяет определить взаиморасположение генов, которые кодируют эти признаки. Таким образом, карты генома прокариот строят в масштабе минут или центисом. Процесс переноса всего генома E. coli в клетку-реципиент при 37 °С занимает 100 мин.
ФИЗИЧЕСКОЕ КАРТИРОВАНИЕ: ПОЛУЧЕНИЕ КОНТИГОВ. Важной задачей является идентификацияклонов геномной библиотеки, содержащих перекрывающиеся фрагменты ДНК (контиги) (от англ. contiguous– непрерывный). Исходя из этой информации,можно реконструировать непрерывный ряд клонированных фрагментов, составляющих весь геном. Дляпоиска контигов применяют метод генетической«дактилоскопии» (clone fingerprinting), например,сравнивая рестриктные карты или перекрывающиесяSTS и выявляя «соседние» клоны. Полезную информацию можно получать из анализа распределениягенетических маркеров. Позиционное клонирование(т. е. поиск гена, соседствующего с маркером)осуществляют методом «прогулки по хромосоме»(chromosome walking). Уникальный участок ДНК,примыкающий к одному из концов клонированногофрагмента, используют в качестве зонда для гибридизации с геномной библиотекой. Некоторые гибридизующиеся клоны полностью перекрываются с исходным участком, а другие включают новые сегменты. Таким образом карта расширяется. При повторении этой процедуры совершается «прогулка» на большее расстояние.
ФИЗИЧЕСКОЕ КАРТИРОВАНИЕ ГЕНОМА: МЕТОД «ДРОБОВИКА» (SHOTGUN). Физическая карта геномапредставляет собой его полную нуклеотидную последовательность. В настоящее время возможно секвенирование фрагментов ДНК размером до 600 п.н.Для создания физической карты геном разрезают нанебольшие фрагменты с помощью рестриктаз или ультразвука, затем секвенируют клонированные фрагменты и с помощью компьютерных программ устанавливают последовательность их расположения в геноме. Современные компьютерные технологии позволяют быстро составлять кар ты и анализировать бактериальные геномы (размером, как правило, до 5 млн п.н.). Наличие генетических карт и постоянное пополнение данных о взаиморасположении генетических маркеров позволяет проводить корреляцию между физической и генетической картами. Так, к 1990 г. на хромосоме E. coli были локализованы более 1400 генетических маркеров, расположенных в среднем через каждые 3300 п.н. (размер всего генома E. coli составляет 4,64 млн п.н.).
БИОИНФОРМАТИКА. Большинство компьютерных программ для анализа генома основываются на поиске гомологичных последовательностей, поэтому даже такое редкое явление, как ошибка секвенирования (стандартная точность секвенирования составляет 99%), приводит к появлению неточностей практически во всех последовательностях. По этой причине в компьютерные банки данных вносят информацию, подтвержденную многократным секвенированием.
5. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР)
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК или РНК) в биологическом материале (пробе). Помимо амплификации ДНК, ПЦР позволяет производить множество других манипуляций с нуклеиновыми кислотами (введение мутаций, сращивание фрагментов ДНК) и широко используется в биологической и медицинской практике.
Полимеразная цепная реакция — молекулярно-биологический метод, позволяющий добиться колоссального (до 10 12 раз) увеличения числа копий определенного фрагмента ДНК in vitro. Она была изобретена Кэри Муллисом (Kary Mullis) в 1983 году, за что в 1993 году он получил Нобелевскую премию по химии (совместно с М. Смитом).
Давайте вначале попытаемся извлечь максимум информации из самого названия метода. Ааббревиатура ПЦР (произносим «пэ-цэ-эр») обозначает «Полимеразная Цепная Реакция». Разберем эти слова по порядку. Слово «полимеразная» говорит нам о полимеризации, то есть построении полимера из мономеров. Слово «цепная» означает зависимость следующих этапов реакции от продуктов предыдущих. Наконец, слово «реакция» предполагает превращение одних веществ в другие, отличающиеся от исходных по химическому составу и (или) строению. Теперь посмотрим, одно из определений термина:
Основной принцип ПЦР состоит в том, что реакция полимеризации (синтеза полимерной цепи ДНК из мономерных нуклеотидных звеньев) инициируется специфическими праймерами (короткими фрагментами «затравочной» ДНК) в каждом из множества повторяющихся циклов. Специфичность ПЦР определяется способностью праймеров «узнавать» строго определенный участок ДНК и связываться с ним согласно принципу молекулярной комплементарности.
В обычной реакции ПЦР используется пара праймеров, которые «ограничивают» амплифицируемый участок с двух сторон, связываясь с противоположными цепями ДНК-матрицы. Для многократного увеличения количества копий исходной ДНК нужна цикличность реакции. Как правило, каждый из последовательно повторяющихся циклов ПЦР состоит из трех этапов:
Смена этапов каждого цикла осуществляется путем изменения температуры реакционной смеси ( рис. 27 а,б,в). Сначала праймеры могут связаться только с определенной последовательностью исходной ДНК, но в последующих циклах они связываются с копиями этой последовательности, синтезированными в предыдущих циклах. При этом количество основного продукта ПЦР (копии последовательности ДНК, ограниченной праймерами) теоретически удваивается в каждом цикле, то есть растет с числом циклов экспоненциально.
Как проводится ПЦР?
ПЦР можно условно разделить на два этапа – подготовительный и основной. Во время первого этапа идет подготовка реакционной смеси, иными словами, в одну пробирку скапываются все необходимые компоненты. Длится этот этап, в зависимости от количества пробирок и способа скапывания, обычно до часа. Во время второго этапа происходит собственно ПЦР, при этом пробирки с реакционной смесью помещают в специальный прибор и оставляют на несколько часов (обычно 3-5). Разберем подробно каждый из этих этапов.
Подготовительный этап. Компоненты для ПЦР.

Схематическое изображение синтеза комплементарной цепи и расположения мест присоединения праймеров.
Таблица 1. Роль компонентов реакционной смеси ПЦР