Для чего вводят адреналин в сердце
Для чего вводят адреналин в сердце
Согласно статистике Американской ассоциации сердца, в США ежегодно происходит более 356 000 остановок сердца, причем почти 90% из них приводят к смерти пациентов.
В настоящее время адреналин (другое принятое название – эпинефрин) является важнейшим препаратом в терапии этой патологии: в Великобритании в этом случае его вводят 60-80%, а в США – 57-98% пациентов. Между тем, его эффективность и прогноз выживания, в отдаленном периоде после его применения, недостаточно изучены, что стало основанием для проведения двойного слепого рандомизированного клинического исследования под названием «PARAMEDIC 2».
Данные исследования свидетельствуют о том, что введение адреналина приводит к улучшению тридцатидневной выживаемости, но это сопровождается более частым поражением центральной нервной системы. В исследовании у существенной части пациентов, получавших адреналин, была выявлена патология головного мозга, приведшая к инвалидности.
Опубликованные данные активно обсуждаются как международными медицинскими организациями, так и широкой общественностью, поскольку выбор врачом лечения в этом случае требует учитывать предпочтения пациентов. Около 95% потенциальных пациентов при опросе заявляют, что выживание после остановки сердца ценой развития тяжелой неврологической патологии не является для них желанным исходом.
«PARAMEDIC 2» стало первым испытанием такого рода, и доза адреналина, одинаковая для всех включенных пациентов (1,0 мг каждые 3-5 минут), в значительной степени была выведена эмпирически. Следует отметить большой разброс во времени между вызовом неотложной помощи и введением препарата. Медиана этого показателя составила 21 минуту.
Новые исследования в этой области могут дать больше информации о том, в каких случаях терапия адреналином безопаснее, а в каких случаях от нее лучше воздержаться. Тем не менее, эксперты считают, что из-за появившихся данных частота введения адреналина при внебольничной остановке сердца в США и Великобритании может сократиться.
Экстренное введение адреналина при остановке сердца
Okubo с соавт. [1] обнаружили динамическую связь между введением адреналина и выживаемостью до окончания срока госпитализации и благоприятным функциональным исходом при выписке взрослых людей с внебольничной остановкой сердца (ВБОС), сочетающейся дефибриллируемым (т. е. фибрилляцией желудочков/желудочковой тахикардией с отсутствием пульса) или недефибриллируемым сердечным ритмом (электрическая активность миокарда без пульса или асистолия). Согласно результатам работы, при использовании адреналина во время сердечно-легочной реанимации (СЛР) большей его эффективности можно будет добиться в начале реанимационных мероприятий. Авторы изучили большой массив данных (> 40 000 пациентов из Северной Америки) и сопоставили показатели систематической ошибки по времени ограничения реанимационных мероприятий [2]. В ходе осуществления СЛР необходимость применения адреналина возрастает по мере увеличения времени оказания реанимационных мероприятий. Однако необходимость оказания более длительной СЛР также связана с развитием худшего исхода, что вынуждает применять адреналин даже с учетом его побочных эффектов. Данную статистическую погрешность можно нивелировать при сравнении пациентов, которым вводили адреналин после определенного времени с начала реанимации с пациентами, которым адреналин в тот же момент времени с начала реанимации не вводился (при том, что СЛР проводилась).
Работа Okuda с соавт. [1] подтверждает еще один вывод исследования PARAMEDIC-2, согласно которому любой положительный лечебный эффект адреналина на ВСК, выживаемость до окончания срока госпитализации и благоприятный исход снижались по мере увеличения времени до введения препарата по сравнению с плацебо, а любые полезные лечебные эффекты были выше при сопутствующем недефибриллируемым ритме сердца [5]. Рандомизированные клинические испытания введения адреналина при внутрибольничной остановке сердца (ВОС) не проводились. В случае ВОС время до введения препарата при остановке сердца значительно короче, чем в случае ВБОС. Однако важность раннего введения адреналина среди пациентов с ВОС находит подтверждение в обсервационном исследовании, в котором были применены данные реестра Реанимационных мероприятий Американской кардиологической ассоциации «Get With The Guidelines». В этом исследовании пациентов с сопутствующим недефибриллируемым сердечным ритмом было выявлено ступенчатое снижение выживаемости через каждые три минуты времени задержки до введения первой дозы адреналина [6]. Однако в случае фибриллируемых ритмов сердца, согласно данным из того же реестра ВОС, в которых учитывалась систематическая ошибка времени реанимации, было выявлено, что введение адреналина в течение первых двух минут СЛР было связано со снижением ВСК, выживаемости до окончания срока госпитализации и благоприятных исходов неврологического характера при выписке.
Адреналин в дозе 1 мг используется в качестве «грубого» средства при СЛР для увеличения скорости восстановления спонтанного кровообращения и выживаемости до выписки. Адреналин оказывает более выраженный лечебный эффект, если его вводить в начале попытки реанимации, особенно при остановке сердца, не сопровождающейся развитием шока. Кроме того, этот препарат способствует повышению вероятности выживания, как сопровождающейся возникновением негативной неврологической симптоматики, так и без таковой. Также при использовании адреналина повышается вероятность использования донорских органов от невыживающих пациентов (т. е., органов без выраженных патофизиологических нарушений) и количество удачных трансплантаций органов реципиентам. Результаты исследования Okuda с соавт. [1] согласуются с текущими рекомендациями по использованию адреналина во время СЛР. Согласно последним, в случае как с ВБОС, так и ВОС, рекомендовано как можно быстрее использовать введение адреналина, когда исходный ритм при остановке сердца не является фибриллируемым, а также после неудачных попыток дефибрилляции, когда исходный сердечный ритм характеризуется как фибриллируемый.
Сердечно-легочная реанимация на догоспитальном этапе
Каковы наиболее частые причины внезапной смерти? Что можно сделать в случаях остановки дыхания и кровообращения на догоспитальном этапе? Почему внутрисердечный путь введения лекарственных средств — «путь отчаяния»? Сердечно-легочная реанимация — э
Каковы наиболее частые причины внезапной смерти?
Что можно сделать в случаях остановки дыхания и кровообращения на догоспитальном этапе?
Почему внутрисердечный путь введения лекарственных средств — «путь отчаяния»?
Сердечно-легочная реанимация — это комплекс мероприятий, направленных на оживление организма в случае остановки кровообращения и/или дыхания. Своевременное (в течение первых минут) начало реанимационных мероприятий может предотвратить необратимое повреждение мозга и, возможно, наступление биологической смерти.
Большинство случаев внезапной смерти имеют кардиальную причину.
Основными признаками остановки кровообращения являются потеря сознания, остановка дыхания и отсутствие пульса (следует оценивать наличие пульса на сонных артериях).
Сердечно-легочная реанимация (СРЛ) состоит из двух основных частей.
Алгоритм действий при проведении ОРМ представлен на рис. 1.
Способы введения лекарственных препаратов при СЛР
Внутривенный. При налаженном периферическом венозном доступе возможно введение лекарственных препаратов в периферическую вену, но после каждого болюсного введения необходимо поднимать руку больного для ускорения доставки препарата к сердцу, сопровождая болюс введением некоторого количества жидкости (для его проталкивания). С целью обеспечения доступа в центральную вену предпочтительно катетеризировать подключичную или внутреннюю яремную вену. Введение лекарственных препаратов в бедренную вену сопряжено с их замедленной доставкой к сердцу и уменьшением концентрации.
Эндотрахеальный. Если интубация трахеи произведена раньше, чем обеспечен венозный доступ, то атропин, адреналин, лидокаин можно вводить зондом в трахею. При этом препарат разводят на 10 мл физиологического раствора, и его доза должна быть в 2–2,5 раза больше, чем при внутривенном введении. Конец зонда должен находиться ниже конца интубационной трубки; после введения препарата необходимо выполнить последовательно 2—3 вдоха (прекратив при этом непрямой массаж сердца) для распределения лекарства по бронхиальному дереву.
Внутрисердечный. «Путь отчаяния» применяется лишь в том случае, если невозможен другой способ введения. Следует по возможности воздерживаться от внутрисердечных инъекций, так как при использовании этого способа в 40% случаев повреждаются крупные коронарные артерии.
Тактика реанимации при фибрилляции желудочков и гемодинамически неэффективной желудочковой тахикардии
Начинать реанимацию необходимо с ОРМ и электрической дефибрилляции (ЭДФ). Дефибрилляцию начинают с разряда мощностью 200 Дж. При сохранении фибрилляции снова используют разряд, но более высокой мощности — 200—300 Дж, затем — 360 Дж. Начинать реанимационные мероприятия сразу с разряда максимальной мощности не следует, чтобы избежать повреждающего действия на миокард.
При неэффективности вышеперечисленных мероприятий возобновляют ОРМ, производят интубацию трахеи, налаживают венозный доступ, вводят адреналин в дозе 1 мг каждые 3—5 минут; можно вводить возрастающие дозы адреналина 1—3—5 мг каждые 3—5 минут или промежуточные дозы 2—5 мг каждые 3—5 минут. Адреналин можно заменить вазопрессином, который вводится в дозировке 40 мг в вену однократно.
При продолжении фибрилляции желудочков используют антиаритмические препараты, которые позволяют снизить порог дефибрилляции:
После введения лекарства 30—60 секунд проводят ОРМ, а затем повторно проводят ЭДФ (за это время антиаритмик достигает цели). Рекомендуется чередовать введение лекарств с ДФ по такой схеме: антиаритмик — ЭДФ (360 кДж) — адреналин — ЭДФ (360 кДж) —антиритмик — ЭДФ (360 кДж) — адреналин и т. д. Можно использовать не один, а три разряда максимальной мощности. Количество ЭДФ не ограничено.
Алгоритм действий при фибрилляции желудочков представлен на рис. 2.
Широко практиковавшееся ранее введение бикарбоната натрия (как средства борьбы с ацидозом) в настоящее время применяется значительно реже из-за ограниченных показаний:
Бикарбонат натрия вводится в дозе 1 мэкв/кг в вену (в среднем 140–180 мл 4%-ого раствора).
Тактика при электромеханической диссоциации
Электромеханическая диссоциация (ЭМД) — это отсутствие пульса и дыхания у больного с сохраненной электрической активностью сердца (на мониторе ритм виден, а пульса нет).
К сожалению, прогноз при этом виде нарушения деятельности сердца плохой, если не устраняется причина, вызвавшая остановку кровообращения (ацидоз, гиповолемия, гипоксия, гипотермия, тампонада сердца, напряженный пневмоторакс).
Лечение ЭМД включает ОРМ, внутривенное введение адреналина — 1 мг каждые 3—5 минут и атропина 1 мг каждые 3—5 минут, электрокардиостимуляцию, на 15-й минуте реанимации введение бикарбоната натрия. Необходимо попытаться устранить причину ЭМД.
Тактика при асистолии
Тактика устранения этой причины остановки кровообращения практически не отличается от схемы лечения ЭМД. Необходимо обратить внимание на то, что ЭКГ в одном отведении при мелковолновой фибрилляции желудочков может имитировать экстрасистолию, поэтому асистолия должна быть подтверждена в нескольких отведениях ЭКГ. Электрическая дефибрилляция в этом случае не только не показана, но даже вредна, так как она усиливает ваготонию. Лечение включает ОРМ, в вену вводится адреналин — 1 мг каждые 3—5 минут, атропин — 1 мг каждые 3—5 минут, проводится электрокардиостимуляция, на 15-й минуте реанимации показано введение бикарбоната натрия. Необходимо попытаться устранить причину асистолии. Алгоритм действий при асистолии представлен на рис. 3.
Заключение
В случае успешно проведенных реанимационных мероприятий необходимо:
А. Л. Верткин, доктор медицинских наук, профессор
О. Б. Талибов, кандидат медицинских наук
О. Н. Ткачева
МГМСУ, ННПОСМП, Москва
Сердечно-легочная реанимация: оправдано ли вводить адреналин?
Резюме. Оправданность применения эпинефрина с учетом его влияния на церебральный кровоток и неврологические исходы

Адреналин (эпинефрин) оказывает потенциально благоприятное воздействие в случае остановки сердца за счет сужения артериол, опосредованных α-адренергическими рецепторами. Вазоконстрикция повышает диастолическое давление в аорте во время сердечно-легочной реанимации, тем самым улучшает коронарный кровоток и повышает вероятность восстановления спонтанного кровообращения.
Потенциально неблагоприятное воздействие на сердце опосредуется β-адренергической стимуляцией, которая приводит к развитию аритмии, увеличивает потребность миокарда в кислороде и повышает риск рецидивирующей остановки сердца. Кроме того, α-адренергическая стимуляция вызывает активацию тромбоцитов, которая обусловливает тромбоз и нарушает микрососудистый кровоток в коре головного мозга, что, в свою очередь, усугубляет тяжесть церебральной ишемии во время сердечно-легочной реанимации и после восстановления спонтанного кровообращения.
Предыдущие исследования, в которых сравнивали применение стандартных доз эпинефрина (1 мг) с высокими его дозами (5–10 мг), а также эпинефрина и вазопрессина с плацебо, не продемонстрировали доказательств улучшения результатов.
В другом исследовании с участием более 500 тыс. пациентов сообщалось о более высокой частоте возвращения спонтанного кровообращения, но о худших неврологических исходах у пациентов, у которых применяли эпинефрин.
Описание исследования
В связи с вышеизложенным с декабря 2014 по октябрь 2017 г. пятью службами скорой помощи Национальной службы здравоохранения (National Health Service Ambulance Services) Великобритании было проведено мультицентровое рандомизированное двойное слепое плацебо-контролируемое исследование «PARAMEDIC2». Результаты этой работы опубликованы 18 июля 2018 г. в «Журнале медицины Новой Англии» («The New England Journal of Medicine»).
Критерии включения
В исследование были включены взрослые пациенты, перенесшие внебольничную остановку сердца, которым опытные парамедики оказывали экстренную помощь. Критериями исключения стали беременность, возраст менее 16 лет, остановка сердца при анафилаксии или бронхиальной астме и применение эпинефрина до прибытия медицинского работника.
Реанимационные мероприятия
Если первоначальные попытки реанимации (сердечно-легочная реанимация или дефибрилляция) были безуспешными, пациенту случайным образом назначали либо введение 1 мг эпинефрина, либо 0,9% физиологического раствора (плацебо). Разовые дозы эпинефрина или физиологического раствора вводили внутривенно или внутрикостно каждые 3–5 мин.
Вмешательство продолжалось до тех пор, пока не был достигнут устойчивый пульс, не была прекращена реанимация или не была оказана помощь в больнице.
Результаты исследования
Из 10 623 пациентов, соответствующих критериям, 8014 (75,4%) были включены в исследование: 4015 пациентов в группе эпинефрина и 3999 пациентов в группе плацебо. В этих двух группах среднее время от экстренного вызова до прибытия машины скорой помощи составляло 6,6 мин (интервал 4,2–9,7 мин).
Доля пациентов, у которых было зафиксировано восстановление спонтанного кровообращения во время догоспитальной фазы реанимации, была выше в группе эпинефрина, чем в группе плацебо (36,3% против 11,7%), как и доля пациентов, которые были доставлены в больницу (50,8% против 30,7%).
Среди пациентов, которые были госпитализированы, не выявлено значительных межгрупповых различий в продолжительности пребывания в больнице или отделении интенсивной терапии.
Первичный исход
Данные по первичному исходу были доступны для 4012 пациентов (99,9%) в группе эпинефрина и 3995 пациентов (99,9%) в группе плацебо. В группе эпинефрина 130 пациентов (3,2%) были живы через 30 дней по сравнению с 94 пациентами (2,4%) из группы плацебо.
Неврологический исход
Не выявлено доказательств значительного различия между группами эпинефрина и плацебо в отношении числа пациентов, которые выжили с благоприятным неврологическим исходом (87 из 4007 пациентов (2,2%) и 74 из 3994 пациентов (1,9%) соответственно).
Тяжелые неврологические нарушения (оценка 4 или 5 по модифицированной шкале Рэнкина) были более распространенными среди выживших в группе эпинефрина, чем в группе плацебо (39 из 126 пациентов (31,0%) против 16 из 90 пациентов (17,8%)). Результаты в отношении выживаемости через 3 мес и неврологических исходов через 3 мес были одинаковыми в обеих группах.
Не выявлено статистических свидетельств влияния на исход возраста пациента, начального сердечного ритма и времени реакции на введение эпинефрина/плацебо. О дополнительных серьезных побочных эффектах не сообщалось.
Стоит ли использовать эпинефрин?
В этом исследовании применение эпинефрина во время сердечно-легочной реанимации в случае остановки сердца вне больницы привело к значительно более высокой выживаемости через 30 дней, чем применение плацебо.
Пациенты в группе эпинефрина имели более высокую частоту возвращения спонтанного кровообращения, более высокую частоту транспортировки в больницу и более высокую частоту лечения в отделении больницы.
Однако хотя показатель выживаемости был лучше, в исследовании не выявлено различий в показателях выживаемости между группами с благоприятным неврологическим исходом. Этот результат был объяснен более высокой долей пациентов, которые выжили с тяжелым неврологическим дефицитом в группе эпинефрина.
Причины того, что использование эпинефрина не улучшило неврологические исходы в этом исследовании, являются неопределенными. Одно из объяснений состоит в том, что, хотя эпинефрин увеличивает мозговой кровоток, он парадоксально ухудшает церебральную микрососудистую перфузию и, таким образом, может усугубить повреждение головного мозга после возвращения спонтанного кровообращения. Альтернативное объяснение заключается в том, что головной мозг более чувствителен к ишемии, чем другие органы: имеют место реперфузионное повреждение и меньшая способность к функциональному восстановлению после успешной сердечно-легочной реанимации. Не было показано каких-либо специальных методов лечения, кроме целенаправленного регулирования температуры тела, которые могли бы снизить степень повреждения головного мозга после остановки сердца.
Стоит отметить, что результаты данного исследования определили выживаемость с благоприятным неврологическим исходом как более приоритетный исход, чем индивидуальная выживаемость.
Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
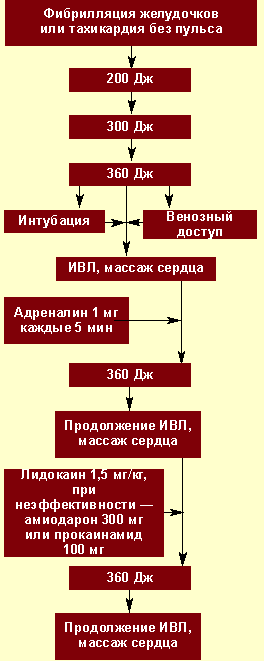 |
| Рисунок 2. Алгоритм неотложной помощи при фибрилляции желудочков |
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара

