Для интраназального введения что это
Передовая фармакология: cavum nasi
Изучаем интраназальные системы доставки лекарственных веществ — их преимущества, особенности абсорбции и ограничения
Долгое время в медицине интраназальное введение ассоциировалось исключительно с местными лекарственными препаратами, в частности — с деконгестантами. Однако, благодаря тому, что в носовой полости может происходить и активное всасывание лекарственных веществ в кровоток, сегодня интраназальные формы распространились и на другие классы ЛС. Удобство и простота использования современных интраназальных форм стали мощным стимулом к созданию системных лекарственных средств для интраназального применения. Именно им и посвящена наша очередная статья в цикле материалов об инновационных формах доставки ЛС.
Возможности и ограничения интраназальной доставки
Альтернативные способы системной доставки — трансдермальный, ректальный, буккальный — имеют ряд очевидных преимуществ по сравнению с традиционным пероральным и парентеральным введением. Тем не менее, нельзя не учитывать их недостатки. Так, у трансдермальных форм ограничены возможности доставки липофильных формул, к тому же для этого пути введения характерна невысокая скорость достижения пиковой концентрации препарата в плазме. Всасывание ректальных форм зависит от глубины введения в прямую кишку, а их применение ограничивает невысокий комплаенс. Буккальные и сублингвальные формы могут быть связаны с рядом неудобств, в частности, с необходимостью соотнесения их применения с приёмом пищи. А вот интраназальные препараты с системным действием, обладая очевидной простотой и удобством применения, лишены недостатков, свойственных другим системным средствам с альтернативной доставкой.
Преимущества интраназального введения лекарственных веществ:
Нельзя не упомянуть и ряд ограничений интраназальных системных форм. Среди них:
Особенности назальной абсорбции
Носовая полость общей площадью 150–160 см 2 и объёмом примерно 15 мл покрыта слизистой оболочкой толщиной 2–4 мм. Её эпителий имеет реснитчатые клетки, каждая из которых содержит около 200 ресничек, обеспечивающих мукоцилиарный транспорт слизи со средней скоростью 5–6 мм в минуту. Под эпителиальным слоем расположен подслизистый слой, имеющий разветвлённую сосудистую и лимфатическую сеть, обеспечивающую абсорбцию лекарственных препаратов, которая, в свою очередь, определяется рядом факторов.
Абсорбция лекарственных веществ со слизистой оболочки носа происходит главным образом за счёт пассивной диффузии. Небольшие незаряжённые молекулы способны легко проникать через слизистую оболочку носа, в отличие от крупных молекул. Транспорт может происходить как через клеточную мембрану (трансцеллюлярно), так и через межклеточное вещество (парацеллюлярно). Трансцеллюлярно всасываются прежде всего липофильные молекулы, причём скорость абсорбции коррелирует со степенью липофильности. Парацеллюлярно всасываются небольшие полярные молекулы. Степень и скорость абсорбции зависит от анатомо-физиологических особенностей носовой полости и физико-химических характеристик действующего вещества.
Физиологические факторы, влияющие на абсорбцию
Мукоцилиарный клиренс — который, в свою очередь, зависит от длины, плотности и частоты биения ресничек эпителия, а также от количества назальной слизи и её вязкости.
Кровеносная система слизистой оболочки носа — известно, что сосудистая сеть носовой полости приспособлена для быстрого прохождения жидкости из крови в ткани и обратно. Стенки сосудов носовой полости имеют повышенную пористость, а в сосудистом эндотелии есть дефекты, способствующие быстрому перемещению жидкости из сосудов в окружающую ткань и поступлению в просвет сосудов лекарственных веществ. Абсорбция последних определяется скоростью кровотока, на который, в свою очередь, влияют сосудосуживающие и сосудорасширяющие агенты. Доказано, что введение в состав интраназального препарата сосудосуживающего компонента обеспечивает удержание основного препарата на эпителии слизистой носа и, как следствие, активизирует его поступление в кровь и доставку лекарственного вещества в ЦНС.
Ферментативное расщепление — ещё один фактор, который может влиять на интраназальную абсорбцию препаратов. В эпителиальных клетках носовой полосы обнаруживается целый ряд ферментов. Носовая полость занимает второе место после печени по количеству вырабатываемого цитохрома Р450, который расщепляет эстрадиол, тестостерон, деконгестанты и другие препараты. Чтобы предотвратить ферментативное расщепление в носовой полости, в состав препаратов вводят ингибиторы ферментов.
Белки-транспортеры — которые способствуют активному выведению препаратов в межклеточную среду и снижению их накопления в клетках. В интраназальные препараты могут вводиться ингибиторы белков-транспортеров, позволяющие затормозить процесс выброса препарата из клетки.
Физико-химические свойства активных компонентов, влияющие на абсорбцию в носовой полости
Молекулярная масса — низкомолекулярные препараты (до 300 Да) всасываются легче, чем высокомолекулярные.
Липофильность и гидрофильность — слизистая носа имеет липофильные свойства, и степень абсорбции препаратов снижается с уменьшением степени липофильности активных веществ.
Другие свойства активного вещества, в частности: вязкость — чем она выше, тем дольше контактирует препарат со слизистой носа и лучше всасывается; кислотность — при показателе pH, соответствующем таковому в полости носа (5,5–6,5), может развиваться раздражение слизистой и ухудшаться абсорбция. Влияние на всасываемость могут оказывать и дополнительные вещества, например, усилители абсорбции, ингибиторы ферментов и т. д.
Интраназальная доставка в мозг
Перспективное направление фармакологии — создание интраназальных препаратов центрального действия. Инновационные технологии позволяют создать лекарственные препараты для интраназального введения, поступающие в головной мозг. Для этого в их состав вводят микро- и наноносители направленной доставки, отвечающие ряду требований: биосовместимость, нетоксичность, биодеградируемость, физическая стабильность в кровеносном русле, способность преодолевать гематоэнцефалический барьер и др.
На сегодняшний момент используются микрочастицы (диаметр 1–1000 мкм) на основе хитозана и гидроксипропилметилцеллюлозы. Последняя применяется для создания современной интраназальной формы трамадола, поступающего в головной мозг. В качестве наночастиц используются полимерные частицы, дендримеры, мицеллы, эмульсии, липосомы размером до 300 нм. Разработаны наночастицы, поверхность которых модифицирована полиэтиленгликолем («пэгилированные частицы»). Благодаря им удалось значительно уменьшить дозировку атипичного нейролептика сульпирида, обеспечив его накопление именно там, где это необходимо — в головном мозге.
Ещё один системный препарат, который используется интраназально — золмитриптан, оказывающий противомигренозное действие. Пероральные его формы имеют низкую биодоступность и плохо переносятся — они связаны с тошнотой. Интраназальная форма препарата, содержащая наноносители в виде мицелл, оказывает центральное действие и гораздо более активна по сравнению с парентеральной.
Лекарственные формы интраназальных системных препаратов
Самыми распространёнными и доступными интраназальными средствами системного действия сегодня являются капли в нос. Однако, наряду с простотой производства и применения для них характерна сложность дозирования: количество препарата, поступающего внутрь в форме интраназальных капель, сложно контролировать, что особенно опасно в случае применения сильнодействующих средств. Этого недостатка лишены дозированные спреи и аэрозоли, которые, так же, как и капли в нос, отличаются компактностью, удобством и простой применения, но при этом могут дозироваться с точностью от 25 мкл.
Для препаратов, плохо растворимых в воде, используют форму порошка. Их положительное свойство — отсутствие консервантов и устойчивость при хранении. Однако интраназальные порошки могут оказывать раздражающее действие на слизистую оболочку, что ограничивает их применение. В последние годы появились гели для интраназального применения, представляющие собой вязкие растворы или суспензии. За счёт отсутствия при их применении синдрома постназального затека увеличивается абсорбция лекарственных веществ и достигается оптимальный терапевтический эффект.
Инновационные интраназальные препараты — настоящее и будущее
На протяжении последнего десятилетия продолжаются исследования, изучающие свойства интраназальных препаратов для системного применения. Так, изучено применение интраназального эстрадиола в качестве менопаузальной гормональной терапии женщинам во время менопаузы. Исследование с участием более 600 пациенток показало, что интраназальная терапия обеспечила незначительно менее выраженный эффект и существенно более благоприятную переносимость по сравнению с пероральными формами.
Уже разработана интраназальная форма инсулина. Считается, что она переносится лучше по сравнению с парентеральными, при сопоставимой эффективности. По оценкам специалистов, доход от продажи интраназального инсулина за 5 лет может превысить 10 миллионов долларов.
Ещё одна инновационная разработка — интраназальная инактивированная противогриппозная вакцина, которая обеспечивает как формирование системного иммунитета, так и стимуляцию местного иммунного ответа в носовой полости, являющейся входными воротами инфекции. Очевидно, что это лишь первые шаги в столь перспективном направлении фармакологии. Сегодня, когда в аптеках уже есть системные интраназальные средства, провизоры и фармацевты могут быть непосредственными свидетелями стремительного развития фармакологической науки и наблюдать за появлением всё новых инновационных препаратов с поистине удивительными свойствами.
4.10. Интраназальное введение лекарственных средств
Описание методов локального терапевтического воздействия на
респираторный тракт было бы неполным, без упоминания о
возможности введения лекарственных средств непосредственно в
быту, и в педиатрических стационарах. Частота его применения
прямо связана с частотой воспалительных заболеваний носоглотки,
Очевидно, что главная цель применения любых носовых капель не
имеет никакого специфического отношения к синдрому вирусного
на некоторые проявления ОРВИ.
Фармакологическая активность при лечении ОРВИ, уже сама по
себе, является существенным поводом для дискуссии. При тяжелых
или осложненных формах особых оснований для спора нет. Но ведь
подавляющее большинство ОРВИ протекают легко, а лечатся, тем не
менее, весьма активно. Логичным следствием последнего является
тот факт, что ни один патологический процесс не может сравниться
с ОРВИ по частоте осложнений, непосредственно связанных с
лечебными воздействиями! [16]. В основе описываемого явления
лежит всеобщая убежденность в том, что любая болезнь требует
лечения. Это вдвойне актуально, когда речь заходит болезни
— неминуемо приходит понимание того, что интраназальное введение
лекарственных средств очень мало влияет на тяжесть и
продолжительность ОРВИ. Однако выражение: «Что это за лечение,
попытке практической реализации своей убежденности в
нецелесообразности подобных действий.
Отсюда вытекают некоторые общие правила.
Интраназальное введение лекарственных средств может быть
обусловлено либо медицинскими, либо деонтологическими
показаниями. Но врач, по крайней мере, всегда должен четко
представлять себе, по каким соображениям назначены капли в нос:
воздействие на болезнь ребенка или обеспечение адекватного
психологического состояния его матери. Очевидно, что при выборе
второго варианта, требования к безопасности препарата должны
Все используемые при ОРВИ интраназальные средства можно
разделить на две основные группы:
1. Воздействующие на этиологию заболевания.
2. Ставящие своей целью оказать влияние на один из ведущих
Этиотропные препараты были рассмотрены нами в соответствующей
главе (4.3.). Применительно к интраназальному введению, еще раз
обратим внимание на интерферон. Если терапевтическая активность
Вывод очевиден: использование интерферона при ОРВИ вообще и при
вирусном крупе в частности, не может вызвать принципиальных
Клиническая симптоматика у конкретного больного, с трудом
позволяет оценить эффективность интерферона. С лекарственными
препаратами, обеспечивающими проходимость носовых ходов, дело
обстоит принципиально иным образом.
Ринит и, как его следствие, затрудненное носовое дыхание,
обусловлено очень хорошо знакомыми нам патогенетическими
желез. Оба эти механизма проявляются довольно характерными
симптомами, а ринит протекает, как правило, по одному из двух
т.е. доминирующий отек, и обратная ситуация, при которой
имеющийся насморк обусловлен ведущей ролью гиперсекреции. Второй
вариант более неприятен, особенно для маленьких детей,
неспособных к сознательной очистке носовых ходов.
всего нафтизина (галазолина, санорина) или сложных капель,
включающих в себя адреналин (эфедрин, мезатон) в сочетании,
чаще всего фурацилине. Вариантов подобных прописей огромное
множество, но понятно, что наиболее активным компонентом
является именно адреномиметик.
Все достоинства и недостатки этих препаратов, описанные выше
(4.9.2.3.), в равной степени относятся и к интраназальному и к
Кратковременный эффект очень часто заканчивается новым
витком активизации ринита, нередко на более высоком уровне.
Подобная ситуация логично вытекает из особенностей фармакологии
адреномиметиков, которые при передозировке или длительном
применении (достаточно более суток) способны вызвать стойкий
спазм посткапилляров с последующим нарастанием отека. Указанное
явление прослеживается особенно характерно тогда, когда поводом
для назначения нафтизина служит насморк. После
непродолжительного улучшения, происходит отчетливая смена
ведущего патогенетического механизма: гиперсекреция уменьшается,
отек усиливается. Субъективно, больной или его мать, описывают
положение следующим образом: «Насморк прекратился, но дышать
В качестве одного из аргументов, обусловливающих
целесообразность интраназального применения адреномиметиков,
приводится необходимость профилактики отитов. Очевидно, что
натужные усилия по удалению слизи в немалой степени способствуют
Практические наблюдения не подтверждают профилактический
эффект этих препаратов. Напротив, уменьшение секреторной
активности и соответствующие подавление факторов неспецифической
защиты, в немалой степени способствуют активизации бактериальной
флоры, росту числа осложнений и, прежде всего, все тех же
Применение нафтизина, кратковременно облегчая состояние,
нередко приводит к тому, что длительность насморка
увеличивается. Отделяемое носовых ходов приобретает при этом
слизисто-гнойный характер, подтверждая переход ринита из
процесса чисто вирусного в вирусно-бактериальный.
Таким образом, тактический выигрыш, обусловливает
высоковероятное стратегическое поражение. Отсюда возникает
потребность в формулировке некоторых общих правил,
регламентирующих принципы интраназального введения
1. Адреномиметики всегда более показаны при выраженном отеке
и менее показаны при доминировании гиперсекреции.
2. В тех случаях, когда носовое дыхание сохранено, применение
адреномиметиков не имеет особого смысла.
3. По мере того, как возрастают потребности в увлажнении
дыхательной смеси, показания к применению адреномиметиков
дыхание через рот особенно опасно).
4. Обеспечение ингаляционной терапии. При выраженных
показаниях к проведению последней, предварительное
интраназальное введение адреномиметиков повышает эффективность
ингаляции. В данной ситуации, более целесообразно использование
препаратов с коротким (адреналин), а не с пролонгированным
(нафтизин, галазолин) действием.
5. Реальная клиническая ситуация очень часто заставляет
пренебрегать общестратегическими рассуждениями, а требует
получения немедленного терапевтического эффекта. Очевидно, что
выраженность обструктивной или обструктивно-паренхиматозной ДН
не позволяет мириться еще и с расстройством проходимости носовых
ходов. В этом случае показания к итраназальному введению
адреномиметиков становятся почти абсолютными.
В терапии ОРВИ довольно широко используются разнообразные
масляные капли. Принципиальных различий в механизме лечебного
действия вазелинового, абрикосового, персикового и других масел
нет. Широкое их применение бессмысленно, но, в ряде случаев,
показания весьма конкретны.
Во-первых, использование масляных капель заметно уменьшает
риск травматизации слизистой оболочки при аспирации слизи
электроотсосом. Во-вторых, размягчая корочки слизи, масляные
капли повышают эффективность механической санации носовых ходов.
а, в-третьих, покрывая тонким слоем слизистые оболочки,
предотвращают их высыхание. С учетом последнего, применение этих
препаратов показано, как временная мера, при выраженной сухости
слизистых. Показания к применению масел уменьшаются по мере
того, как достигает своей цели проводимая регидратационная
терапия (эти же показания могут, в ряде случаев, обусловить
целесообразность масляных ингаляций). Помимо растительных масел,
применяются различные масляные растворы, например, токоферола
ацетата, нередко используется эктерицид.
Никаких принципиальных возражений не могут вызвать
рекомендации по использованию, так называемых, «нейтральных»
капель, подразумевающих интраназальное введение физиологического
раствора.
Очевидно, что разжижение слизи будет способствовать ее
эвакуации как естественной, так и искусственной (механической).
Исключительно серьезные возражения вызывают всяческие попытки
интраназального введения антибиотиков. Результатом подобной
«терапии» являются аллергизация организма и селекция
Итоговые практические выводы:
1. Интраназальное введение лекарственных препаратов не
является обязательным в лечении вирусного крупа и очень мало
влияет на результаты терапии.
2. Если без капель в нос нельзя обойтись по деонтологическим
соображениям, то целесообразно применять либо водный раствор
интерферона, либо физиологический раствор натрия хлорида.
3. Применение адреномиметиков и масляных капель должно
базироваться на конкретных показаниях, рассмотренных выше.
4. Использование антибиотиков для интраназального введения
Сводка по вакцинам для интраназального введения
Высококонтагиозный коронавирус SARS-CoV-2, вызывающий тяжелый острый респираторный синдром, поражает дыхательные пути, а одним из способов его передачи является воздушно-капельный (аэрозольный). Следовательно, непривитым людям рекомендовано носить маски в общественных местах, соблюдать карантинные мероприятия при наличии симптомов и социальное дистанцирование. Несмотря на эти меры предосторожности, миллионы людей умирают. Поскольку волны пандемии следуют одна за одной, тема актуальности вакцин вновь занимает первые полосы газет. Кроме того, скорость разработки вакцинных препаратов на основе информационной (матричной) РНК (мРНК) возрастает. Однако, учитывая тропность вируса к тканям дыхательных путей, удивительно, что только семь из почти 100 вакцин против SARS-CoV-2, которые в настоящее время проходят клинические испытания, предназначены для интраназального введения. К преимуществам вакцин для интраназального введения относятся:
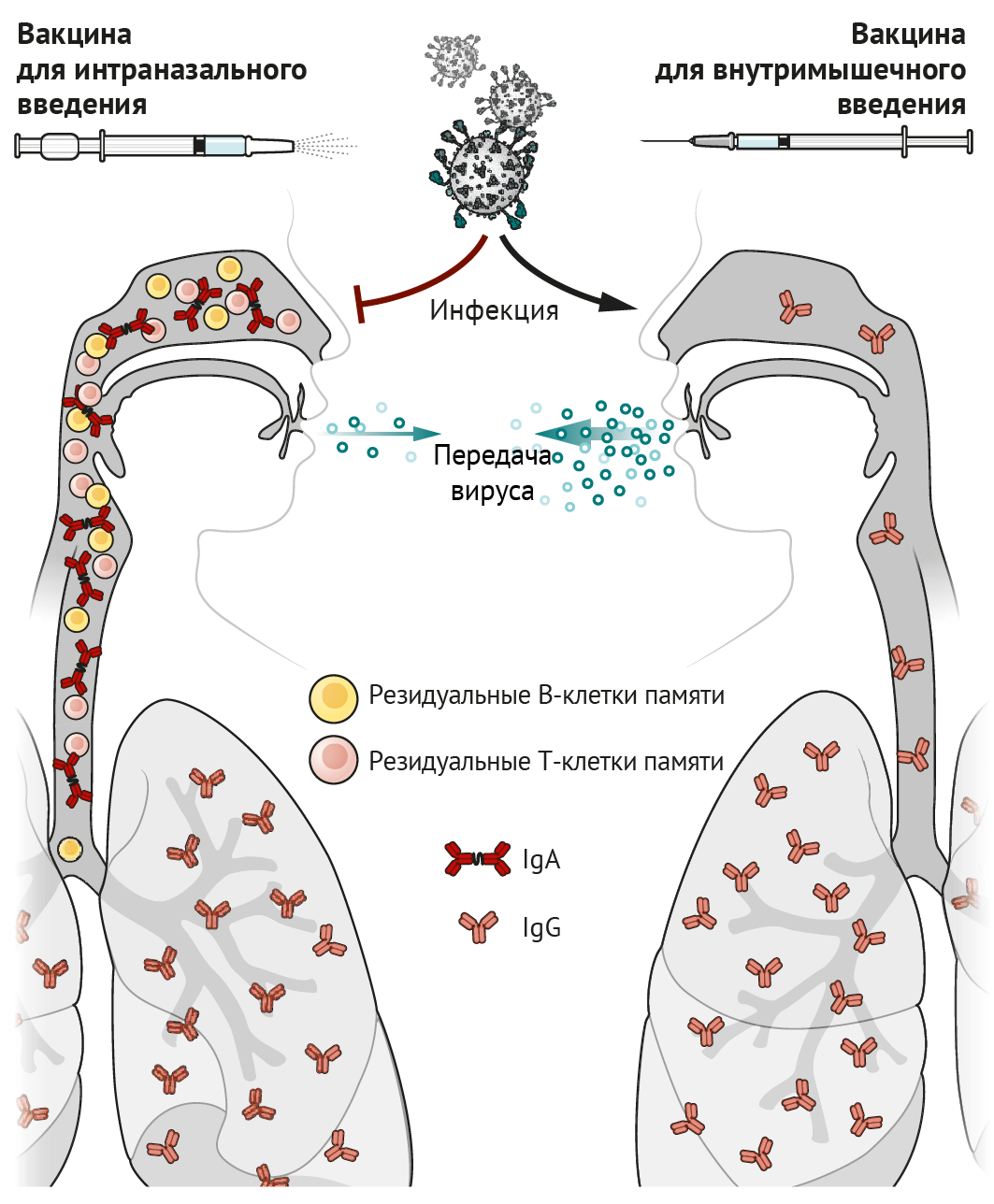
Идея о том, что интраназальная вакцинация преимущественно защищает дыхательные пути, не нова: еще в 1960-е гг. велись разработки живой аттенуированной вакцины против гриппа (ЖАВПГ), которая была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Иммунологам давно известно, что инфекция верхних дыхательных путей (ВДП) или вакцинация стимулируют антительный ответ (в виде иммуноглобулина A [IgA]) как в сыворотке, так и в жидких средах тканей ВДП. Внутримышечные вакцины преимущественно стимулируют выделение IgG (накапливается в сыворотке). IgA играет важную роль в ВДП и носовых ходах, где происходит его активный транспорт через эпителий и высвобождение в просвет дыхательных путей в виде димера, связанного с секреторным компонентом, посредством чего формируется стабилизирующая конфигурация, позволяющая более эффективно нейтрализовать вирусы, такие как SARS-CoV-2 [1]. Напротив, IgG проникает через бронхиальное дерево в легочную ткань и защищает нижние доли легкого посредством пассивной транссудации через тонкий альвеолярный эпителий [2]. Возможно, IgG, выявленный в ВДП и носовых проходах, попадает в них из нижних отделов легких посредством мукоцилиарного транспорта. Однако высокая степень иммунной защиты носовых ходов с помощью IgG может быть достигнута только при высоких концентрациях данных антител в сыворотке крови [2]. Таким образом, вакцины, вводимые внутримышечно, стимулирующие высокие титры сывороточного IgG, могут снижать вирусную нагрузку в легких и носовых ходах.
CD8+ Т-лимфоциты являются еще одним важным компонентом противовирусного иммунитета; они уничтожают непосредственно инфицированные вирусом клетки, тем самым снижая репликацию вируса и ускоряя восстановление клеток и тканей от вирусной нагрузки. Некоторые активированные CD8+ Т-лимфоциты трансформируются в клетки памяти, которые сами по себе не могут предотвратить инфицирование, но способствуют запуску быстрых реакций в ответ на вторжение патогена и стимулируют эффекторные клетки. Примечательно, что В- и Т-клетки, стимулированные вакцинацией слизистой оболочки интраназальным способом или непосредственно инфекцией, экспрессируют рецепторы, способствующие закреплению на участках слизистой оболочки клеток, способных длительно функционировать и секретировать антитела; или благодаря этим рецепторам Т- и В-клетки могут существовать в качестве резидуальных клеток памяти. Резидуальные В- и Т-клетки памяти в легких и носовых ходах — незаменимые компоненты формирования иммунного ответа, они первыми реагируют на вторжение инфекции и необходимы для быстрого очищения тканей от вируса [3, 4]. Размещение резидуальных клеток памяти в дыхательных путях необходимо для того, чтобы оказался возможным их быстрый контакт с антигеном в данной области [3, 5]. Именно это означает, что способ введения вакцин, предназначенных для задействования резидуальных клеток памяти в процессе иммунного ответа в дыхательных путях, должен быть интраназальным.
По сравнению с вакцинами, вводимыми внутримышечно, интраназальные вакцины формируют две дополнительных линии «обороны»: индуцированный вакциной синтез IgA и резидуальные В- и Т-клетки памяти в слизистой оболочке дыхательных путей, создающие эффективный барьер для инфекционных агентов в этих областях. Даже в случае развития инфекции (например, вирусной или вызывающей перекрестные реакции с тканями макроорганизма) резидуальные В- и Т-клетки памяти, которые раньше сталкиваются с антигеном и реагируют значительно быстрее, чем циркулирующие по кровотоку клетки памяти, препятствуют репликации вируса и уменьшают его распространение по организму, а также, соответственно, снижают трансмиссивность инфекции (см. рисунок).
Таблица 1 | Вакцины против SARS-CoV-2 для интраназального введения, проходящие клинические испытания
Результаты доклинических испытаний вакцин на основе аденовирусных векторов, экспрессирующих шипиковый белок SARS-CoV-2 или его рецептор-связывающий домен (РСД), свидетельствуют о том, что интраназальное введение индуцирует длительный вирус-нейтрализующий антительный ответ (в виде сывороточных IgG), а также выделение антиген-специфических IgA и реакцию CD8+ Т-клеток дыхательных путей [6–8]. Более того, как интраназальное, так и внутримышечное введение вакцин на основе аденовирусных векторов предотвращает развитие пневмонии и истощения в модели инфекции. Однако животные, вакцинированные внутримышечным путем, продолжают выделять вирус из ВДП, тогда как у животных, вакцинированных интраназальным способом, наблюдается сниженная репликация и выделение вируса как из легких, так и из носовых ходов [8].
Аденовирусы — естественные патогены человека, и большинство взрослых людей подвергаются воздействию одного или нескольких штаммов, следовательно, у них могут оказаться антивирусные антитела, способные снизить эффективность вакцины (т. н. отрицательный перекрестный эффект). Однако интраназальная противогриппозная вакцина на основе вектора Ad5 (NasoVAX), вводимая в высоких дозах, работает аналогичным образом как у серопозитивных, так и серонегативных по наличию Ad5 людей [9]; возможно, это происходит по причине того, что вводимый объем вакцины способствует снижению локальных концентраций антител. Тем не менее, пытаясь избежать любого потенциального отрицательного воздействия вакцины, некоторые разработчики используют редкие штаммы аденовирусов человека или аденовирусов шимпанзе, с которыми большинство людей в популяции не сталкивалось.
В этой связи вакцина против SARS-CoV-2 на основе гриппозного вектора из университета Гонконга в процессе своей разработки может столкнуться с определенными препятствиями. Удаление гена вируса гриппа, кодирующего неструктурный белок 1 (NS1), в значительной степени ослабляет вектор (вирулентность самого вируса гриппа) и позволяет разработчикам заменить NS1 на РСД шипикового белка SARS-CoV-2. Как и вакцины на основе аденовирусного вектора, эта вакцина также должна вызывать синтез IgA к РСД на слизистых оболочках, а резидуальные клетки памяти также должны размещаться в дыхательных путях. Однако отрицательные перекрестные реакции со стороны уже существующих антител против гриппозного вектора могут снизить эффективность вакцины. Аналогичным образом, компания Meissa Vaccines разработала вектор из живого аттенуированного респираторно-синцитиального вируса (РСВ); в нем рецепторные белки F и G РСВ были заменены на шипиковый белок SARS-CoV-2. При интраназальном введении такой химерный вирус должен вызывать иммунные реакции в слизистой оболочке. Необходимо отметить, что существует предположение, согласно которому изменение поверхностных белков изменит клеточную тропность вируса, а также его иммуногенность. Уже существующие антитела против РСВ теоретически не должны мешать развитию иммунного ответа вследствие вакцинации, но уже существующие антитела против шипикового белка могут снизить его интенсивность.
Показателями эффективности живых аттенуированных интраназальных вакцин против SARS-CoV-2 также должны стать способность вызывать антительный ответ (в виде IgA) слизистых оболочек и формирование популяции резидуальных клеток памяти в ВДП. В отличие от векторных вакцин, экспрессирующих только шипиковый белок или РСД, живой аттенуированный вирус SARS-CoV-2 обладает преимуществом в экспрессии и потенциальной стимуляции иммунного ответа против всех вирусных белков, тем самым формируя иммунитет широкого спектра действия, который теоретически способен обеспечивать определенный уровень иммунной защиты против различных вариантов штаммов SARS-CoV-2. Хотя современные молекулярные методы минимизируют риск реверсии, живые аттенуированные вирусы сохраняют репликативную способность и противопоказаны детям младше 2 лет, людям старше 49 лет или лицам с ослабленным иммунитетом, поэтому живые аттенуированные вирусы SARS-CoV-2 и РСВ, экспрессирующий шипиковый белок, также могут столкнуться с пристальным изучением их потенциальной возможности вызывать побочные симптомы со стороны нервной системы [10].
При разработке живых аттенуированных вакцин необходимо обязательно брать в расчет опыт применения ЖАВПГ в прошлом. У детей чаще применяют интраназальный способ введения ЖАВПГ, нежели внутримышечный [11]. Вероятно, это отражает иммунологическую наивность детей (большинство из них за жизнь еще не сталкивалось с вирусом гриппа). Следовательно, отсутствует иммунный барьер для инфекции, провоцируемой ЖАВПГ в носовых ходах, и введение вакцины оказывается эффективным, приводя к формированию устойчивого антительного ответа (IgA) в слизистой оболочке и появлению резидуальных клеток памяти в ВДП. ЖАВПГ, вводимая интраназально, также эффективна у взрослых, но не в той же степени, что вакцина, введенная внутримышечно [11], отчасти потому что инфекция гриппа в анамнезе привела к формированию базового уровня иммунитета, который еще больше снижает вирулентность вируса в ЖАВПГ. Следовательно, живые аттенуированные вакцины против SARS-CoV-2 могут привести к формированию надежной защиты у наивных людей, но у людей, переболевших COVID-19 в анамнезе, может быть достаточная степень иммунной защиты для нейтрализации вакцины, что ставит под сомнение ее эффективность даже в качестве средства ревакцинации.
Только одна из интраназальных вакцин, проходящих клинические испытания, является инертной — это кубинская вакцина CIBG-669, в составе которой присутствует РСД, связанный с коровым антигеном вируса гепатита B (является мощным стимулятором Т-лимфоцитов). Поскольку инертные вакцины не зависят от наличия инфекции в анамнезе или экспрессии генов, иммуногенность таких препаратов не может быть нейтрализована уже существующими антителами. Однако растворимые белки в составе вакцин при попадании на слизистые ВДП, не приводят к нарушению целостности эпителия (что необходимо для эффективного развития иммунного ответа). Вместо этого они должны переноситься сквозь эпителиальный барьер специализированными микроскладчатыми клетками (M-клетки) [12], способными доставлять антигены к иммунокомпетентным клеткам под слоем эпителия.
Примечательно, что в списке интраназальных вакцин отсутствуют вакцины, в составе которых находится мРНК, инкапсулированная в липидный слой. МРНК-вакцины, вводимые внутримышечно, приводят к образованию высоких титров сывороточного IgG против антигенов, кодируемых мРНК. Исследования на животных моделях (грызуны) свидетельствуют, что вакцины, содержащие мРНК, также эффективны при интраназальном введении [13]. Однако важно различать интраназальную вакцинацию и назальную вакцинацию. Грызунам часто дают наркоз для интраназальной вакцинации, чтобы животные медленно и глубоко дышали, вследствие чего вакцинный биоматериал в полной мере попадает в легкие. В результате большая часть литературы (включая некоторые цитируемые здесь источники) об интраназальной вакцинации грызунов на самом деле относится к внутрилегочной вакцинации, которая может обеспечить более полную защиту, чем строго назальная вакцинация. Тем не менее, резидуальные клетки памяти из носовых ходов могут предотвратить попадание вируса в легкие [4]. Учитывая, что доставка вакцины непосредственно в нижние дыхательные пути может вызывать воспаление или привести к обострению таких состояний, как бронхиальная астма или хроническая обструктивная болезнь легких (ХОБЛ), введение интраназальных вакцин людям обычно осуществляют таким образом, чтобы предотвратить непосредственное попадание антигена в легкие.
Липидный состав имеет решающее значение для стабильности мРНК вакцины, для прицельного воздействия иммунокомпетентных клеток и высвобождения мРНК в цитозоль. Таким образом, успешность применения интраназальных мРНК-вакцин в будущем, вероятно, будет зависеть от разработки липидных наночастиц, на которые смогут воздействовать соответствующие типы клеток в носовых ходах. В отличие от вирусов и вирусных векторов, на поверхности липидных наночастиц нет белков, и теоретически они не должны нейтрализоваться антителами. Благодаря этому, тот же состав, что и при первом введении, может быть применен для ревакцинации. Однако сохраняется вероятность развития побочных эффектов, таких как повышенная усталость и недомогание, часто связанных с введением вакцин на основе мРНК. Следовательно, при разработке интраназальных вакцин, содержащих мРНК, важно учитывать эти аспекты во избежание побочных эффектов и повышенной реактогенности.
В конечном счете, цель вакцинации — стимуляция иммунитета на длительное время. Однако продолжительность антительного ответа (по антителам сыворотки) значительно варьируется в зависимости от недостаточно изученных свойств антигенов, инициирующих иммунную реакцию [14]. Антительный ответ в слизистой оболочке считается краткосрочным, однако его фактическая продолжительность зависит от того, как часто иммунокомпетентные клетки встречают определенный антиген. Аналогично, циркулирующие Т-клетки иммунной памяти самообновляются и сохраняются на длительные периоды времени, тогда как популяция Т-клеток памяти, находящаяся в легких, исчезает относительно быстро: в большей степени это касается CD8+ Т-клеток, чем CD4+ Т-клеток. Таким образом, действие интраназальных вакцин должно вносить равновесие между функционированием местного иммунитета в дыхательных путях и длительностью системного иммунитета. Однако эффективные стратегии вакцинации не должны ограничиваться одним путем введения. Действительно, клетки памяти, стимулированные вакциной, введенной внутримышечно, могут быть доставлены внутрь слизистой путем интраназальной ревакцинации слизистой оболочки [15]. Таким образом, идеальная стратегия вакцинации может быть следующей: