Дмт 1 степени у ребенка что это такое
Недостаточность питания у детей раннего возраста: патогенез, диагностика, диетологическая коррекция
Освещены этиология и патогенез недостаточности питания у детей раннего возраста. Особое внимание уделено вопросам диагностики и тактики диетотерапии, а также опыту применения современной смеси на основе козьего молока у пациентов с недостаточностью питани
Pathogenesis and aetiology of nutritional deficiency in children of the early age were presented. Particular attention was paid to the issues of diagnostics and dietary therapy strategy, as well as to experience of use of modern mixture based on goat’s milk in patients with nutritional deficiency.
Согласно современным представлениям, питание — это синхронизация взаимодействия и ассимиляции нутриентов по всей трофической цепи организма — доставка и усвоение питательных веществ клетками организма, удаление продуктов жизнедеятельности, ресинтез веществ, уравновешенность процессов (анаболизм и катаболизм) и т. д. [1, 2]. Поэтому вопросы адекватного питания как здоровых детей раннего возраста, так и детей с синдромом недостаточности питания широко обсуждаются и являются актуальными. И в настоящее время уже определены количественные и качественные составляющие рационов питания, учитывающие возраст и степень тяжести недостаточности питания.
Для нормального жизнеобеспечения ребенку необходимо ежедневно с рационом питания получать более 75 нутриентов, 45–50 из которых являются незаменимыми.
Обмен веществ в организме — это единый процесс, который поддерживает равновесие, перераспределяя потоки питательных веществ, и может обеспечивать свои энергетические и пластические потребности при отсутствии поступления тех или иных нутриентов. Установлено, что углеродные цепи глюкозы могут трансформироваться в углеродные цепи всех эссенциальных аминокислот. При дефиците белка в рационе из углеводов в тканях, в результате химических реакций, могут синтезироваться аланин, аспарагиновая и глутаминовая кислоты. Из белков путем глюконеогенеза могут образовываться углеводы. Ряд аминокислот может трансформироваться в жирные кислоты, а глицерин, образующийся при расщеплении жиров, в свою очередь, может превращаться в углеводы [1].
Важно отметить, что постоянный избыток или, напротив, недостаток какого-либо нутриента, особенно в рационе питания ребенка, может приводить к негативным последствиям. Например, избыток белка в рационе ведет к снижению его утилизации, накоплению аммиака и азотистых продуктов, что способствует развитию ацидоза. Недостаточное поступление в организм ребенка питательных веществ и, как правило, уменьшение общей калорийности рациона способствует развитию или первичной трофической (алиментарной) недостаточности, или вторичной, обусловленной дисбалансом между неучтенными повышенными потребностями детского организма при болезни и поступлением питательных веществ.
Как отмечено ранее, первичная алиментарная недостаточность формируется при нарушениях качества и режима вскармливания. Неправильное вскармливание подразумевает неадекватно подобранное питание в соответствии с возрастом или индивидуальными потребностями ребенка. У детей, получающих грудное вскармливание, наиболее частой причиной недокорма является гипогалактия у матерей [3].
Проблемы с приемом пищи нередко отмечаются у детей с нарушенным актом сосания (например, при пороках развития лицевого скелета), глотания (при синдроме мышечной слабости), обильных срыгиваниях и рвотах, критических ситуациях (при утрате сознания).
В настоящее время в клинической практике редко встречается первичная алиментарная недостаточность питания. Чаще — это вторичная недостаточность питания, обусловленная повышенным расходом энергии, нарушением ассимиляции или метаболизма нутриентов вследствие тяжелых врожденных или приобретенных патологических состояний (инфекционные заболевания, наследственные или врожденные энзимопатии, эндокринные заболевания, органическая патология ЦНС и др.), травм [3].
В этой связи при трофической недостаточности питание не может быть интерпретировано как простое снабжение организма определенным набором нутриентов, так как это гораздо более сложный процесс, в котором пищеварительная система осуществляет активные взаимодействия с другими органами и системами организма.
Важно подчеркнуть, что в основе трофической недостаточности лежат нарушения белково-энергетического, водно-электролитного, витаминного гомеостаза — сложнейшего процесса взаимодействия жизненно необходимых питательных веществ с рядом гормонов, регуляторных веществ, приводящего к нарушению доставки питательных веществ к органам-мишеням и их усвоения ими [2].
Патогенез трофической недостаточности определяется постепенным нарастанием степени нарушений в обмене веществ на фоне дефицита питательного субстрата и изменениями в трофической цепи.
Первоначально истощаются запасы субстратов, несущих энергетическую функцию, — углеводов, а затем — жиров. Следующим этапом является катаболизм белка мышечной ткани. Важно отметить, что при дефиците белков плазмы внутриклеточные белки могут быстро преобразовываться в аминокислоты под влиянием внутриклеточных лизосомальных пищеварительных ферментов [1]. Исключение составляют лишь белки ядра клетки и хромосом, а также структурные белки (например, белки коллагеновых волокон и сократительные белки мышц). Аминокислоты активно используются для синтеза крайне необходимых транспортных, иммунных, острофазных и некоторых других белков, а также расходуются на энергетические нужды. В условиях энергетического голода часть белков метаболизируется до углеводов (глюконеогенез), а часть до жирных кислот. При катаболической направленности обменных процессов энергия (глюкоза) используется преимущественно мозгом, нарушается инсулинозависимый рост тканей, что является дополнительным фактором в снижении массы тела и замедлении роста ребенка.
При продолжающемся отсутствии коррекции трофической недостаточности организм приспосабливается к недостатку нутриентов и переходит на режим максимальной экономии энергии путем замедления распада белка и жира. При этом период полужизни белков увеличивается (например, период полужизни альбумина удваивается). Нарушения метаболизма белка приводят к нарушениям в функционировании иммунной системы в связи с изменением синтеза иммуноглобулинов, а также антиоксидантной активности, сопровождающейся повреждением клеточных мембран. Нарушению строения и функционирования клеточных мембран способствует возникающее ухудшение ассимиляции тканями триглицеридов и, соответственно, неэстерифицированных жирных кислот, снижение концентрация фосфолипидов и холестерина в крови: развивается дефицит эссенциальных жирных кислот. Дальнейшие нарушения связаны со снижением уровня короткоживущих белков крови (транстиретина, трансферрина, церулоплазмина и др.), затем уменьшается концентрация альбумина и общего белка в крови [3].
Недостаточность питания формирует дефицит не только основных нутриентов, но и многих эссенциальных веществ — витаминов, макро- и микронутриентов. В результате развиваются такие дефицитные состояния, как остеопения, анемия и др. [4]. При этом изменения, происходящие при трофической недостаточности во всех органах и системах организма, в том числе и в желудочно-кишечном тракте, усугубляют ситуацию. Так, возникает дистрофия и атрофия слизистой оболочки кишечника, что сопровождается нарушением внутриполостного и мембранного пищеварения, нарушается моторика желудочно-кишечного тракта, страдает местный иммунитет, возможна контаминация условно-патогенной кишечной микрофлоры из дистальных в проксимальные отделы кишечника. Все эти изменения ухудшают всасывание и усвоение пищи.
Таким образом, результатом продолжительной недостаточности питания является снижение массы тела и скорости роста, а также отставание в психомоторном развитии, задержка речевых и когнитивных навыков и функций, высокая инфекционная заболеваемость вследствие снижения иммунитета, что в свою очередь усугубляет расстройство питания [3].
В отечественной педиатрии, говоря о трофической недостаточности у детей первого года жизни, используют термин «гипотрофия». Однако при постановке диагноза гипотрофии врачи руководствуются обычно только отклонениями в антропометрических данных ребенка (массоростовых показателях), по которым сложно оценить степень нарушений, происходящих в организме. Понятие трофической недостаточности наиболее широкое и включает обязательную оценку соматического и висцерального пула белка (определение в крови уровня короткоживущих белков, альбумина, общего белка, абсолютного числа лимфоцитов). Соматический пул белка отражает состояние мышечной массы и определяется путем измерения окружности плеча, толщины кожно-жировых складок, вычислением окружности мышц плеча [5]. Перечисленные показатели достаточно информативны для оценки состояния мышечной массы и жировых депо и позволяют диагностировать недостаточность белка или белка и энергии, а также предположить наличие дистрофических изменений внутренних органов по величине содержания жира. К сожалению, центильные таблицы по таким параметрам, как окружность плеча, толщина кожных жировых складок, разработаны лишь для детей с года жизни. Помимо соматометрических показателей для оценки состояния соматического пула белка применяется суточная экскреция креатинина с мочой (показатель отражает тощую массу). Однако, как и другие методы определения состава тела у детей раннего возраста (биоимпедансометрия, денситометрия), они не являются рутинными. Поэтому основными критериями диагностики трофической недостаточности у детей первого года являются клинические (оценка соматического состояния, кожных покровов, слизистых, тургора тканей и т. д.); среди соматометрических — массоростовые параметры; данные лабораторных исследований (клинический и биохимический анализ крови, мочи, копрограмма) и морфофункциональные критерии (ультразвуковое исследование, фиброэзофагогастродуоденоскопия и т. п.).
Дефицит массы тела (ДМТ) определяют по формуле:
где РМТ — рекомендуемая масса тела, ФМТ — фактическая масса тела.
При дефиците массы тела 10–20% диагностируют легкую, 20–30% — среднетяжелую, более 30% — тяжелую недостаточность питания.
Тактика диетотерапии и метаболической терапии напрямую зависит от степени выявленных нарушений и тяжести состояния ребенка. Необходимо подбирать оптимальное питание и проводить коррекцию нарушенной трофической цепи — оптимизировать процессы пищеварения и всасывания, сохранить кишечный микробиоценоз, обеспечить должный внутриклеточный метаболизм, активировать анаболические процессы [2].
При выборе питания следует отдавать предпочтение грудному молоку, а при его недостатке или отсутствии — современным смесям, сбалансированным по составу основных пищевых веществ, макро- и микронутриентам, обогащенных нуклеотидами, полиненасыщенными жирными кислотами, пре- и пробиотиками. Так как указанные факторы питания способствуют восстановлению нарушенной трофической цепи.
Например, нуклеотиды участвуют в синтезе нуклеиновых кислот, построении АТФ, положительно влияют на обмен липидов и, что очень важно в условиях недостаточности питания, — повышают уровень секреторного IgA, ускоряют созревание эпителия тонкой кишки. Показано улучшение соматометрических показателей (масса тела, рост, окружность головы) у детей с задержкой внутриутробного развития при вскармливании смесями, содержащими нуклеотиды [4].
Полиненасыщенные жирные кислоты — эйкозапентаеновая и докозагексаеновая, обладают противовоспалительным эффектом, позволяют уменьшить спазм сосудов, агрегацию тромбоцитов, улучшить перфузию кишечника, повысить иммунную защиту [6].
Обеспечение организма нутриентами достигается как за счет активного пищеварения, так и синтеза бактериальной флорой кишечника целого ряда незаменимых регуляторных веществ. Облигатная бактериальная флора желудочно-кишечного тракта необходима для поддержания трофического гомеостаза, так как участвует в синтезе витаминов, аминокислот, регуляторных пептидов [7]. Кроме того, поступление нутриентов во внутреннюю среду организма зависит от состояния пристеночного пищеварения и возможностей их всасывания, а также оптимальной моторно-эвакуаторной функции желудочно-кишечного тракта. Поэтому важно проведение деконтаминации кишечника ребенка при наличии патогенных и условно-патогенных бактерий и поддержание индигенной нормофлоры вводимыми в состав смеси пре- и пробиотическими факторами.
При назначении диетотерапии следует учитывать количество вводимых белковых и небелковых килокалорий для того, чтобы достичь должной ассимиляции белка и активации оптимального белкового синтеза. При этом необходимо обеспечивать на 1 г вводимого азота 150 небелковых килокалорий или на 1 г вводимого белка — 30 небелковых килокалорий. Среди небелковых килокалорий соотношение углеводных и липидных килокалорий колеблется от 70:30 до 50:50 [2]. Особенно это следует учитывать при проведении парентерального питания. При отсутствии должного энергетического обеспечения организм через глюконеогенез использует циркулирующие в крови аминокислоты не для пластических целей, а в качестве источника энергии. В свою очередь, дефицит энергии усиливает белковый катаболизм. Большинство современных смесей для питания детей первого года жизни отвечают данным требованиям.
Для детей с недостаточностью питания, получающих искусственное вскармливание, важно наличие в составе смеси легкоусвояемых нутриентов, подобных грудному молоку. Так, в состав жирового компонента смесей на основе козьего молока Kabrita® Gold (1, 2, 3 формулы) включен DigestX® — липидный комплекс с высоким содержанием в нем пальмитиновой кислоты в sn-2-позиции (42%) в молекуле глицерола, аналогично грудному молоку. Дополнение смеси DigestX® способствует улучшению усвоения жира путем уменьшения экскреции жирных кислот с калом, а также уменьшению экскреции кальция с калом, что ведет к улучшению усвоения кальция. Благодаря наличию пальмитиновой кислоты в sn-2-позиции, уменьшается содержание кальциевых солей жирных кислот в кале — облегчается пищеварение и формируется мягкий стул. Эффективность и безопасность DigestX® подтверждена клинически [8, 9].
Таким образом, модификация жирового состава смеси способствует ее легкой и лучшей усвояемости, что важно для пациентов с недостаточностью питания. Cостав белка смеси на основе козьего молока (Kabrita® Gold) отличен от коровьего, так как имеет низкое содержание альфа-s1-казеина и высокое — бета-казеина. Известно, что альфа-s1-казеин определяет уровень коагуляции белка, поэтому белок козьего молока образует мягкий, легко перевариваемый сгусток в желудке, подобный сгустку белка грудного молока [10]. Смеси Kabrita® Gold являются сывороткодоминирующими. Установлено, что смеси, обогащенные сывороточными белками, способствуют более оптимальному составу кишечной микрофлоры, чем казеиндоминирующие смеси, реже вызывают срыгивания и другие функциональные нарушения со стороны желудочно-кишечного тракта [11].
В смесях Kabrita® Gold помимо легкоусвояемого белка козьего молока и жира, дополненного DigestX®, содержатся пребиотики GOS и FOS, бифидобактерии ВВ-12, нуклеотиды, длинноцепочечные полиненасыщенные жирные кислоты — докозагексаеновая и арахидоновая кислоты, витамины, макро- и микронутриенты.
По данным Т. В. Белоусовой, при применении смеси на основе козьего молока Kabrita® Gold (1 формула) у детей с недостаточностью питания легкой степени в постнатальном периоде и с исходной гипотрофической задержкой внутриутробного развития I степени, с наличием гастроинтестинальной дисфункции (срыгивания, метеоризм), была достигнута положительная динамика в нутритивном статусе в сравнении с показателями при использовании формул на основе сывороточных белков коровьего молока [12]. В группу исследования включен 21 ребенок первых 2–3 месяцев жизни. Пациенты изначально получали заменители грудного молока на основе сывороточных белков коровьего молока, базовые формулы. До момента назначения смеси Kabrita® Gold среднесуточные прибавки в массе тела у детей на предшествующей исследованию неделе отличались от средних значений и составляли в среднем не более 15 г, что послужило основанием смены питания. Уже к концу первой недели приема смеси Kabrita® Gold среднесуточные прибавки у них возросли до 25 г, а к концу 2-й недели составили в среднем 35 г (рис.).
Выраженный метеоризм и срыгивания (1–2 балла) отмечались у пациентов до начала применения смеси Kabrita® Gold. Тогда как в динамике наблюдалось уменьшение степени выраженности и купирование симптомов на второй неделе использования смеси, при этом объем потребляемого продукта увеличился в среднем в 1,3 раза. Исследователь отмечает, что до перехода на данную смесь эти дети нуждались в назначении прокинетиков и препаратов, содержащих симетикон, и уже к концу первой недели приема смеси указанные препараты были отменены. Кроме того, при опросе матерей относительно толерантности к питанию и комфортности в поведении детей были получены положительные отзывы. Таким образом, молочная смесь на основе козьего молока Kabrita® Gold, содержащая пре- и пробиотики, может быть рекомендована в качестве базового питания детей с периода новорожденности и детей раннего возраста, в том числе при умеренном дефиците питания, как продукт с хорошей переносимостью при отсутствии грудного молока у матери [12].
При среднетяжелой и тяжелой недостаточности питания требуется высококалорийная/высокобелковая диета [3]. В данной ситуации возможно использование смесей с более высоким содержанием белка, например, смесей для недоношенных и маловесных детей, а также специализированных продуктов энтерального питания для детей раннего возраста. При выявлении нарушений расщепления/всасывания пищевых ингредиентов целесообразно применение лечебных продуктов — смесей на основе высокогидролизованного молочного белка со среднецепочечными триглицеридами [4].
При назначении диетотерапии рекомендуется постепенное увеличение пищевой нагрузки с учетом толерантности ребенка к пище. При недостаточности питания легкой степени расчет питания проводится на ДМТ. Необходимо также учитывать наличие заболеваний у ребенка, при которых требуется повышение энергетической ценности рациона питания (например, бронхолегочная дисплазия, врожденные пороки сердца и т. д.).
Алгоритм пошаговой коррекции недостаточности питания среднетяжелой степени выглядит следующим образом: в первые 2–5 дней (период адаптации) расчет питания проводится на ФМТ, количество кормлений увеличивается на 1–2. Затем следует период репарации (5–7 дней), когда расчет питания проводится на ДМТ. При достижении ребенком ДМТ дальнейшее питание назначается в соответствии с возрастом и заболеванием. При отсутствии ДМТ рекомендуется период усиленного питания (повышение калорийности рациона до 130–145 ккал/кг/сут, белка до 4,5 г/кг/сут) на 1–2 месяца [3].
Питание ребенок получает через рот при сохранном сосательном рефлексе и глотании. В тяжелых случаях (при тяжелой недостаточности питания) доставка грудного молока/смеси осуществляется через зонд и/или дополняется парентеральным питанием.
Начиная с периода репарации целесообразна заместительная ферментотерапия препаратами поджелудочной железы, коррекция железодефицитной анемии, рахита, поливитаминные комплексы и средства, положительно влияющие на обменные процессы.
Таким образом, при недостаточности питания у детей раннего возраста необходима продуманная комплексная метаболическая и диетологическая коррекция, способствующая восстановлению нарушенной трофической цепи организма и, в итоге, достижению положительного результата.
Литература
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Миодистрофия Дюшенна: что это такое?
Время чтения: 10 мин.
Доктор медицинских наук, президент благотворительного фонда «Гордей» и бабушка Гордея, мальчика с диагнозом миодистрофия Дюшенна, Татьяна Андреевна Гремякова рассказывает о том, что это за болезнь, почему ее часто принимают за гепатит, и что необходимо делать, чтобы дети с этим диагнозом как можно дольше сохраняли активность и жили полной жизнью.
Мышечная дистрофия Дюшенна (МДД) — одно из наиболее распространенных среди редких (орфанных) генетических фатальных нейромышечных заболеваний. В большинстве случаев оно встречается только у мальчиков.
Заболевание развивается вследствие мутации гена, который отвечает за синтез белка дистрофина. У детей прогрессирует повреждение и дегенерация мышц. Со временем мышцы слабеют до такой степени, что дети/подростки не могут самостоятельно передвигаться — в возрасте 10-15 лет мальчики садятся в инвалидную коляску. Параллельно у них развиваются кардиореспираторные нарушения — проблемы с сердцем и дыханием. В возрасте 15-20 лет им уже требуется респираторная поддержка: вначале только ночью, а в дальнейшем – круглосуточно.
Сегодня, благодаря профилактике формирования контрактур, сколиоза и кардиомиопатии, применению стероидов, внедрению респираторной поддержки и другим превентивным мерам, удалось существенно продлить функциональную активность пациентов,
качество и продолжительность их жизни.
Ожидаемая продолжительность жизни мальчиков с МДД, рожденных в последние годы в развитых странах (при условии, что им доступна современная реабилитация, терапия и респираторная поддержка), — 30-40 лет.
Болезнь в большинстве случаев передается от матерей, но сами женщины от нее практически не страдают: они бессимптомные или малосимптомные носители дефектного гена. Ген может передаваться по женской линии многие поколения и никак не проявляться, поэтому рождение ребенка с дистрофией Дюшенна для семьи часто становится неожиданностью. В трети случаев болезнь – результат спонтанной мутации плода без семейной истории.
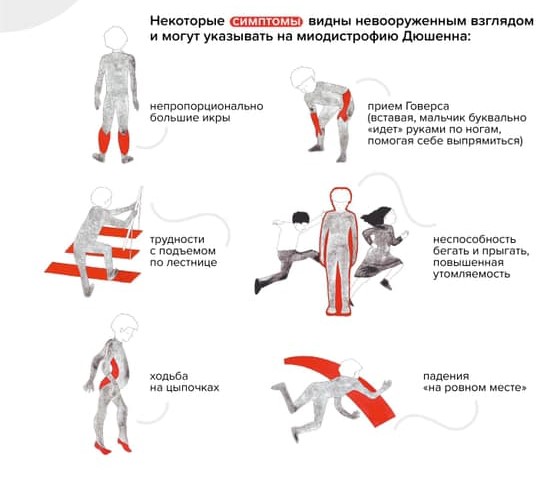
В начале болезнь распознать трудно: симптомы проявляются не сразу и нарастают постепенно. Чаще всего до четырех-пяти лет врачи и родители считают, что малыш здоров. У ребенка могут быть некоторые задержки двигательного и речевого развития, он может быть неуклюжим, часто падать и быстро уставать. Мальчик с МДД не бегает так быстро, как сверстники, не прыгает. Родителям зачастую видны некоторые особенные нюансы взросления, но никаких «красных флагов», которые позволили бы серьезно обеспокоиться, нет довольно долго.
Ребенок растет, со временем меняется его походка и осанка. Можно заметить, что он ходит на носочках. Ему трудно вставать с пола — поднимается, опираясь на руки (прием Говерса).
«Прием Говерса» и другие вероятные признаки наличия у ребенка миодистрофии Дюшенна / Фонд «Гордей»
Обращает на себя внимание увеличение икроножных мышц. Позднее трудности при ходьбе нарастают: ребенок с трудом поднимается по лестнице, у него совсем нет сил. В какой-то момент он вовсе перестает ходить и садится в инвалидную коляску.
Если есть сомнения относительно здоровья мальчика, то первое, что нужно сделать, — анализ крови на активность креатинфосфокиназы (КФК). Это фермент, содержащийся в скелетных мышцах, маркер их распада. Обычно при МДД он бывает выше нормы во много раз — например, несколько десятков тысяч единиц при норме в сотню.
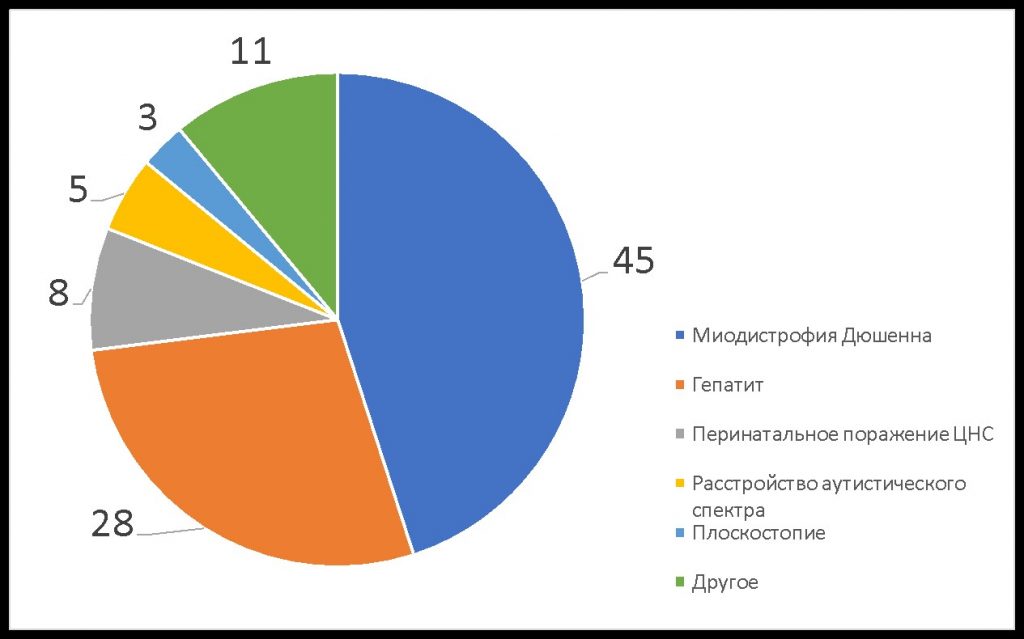
МДД — редкое заболевание. Врачи могут ни разу за свою практику не столкнуться с ним и не знать, что делать. Часто ребенку ошибочно ставят диагноз гепатит, перинатальное поражение ЦНС и/или аутизм и назначают лечение, подчас ускоряющее прогрессирование Дюшенна (Рис. 1).
Рис. 1. Результаты опроса
200 родителей (%): «Какой первый диагноз был поставлен мальчику с миодистрофией Дюшенна в первичном поликлиническом звене?»
Почему гепатит — самый частый из неверных диагнозов? При МДД в крови повышаются уровни трансаминаз, что ошибочно принимается за симптоматику гепатитов. Но эти ферменты в случае МДД мышечного, а не печеночного происхождения.
Если выявлено увеличение уровня КФК выше критического (более 2000 ед), необходимо делать генетический анализ и искать мутацию в гене дистрофина.
Информация для медицинских специалистов
Ген дистрофина — один из самых больших в человеческом организме. Он состоит примерно из 2,5 млн пар нуклеотидов, содержит 79 экзонов, размер гена 2,2 Мб. Уровень мутаций гена относительно высок: в одном из трех случаев МДД вызывается мутацией de novo (впервые возникшее изменение, в отличие от унаследованного – прим.ред). Таким образом, новые случаи возникают даже при наличии хороших инструментов пренатальной диагностики и семейного консультирования для известных случаев.
Высокая частота мутаций также лежит в основе большого разнообразия мутаций, выявленных у пациентов с МДД. Наиболее часто встречаются делеции (
68%), затем по частоте идут дупликации (
11%) одного или нескольких экзонов, реже обнаруживаются небольшие мутации (∼20% пациентов). Мутации могут происходить на любом участке гена, но делеции чаще сконцентрированы между экзонами 45–55, а дупликации — между экзонами 2–10. Тип и расположение мутации определяют ход течения заболевания и то, какое лечение требуется больному.
Сейчас в России применяется специфическая молекулярно-генетическая диагностика повреждения гена дистрофина, определение мутации в каждом конкретном случае.
Генетическое тестирование позволяет точно поставить диагноз. Ранняя и прецизионная диагностика больных МДД необходима для правильного сфокусированного назначения этиопатогенетической терапии. Фактически каждому такому ребенку требуется персонализированная терапия в зависимости от типа и локализации мутации гена.
Бесплатная генетическая диагностика проводится больным с диагнозом МДД, а также бессимптомным пациентам с высокими значениями КФК (более 2000 ЕД\л) с 2019 года. Ограничений по возрасту исследуемых больных нет.
Как попасть на генетическую диагностику?
Диагностику проводят в ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова». Направить на диагностику может только врач. Для этого он должен позвонить на Горячую линию по номеру 8-800-100-17-60 (линия предназначена исключительно для врачей) и зарегистрировать пациента в программе бесплатного генотипирования. В этом случае транспортные услуги по перевозке биоматериалов также будут бесплатны.
Только в 30% случаев больной ребенок рождается в результате спонтанной мутации. В 70% случаев носителем мутации является мама ребенка, которая, как правило, не знает об этом.
При планировании беременности женщинам желательно сделать генетический тест на носительство МДД. В некоторых странах такой тест обязателен.
Оценка функциональной активности ребенка позволяет понять его состояние и спрогнозировать дальнейшее течение заболевания. Для этого заболевания нет биохимических маркеров течения болезни. Изменение функциональной и физической активности у детей с МДД выражается в числовых значениях. Это позволяет понять степень выраженности болезни и динамику ее клинической симптоматики.
Если ребенок ходит, его состояние оценивают по методу The North Star (NSAA). Дополнительно оценивается расстояние, пройденное за 6 минут, и время подъема и спуска с четырех ступеней.
Для тех, кто потерял способность ходить, есть метод оценки работы рук — Performance of Upper Limb (PUL) test.
Физическая терапия и реабилитация — основа ухода за больными с МДД на протяжении всей жизни. Она нужна, чтобы поддерживать физическую активность и функциональность.
Современная реабилитация ориентирована:
На более поздних этапах болезни это:
Тутора для ребенка с миодистрофией Дюшенна / Фонд «Гордей»
Для сохранения способности ходить важно следить за постановкой ног ребенка на полную стопу, а также уделять внимание растяжке, особенно мышц голеностопа. Иначе через некоторое время мальчик сможет ходить только на цыпочках, и тогда ему понадобится коляска.
Занятия в бассейне / Фонд «Гордей»
Если не заниматься физической терапией, ребенок может потерять способность ходить рано и сесть в коляску в 7-8 лет.
В результате начнутся серьезные изменения, в первую очередь, позвоночника: сильный сколиоз, требующий операции на позвоночнике, пострадают сердце и дыхание.
Реабилитация и физическая терапия способны надолго продлить двигательную активность больного.
Позиционирование на стадии коляски фокусируется на том, чтобы сохранить правильное положение тела и ног, не допустить развития сколиоза и контрактур в суставах, сохранить максимальный объем движений рук.
В наиболее тяжелой стадии заболевания важна респираторная реабилитация.
Медицинская помощь
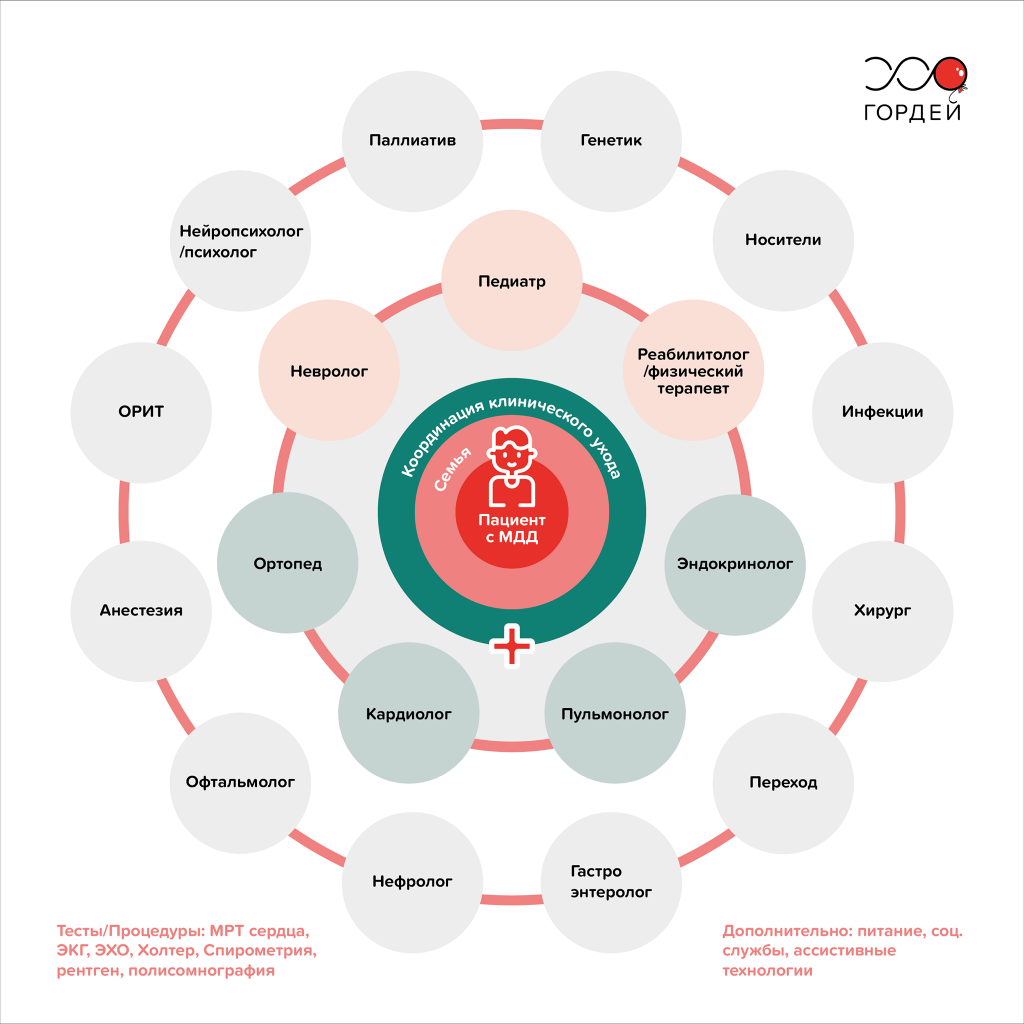
Миодистрофия Дюшенна — прогрессирующее заболевание, которое со временем поражает многие системы и органы человека. А значит, вести пациента с МДД должна мультидисциплинарная команда врачей под руководством специалиста по нервно-мышечным заболеваниям (например, педиатр или детский невролог).
По мере взросления ребенка эта функция переходит к неврологу, работающему со взрослыми пациентами. Следует заранее определить необходимых специалистов, чья помощь понадобится уже взрослому пациенту.
В современной медицинской и паллиативной концепции ведения пациентов с МДД считается важным ориентироваться на его семью: общаться, координировать уход, информировать об ожидаемых изменениях, связанных с болезнью.
Какие врачи ведут пациента с МДД
| Специалист | Сфера ответственности |
|---|---|
| Невролог | Комплексное ведение болезни на протяжении всей жизни. |
| Реабилитолог | Упреждение развития контрактур и деформации, минимизация боли, продление функциональности и способности к передвижению. |
| Ортопед/Хирург | Поддержка двигательных функций как можно дольше, минимизация контрактур суставов, поддержка позвоночника в прямом положении. |
| Эндокринолог (поддержание костного здоровья) | Уменьшение прогрессирования остеопороза, восстановление при ранних признаках остеопороза. |
| Эндокринолог (рост и половое созревание) | Минимизация нарушений роста, коррекция пубертатного развития, развитие и предотвращение опасного для жизни криза надпочечников. |
| Пульмонолог | Уменьшение респираторных осложнений и сохранение функции дыхательных мышц. |
| Кардиолог | Максимальное продление работы сердца, упреждение формирования сердечной недостаточности и других отклонений. |
| Гастроэнтеролог и диетолог | Профилактика недостаточного или плохого питания, избыточного веса и ожирения. |
| Психолог | Психосоциальная поддержка на протяжении всей жизни, помощь в планировании будущего и формировании представлений о том, как пациенты будут активно участвовать в уходе за собой и ежедневной деятельности. |
| Паллиативная помощь | Симптоматическая терапия, предоставление технических средств реабилитации и медицинских изделий, социальная поддержка. |
Рис. 2. Схема организации мультидисциплинарного ухода за пациентами с миодистрофией Дюшенна на протяжении всей жизни / Фонд «Гордей»
Транзит во взрослую медицину и жизнь
Человек с заболеванием, которое начинается в детском возрасте и ведется детскими врачами, взрослея, переходит во взрослую медицинскую и паллиативную службу. Переход обычно происходит в возрасте от 17 лет до 21 года, в зависимости от системы здравоохранения. Однако, чем старше становится больной с МДД, тем больше он нуждается в медицинской помощи и уходе — ведь болезнь прогрессирует. А значит, без поддержки семьи и медиков не обойтись.
К сожалению, не все больные МДД смогут перейти к самостоятельной и долгой взрослой жизни. Первая причина: около трети молодых взрослых с МДД испытывают психосоциальные трудности или страдают когнитивными нарушениями, которые ограничивают самостоятельность и независимость. Вторая причина: различное течение заболевания.
Обе причины зависят от множественности мутаций гена дистрофина: от чрезвычайно злокачественной, когда дети вовсе не научаются ходить, до доброкачественной, похожей по течению и сроку жизни на миодистрофию Беккера (Birnkrant DJ, Bushby KM, Bann CM, и др., Диагностика и ведение пациентов с мышечной дистрофией Дюшенна, часть 3: первичная помощь, неотложная помощь, психосоциальная помощь и преемственность в оказании помощи на протяжении жизни пациента., The Lancet Neurology, 2018; том 17: 445-55′).
И все же для большинства молодых взрослых с МДД следует прогнозировать полноценное участие в планировании будущего и принятии решений.
Есть ли лекарство?
Сделать лекарство для МДД сложно: один препарат не вылечит всех, как при СМА. Больные МДД, как снежинки: нет одинаковых — уже описано около десяти тысяч мутаций гена. Поэтому болезнь по-разному проявляется — даже в одной семье у двух братьев.
Уже есть одобренные патогенетические лекарства, а препарат для коррекции нонсенс-мутаций в ноябре 2020 года зарегистрирован в России. Несколько препаратов находятся в третьей стадии клинических исследований. Одна из самых обнадеживающих перспектив — доставка в мышечную клетку исправленной укороченной копии гена дистрофина с помощью AAV вирусов: именно они могут перенести нужный фрагмент ДНК.
Какие перспективы?
Дети, которым диагноз «миодистрофия Дюшенна» ставится сегодня, будут жить по-другому — лучше и дольше, чем больные, рожденные 10-20 лет назад. Разработаны международные стандарты ухода, накоплен большой опыт, позволяющий предупредить развитие тяжелых осложнений болезни, продлить стадию функциональной активности ребенка, на горизонте — генетическая терапия, которая подойдет многим. Уже сейчас доступны четыре патогенетических препарата для определенных мутаций. В 2020 году в России зарегистрирован первый препарат для лечения миодистрофии Дюшенна — Аталурен.
Кто поможет?
Фонд «Гордей» создала семья, в которой растет Гордей — семилетний мальчик с миодистрофией Дюшенна. Цель фонда – улучшить на системном уровне качество диагностики, ведения, ухода, реабилитации и лекарственного обеспечения больных МДД.
Гордей с мамой, Ольгой Гремяковой. Фото из личного архива / Facebook
Одна из основных задач фонда – информирование и повышение осведомленности о миодистрофии Дюшенна врачебного и родительского сообщества. Чтобы практикующие и будущие педиатры, детские неврологи, медработники детских садов и школ знали о симптомах заболевания, а профильные специалисты имели возможности для обучения, стажировок, обмена опытом и в своей работе опирались на международные стандарты ухода и лучшие мировые практики.
Президент фонда «Гордей», доктор медицинских наук и бабушка Гордея, Татьяна Андреевна Гремякова ежемесячно проводит Школу для родителей вновь диагностированных детей с Дюшенном: отвечает на вопросы, помогает родителям понять, что именно они могут сделать для своего ребенка уже сегодня и что происходит в науке и медицине по данной нозологии.
Учредитель фонда «Гордей», психолог и мама Гордея, Ольга Гремякова два раза в месяц проводит «Передышку» — группу поддержки для мам и пап и вебинары, помогающие родителям развивать жизнестойкость, справляться со стрессом, возвращать себе контроль над своей жизнью. Для родителей вновь диагностированных мальчиков есть индивидуальные консультации с психологом.
Чтобы записаться на ближайшую Школу, «Передышку» или на индивидуальную психологическую консультацию, нужно написать по адресу: go@dmd-russia.ru
Сообщество фонда «Гордей» в Фейсбуке.
Сообщества по таргетной (подходящей для определенных мутаций) терапии:
Для родителей детей с «нонсенс-мутацией».
Для родителей детей с одной из делеций, корректируемых пропуском экзона 45.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 51.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 53.
С МДД также работают следующие организации:
Федеральные центры, работающие с МДД:
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
.gif)