Днк на рнк что на что меняется
Биологическая роль ДНК и РНК
ДНК – самая важная молекула для всех живых существ, даже растений. Она определяет наследование, кодирования белков и содержит инструкции для развития и размножения всего организма и каждой его клетки в отдельности. Достижения генетики позволили раскрыть информацию, содержащуюся в ДНК, и использовать ее с пользой для людей. Теперь каждый может сделать конфиденциальный ДНК-тест, чтобы получить ответы на самые сложные вопросы. Давайте узнаем больше, как работает и какова биологическая роль ДНК.
Какие функции выполняет ДНК в организме
ДНК несет ответственность за рост и поддержание жизни, что выражается в выполнении этой молекулой трех функций.
Таким образом, на что влияет ДНК в организме? Размеры ее влияния огромны – эта молекула содержит инструкции, необходимые организму для развития, жизни и размножения. Эти инструкции находятся внутри каждой клетки и передаются от обоих родителей их детям.
ДНК помогает синтезу РНК
Матричная РНК, или мРНК, – это одноцепочечная промежуточная молекула, которая переносит генетическую информацию от ДНК в ядре к цитоплазме, где она служит шаблоном в образовании полипептидов. мРНК синтезируется в ядре с использованием нуклеотидной последовательности ДНК в качестве матрицы.
Процесс создания мРНК из ДНК называется транскрипцией и происходит в ядре. мРНК направляет синтез белков, который происходит в цитоплазме. мРНК, образованная в ядре, транспортируется из ядра в цитоплазму, где она присоединяется к рибосомам. Белки собираются на рибосомах с использованием нуклеотидной последовательности мРНК в качестве инструкции. Таким образом, мРНК несет «сообщение» от ядра к цитоплазме. Сообщение закодировано в нуклеотидной последовательности мРНК, которая комплементарна нуклеотидной последовательности ДНК, служившей матрицей для синтеза мРНК. Создание белков из мРНК называется трансляцией. В этом заключается биологическая роль РНК.
Молекулярные болезни и связь молекул ДНК
Молекулярное, или генетическое, заболевание – это любое заболевание, вызванное сбоем на молекулярном уровне, то есть в молекуле ДНК. Генетическая аномалия может варьироваться от незначительной до крупной – от одной мутации в единственном основании в ДНК до грубой хромосомной аномалии, включающей изменение количества или набора хромосом. Мутации могут происходить либо случайно, либо из-за воздействия окружающей среды.
Существует ряд различных типов генетических нарушений обмена, в том числе:
Однако далеко не все мутации в генах – это приговор. Гены могут включаться и выключаться при определенных условиях среды. Поэтому даже имея предрасположенность к тому или иному заболеванию, для предупреждения их развития человек может соблюдать назначенный врачом план питания и тренировок, отказываясь от вредных привычек.
Строение и действие гена РНК
ДНК – дезоксирибонуклеиновая кислота, а РНК – рибонуклеиновая кислота. Хотя и ДНК, и РНК несут генетическую информацию и имеют связь между собой, между ними довольно много различий. Что общего между ДНК и РНК и в чем отличия?
Функции ДНК и РНК в организме разные. ДНК отвечает за хранение и передачу генетической информации, в то время как РНК непосредственно кодирует аминокислоты и выступает в качестве посредника между ДНК и рибосомами для производства белков.
Преимущества проведения анализов в лаборатории Медикал Геномикс Украина
Лаборатория Медикал Геномикс Украина – крупнейшая в стране английская лаборатория генетических исследований. Здесь вы можете пройти любой генетический тест, в том числе для установления родственных отношений, а также медицинские, генеалогические исследования.
Мы работаем быстро и качественно, гарантируя конфиденциальность и высокую точность результата, поскольку используем передовое оборудование, а каждый тест проверяется двумя независимыми группами ученых.
Позвоните нам, если у вас есть вопросы – наши консультанты ответят на них и помогут оформить заказ. Сдать биоматериалы можно в одном из наших 78 пунктов приема образцов по всей Украине или заказав набор для домашнего забора материала.
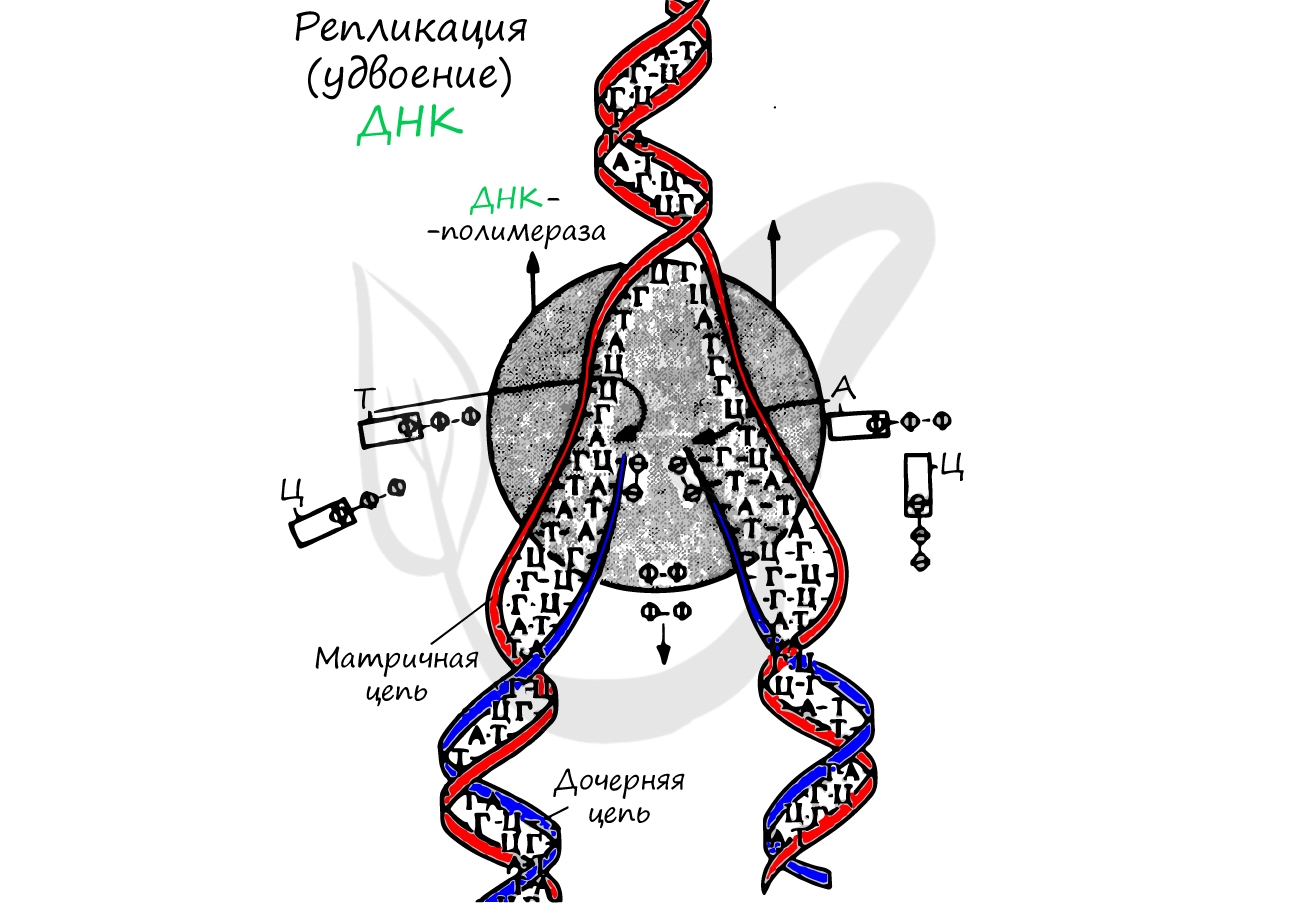
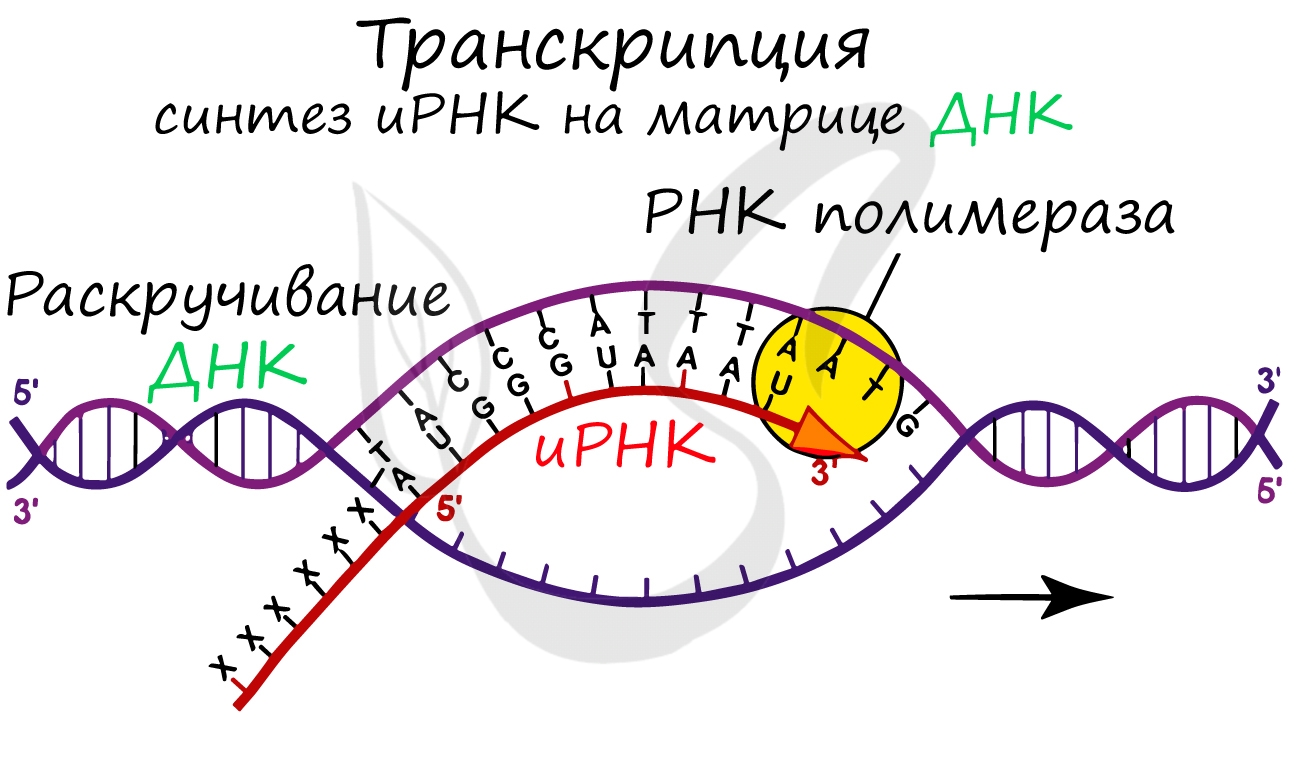
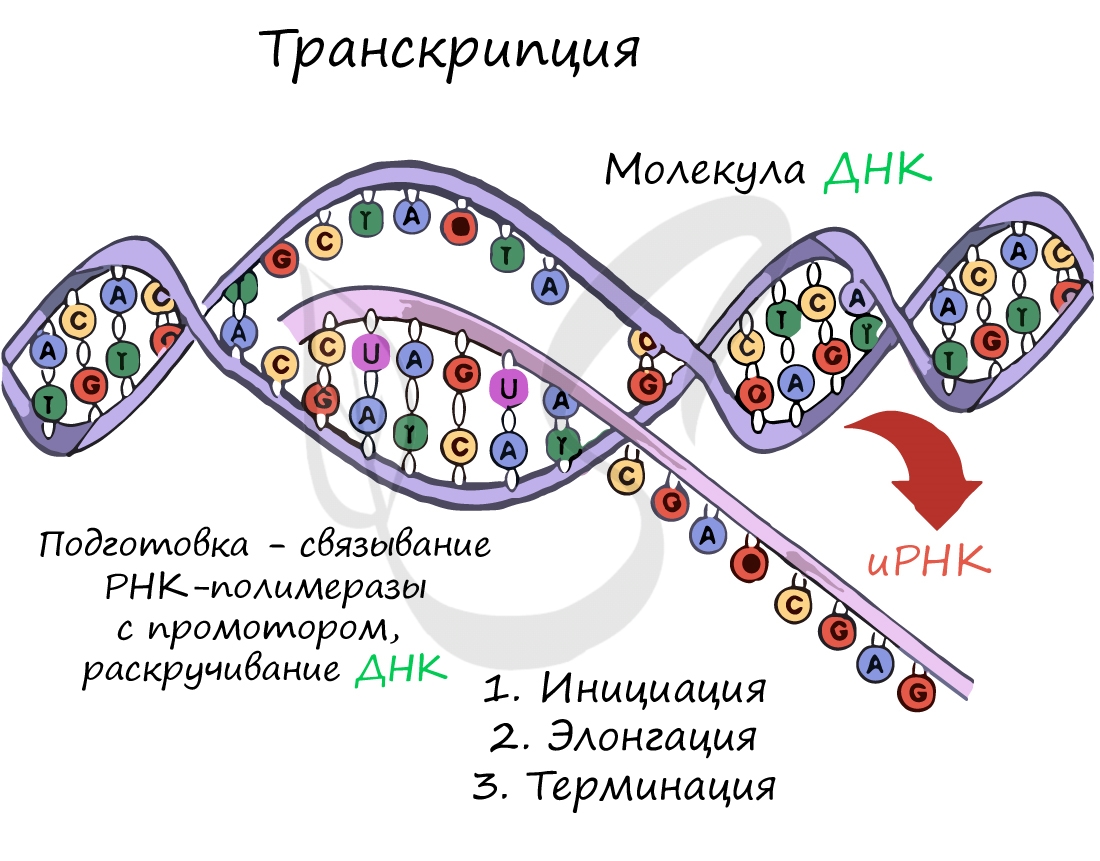
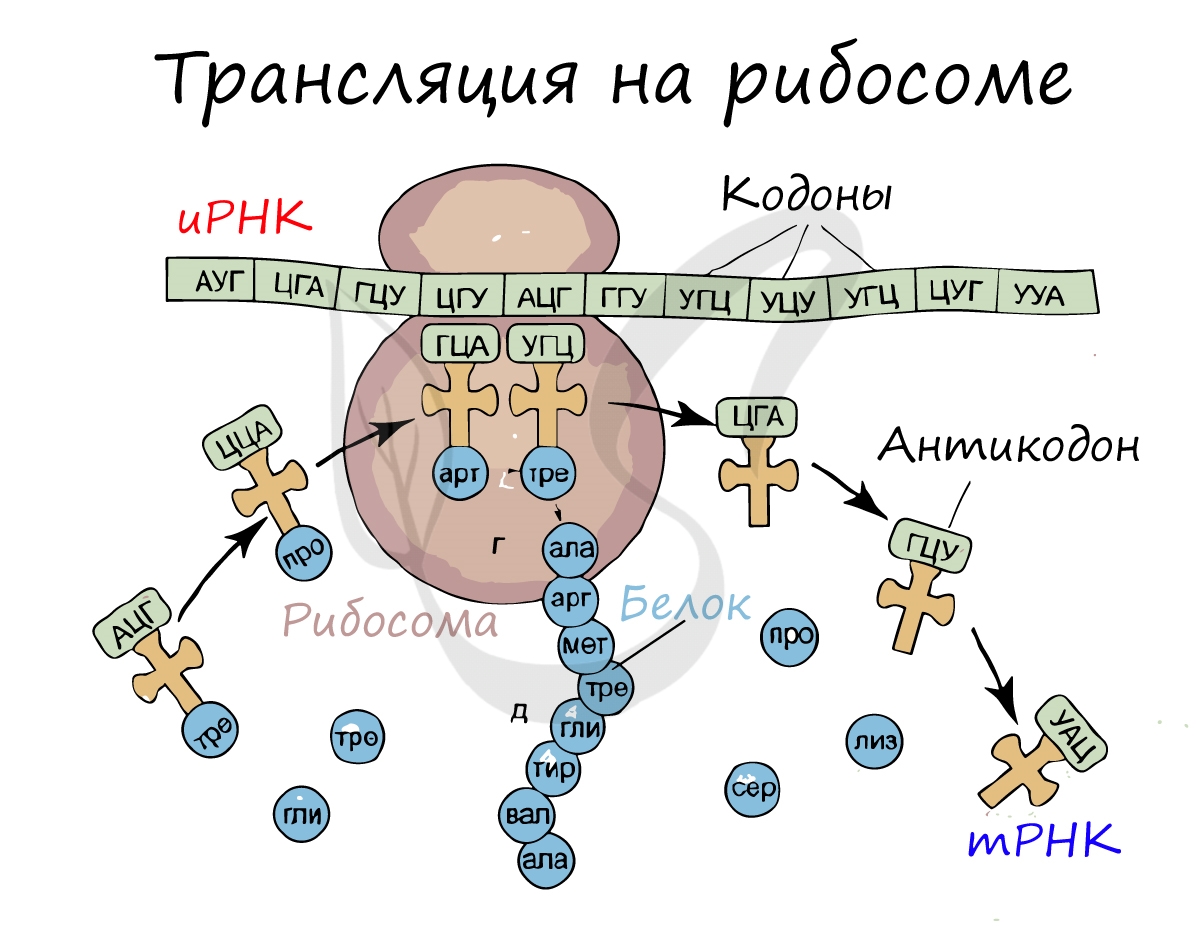
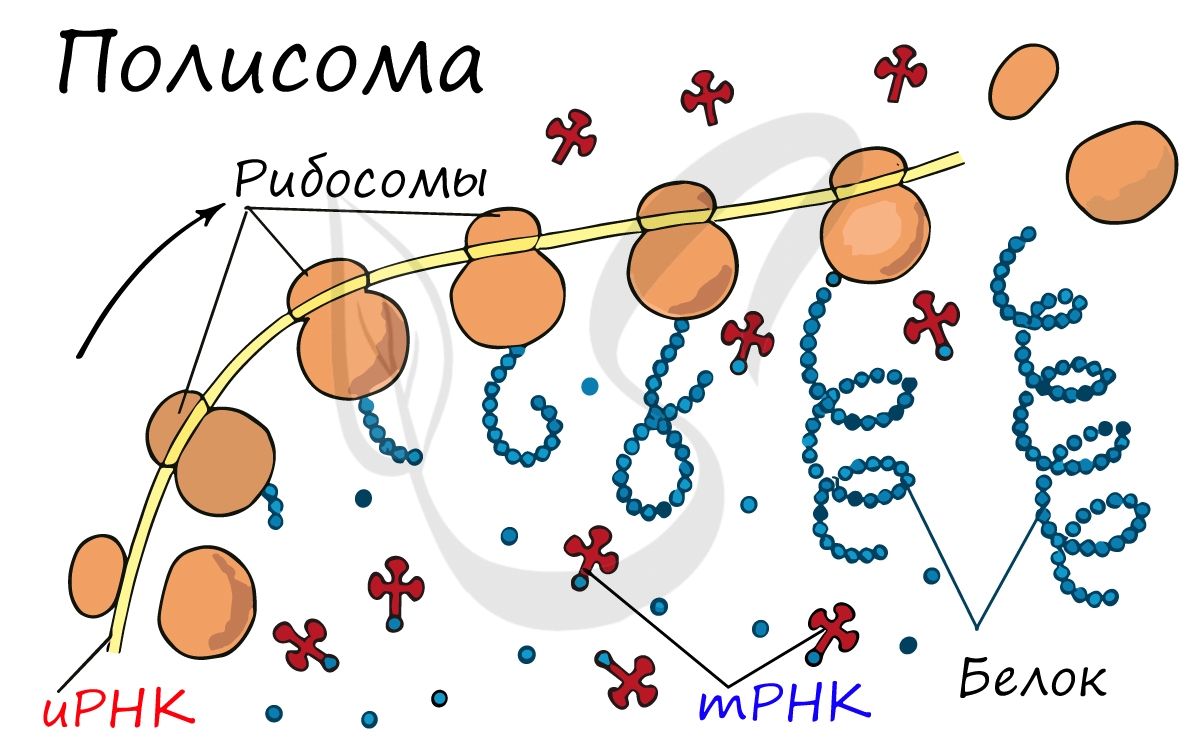
Транскрипция и трансляция
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между дочерними клетками.
Транскрпиция (лат. transcriptio — переписывание)
Образуется несколько начальных кодонов иРНК.
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК быстро растет.
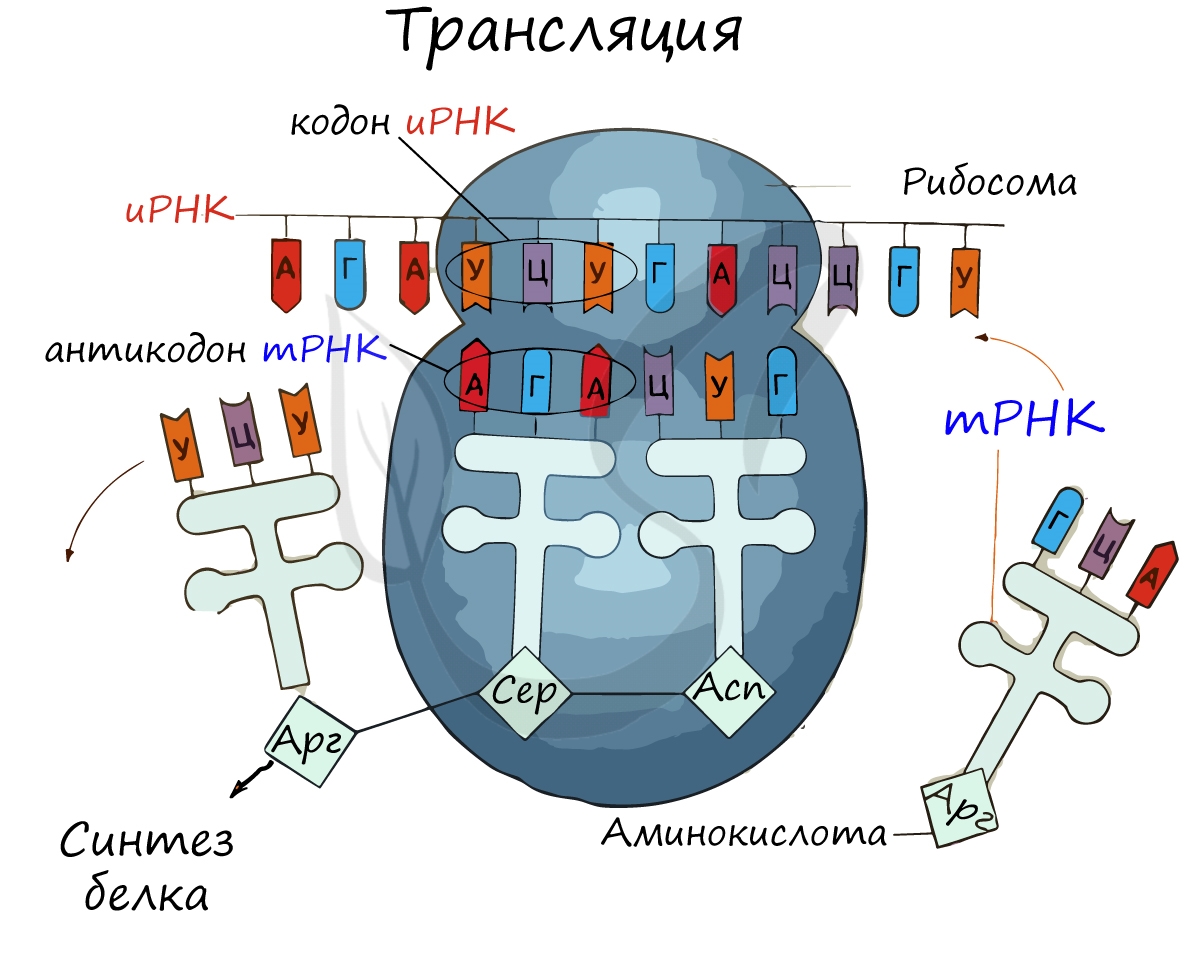
Трансляция (от лат. translatio — перенос, перемещение)
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз. Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Примеры решения задачи №1
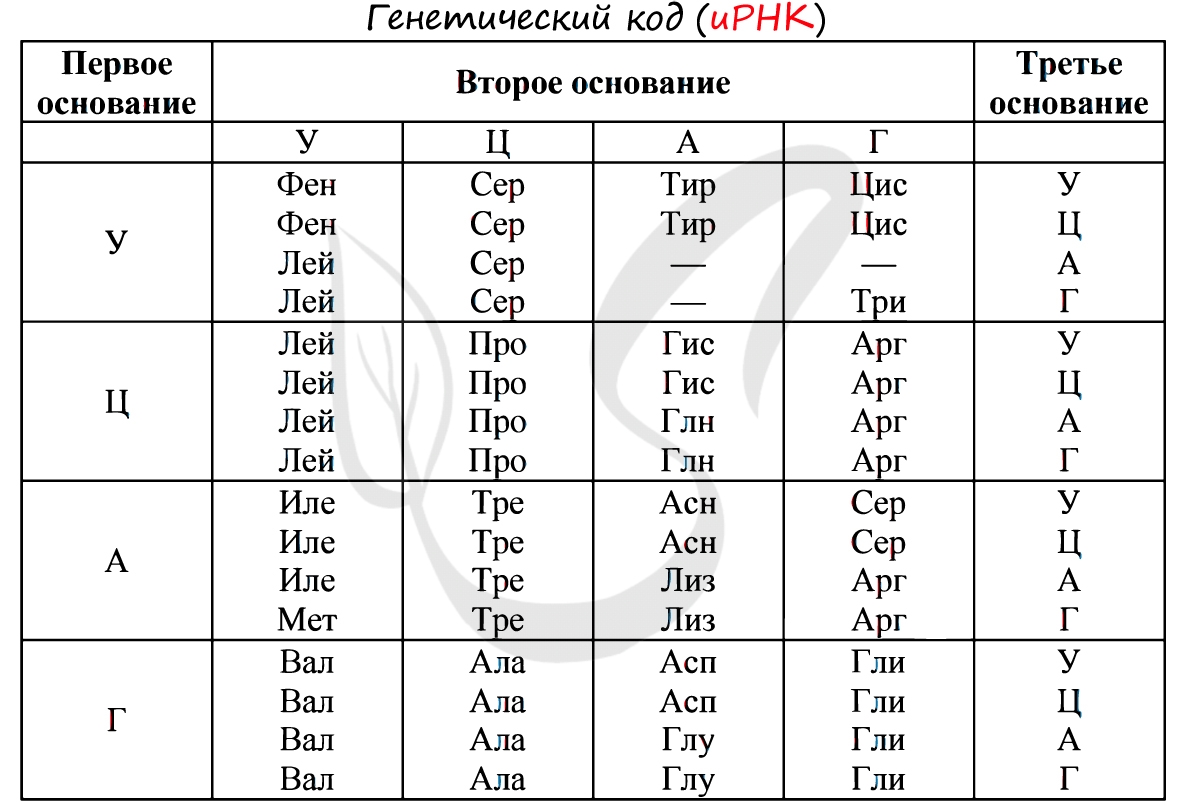
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК), приведенной вверху.
«Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода»
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК: А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК: А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
«Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону тРНК»
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? 🙂
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
РНК-зависимая репарация ДНК
Репарация ДНК: процесс, необходимый для жизни клетки
Автор
Редакторы
В клетке существует специальный механизм, поддерживающий целостность генетической информации. Ультрафиолетовые лучи могут разрушать азотистые основания, входящие в состав ДНК, и служить причиной образования одно- или двухцепочечных разрывов (ДЦР) в этой молекуле. Механизм «залечивания» (репарации) ДНК восстанавливает status quo и является совершенно необходимым для жизни клетки. Нарушения в механизме репарации ДНК служат причиной серьезных заболеваний, таких как пигментная ксеродерма и рак кожи. Оказывается, РНК может служить матрицей для синтеза ДНК во время устранения двухцепочечных разрывов в хромосомной ДНК дрожжей.
РНК выступает в роли матрицы для синтеза ДНК при обратной транскрипции ретровирусов (например, ВИЧ), ретротранспозонов и при поддержании длины теломер (повторяющихся последовательностей ДНК на концах хромосом, необходимых для их стабильности). Никаких указаний на прямое участие РНК как матрицы в репарации хромосом, включая залечивание двухцепочечных разрывов, получено не было, несмотря на то, что РНК присутствует в ядре в большом количестве. В большинстве организмов ДЦР устраняются за счёт гомологичной рекомбинации, или же за счёт негомологичного соединения концов разрыва.
Было обнаружено, что РНК косвенно может участвовать в репарации (негомологичном соединении концов), являясь матрицей для синтеза одноцепочечной ДНК-копии (кДНК), с последующим образованием комплиментарной цепи ДНК.
РНК также участвует в гомологичной рекомбинации в клетках почкующихся дрожжей (Saccharomyces cerevisiae), в которых рекомбинация проходит очень легко. И там РНК действует не напрямую, а посредством своей кДНК, синтезируемой в цитоплазме обратной транскриптазой, ферментом, поставляемым ретротранспозоном Ty.
Образование духцепочечных молекул (так называемых гетеродуплексов) одноцепочечными фрагментами ДНК и РНК возможно как in vitro, так и in vivo, однако прямой гомологичный обмен генетической информации между молекулами РНК и ДНК известен не был.
Авторы статьи, досрочно опубликованной на сайте журнала Nature, утверждают, что РНК может служить матрицей для синтеза ДНК во время репараци ДЦР хромосомной ДНК дрожжей [1]. Репарация осуществляется рибоолигонуклеотидами (одноцепочечными короткими фрагментами РНК), комплиментарными разорванным концам ДНК. Принимая во внимание этот факт и то, что ДНК-полимеразы α и δ, участвующие в репликации дрожжевой ДНК, могут копировать короткие РНК-матрицы in vitro, можно говорить о возможности переноса генетической информации молекулами РНК in vivo за счёт прямого взаимодействия с гомологичными последовательностями хромосомной ДНК.
Открытие синтеза ДНК in vitro и in vivo полимеразами α и δ на матрице РНК-содержащих олигониклеотидов существенно в ситуациях, когда фрагменты РНК оказывается в составе цепи ДНК in vivo, как, например, в случае с митохондриальным геномом млекопитающих. Включение рибонуклеотидных остатков в состав ДНК может происходить в процессе нормального метаболизма ДНК: некоторые ДНК полимеразы могут использовать в качестве субстрата рибонуклеотиды in vitro, a ДНК-лигаза I (фермент, сшивающий фрагменты ДНК) может пришивать к ДНК также и остатки рибонуклеотидов в процессе созревания фрагментов Оказаки in vitro.
Репарация двуцепочечных разрывов «на матрице РНК» четко отличается от открытой ранее РНК/кДНК-зависимой репарации. В первом случае, отсутствует барьер для прямого переноса генетической информации от РНК на хромосомную ДНК. Исходя из этой новой способности РНК, авторы статьи предполагают, что эндогенные РНК могут непосредственно участвовать в залечивании фрагментов ДНК после транскрипции, тем более, что локальная концентрация РНК в данном случае высока. Результаты, представленные в статье, закладывают основы нашего понимания возможных механизмов прямого переноса генетической информации от гомологичных эндогенных РНК к ДНК.
Способность РНК переносить генетическую информацию на гомологичные молекулы хромосомных ДНК открывает новые возможности для направленного изменения генов (gene targeting), учитывая легкость амплификации РНК внутри клетки. Более того, РНК-матрицы, участвующие в репарации ДНК, могут вносить свой вклад в процессы эволюции генома и поддержания его стабильности.
А не замахнуться ли нам на. изменение генома?
А не замахнуться ли нам на. изменение генома?
Ученые научились редактировать молекулу ДНК в интересующем месте
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Человек стремится покорить природу, и ключ для этого — ДНК. Но чтобы подобраться к молекуле ДНК и повлиять на нее, необходимо использовать точнейшие молекулярные инструменты — белки или РНК. В этой статье рассказывается о новейшем инструменте для внесения мутаций в геном in vivo — сиквенс-cпецифичных нуклеазах.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
История изучения ДНК непроста, как и любое значительное исследование. Открыта она была еще в 1868 году Иоганном Фридрихом Мишером, который выделил некое вещество, содержащее азот и фосфор, из остатков клеток в гное [1]. После того, как Мишер обнаружил, что оно обладает кислотными свойствами, вещество назвали нуклеиновой кислотой. Однако долгое время функция ДНК была неясной: ее считали всего лишь способом запасания фосфора в организме. Данная теория считалась правильной почти до середины XX века; в качестве косвенного доказательства ученые ссылались на однообразное, по их мнению, строение молекулы ДНК (состоящей исключительно из четырех различных видов нуклеотидов: дезоксиаденозина — А, дезоксигуанозина — G, дезокситимидина — Т, дезоксицитидина — С).
Функцию ДНК, естественно, открыли раньше, чем ее вторичную структуру, которая оставалась неизвестной вплоть до 1953 года. Соответственно, из-за этого не могли установить, как проходят такие процессы как передача наследственной информации, как белки распознают определенные последовательности в ДНК и т.п.
В 1949–1951 годах Эрвин Чаргафф сформулировал свои знаменитые правила, которые говорят о строгом соотношении количества азотистых оснований внутри каждой молекулы ДНК [4] (в частности, что количество аденина равняется количеству тимина, а количество цитозина — количеству гуанина); затем Морисом Уилкинсом и Розалиндой Франклин были получены рентгеноструктурные данные, несущие структурную информацию о ДНК. На основании этих двух фактов Френсис Крик и Джеймс Уотсон предложили структуру двойной спирали ДНК [5], которая была доказана позднее в опытах Мэтью Мезельсона и Франклина Сталя [6].
Как только была открыта вторичная структура ДНК, стало легче предсказывать, а затем доказывать экспериментами механизмы различных процессов, происходящих с ДНК. Репликация (удвоение молекулы ДНК), транскрипция (перенос генетической информации с ДНК на РНК), различная регуляция экспрессии генов стали главными проблемами, интересующими молекулярных биологов.
Очевидно, что для осуществления этих процессов необходимы определенные белки, которые, в свою очередь, взаимодействуют как друг с другом, так и с ДНК. И если некоторые стадии протекают неспецифично (например, у эукариот репликация ДНК может начаться во множестве участков ДНК [7]), то, например, регуляция экспрессии генов происходит с помощью взаимодействия белков с довольно консервативными, т.е. строгими последовательностями ДНК.
Эндонуклеазы рестрикции: «Режем ДНК в нужном вам месте!»
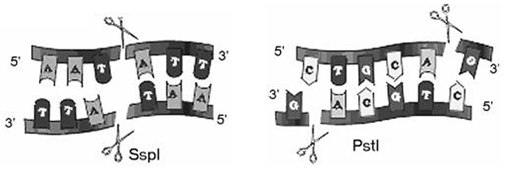
Одними из первых открытых белков, специфически связывающих ДНК, являются эндонуклеазы рестрикции. Это ферменты, которые разрезают ДНК по специфическим нуклеотидным последовательностям, называемым сайтами рестрикции (рис. 1) [8].
Рисунок 1. Рестрикция с образованием а) «тупых» концов; б) «липких» концов
Сам термин «рестрикция» появился благодаря исследованиям фага λ и феномена контролируемой рестрикции и модификации бактериальных вирусов клетками-хозяевами. Этот процесс был впервые обнаружен в результате работ Сальвадора Лурии [9] и Джузеппе Бертани [10] в 1950-х годах. Ученые обнаружили, что если фаг λ хорошо растет в одном штамме Escherichia coli, то в другом штамме его рост падает на несколько порядков, т.е. клетка-хозяин может снижать его биологическую активность. Оказалось, что запрет роста — «рестрикция» — вызывается ферментативным расщеплением ДНК фага. Соответственно, и фермент, отвечающий за этот процесс, назвали ферментом рестрикции.
Сами ферменты были обнаружены в лабораториях Вернера Арбера и Мэттью Мезельсона [11]; причем эндонуклеазы, которые исследовались в их работах, принадлежали, как определили позже, к I классу эндонуклеаз рестрикции. Они разрезают ДНК в случайном месте снаружи от места распознавания, причем как минимум на расстоянии 1000 нуклеотидов.
В 1970-х годах Гамильтон Смит, Томас Келли и Кент Велкокс выделили и охарактеризовали первую эндонуклеазу рестрикции II класса. Этот тип ферментов рестрикции более удобен для лабораторного использования, поскольку расщепляет ДНК внутри своего сайта распознавания, который, как правило, представляет собой палиндром из 4–8 нуклеотидов. Кроме того, эндонуклеазы этого класса не нуждаются в энергетической молекуле АТФ для активности, — только в ионах магния в качестве кофактора.
В 1990-х и ранних 2000-х годах были открыты другие представители данного семейства, которые не соответствовали всем критериям этого класса ферментов [12]. На данный момент уже открыты эндонуклеазы типов IIB, IIE, IIF, IIG, IIM, IIS, IIT. Возможно, в будущем этот список еще значительно расширится.
Существует также III класс эндонуклеаз рестрикции. Они были также открыты как компоненты прокариотической защитной системы против чужеродной ДНК. Эндонуклеазы III типа распознают две отдельных последовательности ДНК длиной 5–6 нуклеотидов и разрезают её примерно через 20–30 пар после сайта распознавания. Для их работы необходимы молекулы АТФ.
Эндонуклеазы рестрикции используют для обработки ДНК в различных лабораторных экспериментах. Обычно их применяют для вставки генов в процессах генного клонирования и экспериментах по исследованию белков.
Кроме того, эндонуклеазы могут быть использованы для выявления различий в аллелях гена [13]. Это возможно только в случае, если мутация произойдет в сайте узнавания, содержащемся внутри аллеля. Таким образом, отпадает нужда в дорогостоящем секвенировании гена; в частности, до изобретения секвенирования обработка эндонуклеазами рестрикции использовалась для картирования геномов.
Одно из новейших применений нуклеаз — внесение с помощью них различных изменений в геном клетки, таких как мутации уже имеющихся генов, вставка новых генов или вырезание исходных. Это очень перспективное направление генной инженерии с широчайшими возможностями практического применения! О нем будет рассказано в следующем разделе.
Эндонуклеазы — это эффекторы, т.е. белки действия. Если они окажутся у цели, то точно ее разрежут. Но природные белки распознают лишь небольшое число последовательностей ДНК, что накладывает огромные ограничения на использование этого уникального инструмента. Ах, если бы можно было доставить эндонуклеазу к любой желаемой последовательности ДНК.
Революция в области ДНК-связывающих белков: «Доставим ваш белок по любому адресу ДНК, используя TAL-эффекторы или CRISPR/Cas9-систему»
Одной из наиболее заманчивых идей для ученых является возможность напрямую точечно влиять на работу клетки. Для этого необходимо прицельно воздействовать на ДНК именно в области интересующего гена. Воздействие может быть разного характера: включение/выключение гена, внесение мутации и др. Для этого потребовалось уметь синтезировать белки, узнающие конкретную последовательность ДНК («следопыты»), к которым можно было бы пришить белки «действия».
Недавно открытые белки TAL-эффекторы и система Cas9 произвели настоящую революцию в нацеливании различных эффекторов на специфическую последовательность ДНК!
TAL-эффекторы: «Используем паразитов во благо»
TAL-эффекторы (Transcription Activator Like Effectors) — белки, синтезируемые многочисленным видами бактерий рода Xanthomonas — паразитами растений. Они были открыты в 2009 году практически одновременно несколькими группами ученых. TAL-эффекторы активируют считывание нужных паразитам генов в растениях-хозяевах (крайне специфично связываясь с хозяйской ДНК), что облегчает бактериальную колонизацию этого растения и выживание бактерий внутри него [14].
TAL-эффектор можно мысленно поделить на три части (рис. 2); наибольший интерес представляет средняя, крайне консервативная центральная область белка, состоящая из повторяющихся блоков размером 34 аминокислоты. В 2009 же году была показана простая и однозначная связь между повторами и узнаваемыми нуклеотидами. Блоки отличаются друг от друга лишь аминокислотами № 12 и № 13, которые и определяют вид нуклеотида, распознаваемый данным мономером. На каждый из четырех нуклеотидов ДНК приходится определенное сочетание этих аминокислот TAL-эффектора [15]; т.е. можно представить себе этот белок как паровозик, состоящий из одинаковых вагонов, центральное окошко которых покрашено в один из четырех цветов.
Рисунок 2. Строение TAL-эффектора на примере avrBs3
Простота «TALE-кода» открывает многочисленные возможности для биологического применения этих белков. Недавние исследования показали, что можно специально подобрать «вагоны» для искусственного «паровозика» и синтезировать ранее не существовавшие в природе белки для узнавания конкретных последовательностей ДНК в различных типах клеток — как растений, так и млекопитающих. Многие группы ученых уже используют искусственные TAL-эффекторы, узнающие новые последовательности ДНК, например, в томатах, Arabidopsis thaliana [16] и клетках человека [17].
Синтезированные TAL-эффекторы также сшивают с каталитическим доменом нуклеазы (см. раздел «Эндонуклеазы рестрикции») для создания TAL-эффекторных нуклеаз. Эти нуклеазы могут быть полезны для генной инженерии и генной терапии [18].
TAL-нуклеазы используют для создания двуцепочечных разрывов в строго определенном месте ДНК. Известно, что нарушенные таким образом гены клетка может чинить двумя путями: либо просто соединением концов (что может привести к случайным мутациям), либо заново синтезируя поврежденную цепь по комплементарной ей цепи ДНК (т.н. гомологичная рекомбинация).
Во втором случае вырезается значительный по длине участок ДНК, а вместо него по комплементарной (на краях разрыва) матрице синтезируется вставка, закрывающая брешь [19]. Если в клетку поместить ДНК специально мутированного гена, то он будет использован в качестве донорной матрицы, и в геном встроится желаемая мутация. Можно таким методом даже вырезать отдельные гены — или вставлять новые! Таким образом, благодаря разработанной технике сборки ДНК-узнающих повторов, TAL-эффекторы в составе гибридных белков предоставляют возможность направить желаемый эффектор к любой специфической последовательности ДНК — и добиться самых разных воздействий на ДНК: от регуляции транскрипции до внесений мутаций.
CRISPR/Cas9 система: «Неожиданное альтернативное применение защитного комплекса бактерий»
В нашем организме, после того, как мы переболели какой-то болезнью, остаются клетки памяти иммунной системы, которые при повторном попадании в организм вредителей активизируются и помогают ускоренно справиться с ними.
Бактерии справляются со своими патогенами с помощью аналогичной «системы памяти»: CRISPR/Cas-системы обеспечивают иммунитет бактерий и архей против вирусов и плазмид. Этот защитный комплекс состоит из:
Этот комплекс был открыт в 2012 году при совместной работе ученых из США, Швейцарии, Австрии и Швеции [20], [21].
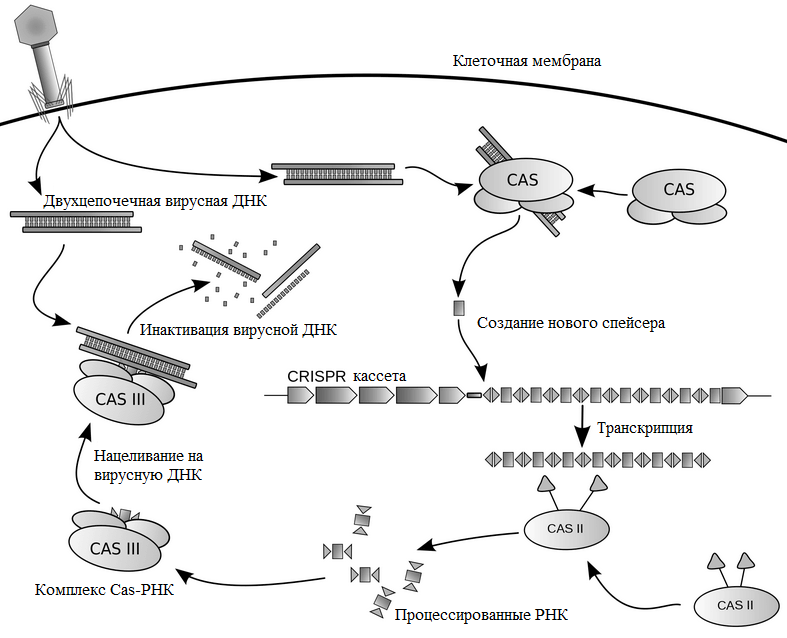
Иммунитет, обусловленный CRISPR/Cas, возникает за три стадии (рис. 3). В первой фазе бактерии или археи, у которых в геноме есть «блокнотик для записи» — CRISPR-кассета, — отвечают на появление вируса включением в конец кассеты коротких фрагментов чужеродной ДНК. На следующей стадии происходит транскрипция — считывание этой свежевключенной последовательности (образование описанных выше двух РНК) и обработка их нуклеазами. Теперь эти РНК могут специфично связаться с вирусной ДНК, и это взаимодействие через цепь событий приводит к ее расщеплению и «смерти» вредителя.
Рисунок 3. Схема работы комплекса Cas—РНК и CRISPR-кассеты
Грубо говоря, ситуация напоминает сказку про репку: первая РНК связывается с «репкой» — чужеродной ДНК — и «зовёт» вторую, вторая — специальный белок Cas9, который уже осуществляет двухцепочечный разрыв цепи чужой ДНК [22].
Несмотря на то, что в природе две РНК системы Cas9 разделены, учёные показали, что химерная РНК, представляющая собой сшитые в одну цепь вышеуказанные РНК, так же способна направлять Cas9 к ДНК-мишени. Более того, при соблюдении ряда условий можно менять последовательность первой внутри химерной РНК так, чтобы нацеливать Cas9 на желаемые гены.
Эта система даже проще TAL-эффекторов, поскольку для распознавания одного дезоксирибонуклеотида ДНК не нужен громоздкий «вагон» белка: один рибонуклеотид РНК легко и точно узнаёт комплементарный ему дезоксирибонуклеотид ДНК мишени! Экономия как в размере инструмента, так и в легкости его синтеза.
К настоящему времени показано, что эта система работает не только в археях и бактериях, но и в организмах рыб (Danio rerio), а также в клетках млекопитающих [23]. Уже установлено, что, как и в случае TAL-эффекторных нуклеаз, обработка ДНК Cas9-системой приводит к эффективному (10–30% случаев) возникновению мутаций.
Человек стремится покорить природу, и ключ для этого — ДНК. Но чтобы подобраться к ДНК и повлиять на нее, необходимо спуститься на молекулярный уровень и использовать белки или РНК. Сейчас развитие данных направлений идет стремительно, каждый месяц случаются значительные прорывы в этой области. Кто знает, какие чудеса ожидают нас через год? Возможно, будет найдена новая система, максимально упрощающая исходно сложный и кропотливый процесс вмешательства человека в работу природы.