Доказать что al2o3 амфотерный оксид
Доказать что al2o3 амфотерный оксид
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
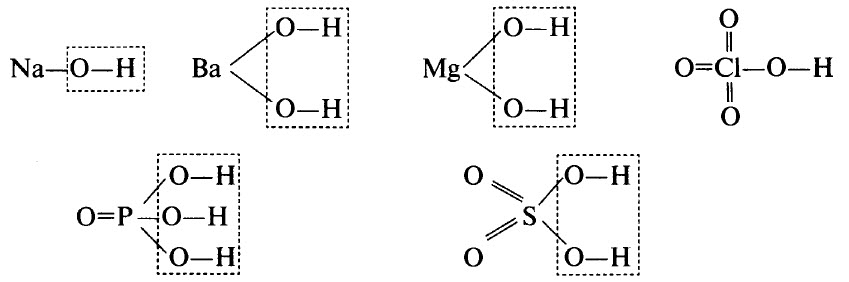
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Урок химии «Амфотерность оксида алюминия»
Тема урока: Амфотерность оксида и гидроксида алюминия. Соли алюминия
Расширить и углубить знания учащихся об амфотерности на примере изучения свойств оксида и гидроксида алюминия;
Рассмотреть способность солей алюминия к гидролизу;
Закрепить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ.
Продолжить развивать у учащихся умение проводить химический эксперимент, составлять отчёт о его выполнении, делать выводы;
Способствовать развитию навыков самостоятельной работы и работы в парах;
Содействовать дальнейшему развитию умения составлять уравнения химических реакций, решать расчётные задачи.
Через знание правил ТБ при проведении химического эксперимента формировать чувство ответственности за своё здоровье и окружающих;
Способствовать формированию у учащихся выслушивать мнения других, владению различными формами устных выступлений, оценке разных точек зрения.
Тип урока: Комбинированный.
Формы и методы: Беседа, рассказ, фронтальный опрос, работа в парах, химический эксперимент, самостоятельная работа.
Химический эксперимент: Лабораторный опыт №4. Получение гидроксида алюминия и изучение его амфотерных свойств. Лабораторный опыт №5. Гидролиз солей алюминия.
Оборудование и реактивы: Хлорид алюминия, сульфат алюминия, гидроксид натрия, соляная кислота, штатив с пробирками, универсальная индикаторная бумага.
проводит химический эксперимент, составляет уравнения реакций, доказывающие амфотерность оксида и гидроксида алюминия;
обосновывает условия получения гидроксида алюминия;
знает, как протекает гидролиз солей алюминия.
Организация начала урока………………………………………. 1 мин.;
Проверка домашнего задания. Актуализация опорных знаний. Мотивация изучения темы. Создание проблемной ситуации…6-8 мин.;
Изучение нового материала…………………………………… 13-15мин.;
Амфотерность оксида алюминия………………………………5 мин.;
Амфотерность гидроксида алюминия………………………. 10 мин.;
Проверка понимания и закрепления знаний……………………15 мин.;
Инструктаж домашнего задания………………………………….2 мин.;
Подведение итогов урока………………………………………….2 мин.
I . Организация начала урока
II . Проверка Д/з. Актуализация опорных знаний
Фронтальный опрос Слайд[1]
Какую тему мы изучили на прошлом уроке?
Охарактеризуйте физические свойства алюминия.
К каким металлам относят алюминий по его химическим свойствам?
Что называют амфотерностью?
Назовите известные вам амфотерные вещества.
Как доказать амфотерность алюминия? Ответ подтвердите химическими уравнениями реакций.
Способен ли алюминий растворяться в воде?
Как объяснить тот факт, что из него изготавливают кухонную посуду и линии электропередач?
Учитель: Как вы думаете: какими свойствами обладают оксид и гидроксид алюминия? Скажите: из каких веществ можно получить гидроксид алюминия? Как, по-вашему, имеет значение количество взятых веществ соли алюминия и щёлочи для получения гидроксида алюминия? Или – «от перестановки мест слагаемых сумма не изменяется»?
III . Изучение нового материала
Амфотерность оксида алюминия
Рассказ учителя: Одно из самых распространенных соединений алюминия – это его оксид Al 2 O 3. В природе он представлен в виде различных горных пород и минералов. Слайд[4]
Al 2 O 3 – амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, взаимодействует с растворами кислот и щелочей при нагревании и может реагировать с расплавленной щелочью. Слайд[5]
Напишите уравнение реакции взаимодействия Al 2 O 3 с:
1-й ряд: серной кислотой
2-й ряд: азотной кислотой
3-й ряд: соляной кислотой
Зная, как реагирует с раствором щёлочи алюминий, составьте уравнение взаимодействия оксида алюминия с раствором щёлочи: Слайд[6]
Какой вывод можно сделать относительно химических свойств оксида алюминия?
Сплавление оксида алюминия с твёрдым гидроксидом натрия:
Амфотерность гидроксида алюминия
Рассказ учителя: Гидроксид алюминия Al(OH) 3 – бесцветное твердое вещество, нерастворимое в воде, входит в состав многих бокситов. Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах. Слайд[7]
1) Лабораторный опыт №4. Получение гидроксида алюминия и изучение его амфотерных свойств Слайд[8]
Цель: Изучить условия получения гидроксида алюминия и доказать его амфотерность
Опыт 1. Получение гидроксида алюминия
а) В две пробирки налейте по 1 мл хлорида алюминия. В обе пробирки добавьте по 2-3 капли гидроксида натрия. Что наблюдаете? Составьте уравнение химической реакции в молекулярном и ионном виде.
б) Налейте в пробирку 1-2 мл гидроксида натрия и добавьте 2-3 капли хлорида алюминия. Что наблюдаете? Как это можно объяснить?
Опыт 2. Изучение амфотерности гидроксида алюминия Слайд[9]
В одну пробирку с полученным гидроксидом алюминия добавьте по каплям раствор соляной кислоты. В другую – избыток раствора гидроксида натрия. Что наблюдаете? Составьте уравнения химических реакций в молекулярном и ионном виде.
Сделайте вывод к работе согласно поставленной цели. Слайд[9]
Лабораторный опыт №5. Гидролиз солей алюминия. Слайд[10]
Цель: Изучить, как протекает гидролиз солей алюминия.
Налейте в 2 пробирки соли алюминия: в одну – хлорид алюминия, в другую – сульфат алюминия. Опустите в каждую пробирку универсальную индикаторную бумагу. Как изменилась окраска индикатора? Чему равно значение рН? О наличии каких ионов в растворах солей это говорит? Составьте уравнения реакций гидролиза.
Сделайте вывод к работе согласно поставленной цели.
Сплавление гидроксида алюминия с твёрдым гидроксидом натрия.
При сплавлении гидроксида алюминия с твёрдым гидроксидом натрия или калия, подобно тому, как сплавляется оксид алюминия, образуется метаалюминат натрия или калия. Составьте уравнение химической реакции.
IV . Проверка понимания и закрепления знаний Слайд[11]
Решите задачу. Слайд[12]
Рассчитайте объём раствора гидроксида натрия с массовой долей 20% (ρ = 1,2 г/мл), необходимого для превращения хлорида алюминия, содержащегося в 40 г раствора с массовой долей соли 5% в тетрагидроксоалюминат натрия.
VI . Инструктаж домашнего задания Слайд[14]
Составьте уравнения химических реакций:
Определите массу твёрдого остатка, полученного при прокаливании осадка, образовавшегося при сливании 25 г раствора хлорида алюминия с массовой долей соли 8% с раствором гидроксида натрия массой 25 г с массовой долей щёлочи 8%.
VII . Подведение итогов урока
Амфотерные свойства оксида и гидроксида алюминия
Описание презентации по отдельным слайдам:
Амфотерность оксида и гидроксида алюминия
Дать понятие об амфотерности; Рассмотреть свойства амфотерного оксида и гидроксида алюминия; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов и о генетической связи между классами веществ. Цели урока:
Изучение нового материала: Алюминий в природе:
Повторение изученного материала: Применение алюминия
Оксид алюминия Al2O3 Бокситы Корунд Глинозём горная порода минерал драгоценные камни рубины сапфиры
Гидроксид алюминия Al(OH)3 белое гелеобразное вещество, нерастворимое в воде, входит в состав многих бокситов. типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl3 + 3NaOH Al(OH)3 + 3NaCl Лабораторный опыт:
Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи Лабораторный опыт:
Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Al(OH)3 + 3HCl = AlCl3 +3H2O Al(OH)3 + NaOH = Na[Al(OH)4] Запишите уравнения реакций:
Лабораторный опыт От перемены мест слагаемых сумма …. изменяется. 1. В одну пробирку налейте 1 мл соли хлорида алюминия AlCl3 и добавьте 3-4 капли раствора натриевой щелочи NaOH. 2. Во вторую пробирку налейте наоборот- 1 мл натриевой щелочи NaOH и добаьте 3-4 капли соли хлорида алюминия AlCl3.
Генетический ряд алюминия. Осуществите превращения: Na[Al(OH)4] Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-294861
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Трехлетнюю олимпиаду среди школ запустят в России в 2022 году
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
В России будут создавать школьные театры
Время чтения: 1 минута
В России планируют создавать пространства для подростков
Время чтения: 2 минуты
В московских школах придумали новый формат классных часов с участием отцов
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Химические свойства амфотерных оксидов
Перед изучением этого раздела рекомендую изучить следующие темы:
Химические свойства амфотерных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
амфотерный оксид + кислота = соль + вода
амфотерный оксид + кислотный оксид = соль
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.