Докажите что первый и второй законы термодинамики соблюдаются в живых системах
Первый и второй законы термодинамики и их приложимость к биосистемам



Формулировка первого закона термодинамики: в изолированной термодинамической системе полный запас энергии есть величина постоянная и возможны только превращения одного вида энергии в другой в эквивалентных соотношениях. U=const. ∆U=0.
Формулировка первого начала термодинамики для закрытых систем: теплота, подведённая к системе, расходуется на изменение внутренней энергии системы и на совершение работы против внешних сил. ᵟQ=dU+ᵟA.
Q и A не являются функциями состояния системы.
U является функцией состояния системы (полностью определяется параметрами системы данной точки и не зависит от пути перехода).
Доказательство, что энергетический баланс живого организма находится в полном соответствии с законом сохранения энергии (первым законом термодинамики).
Лавуазье и Лаплас доказали применимость к живым организмам. Колориметр – прибор, измеряющий теплоту, которую выделяет живой организм. В камеру помещали морскую свинку, вокруг камеры находился изолятор – лёд. По количеству растаявшего льда определяли сколько теплоты выделило животное. Потом жгли объём пищи, потребляемый животным. Определили теплоту при сжигании. Обе теплоты были примерно равны. Потом это доказали и на человеке в колориметрических комнатах.
Следствие первого закона т/д: тепловой эффект химической реакции, которая протекает в стадии, не зависит от теплового эффекта стадий, а зависит от разницы теплосодержания продуктов реакции и начальных веществ. Расхождение в том, что теплота не свойство функции. При выполнении ряда условий функции не состояния системы могут выполнять свойства функции состояний системы.
Второй закон термодинамики: в изолированной системе самопроизвольно протекающие процессы могут происходить только в направлении перехода энергии от более высокого к более низкому уровню.
Энтропия S=Q/T. Характеризует то количество энергии, которое необратимо переходит в тепловую форму при протекании процессов. Мера упорядоченности системы. S=klnW, k – константа Больцмана, W – термодинамическая вероятность. Т/д вероятность характеризует число микро состояний системы, в которых может быть реализовано данное макросостояние. Чем выше S, тем более неупорядоченная система.
Во всех осуществляющихся в природе замкнутых системах энтропия никогда не убывает — она увеличивается или, в предельном случае, остается постоянной — все процессы, происходящие с макроскопическими телами, можно разделить на необратимые и обратимые.
Под необратимыми подразумеваются процессы, сопровождающиеся возрастанием энтропии всей замкнутой системы. Процессы, которые были бы их повторениями в обратном порядке — не могут происходить, так как при этом энтропия должна была бы уменьшиться.
Обратимыми же называют процессы, при которых термодинамическая энтропия замкнутой системы остается постоянной. (Энтропия отдельных частей системы при этом не обязательно будет постоянной.) Противоречия:
Законы термодинамики в биологических системах
Законы термодинамики являются важными объединяющими принципами науки биологии. Эти принципы регулируют химические процессы (обмен веществ) во всех биологических организмах.
Первый закон термодинамики, также известный как закон сохранения энергии, утверждает, что энергия не может появиться ниоткуда и исчезнуть. Она способна переходить от одной формы к другой, но энергия в замкнутой системе остается постоянной.
Второй закон термодинамики гласит, что при передаче энергии в конце процесса переноса будет меньше энергии, чем в начале. Из-за энтропии, которая является мерой беспорядка в замкнутой системе, вся доступная энергия не будет полезна для организма. Энтропия увеличивается по мере передачи энергии.
В дополнение к законам термодинамики теория клеток, теория генов, теория эволюция и гомеостаз составляют главные принципы, лежащие в основе изучения жизни.
Первый закон термодинамики в биологических системах
Все биологические организмы нуждаются в энергии для выживания. В замкнутой системе, такой как Вселенная, эта энергия не потребляется, а трансформируется из одной формы в другую. К примеру, клетки организма выполняют ряд важных процессов. Эти процессы требуют энергии. При фотосинтезе энергия подается солнцем. Световая энергия поглощается клетками листьев растений и превращается в химическую энергию.
Химическая энергия хранится в виде глюкозы, которая используется для образования сложных углеводов, необходимых для создания растительной массы. Энергия, хранящаяся в глюкозе, также может выделяться через клеточное дыхание. Этот процесс позволяет растительным и животным организмам получать доступ к энергии, хранящейся в углеводах, липидах и других макромолекулах, путем производства АТФ.
Эта энергия необходима для выполнения клеточных функций, таких как репликация ДНК, митоз, мейоз, движение клеток, эндоцитоз, экзоцитоз и апоптоз.
Второй закон термодинамики в биологических системах
Как и в случае с другими биологическими процессами, передача энергии на 100% не эффективна. При фотосинтезе, например, не вся энергия света поглощается растением. Некоторая ее часть отражается, а другая часть трансформируется в тепло. Потеря энергии в окружающую среду приводит к увеличению беспорядка или энтропии.
В отличие от растений и других фотосинтезирующих организмов животные не могут генерировать энергию непосредственно из солнечного света. Они должны потреблять растения или других животных организмы для получения энергии. Чем выше организм находится в пищевой цепи, тем меньше доступной энергии он получает от своих источников пищи.
Большая часть этой энергии теряется во время метаболических процессов. Поэтому для организмов в высших трофических уровнях доступно гораздо меньше энергии. Чем меньше энергии, тем меньше число организмов может быть поддержано. Именно поэтому в экосистеме больше производителей, чем потребителей. Живые системы непрерывно нуждаются в энергии для поддержания своего высокоупорядоченного состояния.
Клетки, например, сильно упорядочены и имеют низкую энтропию. В процессе поддержания этого порядка некоторая энергия теряется в окружающей среде или трансформируется. Таким образом, в то время как клетки упорядочены, процессы, выполняемые для поддержания этого порядка, приводят к увеличению энтропии в окружении клетки/организме. Передача энергии приводит к увеличению энтропии во Вселенной.
Первый и второй законы термодинамики в биологии.



I закон термодинамики обобщает многовековой опыт человечества и является законом сохранения энергии. В применении процессами преобразования теплоты обычно этот закон формируется так: «количество теплоты(Q) подведенная к системе из внешней среды идет на увеличение внутренней энергии(U) системы и на совершения работы(А) против внешних сил» бQ=dU+бА
Под внутренней энергии понимают сумму кинетической и потенциальной энергии частиц образующих систем. Внутренняя энергия является функцией состояния и зависит от начального и конечного состояния систем. И поэтому перед U используют символ «d», а теплота и работа зависит от пути или способа перехода между этими двумя состояниями, поэтому перед ними ставится символ «б». В общем случаи работа против внешних сил включает в себя работу против сил внешнего давления и максимальную полезную работу. бА= pdV+ бАmax
II закон термодинамики устанавливает критерии отражающий односторонюю направленность необратимых процессов независимо от их конкретной природы. Согласно II закону состояние системы описывается особой функцией состояния энтропии изменения которой определяется суммарным значением приведенных к количеству теплоты. Приведенная к количеству теплоты называется количество теплоты полученное системой и деленная на абсолютную температуру при которой это количество теплоты было получено т.е это величина бQ/T.
II закон термодинамики формируется так: «при бесконечном малом изменении состояния системы изменения энтропии равно или больше элементарного приведенного количества теплоты. dS=бQ/T
Основные термодинамические функции.
Помимо энтропии для описания условий равновесия вне изолированных системах используется и другие термодинамические функции: Энтальпия (Н) ее значение определяется уравнением: Н= U+pV
В изобарическом значении изменение энтальпии равно изменению количеству теплоты, эту функцию иногда называют тепловой функцией или теплосодержанием. Вторые и третье термодинамические функции называют одинаково свободная энергия. Чтобы избежать путаницы один вид энергии назван энергией Гельмгольца (F=U-TS). Другой вид свободной энергии назван энергией Гипса (G=H-TS). Таким образом 2 вида свободной энергии различаются между собой лишь на величину рV
Мы рассматривали изолированные системы которых число частиц и полная энергия заданная граничными условиями определяемыми возможность их обмена энергией и массой с окружающей средой. В закрытых системах заданных граничных условий так что температура поддерживается постоянной за счет теплообмена окружающей среды равновесие соответствует не максимальной энтропии а минимальной свободной энергии Гельмгольца. Это соотношение показывает что равновесие в системе есть результат конкуренции между внутренней энергии и энтропии а температура выступает в роли множителя определяющий относительный вес этих 2-х факторов. Если конечным состоянием изолированной системы является термодинамическое равновесие, то открытые системы находятся в состоянии далеком термодинамическом равновесии. В целом поддержания неравновесных состоит в открытых системах возможно лишь за счет создания в них соответствующих потоков вещества и энергии. Изменения в открытой системе могут происходить либо за счет возникновения энтропии в результате теплообмена с окружающей средой либо за счет изменения энтропии в результате внутренних самопроизвольных процессов. Таким образом изменение энтропии складывается из 2-х независимых частей. В этом состоянии исходное положение термодинамики необратимых процессов, что соответствует классической формулировке 2 закона термодинамики: составляющая энтропии des учитывающая в процессе обмена со средой может быть как положительной, так и отрицательной. В зависимости от знака и величины общее значение энтропии может как увеличиваться, так и уменьшаться.
Соотношение Онзагера. Теорема Пригожина.
Рассмотрим перенос через мембрану теплоты и вещества из заряженных частиц. Обозначим через Х- значение движущих сил, У- значение потоков или суммарной скорости соответствующего потока во всех случаях возрастания энтропии во времени. Dis/dt=Y*X>0 Между потоком и движущей силой существует соотношение У=L*X, где L-линейный коэффициент. Рассмотрим допущение когда одновременно протекает 2 необратимых процесса каждый из которых характеризуется собственным значением скорости и движущей силы причем каждый поток зависит не только от «своей силы», но и от движущей силы одновременно протекающего с ним другого потока. Это допущение можно записать так:
Соотношение 1.11 называется соотношением Онзагера а коэффициенты L12 и L21 соответствует возможной взаимосвязи 2-х потоков и называется коэффициентами взаимности Онзагера. Эти коэффициенты могут иметь любой знак но между ними существует равенство: L12 = L21. Это соотношение показывает, что если поток первого необратимого процесса испытывает влияние с родства. Х2 2-го необратимого процесса через посредство коэффициента L12 то и поток 2-го необратимого процесса испытывает влияние с родства Х1-1-го необратимого процесса через посредство того же самого коэффициента. Соотношение типа 1.11 применимо например: в случае одновременной диффузии вещества и переноса теплоты или переноса электрического тока и диффузии ионов.
Формулировка теоремы Пригожина: при неизменных внешних условиях в частично равновесной открытой системе стационарном состоянии близком термодинамическому равновесию значение скорости при росте энтропии за счет внутренних необратимых процессах достигает отличного от нуля постоянного минимального положительного значения. В этом заключается принцип минимума при росте энтропии или критерии эволюции открытых систем.
Биофизика как наука. Первый и второй законы термодинамики. Превращение энергии в живой клетке. Современная гипотеза первично активного транспорта
Страницы работы
Фрагмент текста работы
фундаментальной естественной науки о законах движения материи к объяснению процессов, происходящих в живой природе.
Целью биофизики является изучение фундаментальных процессов, обеспечивающих основу жизнедеятельности всех без исключения живых организмов, независимо от уровня их развития, эволюционной ступени, возраста индивидуума, среды обитания.
В задачу биофизики входит:
— изучение на молекулярном уровне структуры субклеточных образований и выяснение связей между строением и функциональными свойствами биополиметов и других биологически активных веществ;
— выявление общих закономерностей обмена веществ и энергией на уровне клетки и организма;
— исследование молекулярных механизмов транспорта ионов, молекул через биологические мембраны;
— изучение молекулярных механизмов дыхания, работы механохимических систем;
— исследование поглощения и трансформации энергии в биосистемах;
— термодинамический анализ сложных систем с использованием законов классической термодинамики, а также термодинамики необратимых процессов, теоретическое обоснование термодинамических основ жизни;
— кинетический аналитический подход к изучению сложных систем и предсказание их поведения.
Живые огранизмы – открытая, саморегулирующаяся, самовоспроизводящаяся и развивающаяся гетерогенная система, важнейшими функциональными компонентами которой являются биополимеры: белки и нуклеиновые кислоты сложного атомно-молекулярного строения.
Термодинамика биологических процессов.
Термодинамика – это наука, изучающая наиболее общие закономерности превращения различных видов энергии в системе. Термодинамика базируется на первом и втором законах термодинамики. Практическая значимость законов термодинамики для биологии заключается в том, что с их помощью можно оценить энергетические изменения, происходящие в результате биохимических реакций, рассчитать энергию разрыва химических связей, рассчитать осмотическое давление по обе стороны полупроницаемой мембраны, рассчитать влияние концентрации соли в растворе на растворимость макромолекул и др. Законы термодинамики, применяемые для описания процессов, протекающих в электрохимических ячейках, привлекаются для обоснования теории возникновения и эволюции жизни на Земле.
Термодинамические системы, виды термодинамических систем.
Система – совокупность взаимодействующих между собой относительно элементарных структур или процессов, объединяющихся в целое выполнением некоторой общей функции, несводимой к функциям ее компонентов.
Термодинамическая система – часть пространства с материальным содержимым, ограниченная оболочкой.
Область вне оболочки – окружающая среда.
В зависимости от характера взаимодействия с окружающей средой термодинамические системы делятся на три типа:
а) изолированные (не обмениваются с окружающей средой ни веществом, ни энергией);
б) замкнутые (обмениваются только энергией);
в) открытые (обмениваются веществом и энергией). Живые организмы – открытые термодинамические системы.
Параметры термодинамической системы:
Первый закон термодинамики
Количество теплоты, поступающей в систему (dQ), 
В живых организмах совершаются различные виды работ.
Химическая работа – работа, совершаемая при синтезе высокомолекулярных соединений из низкомолекулярных и при осуществлении определенных химических реакций.
Механическая работа – работа по перемещению тел против механических сил.
Осмотическая работа – работа по перемещению различных веществ через мембраны из области низкой концентрации этих веществ в область более высокой концентрации.
Электрическая работа – работа по переносу заряженных частиц (ионов) в электрическом поле, создание разности электрических потенциалов и электрического тока.
Работа – это мера превращения энергии одной формы в другую.
Для доказательства приложимости первого закона термодинамики к биологическим объектам был применен ледяной калориметр. По скорости таяния льда находили теплоту, выделенную лабораторным животным в изолированной камере (ледяном калориметре). Сравнивали с количеством тепла, выделяемом при прямом сжигании до СО2 и Н2О продуктов питания. Были получены величины близких порядков.
Таким образом, было доказано, что живые организмы не являются источником новой энергии и окисление поступающих в живой организм питательных веществ приводит к высвобождению в нем эквивалентного количества энергии.
Второй закон термодинамики
Первый закон термодинамики позволяет определить количественное соотношение между различными формами энергии, которые принимают участие в данном процессе. Первый закон термодинамики показывает, что различные виды энергии могут превращаться друг в друга в эквивалентных количествах. Однако он ничего не говорит о том, в каком направлении будет происходить превращение энергии в системе. Ответ на этот вопрос дает второй закон термодинамики. Второй закон термодинамики заключается в том, что все процессы превращения энергии протекают с рассеиванием части энергии в виде тепла. Такое рассеивание энергии является необратимым, т.е. в последующем это количество тепла не может быть израсходовано для совершения работы. Это происходит потому, что тепловая энергия является наиболее деградированным видом энергии, обусловленным хаотическим движением микрочастиц.
Возможность протекания термодинамических процессов, их направление и предел характеризуют такие параметры состояния системы, как энтропия и свободная энергия.
Энтропия (S) – это часть общей энергии клетки, которая не может быть использована в данной системе. Энтропия имеет троякий смысл.
1. Если в термодинамической системе происходят процессы, связанные с выделением или поглощением тепла, то эта система при любой температуре способна поглотить некоторое дополнительное количество тепла. Величина, характеризующая тепловую емкость системы, и является энтропией.
2. Энтропия как термодинамическая функция состояния системы, являющаяся мерой ее неупорядоченности (лед S = 9.8, жидкость S = 16.7, газ S = 45.1)/
3. Энтропия как мера вероятности состояния системы. Это понятие энтропии как величины, пропорциональной логарифму вероятности нахождения системы в конкретном макросостоянии ввёл Больцман.
k – постоянная Больцмана.
Термодинамическая вероятность – это количество микросостояний, возможных в пределах данного макросостояния.
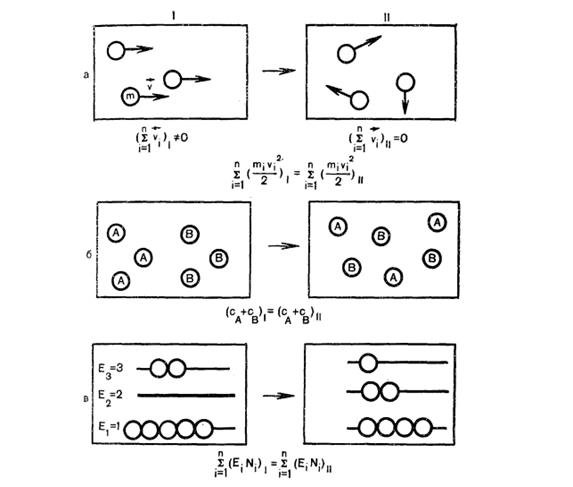
Рост энтропии при самопроизвольных процессах означает переход системы, состоящей из большого числа частиц, в наиболее вероятное состояние, т.е. к максимальному числу микросостояний.
Рис. 1. Примеры перехода систем в наиболее вероятное состояние в направлении I→ II (SII>SI)
а – изменение ориентации частиц (превращение кинетической энергии движущего тела в тепло);
б – изменение распределения частиц в пространстве (диффузия);
в – изменение распределения частиц по энергетическим уровням.
В изолированных системах необратимые термодинамические процессы протекают в направлении возрастания энтропии. Энтропия полностью обратимых термодинамических процессов сохраняет постоянное значение.
Дриллюэн классифицировал виды энергии по их способности превращаться в другие виды энергии.
B. – химическая – энергия химической связи.
C. – тепловая. Это особый, самый обесцененный вид энергии, который не может переходить без потери в другие виды энергии. Тепловая энергия связана с хаотическим движением молекул и характеризуется максимальной энтропией, остальные виды энергии базируются на упорядоченном движении молекул.
Деградация высших типов энергии в энергию низших типов – основное эволюционное свойство изолированных систем.
Исходя из того, что живые организмы – системы открытые, изменение энтропии для них складывается из продукции энтропии внутри организма за счет необратимых биохимических процессов (diS) и обмена энтропии с окружающей средой (dеS)
Именно разделение величины изменения энтропии открытой системы на две составляющие позволяет изучать различия в термодинамических свойствах открытых и изолированных систем.
Формулировка второго закона термодинамики для живых систем: скорость изменения энтропии в организме равна алгебраической сумме производства энтропии внутри организма и скорости обмена энтропией между организмом и окружающей средой.

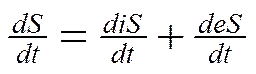
где t– время. Это уравнение является математическим выражением второго закона термодинамики для биосистем.
Стационарное состояние (устойчивое и неустойчивое).
Термодинамическое равновесие. Теорема Пригожина.
Состояние системы, при котором ее параметры не изменяются в течение времени, но происходит обмен веществом и энергией с окружающей средой, называется стационарным.
Термодинамика биологических процессов
ТЕРМОДИНАМИКА БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
В биологии законы термодинамики используются, во-первых, для расчета параметров энергетических превращений в организме и, во-вторых, для определения КПД биологических процессов. Термодинамический аспект необходимо учитывать при изучении физико-химических процессов. Термодинамика биологических процессов послужила основой для разработки представлений об источниках энергии процессов жизнедеятельности, оказалась плодотворной для понимания и количественного анализа таких биологических процессов, как генерация биопотенциалов, осмотические явления, мышечные сокращения.
Термодинамика рассматривает три типа систем, они отличаются по характеру взаимодействия с внешней средой.
1. Изолированные системы не обмениваются с окружающей средой ни веществом, ни энергией, т. е. границы такой системы непроницаемы,
2. Системы, обменивающиеся через свои границы энергией с окружающей средой, но непроницаемые для веществ, относятся к замкнутым системам.
3. Реальные системы в природе никогда не бывают абсолютно изолированными и закрытыми. В открытых системах осуществляется обмен как веществом, так и энергией. Живые организмы как открытые термодинамические системы отличаются от таковых в неживой природе тремя признаками: 1) состоят из биополимеров (белков и нуклеиновых кислот); 2) способны к самовоспроизведению; 3) способны к развитию и саморегуляции.
Первые два типа называют ещё закрытыми системами.
Термодинамические системы характеризуются определенными параметрами (температура, давление, объем, энергия). Термодинамические параметры системы разделяются на экстенсивные и интенсивные.
Параметры, которые не зависят от массы (температура, давление), называются интенсивными. Они используются в качестве независимых термодинамических переменных при моделировании и могут иметь определенное значение в каждой точке системы.
Параметры, зависящие от общего количества вещества в системе и изменяющиеся пропорционально массе отдельных компонентов системы, называются экстенсивными (объем, число молей в системе).
Обратимыми называются такие термодинамические процессы, при которых возвращение системы в первоначальное состояние не требует затрат энергии извне и связанных с этим изменений в окружающей среде. При обратимых процессах не происходит рассеивания энергии в виде теплоты.
Необратимыми называются термодинамические процессы, при которых возвращение системы в исходное состояние возможно лишь при условии затрат внешней энергии, что влечет за собой определенные изменения в окружающей среде. Необратимые процессы характеризуются переходом части энергии в теплоту.
Термодинамика биологических процессов изучает необратимые (неравновесные) процессы.
Под внутренней энергией системы понимают её общий запас, обусловленный всеми видами движений и взаимодействий составляющих ее молекул, атомов, ионов, элементарных частиц. Нельзя вычислить абсолютное значение этой энергии для данной системы, так как она включает большое число трудно поддающихся учету слагаемых, некоторые из них при современном состоянии науки еще неизвестны. Поэтому в термодинамике вычисляют разность между запасом внутренней энергии системы для начального и конечного состояния.
Стационарное состояние системы характеризуется тем, что ее параметры также не изменяются во времени, но происходит обмен веществ и энергии с окружающей средой.
Первый закон термодинамики
Это закон сохранения энергии: в изолированной термодинамической системе полный запас энергии есть величина постоянная и возможны только превращение одного вида энергии в другой в эквивалентных соотношениях.
Формулировка первого начала термодинамики для закрытых систем следующая: теплота, подведенная к системе, расходуется на изменение внутренней энергии системы и на совершение работы против внешних сил.
Особенность первого закона термодинамики в биологии.
В живой системе работа не может совершаться за счёт притока тепла извне, как в тепловой машине, она совершается за счёт изменения внутренней энергии системы при различного рода биохимических процессах или за счёт энтропийного фактора.
Говоря образно: живая система – не паровоз, сколько таракана не подогревай, он за счёт этого тепла быстрее двигаться не будет.
В настоящее время не вызывает сомнения применение закона сохранения энергии к биологическим объектам. Однако так было не всегда. Первые экспериментальные попытки измерения энергетического баланса организма были предприняты в конце 18 в. А. Лавуазье и П. Лапласом. Для доказательства приложимости первого начала термодинамики к биологическим объектам был применен ледяной калориметр. По скорости таяния льда находили теплоту, выделенную морской свинкой в изолированной камере или ледяном калориметре. После этого определяли количество теплоты, выделяющейся при прямом сжигании до СО2 и Н2О продуктов питания морской свинки в калориметрической бомбе. А. Лавуазье и П. Лаплас получили величины близких порядков.
Таким образом, метод калориметрии позволил установить, что количество энергии, поглощенной организмом за сутки вместе с питательными веществами, равно выделенной за это же время теплоте.
Энергетический баланс организма находится в полном соответствии с законом сохранения энергии, и никаких специфических источников жизни не существует.
Энтальпия. Закон Гесса
Жизнедеятельность организмов, как и работа тепловой машины, сопровождается выделением в окружающую среду тепловой энергии за счет дыхания, пищеварения, работы мышц.
Удельной теплопродукцией называют количество теплоты, выделяемое единицей массы животного в единицу времени:
Теплопродукция пропорциональна массе организма. Удельная теплопродукция уменьшается с увеличением массы. Такую зависимость можно объяснить тем, что с увеличением размера и массы животного уменьшается отношение его поверхности к объему. Для компенсации большой потери теплоты мелкими животными требуется более высокая интенсивность метаболизма и, соответственно, потребление большего количества пищи. Этим можно объяснить необычайную прожорливость грызунов и мелких птиц.
Рассчитывается по формуле:
Известно, что биохимические превращения в организме проходят множество промежуточных стадий, которые не всегда выявлены и доказаны. На основании закона Гесса, не зная промежуточных звеньев биохимического процесса, имея данные лишь о начальных и конечных продуктах реакции, можно вычислить суммарный энергетический эффект.
Закон Гесса используется для вычисления калорийности пищевых продуктов и составления пищевых рационов человека и животных.
Второе начало термодинамики и живые организмы
Первое начало термодинамики не дает ответа на вопрос о том, почему процесс, связанный с трансформацией энергии, протекает именно в данном направлении; насколько полно осуществляется превращение энергии; каковы реальные пределы протекания того или иного биохимического процесса.
Второе начало термодинамики позволяет судить о направлении протекания процесса и, таким образом, дополняет первое начало термодинамики.
Формулировку второго начала термодинамики впервые дали независимо друг от друга Р. Клаузиус и У. Томпсон (). Р. Клаузиус: «Теплота не может переходить сама собой от более холодного тела к более теплому».
Второе начало не имеет столь простой и общепринятой формулировки, как первое, и формулируется по-разному, в зависимости от той группы явлений, к которой оно прилагается.
Энтропия является таким же свойством термодинамической системы, как температура, давление и др. В любом теле (лист бумаги) содержится определенная энтропия; так же, как и внутренняя энергия, энтропия системы растет с ее массой и равна сумме энтропии подсистем, она увеличивается при повышении температуры за счет усиления теплового движения молекул. Аналогичное увеличение энтропии наблюдается при переходе вещества из твердого состояния в жидкое. Для вычисления изменения энтропии ΔS биохимической реакции из суммы изменения энтропии продуктов реакции вычитают сумму изменения энтропии исходных веществ.
Изменение энтропии ΔS системы равно отношению количества теплоты (dQ), сообщенного системе, к температуре (Т):
Если ввести понятие энтропии, то второе начало термодинамики можно сформулировать так: энтропия изолированной системы возрастает в необратимом процессе и остается неизменной в обратимых термодинамических процессах. Уравнение второго закона термодинамики:
Сущность второго начала термодинамики для изолированных систем состоит в том, что все необратимые процессы протекают в таком направлении, в котором энтропия системы увеличивается.
Формулировка второго закона термодинамики для живых организмов: скорость изменения энтропии в организме равна алгебраической сумме производства энтропии внутри организма и скорости поступления энтропии из среды в организм.
Биологические процессы могут сопровождаться самопроизвольным уменьшением энтропии. Так, рост и развитие организмов сопровождается усложнением их организации и с точки зрения классической термодинамики выглядит как самопроизвольное уменьшение энтропии и увеличение (накопление) свободной энергии. Дело в том, что свободная энергия не может возрастать лишь в изолированной системе. Живые организмы, как системы открытые, в процессе автотрофного и гетеротрофного питания получают свободную энергию из окружающей среды. Поэтому второй закон термодинамики применительно к живым организмам надо рассматривать, учитывая их взаимодействие с окружающей средой. С этой точки зрения уменьшение энтропии и увеличение свободной энергии фотосинтезирующих организмов происходит благодаря уменьшению свободной энергии и увеличению энтропии в системе Солнце-Земля (ядерные реакции на Солнце) и общий баланс энтропии автотрофов соответствует второму началу термодинамики.
Стационарное состояние. Теорема Пригожина. Термодинамическое равновесие. Устойчивое и неустойчивое стационарное состояние. Принцип Ле-Шателье
Состояние системы, при котором ее параметры не изменяются в течение длительного времени, но происходит обмен веществом и энергией с окружающей средой, называют стационарным. В стационарном состоянии открытой системы концентрация промежуточных продуктов не изменяется со временем, что достигается определенным соотношением различных физико-химических процессов, ответственных за распад и образование промежуточных соединений.
Живой организм в каждый момент времени не отвечает приведенному определению стационарного состояния. Однако, если рассмотреть средние значения его параметров за сравнительно большой промежуток времени, можно отметить их постоянство и утверждать, что стационарное состояние характерно для организма. Так, с большим постоянством поддерживается температура определенных органов и тканей у теплокровных животных, сохраняется неизменный солевой состав и водородный показатель (рН) различных биологических жидкостей, не изменяются в ходе нормальной жизнедеятельности величины биопотенциалов покоя, осмотического давления.
В открытых системах суммарное изменение энтропии в стационарном состоянии равно нулю.
Стационарное состояние биологической системы поддерживается, когда увеличение энтропии системы за счет происходящих в ней необратимых процессов компенсируется оттоком энтропии при взаимодействии с окружающей средой.
Особенности стационарного состояния и термодинамического равновесия:
Отсутствие обмена с окружающей средой веществом и энергией
Непрерывный обмен с окружающей средой веществом и энергией
Энтропия системы постоянна и соответствует максимально возможному в данных условиях значению
Энтропия системы постоянна, но не равна максимально возможному в данных условиях значению.
Полное отсутствие в системе каких-либо градиентов
Наличие постоянных по величине градиентов
Не требуется затраты свободной энергии
Система нереакционноспособна и не совершает работу против внешних сил
В системе совершаются необратимые реакции, ее работоспособность постоянна и не равна нулю
Сходство термодинамического равновесия и стационарного состояния системы заключается в том, что стационарное состояние, так же как и термодинамическое равновесие, сохраняет все основные параметры неизменными. Энтропия системы, находящейся в стационарном состоянии, имеет некоторую постоянную величину, не равную максимальной. Поэтому наиболее характерными свойствами стационарного состояния являются стремление системы к минимуму ежесекундного прироста энтропии и определенная внутренняя стабильность и упорядоченность.
В организме поддерживается гомеостаз в течение времени, протекающего от рождения до смерти. Уровни стационарных состояний в течение онтогенеза постоянно изменяются. У детей уровень Са2+ в костях с их ростом увеличивается, изменяется количество зубов, волос и т. д. Это примеры перехода на новые стационарные уровни, примеры необратимых изменений.
Живой организм может изменить уровень стационарного состояния в результате воздействия окружающей среды и при патологических процессах.
Одной из важнейших характеристик биологических систем является устойчивость стационарных состояний. Устойчивое стационарное состояние характеризуется тем, что при отклонении системы от стационарного уровня в ней возникают силы, стремящиеся вернуть ее в первоначальное положение.
Внешние воздействия вызывают в неустойчивой стационарной системе нарастающие изменения, в результате которых система переходит или в устойчивое стационарное состояние (при дополнительной затрате энергии), или в состояние термодинамического равновесия.
Диаграмма устойчивого (а) и неустойчивого (b) стационарных состояний в открытой системе
Любое отклонение от уровня стационарности вызовет в системе увеличение скорости продуцирования энтропии. Для точки А скорость производства энтропии будет меньше, чем для точки В.
Система, которая функционирует в одном из двух устойчивых стационарных состояний, характеризуется триггерными свойствами, обеспечивающими направленные и скачкообразные переключения из одного стационарного состояния в другое. Например, при раздражении нервного волокна состояние возбуждения, возникающее по принципу «все или ничего», наступает скачкообразно после достижения порога возбуждения. Триггерные свойства биологических систем определяют и процесс клеточной дифференциации, когда при делении возникают дочерние клетки, качественно отличные от клеток-предшественников.
И. Пригожин (1946) на основе изучения открытых систем сформулировал основное свойство стационарного состояния: в стационарном состоянии при фиксированных внешних параметрах скорость продукции энтропии в открытой системе, обусловленная протеканием необратимых процессов, постоянна во времени и минимальна по величине.
Таким образом, согласно теореме Пригожина стационарное состояние характеризуется минимальным рассеянием энергии.
По теореме Пригожина для поддержания стационарного состояния тратится некоторое количество энергии, причем в каждом случае самое минимальное. Организм стремится работать на самом выгодном энергетическом режиме. При этом энтропия возрастает с минимальной скоростью.
Однако теорема Пригожина не позволяет характеризовать стационарное состояние с точки зрения устойчивости к внешним воздействиям и самопроизвольным флуктуациям в самой открытой системе. Теорема Пригожина приложима к живым организмам лишь в качестве первого приближения, ибо она предполагает постоянство кинетических параметров, которое в организме в полной мере не выдерживается, особенно в начальный период его развития.
Стационарное состояние живого организма характеризуется высокой динамичностью: в организме протекают такие процессы, которые нарушают стационарное состояние тех или иных систем (повышение температуры тела при воспалительных процессах). Если эти изменения не превышают определенных пределов, то стационарное состояние может восстановиться, т. е. небольшие отклонения от стационарного состояния не ведут к необратимым изменениям. Биологические системы обладают способностью к саморегуляции (установление наиболее экономичных, наиболее надежных уровней в работе живых организмов). Это положение впервые было сформулировано в работе Ле-Шателье.
Всякая система, находящаяся в состоянии химического равновесия и отклонившаяся от этого состояния под воздействием внешнего возмущения, стремится самопроизвольно вернуться в равновесное состояние за счет изменения параметров в направлении, противоположном тому, которое вызвало возмущение.
Принцип автостабилизации биологических систем имеет прямое отношение к теореме Пригожина, так как стремление энтропии в стационарном состоянии к минимальной величине приводит к тому, что при отклонениях от стационарного уровня в системе наступают такие изменения, которые стремятся вернуть ее к минимуму производства энтропии. Принцип Ле-Шателье является следствием закона сохранения энергии, лежит в основе регулирования по типу обратных связей и поддержания гомеостаза в организме.
Принцип автостабилизадии в применении к биологическим системам состоит в том, что увеличение потока положительной энтропии при отклонении системы от стационарного уровня (заболевание) приводит к появлению таких внутренних изменений, которые ограничивают этот поток, т. е. в организме происходят процессы, способствующие ликвидации причин, вызывающих заболевание, и система настраивается на более термодинамически выгодный ритм функционирования.
Работоспособность биологических, систем
Биологические системы характеризуются наличием разнообразных градиентов. Одним из них является концентрационный градиент: содержание ионов калия в цитоплазме выше (в 15 раз), чем в межклеточной жидкости, и концентрационный градиент калия направлен из клетки в окружающую среду; концентрационный градиент натрия имеет обратное направление. Осмотический градиент, обусловленный наличием разности осмотического давления в клетке и омывающей жидкости, играет особенно значительную роль в жизнедеятельности растительных клеток (тургор). С неравномерным распределением ионов между клеткой и средой связано возникновение электрического градиента.
При совершении работы происходит уменьшение градиента, за счет энергии которого осуществляется работа, при этом возникает градиент противоположного направления. При обратимых процессах возникающий градиент имеет такую же величину, как и вызывающий его; при необратимых процессах вновь появляющийся градиент имеет всегда меньшую величину. Поэтому биологические процессы (диффузия ионов, передача теплоты) протекают в направлении уменьшения градиентов.