Доклинические исследования это что
Доклинические исследования
Доклинические исследования лекарственного препарата –это научные исследования, направленные на получение первичных результатов о эффективности и безопасности использования лекарственного препарата in vivo. Данный вид исследований является обязательной частью процесса регистрации лекарственных средств для медицинского применения. Основной целью доклинических исследований является получение результатов и выводов о возможности или невозможности проведения в дальнейшем клинических исследований, то есть исследований препарата на человеке. Доклинические исследования проводятся по физическим, химическим, физико-химическим, токсикологическим, биологическим, микробиологическим, фармакологическим и другим направлениям. Данные исследования позволяют оценить возможную эффективность вещества и его комбинаций, а также определить важные параметры, методики исследования и контроля при дальнейших клинических исследованиях.
Суть проведения доклинических исследований сводится к созданию модели воздействия исследуемого лекарственного вещества на лабораторное животное. В ходе исследования определяется общая токсичность, хроническая токсичность, фармакокинетика, фармакодинамика, специфическая токсичность (мутагенность, канцерогенность, тератогенность, аллергенность, иммунотоксичность).
Общая токсичность – это свойства лекарственного средства вещества оказывать побочные действия при той или иной дозировке.
Хроническая токсичность – это проявление токсического эффекта вещества при многократном введении на протяжении определенного времени.
Фазы клинических исследований
Для полного понимания о процессе клинического исследования нового лекарственного препарата разберем этапы создания нового препарата.
Разработка лекарственных средств
Первый этап
Второй этап: доклинические исследования
Третий этап
I ФАЗА клинического исследования
В ней могут участвовать как здоровые добровольцы, так и пациенты с определенным
заболеванием.
Во время I фазы изучается насколько хорошо переносится исследуемый препарат. Вся
информация обрабатывается, а после того, как в ходе исследований фазы I врачи изучили
фармакодинамику, фармакокинетику и предварительную безопасность исследуемого
лекарственного препарата, запускается следующая фаза КИ — фаза II.
II ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат. Основная цель клинических исследований второй фазы — найти
оптимальный уровень дозировки и подобрать схему приёма препарата для следующей, третьей фазы. Дозы препарата, которые получают пациенты на данном этапе, зачастую ниже, чем самые высокие дозы, которые принимали участники фазы I.
III ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат и основная цель получить результат эффективности и безопасности
препарата.
После того, как в ходе исследований фазы III фармацевтическая компания подтвердила
эффективность и безопасность нового препарата, формируется регистрационное досье
препарата, где описываются методология и результаты доклинических исследований и трех
фаз клинических исследований лекарственного препарата, особенности производства, состав лекарственного препарата и его срок годности. Регистрационное досье оформляют и направляют в уполномоченный орган здравоохранения, осуществляющий регистрацию новых препаратов. После получения регистрационного удостоверения лекарственный препарат выводится на рынок лекарственных средств и поступает в аптеки.
IV ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат. Наступает после того, как лекарственный препарат зарегистрирован и уже появился в аптеках.
Испытания лекарственных средств
Разработка и выпуск лекарств на фармацевтический рынок включает множество этапов: начиная с поиска фармакологически активных веществ и заканчивая проведением обязательных испытаний с последующей регистрацией лекарственных средств.
В нашем материале мы подробно рассмотрели виды испытаний и основные моменты, связанные с проведением доклинических и клинических исследований лекарственных средств.
Основные принципы и требования к исследовательской деятельности указаны в Федеральном Законе N61-ФЗ «Об обращении лекарственных средств» от 12.04.2010.
Доклиническое исследование лекарственных средств
Доклинические исследования — научное изучение лекарственных компонентов или препаратов, в ходе которого можно получить первичные данные об их безопасности и эффективности. Обязательный этап регистрации лекарств для медицинского применения, необходимый для регистрации лекарства для медицинского применения и его вывода на рынок в Российской Федерации.
Основные принципы проведения доклинических исследований размещены в ст. 11 закона N 61-ФЗ.
Их цель — получить реальную оценку эффективности фармакологического вещества и его комбинаций, определить методики для дальнейшего изучения и параметры для контроля. В ходе доклинических исследований изучаются различные показатели: химические, физические, токсикологические, биологические, фармакологические, микробиологические и другие. В результате делается вывод о целесообразности клинических испытаний, в ходе которых препарат проверяется на человеке.
Изучение лекарственного вещества проходит в научно-исследовательских организациях и лабораториях, оснащённых подходящей под эти задачи материально-технической базой и имеющих квалифицированных специалистов в этой области.
Специалисты строят свою работу по специальному плану, который должен утвердить разработчик лекарства. По мере получения результатов вся информация фиксируется в протоколе, который в дальнейшем войдёт в брошюру исследователя и будет использован при составлении регистрационного досье.
При проведении доклинических испытаний препаратов специалисты создают модель воздействия вещества на лабораторных животных. При этом оцениваются общая и хроническая токсичность, фармакодинамика, фармакокинетика, специфическая токсичность.
Общая токсичность — наличие побочных эффектов при разных дозировках.
Хроническая токсичность — наличие побочных эффектов при многократном употреблении вещества в течение определённого промежутка времени.
Специфическая токсичность — иммунотоксичность, мутагенность, канцерогенность и аллергенность средства.
Фармакодинамика — изучение биологических механизмов, локализации и эффектов взаимодействия веществ.
Фармакокинетика — изучение особенностей всасывания, распределения в организме и выведения вещества.
После проведения доклинических процедур, при успешном их результате лекарственное средство поступает на стадию клинических испытаний.
Что такое клинические испытания лекарств?
Клиническое испытание или исследование — научное изучение лекарственных компонентов или препаратов, в котором в качестве испытуемых принимают участие люди-добровольцы. Позволяет оценить безопасность и эффективность нового лекарства, расширить и уточнить показания.
Дизайн — общая схема исследования, описывающая этапы и особенности его проведения.
Протокол — документ, в котором содержится цель и задачи, методология и схемы, организация и статистические аспекты процесса изучения лекарства. Это основной документ, который разрабатывается перед началом испытаний.
Клиническое испытание лекарственных средств— обязательный этап разработки новых лекарственных препаратов, во время которого можно получить данные об их эффективности и безопасности. В дальнейшем эта информация используется при принятии решения о регистрации лекарства или отказе в совершении регистрационных действий. Без этого этапа лекарственное средство не может поступить на рынок.
Организовать испытания может сам разработчик препарата или его доверенное лицо; образовательные или научно-исследовательский организации. Изучение нового лекарства проводится в одной или нескольких медицинских организациях, получивших аккредитацию уполномоченного федерального органа.
Перед медицинскими организациями стоит сразу несколько задач:
При этом организации, которые проводят исследования руководствуются правилами надлежащей клинической практики, которые утверждены уполномоченным федеральным органом.
Правила проведения клинических исследований
Для проверок новых ЛС, проводимых в Российской Федерации, применяется ГОСТ Р 52379-2005 «Надлежащая клиническая практика». Он полностью отражает требования Consolidated Guideline for Good Clinical Practice — международного руководства по надлежащей клинической практике, которое одобрено Международной конференцией по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком.
ГОСТ Р 52379-2005 был разработан для установки одинаковых международных стандартов со странами Евросоюза, США и Японией.
Международные стандарты надлежащей клинической практики — GCP (good clinical practice) — включают требования к качеству и этике; правила по подготовке и реализации исследований с участием добровольцев, оформлению документов и отчётов. Таким образом, они регулируют права участников испытаний и вопросы обеспечения безопасности, снижают риск нанесения вреда и регламентируют обязательность предоставления достоверной информации.
Применение этих правил обеспечивает достоверность результатов, полученных в результате проведения клинических исследований лекарственных средств, а также исключает необоснованный риск для участников и сохраняет их права.
Стадии клинических испытаний новых препаратов
Проверка лекарств предполагает проведение четырёх стадий — фаз. Каждая фаза является отдельным исследованием, имеющим свой дизайн и проводимых в соответствии со строгими протоколами. Для регистрации препарата может потребоваться провести сразу несколько испытаний в рамках одной стадии.
При получении положительных результатов в первых трех фазах, препарат получает регистрационное удостоверение. Проведение IV фазы проходит в качестве пострегистрационного испытания.
От живого к неживому. Доклинические исследования сегодня и завтра
Ученые неустанно работают, чтобы снизить количество животных, используемых при разработке лекарств. Рисунок в полном размере.
Авторы
Редакторы
Рецензент
Ранее «Биомолекула» уже рассказывала о том, как проходят масштабные клинические исследования. Теперь пришло время узнать о не менее важной стадии разработки лекарственных препаратов. Из этой статьи, открывающей спецпроект о доклинических исследованиях, вы узнаете, как именно сегодня происходит изучение свойств потенциальных лекарств еще до начала испытаний с участием добровольцев.
Будущее доклинических исследований
Ни для кого не секрет, что биологические исследования и разработка лекарств — сложный и ответственный процесс. При этом в ходе отбора лучших молекул-кандидатов ученые должны заботиться не только о действенности, но и о безопасности новых препаратов. Так до того, как созданное лекарство получит человек, его изучают в других моделях: от компьютерных программ и клеточных культур до разных видов животных.
Спецпроект о доклинических исследованиях (доКИ) стал своеобразным приквелом к циклу статей о клинических испытаниях (КИ): что нужно сделать и изучить перед тем, как проводить клинические исследования с участием людей? Можно ли обойтись без экспериментов на животных? Почему правильные доКИ не менее значимы для разработки лекарства, чем КИ? Мы постараемся в доступной форме осветить сложные вопросы планирования и регулирования доклинических исследований; принципы этичности работы с лабораторными животными; узнаем, когда и чем можно их заменить; и заглянем в ближайшее будущее биомедицинской отрасли.
Независимый рецензент статьи — Равиль Ниязов, кандидат медицинских наук, специалист по разработке и регулированию лекарств в Центре научного консультирования, автор образовательного YouTube-канала PhED, а также ресурса по переводу на русский язык зарубежных документов по разработке и регулированию лекарств PharmAdvisor.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл», ФМИ (PMI Affiliates in Russia), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Начать рассказ о доклинических исследованиях придется с принятой в отрасли терминологии, которая не лишена особенностей. С первой мы сталкиваемся сразу же, когда видим определение самих доклинических исследований (доКИ).
Доклиническое исследование лекарственного препарата для медицинского применения — это исследование, субъектом которого является любой объект живого или неживого мира, за исключением целостного организма живого человека, и которое направлено на установление безопасности и эффективности такого лекарственного препарата у человека.
О том, как проводят клинические исследования лекарств (которые следуют за доКИ), подробно можно почитать в одноименном спецпроекте «Биомолекулы», например: «С миру по нитке: как соединились компоненты клинического исследования» [1].
На самом деле в доКИ участвуют еще не сами лекарства, а действующие вещества, их метаболиты, примеси и вспомогательные вещества, которые войдут в состав ЛС. Говоря «лекарство», «препарат» или «вещество», будем иметь в виду сразу все возможные объекты исследований.
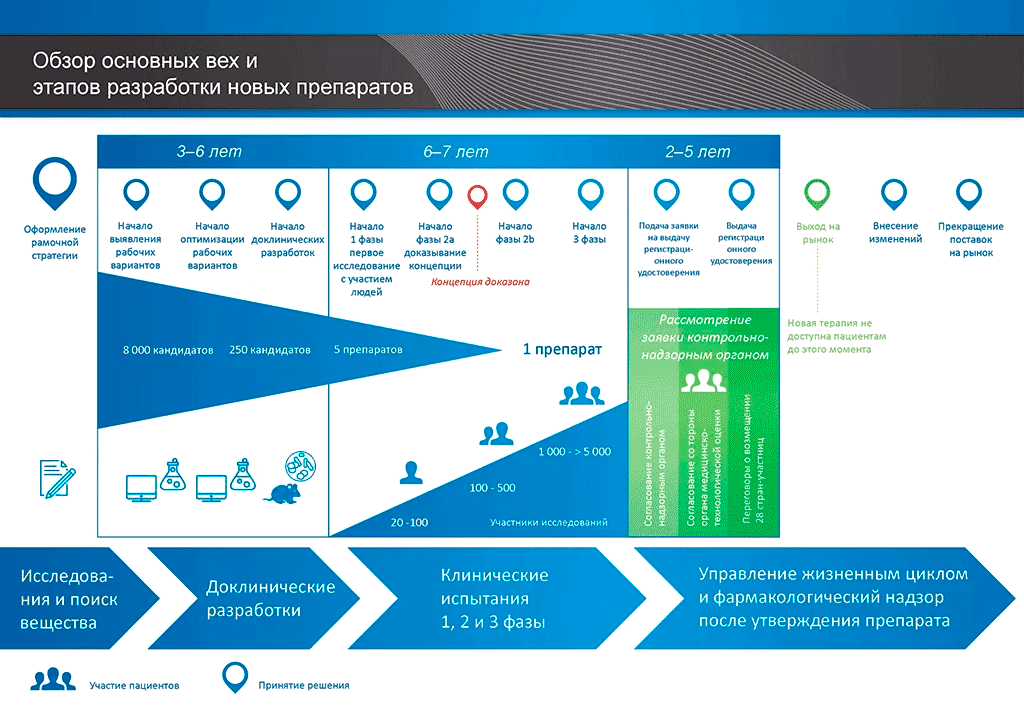
Взглянем теперь на место доКИ в разработке новых препаратов (рис. 1). Здесь важно понять, что программа доклинической разработки может длиться от нескольких месяцев до нескольких лет, не уступая в сложности КИ, и очень дорого стоить. Однако по сравнению с клиническими исследованиями, стадия доКИ всё же примерно в 3 раза быстрее и в 8–10 раз дешевле.
Рисунок 1. Основные этапы разработки новых лекарственных препаратов
Каковы же субъекты доКИ, если в них нельзя прибегать к помощи людей? В качестве моделей в доклинических разработках могут быть использованы компьютерные программы и базы данных, изолированные рецепторы и органеллы клеток, сами клетки (обычно в виде стандартизированных клеточных линий), ткани, органы и цельные живые лабораторные животные. Первая статья спецпроекта в основном будет посвящена работе с лабораторными животными как с наиболее «традиционной» моделью, от которой, тем не менее, хочется «уйти» в сторону более этичных способов получения необходимых данных. Пусть исследования in silico и in vitro имеют свои ограничения и пока не могут полностью заменить животные модели, развитие этих технологий в последние десятилетия позволило начать сокращать количество животных в доКИ, о чем мы расскажем в следующих статьях.
Напомним основные обозначения, пришедшие к нам из латыни: in silico означает компьютерное моделирование; in vitro — исследования на живых клетках, тканях и органах, но не на целостном организме; in vivo — исследования на живом животном. См. также: In vivo — in vitro — in silico [2].
Цели доклинических исследований
Основная идея доКИ — в обосновании целесообразности проведения последующих КИ, после которых новые вещества смогут войти в состав готовых продуктов. Пренебрежение доКИ чревато массой проблем. В лучшем случае будет потрачено очень много денег и времени на дальнейшие исследования неэффективного препарата. В худшем — участники КИ получат опасный для их здоровья препарат, что может привести к серьезным побочным эффектам и даже смерти.
У доклинических исследований существуют вполне определенные цели. Этичность доКИ с участием животных обеспечивается в том числе правильным планированием экспериментов — они должны быть направлены на получение необходимых данных. К целям доКИ относятся:
Виды доклинических исследований
ДоКИ можно разделить на разные типы в зависимости от целей, субъектов исследований и исследуемых параметров (табл. 1).
| По предназначению результатов: | ||
| поисковые (фундаментальные, трансляционные) | регуляторные (пилотные, опорные) | |
| По изучаемым параметрам: | ||
| фармакологические (фармакодинамические и фармакокинетические) | токсикологические (общие и специфические виды токсичности, токсикокинетика, исследования экологической безопасности) | |
| По используемой модели: | ||
| in silico (компьютерная модель) | in vitro (клеточная культура) | in vivo (исследования на животных) |
Поисковые и регуляторные исследования
По использованию получаемых результатов можно выделить поисковые (фундаментальные, трансляционные) и регуляторные (пилотные и опорные) исследования.
К поисковым, или нерегуляторным, исследованиям можно отнести всё, что помогает сформировать правильные гипотезы и цели для последующей разработки нового лекарства. Фундаментальные исследования во всём их многообразии изучают мишень для будущего лекарства. Они проводятся для изучения механизмов развития заболеваний, деталей биохимических взаимодействий в живых организмах и так далее. Такие исследования в основном проводят на клетках, а животных «подключают» для проверки гипотез, предварительно полученных in vitro. Трансляционные исследования изучают возможность какого-либо влияния на выбранную мишень с точки зрения лечения заболеваний, то есть являются первым «мостиком» для переноса научного знания в плоскость реального применения в медицине.
Важно отметить, что проведение поисковых исследований не урегулировано законодательно, т.е. нет строгих юридических требований в отношении используемых моделей, дизайна, размера выборки, оформления отчетов и т.д. Параметры исследований и модели определяются исключительно научными соображениями. Результаты этих исследований обычно не включаются в регистрационное досье, поскольку большинство из них касаются молекул-кандидатов, так и не доходящих до последующих этапов разработки. Задача поисковых исследований — найти несколько многообещающих кандидатов, которые можно было бы начать изучать в КИ.
После того, как разработчик по результатам поисковых клинических исследований приходит к выводу, что можно начать испытания с участием добровольцев, ему необходимо подготовить почву для проведения будущих экспериментов. Для этого инициируются регуляторные доКИ. Данное понятие предполагает, что существуют определенные юридически обязывающие критерии, которые должны быть выполнены при планировании, проведении, анализе, интерпретации и документальном оформлении таких исследований, поскольку на их основании впоследствии будет разрешаться изучение лекарства с участием людей.
Регуляторные исследования (пилотные и опорные) уже относятся к конкретному кандидату и изучению его действия, а их результаты влияют на получение последующих разрешений на КИ. Пилотные исследования проводятся для четкого определения параметров (например, дозы, режима дозирования, частоты введения, времени взятия образцов и др.) опорных исследований. Пилотными являются, например, работы с целью определения подходящих видов животных для последующих доКИ или же изучение диапазона токсических доз для выбранных животных.
Опорные исследования проводят, чтобы получить разрешение на КИ. Они уже отвечают на вопросы, заявленные в целях исследования, а их результаты включаются в регистрационное досье будущего препарата с целью обоснования проведения испытаний с участием добровольцев и регистрации средства.
Итак, строго регламентируются и контролируются только опорные доКИ, так как это, главным образом, исследования безопасности, необходимые для максимального снижения рисков для людей в КИ — об этом мы расскажем в соответствующем разделе ниже.
Фармакологические и токсикологические исследования
По изучаемым параметрам традиционно выделяют фармакологические и токсикологические исследования. Они могут проводиться в рамках как пилотных, так и опорных доКИ. Однако большой объем фармакологических исследований выполняется еще до начала регуляторной разработки, т.е. на поисковом этапе.
Фармакологические испытания нужны, чтобы изучить, как именно вещество будет воздействовать на человека или патогенные микроорганизмы и что происходит с целевым веществом после того, как оно попадет в организм. С другой стороны, токсикологические исследования подразумевают намеренное использование высоких доз исследуемого кандидата, заведомо превышающих предполагаемую терапевтическую дозу, для определения диапазонов его токсичности и ее конкретных проявлений (табл. 2).
В группе фармакологических исследований выделяют фармакодинамические и фармакокинетические исследования.
Фармакодинамика раздел фармакологии, изучающий локализацию, механизм действия и фармакологические эффекты лекарственных средств, силу и длительность их действия. Иными словами, фармакодинамика отвечает на вопрос: «Как лекарство влияет на организм?» Фармакокинетика раздел фармакологии, изучающий кинетические закономерности химических и биологических процессов, происходящих с ЛС в организме (абсорбция, биораспределение, метаболизм, выведение). Таким образом, фармакокинетика отвечает на вопрос: «Как организм влияет на лекарство?»
Токсикологию, в свою очередь, делят на исследования общих, специфических видов токсичности, токсикокинетику, а также исследования экологической безопасности.
Фармакологические исследования: фармакодинамика и фармакокинетика
Разберемся чуть подробнее, из чего состоят фармакологические исследования.
Первая задача фармакодинамики — определить, является ли новое вещество эффективным. Для этого ученые в рамках тестов для оценки первичной фармакодинамики изучают, как препарат влияет на системы организма, на лечение которых он направлен.
Фармакологическая безопасность и токсикология — самая важная часть регуляторных доКИ: все эти испытания входят в так называемые доклинические исследования безопасности и нужны для того, чтобы снизить риски побочных эффектов от лекарств для будущих пациентов (в таблице 2 они выделены синим цветом). Если вещество впоследствии окажется просто неэффективным, это полбеды: тогда компания-разработчик просто не получит прибыль. А вот если оно окажется вредным для здоровья, расплачиваться будут люди — участники будущих исследований. Стремясь исключить возможность таких неприятных сюрпризов, ученые еще на стадии доКИ тщательно ищут и выявляют все нежелательные фармакодинамические свойства испытуемых веществ, анализируют эффекты, выявленные в токсикологических исследованиях (о них мы говорим ниже), и изучают, как и почему они проявляются. Если препарат подозревают в воздействии на какой-то определенный орган (сердце, мочеполовую или нервную системы), его работу изучают более подробно, проводя дополнительные тесты, если это требуется.
Во время исследования фармакодинамических взаимодействий определяют, как разные вещества влияют на работу друг друга: например, лекарство для лечения диабета может существенно изменять свойства противоопухолевого препарата.
А что насчет фармакокинетических исследований? Здесь ученые отслеживают судьбу действующего вещества с момента попадания его в организм и до полного выведения вещества и его метаболитов из организма. Для этого требуется определить биодоступность и способность препарата усваиваться (т.е. попадать в организм, например, после приема внутрь или нанесения на кожу); изучить его распределение в организме (в том числе узнать, достигает ли вещество молекулы-мишени или органов, на которые оно может оказывать токсический эффект); увидеть, как оно трансформируется и выводится. Фармакокинетические тесты делятся на исследования абсорбции, распределения, метаболизма, выведения и фармакокинетических лекарственных взаимодействий (табл. 2). Первые четыре параметра часто сокращают до аббревиатуры ADME (absorption, distribution, metabolism, and excretion). Роль фармакокинетики крайне велика, поскольку большинство испытуемых веществ обычно плохо всасываются или плохо распределяются по организму. Если планировать и проводить такие исследования грамотно, то можно отсечь значительное количество молекул-кандидатов уже на этом этапе, что позволит расходовать больше ресурсов на работу с действительно перспективными веществами.
Во время фармакологических испытаний животным вводят разные дозы препарата, а затем с определенными интервалами берут кровь, мочу и другие биологические жидкости, чтобы определить концентрацию в них лекарства и его метаболитов. Кроме того, нередко проводят исследования с лекарствами, мечеными радиоактивным изотопом. Для этого к исследуемому веществу добавляют радиоактивную метку и далее отслеживают его накопление в тех или иных органах и системах организма. Это позволяет — с помощью радиографического анализа — наглядно отследить, как быстро и сколько вещества попадает в организм, а также как оно распределяется по организму, в том числе количественно охарактеризовать преимущественное накопление в определенных органах и последующее выведение из них. Полученные данные дают возможность, среди прочего, спрогнозировать, каким способом стоит вводить препарат людям в КИ и через сколько времени он будет выводиться из организма.
Общая и специфическая токсичности, токсикокинетика
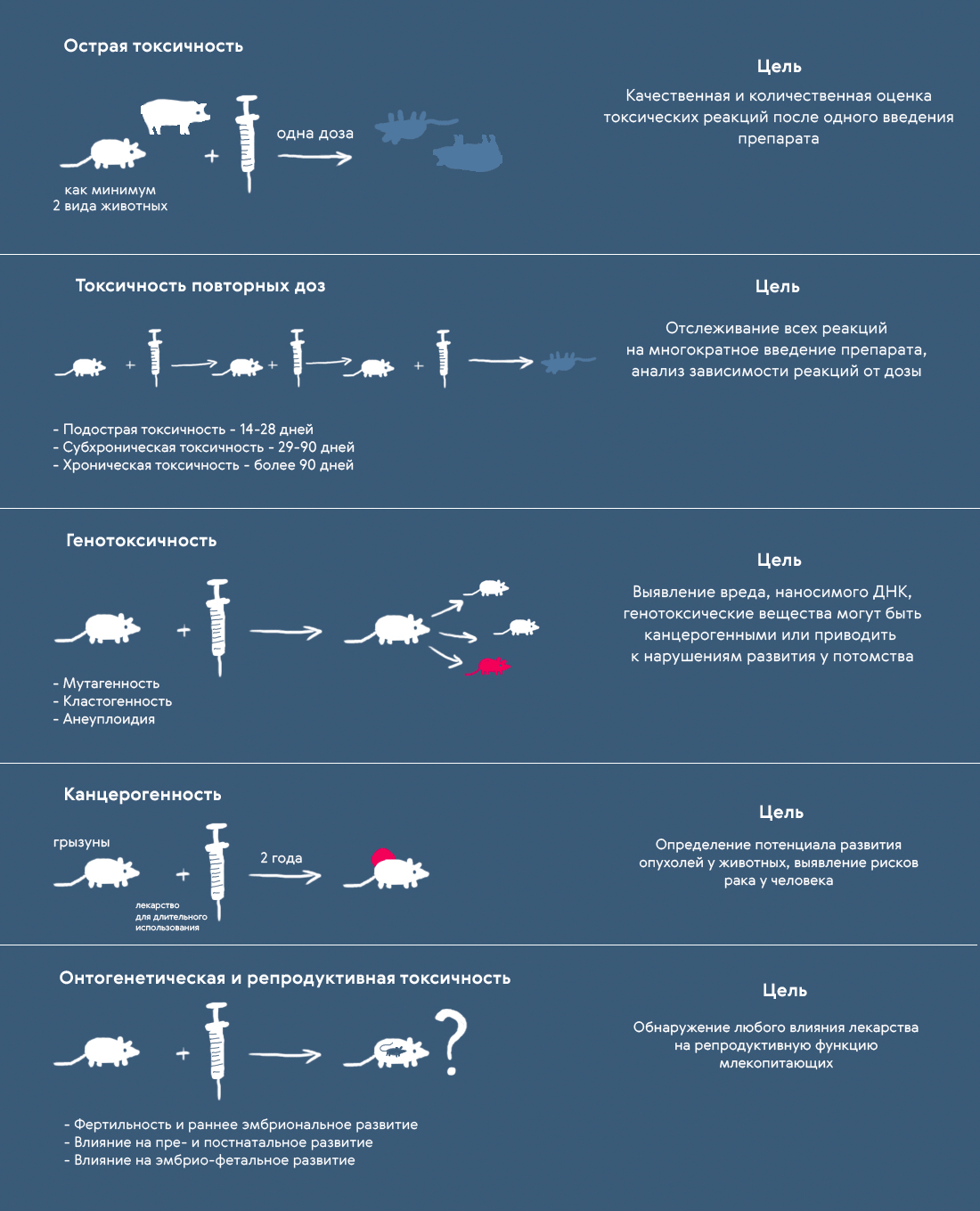
Классификация токсикологических исследований также представлена в таблице 2. Они делятся на исследования общих видов токсичности (то есть исследования, проводимые в отношении всех лекарственных препаратов) и исследования специфических видов токсичности. К общим видам токсичности относятся исследования общетоксических свойств, генотоксичности, канцерогенности, а также онтогенетической и репродуктивной токсичности (т.н. DART studies) (рис. 2).
Рисунок 2. Исследования общих видов токсичности
Общетоксические свойства: что это такое и как их исследуют?
До первой фазы КИ должен быть проведен определенный минимум исследований общетоксических свойств вещества-кандидата (они будут проводиться и дальше для обоснования более длительного применения).
Длительность исследований общетоксических свойств определяется планируемой продолжительностью применения препарата как в клинических исследованиях, так и после регистрации. Например, если лекарство планируется применять лишь однократно (диагностический контраст), то, как правило, достаточно исследования острой токсичности. Если применение будет ограничено 10–14 дням (как в случае многих антибиотиков), то обычно достаточно одномесячных исследований общетоксических свойств. Если лекарство будет применяться длительно, то исследование общетоксических свойств ограничивается шестью месяцами в случае грызунов и девятью месяцами в случае негрызунов (собак, минипигов, нечеловекообразных приматов), поскольку это позволяет охватить большую продолжительность их жизни, чтобы смочь наблюдать долгосрочную токсичность.
Различают два вида общетоксических тестов: определение острой токсичности и токсичности повторных доз. Задача исследователей — выявить любые негативные токсические реакции, вызванные введением вещества, и понять, как они соотносятся с вводимой дозой. Проводя их, ученые предварительно отсекают молекулы, токсичность которых заведомо неприемлема, а также выбирают диапазон токсических доз и решают, какие животные подходят для исследования. При этом неприемлемая токсичность — это компромиссная величина. Очевидно, что порог дозволенной токсичности средства от рака будет выше, чем лекарства от простуды.
Острую токсичность определяют как минимум на двух разных видах животных, более того, используют по крайней мере два способа введения токсических доз препарата: один из них тот, который предполагается использовать в будущих КИ, второй — парентеральный (инъекция). Если сведения об острой токсичности также можно получить, используя результаты других тестов, отдельные испытания не проводят.
Для исследования токсичности повторных доз животному дают препарат с интервалами в течение определенного времени (оно зависит от предполагаемого режима приема ЛС для людей) и отслеживают изменения в его организме и поведении. Внимательно следят за изменением метаболизма и продолжительности жизни, за биохимическими показателями и гистопатологией. Это помогает изучить токсическое воздействие вещества-кандидата на органы-мишени, накопительный эффект потенциального лекарства, отсроченные побочные эффекты (если предусмотрен период, когда вещество перестают вводить), а также их обратимость.
В качестве примера доКИ, которое можно делать параллельно с КИ на добровольцах вплоть до второй фазы, можно привести исследования генотоксичности, но и тут есть нюансы. Изучение способности вещества вызывать изменения в генетическом материале in vitro с использованием бактерий в качестве субъекта исследования (тест Эймса) должно быть завершено только до начала I фазы КИ. Генотоксичность in vivo, в свою очередь, изучают параллельно с исследованиями на здоровых добровольцах до начала II фазы. Некоторые исключения могут быть сделаны, если в разработке находится препарат для детей, исследования которого на взрослых не проводятся — тогда весь комплекс исследований генотоксичности на животных придется завершить до начала исследований с участием детей.
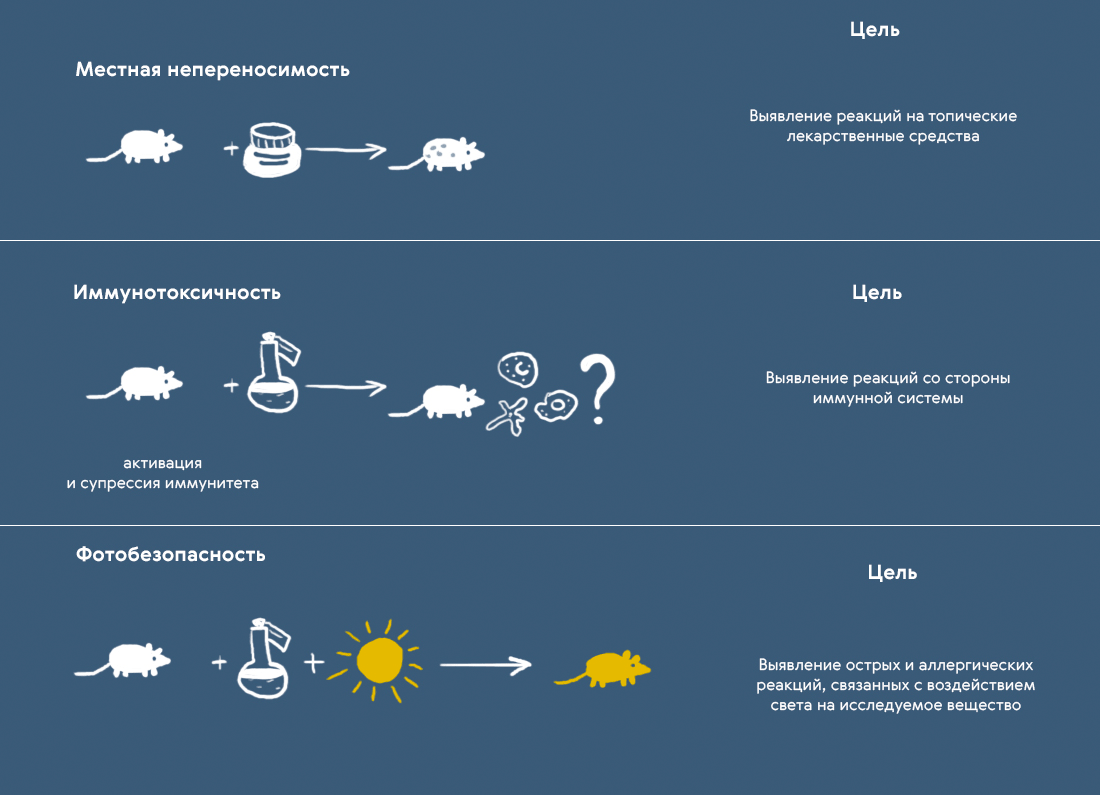
Любая специфическая токсичность исследуется только в том случае, когда это необходимо. Например, если результаты изучения общей токсичности показали, что препарат может вызывать нежелательные реакции со стороны кожи (или же предполагается его наружное нанесение), нужно дополнительно исследовать фототоксичность — способность вещества снижать устойчивость клеток кожи к неблагоприятному воздействию солнечных лучей (рис. 3).
Рисунок 3. Исследования некоторых специфических видов токсичности
Отдельно стоит упомянуть токсикокинетические тесты, в ходе которых ученые определяют системную концентрацию ЛС у животных, участвующих в доКИ безопасности, или, иными словами, проводят оценку фармакокинетики вещества во время токсикологического исследования. Токсикокинетика призвана бороться с риском перепутать отсутствие токсичности с банальным недостижением у животных токсической концентрации исследуемого вещества. Недостижение токсической концентрации может быть связано с использованием животных разного пола, с путем введения вещества, его недостаточной абсорбцией, выраженным метаболизмом, высокой иммуногенностью (в случае биопрепарата) и другими факторами. Кроме того, токсикокинетика помогает удостовериться в биодоступности вещества и дает возможность увидеть зависимость выраженности токсических эффектов от содержания вещества-кандидата в организме. Этот анализ необходим практически во всех случаях опорных токсикологических исследований in vivo, и только после его завершения исследователи могут говорить о дозах вещества, которые станут стартовыми в КИ.
Экологическая безопасность
Требования многих зарубежных стран предусматривают проведение испытаний с целью подтвердить безопасность не только для человека, но и для окружающей среды в целом. Это необходимо для оценки последствий попадания нового препарата в биосферу. В некоторых случаях вред может быть значительным и требовать особых мер по утилизации.
Регламент и контроль доклинических исследований
В соответствии с общемировыми требованиями опорные токсикологические исследования и опорные исследования фармакологической безопасности (они входят в доКИ безопасности и являются стандартным комплексом исследований для всех новых молекул, которые войдут в состав лекарств) должны проводиться в соответствии с GLP. Все остальные фармакологические исследования, а также пилотные токсикологические исследования, могут проводиться без соответствия GLP, однако также должны быть хорошо стандартизированы, чтобы давать валидные результаты. Но что такое GLP? Почему исследования безопасности подвергаются дополнительному контролю? Какие еще есть ограничения и регламенты?
Некоторые компании, заинтересованные в проведении эффективных биомедицинских исследований, на основе международных стандартов разрабатывают собственные методологии, которые, как правило, содержат более широкие перечни требований. Примером может служить подход OECD+, который для своих экспериментов in vitro и in vivo сформировала команда PMI Science. В его основе лежит совместное применение стандартных методов токсикологической оценки и методов системной токсикологии, созданных в компании.
Кроме того, каждая страна имеет национальные документы, так или иначе соответствующие международным принципам проведения доКИ. В России это, например, ГОСТ 33044-2014, ГОСТ 33647-2015 и ряд других (перечислены в вышеобозначенных государственных стандартах), соответствующие приказы Минздрава РФ и Федеральный закон «Об обращении лекарственных средств» от 12.04.2010 №61-ФЗ, а также Правила надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств. Однако многие российские и евразийские ГОСТы и правила являются переводом документов OECD различной степени полноты и качества.
К сожалению, система обеспечения соблюдения норм GLP в России/ЕАЭС не полностью соответствует международной, что означает необходимость иностранных GLP-инспекций или повторения соответствующих исследований за рубежом (в том числе с этим столкнулись разработчики вакцины «Спутник V»), либо дополнительные сложности в процессе признания результатов испытаний новых препаратов.
Принципы надлежащей лабораторной практики
Первую версию свода правил GLP разработала международная группа экспертов, созданная в 1978 году в рамках Специальной программы по контролю химических продуктов OECD, возглавляемой американскими учеными. После нескольких редакций в 1997 году появился итоговый текст действующих правил. Пакет документов и материалов OECD по GLP содержит сотни страниц. Он стандартизирует научные аспекты проведения соответствующих регуляторных доклинических исследований, а также гармонизирует административные механизмы принятия и признания зарубежных данных, в том числе описывает механизм взаимного признания разными странами данных об оценке химических веществ, содержит указания по организации мониторинга соответствия принципам GLP на национальном уровне, руководство для контpолиpующих органов по составлению отчетов о результатах инспектирования на соответствие принципам GLP и многое другое.
GLP в основном касается организации исследования и условий, необходимых для его планирования и выполнения, а также представления и хранения полученных результатов. Оговаривается административная структура испытательного центра, квалификация и обязанности работающих в исследовании специалистов, организация рабочих мест и порядок документирования исследований. Тест-системы, согласно GLP, подразделяются на физические, химические и биологические, которые могут представлять собой животных, а также растения, бактерии, изолированные органы, клетки/клеточные структуры. Корректный выбор и этичное использование тест-систем, обеспечение прозрачности документации эксперимента при наличии системы контроля качества исследования, соответствие биологической модели целям и задачам эксперимента составляют три основополагающих элемента, призванных обеспечить высокий уровень экспериментального исследования. Например, животные на момент испытания должны быть здоровы, а условия их содержания должны обеспечивать достоверность получаемых результатов.
В случае доКИ с животными GLP регламентирует следующее:
Требования GLP в основном касаются качества и целостности данных с фокусом на воспроизводимость и стандартизацию протоколов, но не связаны напрямую с научными аспектами или вопросами гуманности и этичности. Научные аспекты, т.е. дизайн, объем и сроки исследований, материалы и методы, способы анализа и интерпретации регламентируются принимающими ведомствами — организациями, использующими результаты доКИ, которые должны проводиться в соответствии с GLP, для принятия собственных решений, например о выдаче разрешения на клиническое исследование или регистрацию. Наиболее известными организациями, вырабатывающими научные требования к проведению доКИ, являются:
Эти организации составили множество руководств по доклиническим исследованиям, доступных на русском языке на портале PharmAdvisor. А об этичности исследований на животных мы поговорим чуть позже.
Сфера доКИ в России — взгляд изнутри
Об уровне развития отрасли рассказывает Равиль Ниязов, кандидат медицинских наук, специалист по разработке и регулированию лекарств в Центре научного консультирования:
— Можно сказать, что в России доклинические исследования лекарств, как и доклинические исследования в целом находятся в упадке. Лучше всего это иллюстрирует тот факт, что отечественные фармацевтические разработчики, претендующие на вывод своих продуктов не только на внутренний рынок, но и за рубеж, нередко обращаются к иностранным исследователям для выполнения доклинического этапа разработки: там не только шире спектр предлагаемых доклинических моделей, но и гарантия соответствия исследований общепринятым требованиям как с научно-методической, так и оформительско-процессуальной точек зрения.
Существующие проблемы многогранны, однако в их основе лежит несоответствие образования исследователей современным требованиям в этой области. К примеру, многие исследователи имеют медицинское или фармацевтическое образование, тогда как за рубежом специалисты, работающие с животными (в особенности токсикологические патологи), — это в первую очередь ветеринары. Однако следует отметить, что отечественное ветеринарное образование сильно отстает от современных реалий и требует существенной модернизации.
Следующим важным аспектом является слабость регулятора: эксперты в области доклинических исследований, проверяющие регистрационное досье, недостаточно квалифицированы в этой области и предъявляют очень мягкие требования к объему и качеству исследований, формату предоставляемых данных и соответствию GLP. Именно низкий уровень требований не позволяет сектору доклинических исследований развиваться, поскольку регулятором принимаются почти любые данные (это один из факторов отсталости отечественной фармацевтической отрасли). К примеру, отечественные исследователи широко используют и ссылаются на сборник «Руководство по проведению доклинических исследований лекарственных средств», однако в этой публикации приводятся неправильные, недостаточные и не соответствующие международным стандартам подходы и методы, которые приводят лишь к нерациональным тратам ресурсов и необоснованному истреблению лабораторных животных, без какой-либо научной пользы для общества.
Наконец, требованиям GLP у нас соответствуют буквально несколько испытательных центров, да и они проводят лишь относительно узкий спектр исследований. Исследования репродуктивной и онтогенетической токсичности, канцерогенности, генотоксичности, фотобезопасности, иммунотоксичности и т.д., соответствующие требованиям OECD и стандартам ICH, в нашей стране практически не проводятся, равно как и фармакодинамические и сложные фармакокинетические исследования (например, на изолированных рецепторах или с использованием радиоактивных меток).
Как выбирают животных для доклинических исследований?
Итак, мы уже обмолвились, что наиболее значимую роль в доклинических исследованиях играет работа с лабораторными животными. Теперь пришло время обсудить, на какие факторы ученые опираются при выборе животных моделей для исследования новых лекарств.
Для понимания, что данные, полученные в ходе исследований на животных, далеко не всегда отражают, как вещество будет работать в человеческом организме, не нужно получать специального образования. Достаточно взглянуть на такие распространенные животные модели, как крыса и кролик. Между нами и этими пушистыми созданиями много сходств, но много и различий. И тем не менее эти виды млекопитающих помогают науке год за годом, «беря на себя» все риски, связанные с воздействием неизученных молекул, создаваемых людьми. Как же решить, какое животное лучше подойдет для конкретного исследования? Здесь нужно учитывать множество факторов, начиная с природы тестируемого вещества и предполагаемого механизма его действия и заканчивая поиском баланса между этичностью работы и нуждами исследователей.
Идеальная модель — это крыса?
Среди главных факторов, на которые приходится оглядываться, выбирая субъект исследования для доКИ, можно выделить его биологическое соответствие (релевантность), этичность работы с ним и возможность создавать модели для изучения определенных видов заболеваний.
В процессе доКИ важно как можно больше узнать о том, как новое вещество будет взаимодействовать с телом человека, и оценить потенциальные риски, связанные с приемом препарата людьми. Иными словами, выбранная животная модель должна давать возможность предсказать, как препарат поведет себя в КИ. Это значит, что ее фармакодинамические и фармакокинетические профили должны быть максимально приближены к человеческим. Вот почему исследования фармакологии и токсикологии лекарств проводятся исключительно на млекопитающих, а вот исследования экологической безопасности, если они требуются, могут включать работу с другими представителями хордовых и даже беспозвоночных.
В статье «Модельные организмы: грызуны» [3] мы рассказали о множестве заслуг наших маленьких собратьев перед человечеством. Читатель также благоволит ознакомиться с материалом «Грызун особого назначения» [4].
Рисунок 4. Памятник лабораторной мыши в новосибирском Академгородке. Памятник установлен в сквере около Института цитологии и генетики Сибирского отделения РАН в 2013 году.
Грызуны удобны с точки зрения размножения и обращения с ними в процессе экспериментов. Эти животные достаточно мелкие, что позволяет использовать больше особей на единицу затрат: например, им не нужно вводить очень много препарата. Кроме того, их легко транспортировать.
Еще один плюс грызунов — относительная простота выведения специальных линий животных с определенным генетическим статусом, например мышей с «поломанными» генами, на которых удобно изучать какую-то конкретную болезнь. Существует множество линий трансгенных мышей для имитации разных болезней человека: гемофилий, болезни Гентингтона, ожирения, артериальной гипертензии. Так, мыши ApoE−/−, склонные к атеросклерозу из-за дефицита у них аполипопротеина E, активно используются учеными в ходе исследования сердечно-сосудистых и респираторных заболеваний (в том числе в ходе изучения влияния на организм сигаретного дыма), а FUS-TG F19-трансгенные мыши служат для изучения нейродегенеративных расстройств.
Несомненно, мыши и крысы хороши. Но современные требования к разработке лекарств требуют проводить исследования как на грызунах, так и на других млекопитающих. Почему? Давайте разбираться.
Два вида млекопитающих вместо одного для оценки токсичности
Несмотря на то, что в научном сообществе существует тренд сокращения количества используемых в экспериментах животных, официальные нормы часто требуют от исследователей тестирования новых веществ с привлечением двух видов млекопитающих, один из которых — негрызуны. Например, так обстоят дела при изучении общетоксических свойств новых молекул.
Дело в том, что грызуны не всегда позволяют получить полноценную картину того, как препарат будет действовать на человека. Работая с ними, ученые сталкиваются с выявлением как ложноположительной, так и ложноотрицательной токсичности. Конечно, привлечение дополнительных моделей не гарантирует 100% попадания, тем не менее комбинация из двух моделей (грызун + негрызун) лучше, чем одна. Она всё еще позволяет экономно расходовать ресурс и при этом статистически имеет больше шансов выявить потенциально негативное воздействие препарата на людей.
Одна неверная модель и тысячи загубленных жизней
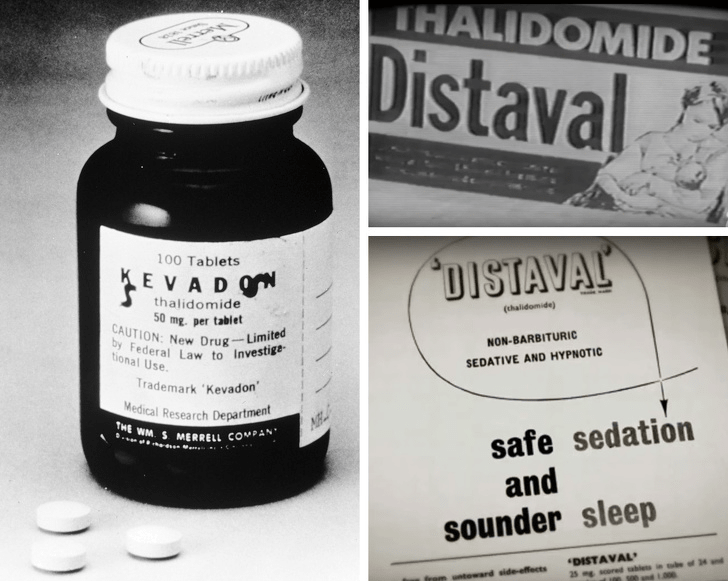
В истории существуют примеры, когда выбор нерелевантного вида животных для проведения доКИ приводил к печальным последствиям. Самый известный из них — это талидомид, впервые выпущенный на немецкий рынок в 1957 году компанией Chemie Grünenthal как безопасное успокаивающее и снотворное средство, отлично подходящее для беременных и кормящих матерей. До того, как препарат был одобрен для продажи, он прошел испытания на мышах и крысах, на которых не было обнаружено репродуктивной и онтогенетической токсичности [5]. Потомство грызунов никак не страдало от препарата, и эти данные оказались роковыми: у людей препарат имел и репродуктивную, и онтогенетическую токсичность. В результате его использования в период с 1956 по 1962 годы в Германии, Великобритании, Канаде и ряде других стран на свет родились тысячи детей с врожденными физическими дефектами, такими как отсутствие ушей и конечностей (рис. 5). Впоследствии препарат был отозван, а затем одобрен вновь, но уже в качестве средства против проказы (с актуальным перечнем показаний к использованию лекарства можно ознакомиться здесь). ВОЗ, тем не менее, высказывается против его использования ввиду сильных негативных эффектов [6].
Рисунок 5а. Талидомид и его реклама. В Канаде препарат выпускался под торговыми марками Kevadon/Distaval и позиционировался как средство против токсикоза беременных.
Рисунок 5б. Мальчик, родившийся с дефектами развития в результате приема его матерью талидомида на ранних сроках беременности.
В качестве «негрызунов» часто используют собак. Однако иногда для работы могут не подойти ни крысы, ни собаки. Это может быть связано, например, с отсутствием у них в организме мишеней, на которые должно воздействовать исследуемое вещество, чтобы проявить свою терапевтическую активность. Такое нередко случается с изучением крупных молекул.
Исследования молекул больших и маленьких
Малые молекулы относятся к первому поколению лекарств и составляют порядка 90% всех лекарственных препаратов на рынке, включая многие безрецептурные препараты. Это низкомолекулярные вещества, которые быстро всасываются в кровоток и оказывают широкий спектр воздействий на организм, как положительных (запланированных), так и отрицательных. В ходе доКИ таких препаратов важно отслеживать зависимость доза—ответ для запланированных и незапланированных, нежелательных эффектов. Здесь прекрасно подходит двухвидовая модель, которая повышает вероятность выявления потенциальной токсичности вещества для человека.
Подробнее о том, как развивалась фармацевтическая отрасль, и какими бывают лекарства, читайте в статье «Три поколения лекарств» [7] на нашем сайте.
О том, какое место макаки и другие обезьяны занимают в современной науке, читайте в статье «Модельные организмы: приматы» [8].
Подробности о данном классе биофармацевтических средств мы сообщили ранее в материале «Терапевтические моноклональные антитела» [10].
Сколько животных нужно для предварительных и опорных доКИ
Предварительные исследования могут включать в себя определение различных параметров, но выборка и количество экспериментов на этом этапе обычно маленькие, потому что цель этих исследований — определить, стоит ли включать вещество в регуляторные доКИ, достаточно ли оно перспективно, и если да, то на каких видах животных целесообразно проводить эксперименты. Вследствие этого опорные тесты могут повторять уже проведенные предварительные исследования, но на большем количестве животных и более подробно. Для проведения одного исследования общетоксических свойств может понадобиться минимум 30 крыс (по пять грызунов каждого пола для каждой дозировки и контрольная группа) и несколько более крупных животных, например, собак [11]. Тогда как для выполнения полной батареи тестов исследований репродуктивной и онтогенетической токсичности на крысах в трех поколениях, в соответствии с действующими стандартами, потребуется участие около 3000 особей.
Имеет ли значение, насколько разными будут животные внутри группы? Спойлер: да!
Как получают и разводят лабораторных животных для исследований
Перед тем как решить, использовать ли однородных или разнородных животных, ученые взвешивают все плюсы и минусы каждого подхода. Если животные внутри группы похожи друг на друга, результаты экспериментов будут более согласованными, их вариабельность будет меньше. Но в то же время эти результаты нельзя будет распространять на другие группы. В целом для регуляторных исследований выбирают более разнородные группы животных — иногда это даже обязательное требование [12].
По степени однородности линии лабораторных животных делят на [13]:
Ранее мы также упоминали создание специальных трансгенных и нокаутных линий животных с измененным геномом. В ДНК первых ученые встраивают чужеродные гены, а у вторых искусственно выключают нужные участки ДНК-цепи.
«Качество» животных внутри линий тщательно контролируется, при этом ученые смотрят на определенные генетические маркеры, по которым можно понять, к какой линии относится та или иная особь [14]. Все животные, которые оказываются «испорченными» в результате случайных скрещиваний, уничтожаются. Чтобы отличить животных разных групп, можно использовать также тесты тканевой совместимости [15].
Выбор животного: каждый раз сначала
Выбрать животных для доКИ не так просто, как кажется на первый взгляд. Нередко исследователи новых лекарств раз за разом оказываются в сложной ситуации, когда имеющихся данных не хватает для того, чтобы качественно спланировать эксперимент. Всё же часто ученым помогает опыт их коллег (табл. 3) — чем больше экспериментов проводится, тем больше знаний накапливается, а это значит, что с каждым годом совершается всё меньше ошибок.
| Животные | Заболевания, на лечение которых чаще всего направлены исследуемые в этой модели препараты |
|---|---|
| Рыбки данио рерио | Врожденные дефекты, генетические заболевания |
| Крысы | Острый панкреатит, геморрагический шок, регенерация печени, диабет, артериальный тромбоз, болезни Паркинсона и Альцгеймера |
| Кролики | Переломы костей, геморрагический шок, синдром раздраженного кишечника, остеопороз, гипертиреоз |
| Минипиги | Гиперхолестеринемия |
| Кошки | Кардиомиопатия, дистрофия роговицы, ВИЧ-1 |
| Собаки | Острый панкреатит, сепсис, сосудистое протезирование, стеноз аорты |
| Свиньи | Сепсис, сосудистое протезирование, геморрагический шок, регенерация печени |
| Бабуины | Инфаркт миокарда, гипертиреоз, ишемическая болезнь почек |
| Овцы | Сосудистое протезирование, переломы костей, эпилепсия, повреждения хрящей |
Этичность исследований на животных
Использование животных в доклинических исследованиях и научных разработках — сложный этический вопрос. Польза для человека имеет свою цену: страдания и гибель сотен тысяч животных.
Животные в исследованиях косметики и в обучении
Первые испытания на безопасность были весьма жестокими. Примером может служить предложенный американским ученым Джоном Дрейзом метод тестирования раздражающей способности веществ: подопытным животным, чаще кроликам, наносили вещество на глаз и под веко, что активно применялось в тестировании воздействия лекарств и косметики на глаза и кожу. Однако к началу XXI века начала набирать популярность концепция уменьшения страдания животных. Тест Дрейза модифицировали так, чтобы уменьшить количество вещества и площадь нанесения: теперь препарат наносят только на роговицу. Конечно, подобного рода улучшения не решают проблему полностью. В апреле 2021 года вышел и сразу же стал вирусным короткометражный мультфильм о кролике Ральфе, который потерял семью из-за лабораторных исследований, а сам ослеп и оглох. Создатели ролика обращают внимание на проблему негуманного отношения к животным при производстве косметики. Кстати, есть страны (некоторые участники Евросоюза, Колумбия, Индия, Израиль), в которых уже существуют запреты, хотя бы частичные, на тестирование косметической продукции на животных.
Рисунок 6. Скриншот из фильма «Спасите Ральфа», выпущенного Международным подразделением Общества защиты животных США (HSI). Ральф — работник косметической индустрии, где он служит животной моделью.
Животных часто используют не только в доклинических исследованиях новых препаратов или исследованиях косметики, но и для обучения специалистов: препарирования и ветеринарных манипуляций. В некоторых странах, например в Нидерландах, студент может сам выбрать, будет ли он проводить опыты над животными, или нет. В США большинство медицинских вузов отказались от опытов над животными в учебных целях и используют тренажеры и специальные манекены. В некоторых случаях возможны практикумы с участием добровольцев.
Несмотря на то, что исследования новых препаратов (их безопасности, эффективности и механизмов действия) на животных можно считать наиболее обоснованными из всего многообразия тестов, это не повод не пытаться сделать так, чтобы в результате пострадало как можно меньше живых существ. Сейчас активно разрабатываются альтернативные модели для изучения раздражающего действия или потенциальной эффективности препаратов [16], а также создаются многочисленные регуляторные документы для гуманизации доКИ.
Попыткой найти баланс между этикой и научным знанием при работе с животными является стратегия 3Rs — reduction, refinement and replacement of laboratory use of animals: уменьшение, усовершенствование и замена использования животных в лабораториях. Существует несколько подходов, которые в равной мере соответствуют принципам 3Rs.
Какие организации отвечают за этичность исследований с животными? Единого международного регулятора, к сожалению, пока нет. Но как правило в каждой научно-исследовательской организации, работающей с животными, присутствует биоэтическая комиссия. Также каждая страна имеет свое законодательство в области биоэтики и организации, следящие за его выполнением. В США это Institutional Animal Care and Use Committees (IACUCs). В странах ЕС существуют аналогичные локальные организации, но на уровне всего Евросоюза часть вопросов регламентируется EMA и входящими в ее состав комиссиями, а основные принципы соответствия подходу 3Rs при работе с животными прописаны в Европейской Фармакопее и Директиве 2010/63/EU. В 2014 году в России была основана Ассоциация специалистов по работе с лабораторными животными Rus-LASA, которая стала членом Федерации европейских ассоциаций по науке о лабораторных животных (FELASA) и Международного совета по науке о лабораторных животных (ICLAS).
Задача этих организаций — обеспечение правовых и этических норм по содержанию лабораторных животных, контроль за экспериментами, процедурами и состоянием помещений (в соответствии с требованиями санитарно-эпидемиологического и ветеринарного законодательства), а также рассмотрение предложений, жалоб и заявлений, касающихся содержания и использования лабораторных животных в научных и учебных целях.
К сожалению, наличие комитетов и ассоциаций не гарантирует стопроцентную этичность доКИ. Например, конвенция Совета Европы и Директива Евросоюза 210/63/EU устанавливают определенные этические принципы в отношении вреда, причиняемого охраняемым животным в исследованиях. Они затрагивают шаги, которые следует предпринимать для уменьшения боли, стресса и других страданий животных, включая применение принципа 3Rs; профессиональную подготовку персонала и качество вивариев; качество дизайна эксперимента. Но эти документы только в общих словах ограничивают цели, для которых могут быть использованы животные, и не содержат специфичных требований к биоэтической экспертизе. Этическую экспертизу, как было отмечено выше, обычно проводят локальные комиссии по биоэтике, и их требования разнятся в зависимости от страны и института или компании. Самым сложным вопросом является оценка соотношения «риск—польза»: точно ли такое исследование нужно проводить на животных?
Биоэтические комиссии оценивают не только планируемые доКИ, но и фундаментальные исследования на животных в научных центрах. Ученые в норме не могут и не должны претендовать на финансовую поддержку или начинать работу без одобрения комиссией по биоэтике специальной заявки на исследования с животными. К сожалению, несмотря на некоторые успехи, говорить о существовании развитого правового поля в сфере доКИ на животных в России пока рано. Основная роль отечественных комитетов по биоэтике остается формальной и сводится к почти автоматической выдаче научным коллективам документов, необходимых для продолжения исследований, без реального анализа планируемых экспериментов, их целесообразности и организации.
Биоэтические комиссии в России
О работе биоэтических комиссий в России рассказывает Владимир Сергеевич Попов, кандидат биологических наук, заведующий лабораторией трансляционной медицины МГУ, эксперт в области биоэтических комиссий и использования животных в исследованиях и автор статьи «Модельные организмы: грызуны» [3]:
— В России существует несколько уровней этических комитетов, которые опираются на Федеральный закон №61-ФЗ («Об обращении лекарственных средств»). Однако все они работают с клиническими исследованиями и не занимаются экспертизой исследований на животных.
Отчасти такую экспертизу проводят локальные независимые этические комитеты, но они действуют в режиме нормативного «вакуума» — у них нет ни иерархии, ни регулирующего органа, ни законов. Все решается на уровне учреждения и держится на добросовестности сотрудников. Надо понимать, что сотрудники учреждения зачастую не могут беспристрастно оценивать исследования, проводимые в их учреждении. Их основная задача в организации — написать бумагу о биоэтичности эксперимента для публикации, потому что зарубежные журналы не принимают рукописи без такой экспертизы.
Будущее отрасли: кто, если не мышь?
Перед тем, как проводить доКИ на животных, вещества исследуют in vitro, то есть вне организма — как правило, сначала на изолированных рецепторах, а потом на клеточных культурах, которые могут быть как человеческими, так и животными. Это позволяет оценить связывание веществ с молекулами-мишенями на клетках и токсичность в простых условиях. Более того, на начальных этапах новые молекулы-кандидаты можно исследовать вообще вне живого, используя физические и химические тесты (например, для определения растворимости и липофильности) или специальные компьютерные программы. Последний подход называется in silico и служит для оценки потенциальной эффективности и токсичности веществ.
Для многих парадоксальной может показаться идея, что свойства реальных молекул реально исследовать в электронных «мозгах» компьютеров. Как это делается, предлагаем прочесть в статье «Биомолекулы»: «12 методов в картинках: “сухая” биология» [17].
Но можно ли совсем отказаться от животных, перейдя к исследованиям in vitro и in silico? К сожалению, пока нет. В случае оригинальных разработок получить разрешения регуляторов [18] и перейти к исследованиям с участием добровольцев без испытаний на лабораторных животных (in vivo) пока что практически невозможно. Животные не потребуются только в ряде случаев и лишь для некоторых тестов, например, если препарат был получен из плазмы крови или на основе клеток человека [19], а также если речь идет о дженериках или биоаналогах уже существующих средств, поскольку их действующие вещества уже были изучены ранее.
Большинство людей согласятся, что существующее положение вещей оправданно. Мы уже обсуждали, как важно выбрать правильную модель в доКИ, чтобы КИ были безопасными. Тем не менее тренд, предполагающий переход к более этичным методам исследования, продолжает набирать обороты, и альтернативные подходы к изучению свойств новых препаратов становятся всё более эффективными и просто реализуемыми. В следующих статьях спецпроекта мы еще коснемся новейших методик подробно, здесь же остановимся на них кратко.
In vitro: клетки в пробирке
In vitro-скрининг, где в качестве субъекта исследования выступает клеточная культура, выращенная в лаборатории, дает первичную информацию о возможных эффектах препарата на биологическую систему. Самый главный плюс такого испытания — возможность избежать трудностей, неразрывно связанных с использованием такой сложной системы, как живой организм.
Наиболее часто используемая модель in vitro — это монослой иммортализованной, или бессмертной, клеточной культуры (2D-культура). На нем удается получать воспроизводимые результаты, так как клетки в культуре унифицированы и способны делиться без ограничения и изменения своих свойств. Благодаря этому данные, полученные таким способом в разное время и даже в разных лабораториях, можно довольно легко сравнивать между собой. Однако они могут мало говорить о том, как препарат поведет себя в реальных клетках и тем более в организме животного или человека. Для получения более точной информации можно пользоваться первичными культурами клеток человека, т.е. взятых у здорового донора или пациента, однако с такими клетками сложнее работать.
В статье «Модельные организмы: бонус — раковые клетки» [22] можно подробнее узнать, для чего и как они используются в научных целях. А в публикации «12 методов в картинках: клеточные технологии» [23] рассказывается, как именно исследователи работают с клетками.
Рисунок 7. Иммортализованная клеточная культура Caco-2, образующая микроворсинки и плотные контакты. Клетки выделены из аденокарциномы толстой кишки человека.
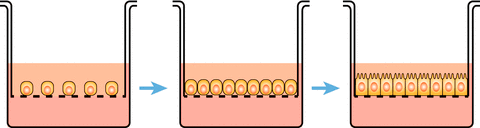
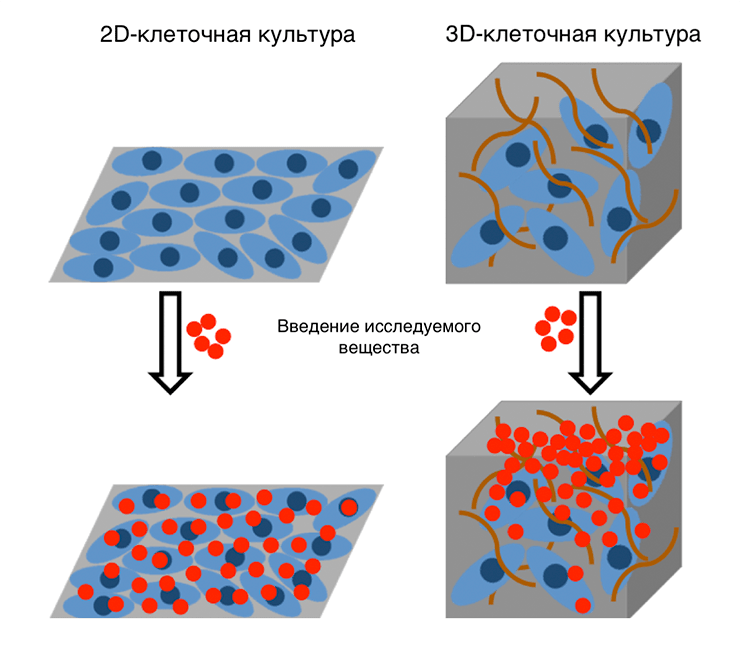
Еще более приближенную к реальности картину дают трехмерные, или 3D-клеточные модели (рис. 8). Они лучше воспроизводят условия жизни клеток в организме — у них есть микроокружение из клеток-соседей и межклеточного матрикса. Это позволяет моделировать взаимодействие клеток разных типов, что важно, так как клетки в естественной среде обитания постоянно «переговариваются» между собой с помощью специальных сигнальных веществ, что невозможно в 2D-культуре.
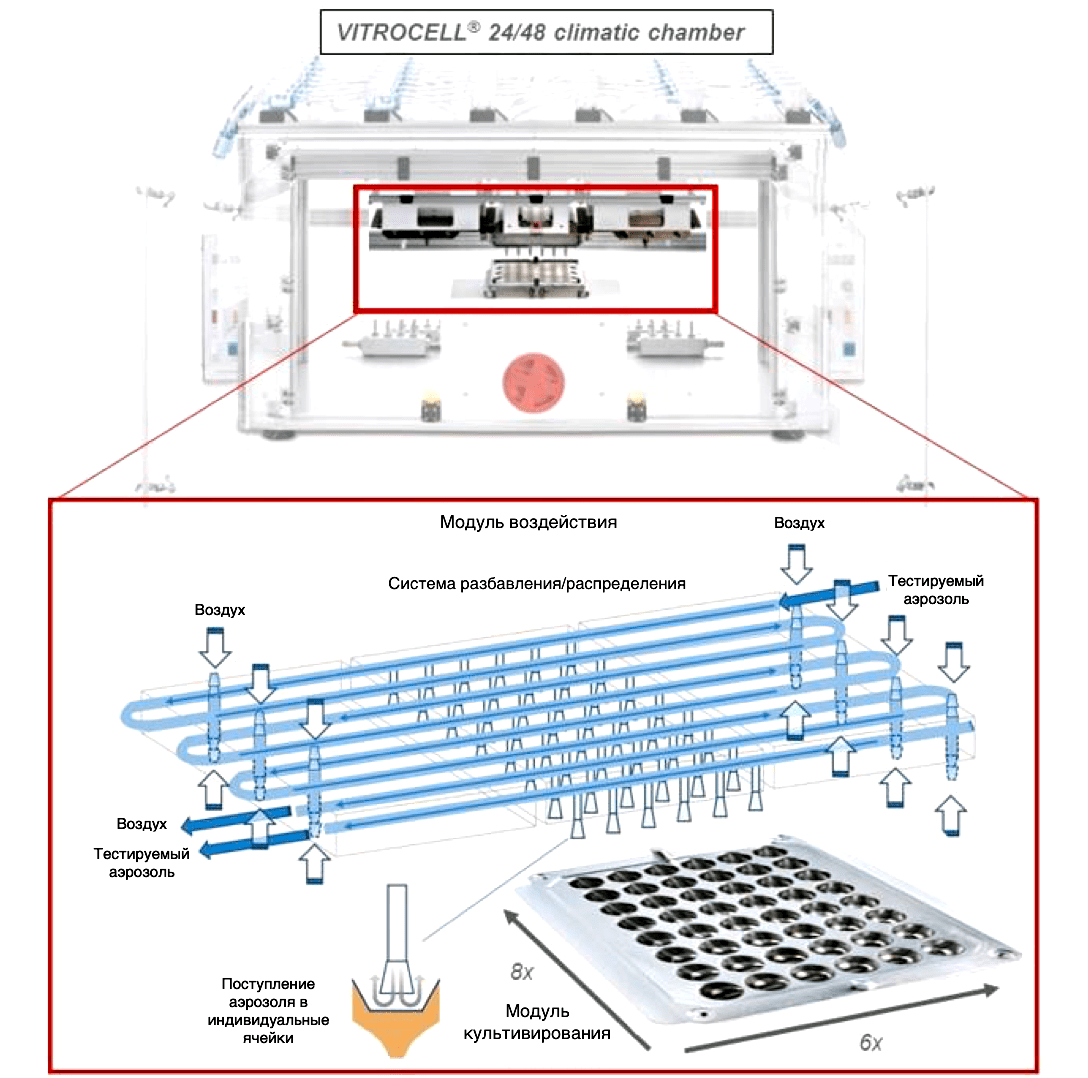
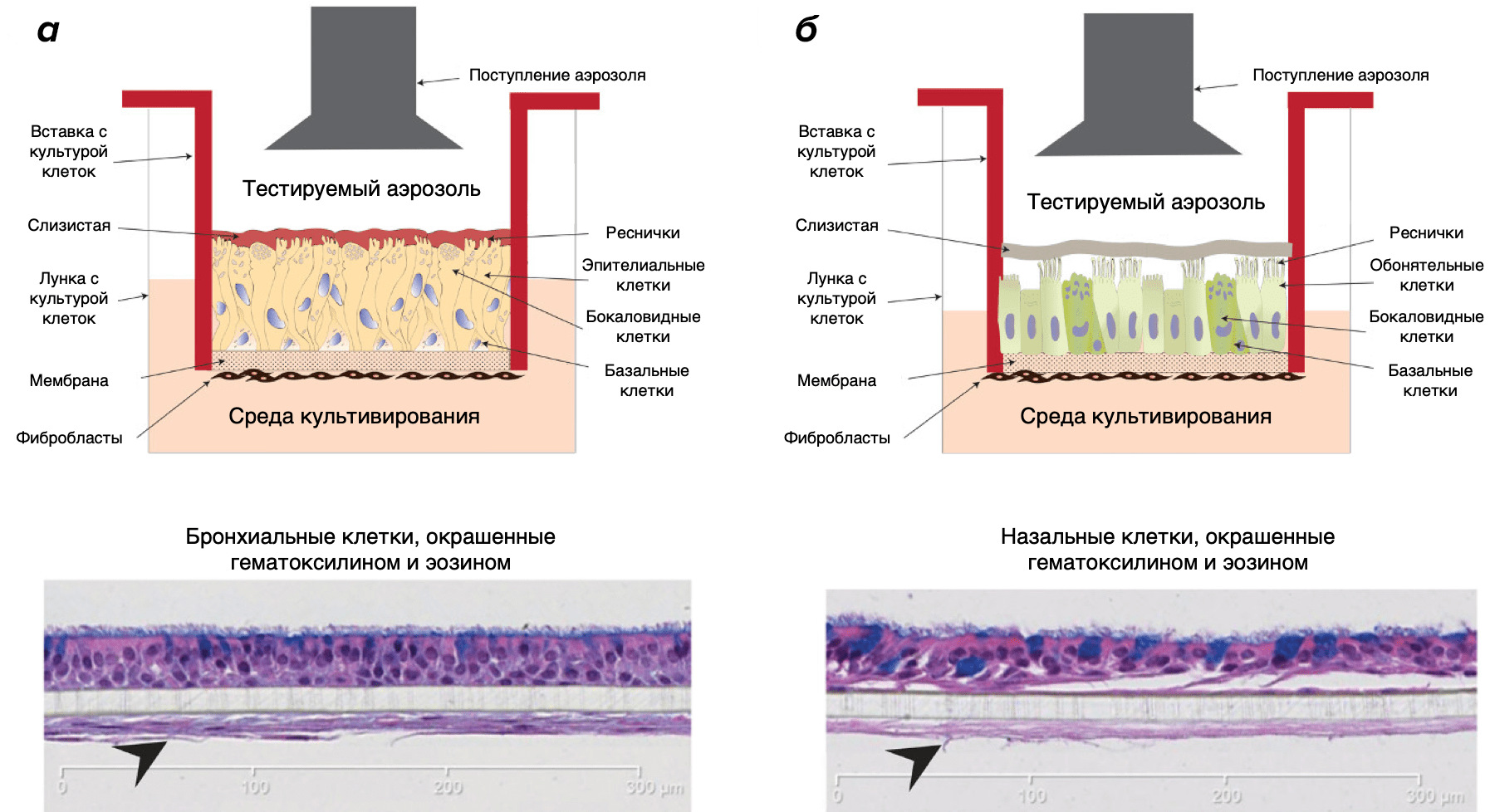
Рисунок 8а. In vitro 3D-клеточная модель, позволяющая оценить воздействие аэрозолей, содержащих никотин, на эпителиальные клетки человека. Подробнее об устройстве модели можно узнать из видео. Экспериментальный дизайн экспонирования человеческих органотипических культур клеток в системе воздействия аэрозолей in vitro (Vitrocell® 24/48).
Рисунок 8б. In vitro 3D-клеточная модель, позволяющая оценить воздействие аэрозолей, содержащих никотин, на эпителиальные клетки человека. Бронхиальные (а) и назальные (б) культуры клеток на границе воздух—жидкость в индивидуальных ячейках, к которым подводится тестируемый аэрозоль. Модели in vitro, содержащие ресничные клетки, показаны в апикальном слое окрашенных гематоксилином и эозином клеток. Модели претерпели совместное культивирование с фибробластами, необходимыми для роста и дифференциации эпителиальных клеток (показаны стрелочками).
Также 3D-модель обеспечивает наличие градиента концентрации вводимого вещества, то есть клетки снаружи получают больше лекарства, чем внутри культуры, как это и происходит внутри живого организма, особенно в твердых опухолях (рис. 9). Здесь виден эффект барьерных клеток, ведь в организме есть эпителиальная ткань, которая может значительно влиять на взаимодействие исследуемого вещества с клетками-мишенями. Благодаря всем этим факторам 3D-модель гораздо более информативна, чем 2D.
Рисунок 9. Распределение исследуемого вещества в 2D- и 3D-клеточных культурах. 3D-культура позволяет получить градиент распределения.
Конечно, у 3D-версии есть и минусы. Она более дорога, сложна и объемна, чем стандартный монослой клеток. Чтобы поддерживать такую культуру, нужно отдельно следить за распределением в ней питательных веществ и кислорода. Из-за сложности ее непросто адаптировать к высокопроизводительному скринингу, то есть процесс тестирования становится дороже, хотя компании активно работают над решением этого вопроса. Наконец, монослой — привычная для многих модель, которая хорошо описана в литературе, поэтому многие используют его по привычке.
Еще более продвинутой моделью являются «органы на чипе» (organs-on-a-chip), им будет посвящена отдельная статья спецпроекта. Здесь скажем лишь, что это устройство для выращивания клеточных культур, которое воспроизводит механические и физиологические условия в органах (рис. 10) или даже системах органов.
Рисунок 10. Трехмерная система «Кишечник на чипе», созданная совместно учеными Mimetas и PMI Science и предназначенная для исследования воспалительных заболеваний кишечника. Система состоит из эпителиальных и иммунокомпетентных клеток. Уже на четвёртый день культивирования команде удалось получить трубчатую структуру, состоящую из клеток Caco-2 и HT29-MTX-E12.
По своей сути это искусственные органы, ведь такая модель учитывает взаимодействие разных тканей, химический градиент веществ и механическую реакцию клеток на них (например, сужение сосудов). Предполагается, что в будущем этот подход позволит обойти тестирование на животных, и прецеденты уже есть: недавно ученым из Израиля удалось разработать новое лекарство от рака и провести доКИ без участия животных. При разработке ученые использовали чип, симулирующий человеческое тело. Этот чип содержит ткани человека и микроскопические сенсоры, чтобы отслеживать ответ человеческого организма — почек, печени и сердца — на препарат. Сейчас потенциальное лекарственное средство находится на стадии получения одобрения для КИ. Хотя этой идее уже 30 лет, израильская команда — первая, кто успешно заменил тестирование на животных исследованиями в искусственном органе. А сейчас настало время поговорить о «сухих» исследованиях — in silico.
In silico: организм внутри компьютера
В исследованиях in silico, чтобы оценить действие нового вещества на живые системы, используют компьютерные модели. Это позволяет сократить объем исследований in vitro и in vivo и удешевить весь процесс разработки.
С помощью подхода in silico можно подобрать молекулу под интересующий ученых сайт связывания (фрагмент биомолекулы-мишени, с которым должно связываться вводимое в организм вещество) и тестировать на животных только отобранных таким образом кандидатов. Этот подход называют драг-дизайном de novo [24].
Существуют также методы, с помощью которых можно предсказать активность вещества и его механизм действия на основании химической структуры. Примером здесь выступает QSAR — Quantitative structure–activity relationship, количественная оценка зависимости «структура—активность». Этот метод представляет собой работу с математическими соотношениями, связывающими химические структуры и биологическую активность с использованием физико-химических свойств веществ. При этом во время расчетов свойство рассматривается как независимая, а биологическое действие — как зависимая переменная. Метод, к примеру, рекомендован для скрининговой оценки генотоксичности реактивных примесей, которые могут содержаться в лекарственных препаратах.
Компьютерное моделирование, сочетающее в себе методы классической токсикологии и системной биологии, — Quantitative Systems Pharmacology (QSP) — может, в свою очередь, предсказать механизм действия вещества, используя имеющиеся данные по препаратам, вышедшим на рынок и не прошедшим отбор. Также оно может предоставить полезные данные о дозах и режиме дозирования схожих средств, таким образом сужая диапазон исследований и уменьшая размер эксперимента, экономя деньги и время на дорогостоящих I и II фазах КИ. Подход системной токсикологии, используемый специалистами PMI Science для исследования воздействия аэрозолей на организм человека, включает в том числе компьютерное моделирование и методы вычислительной биологии, что позволяет получать релевантные результаты, работая с моделями биологических систем, имитирующих множество процессов, происходящих в живых тканях.
Математические модели фармакокинетики, основанной на физиологии (Physiologically based pharmacokinetic modeling, PBPK), широко используют для предсказания фармакокинетических свойств различных веществ. В этих моделях сотни дифференциальных уравнений описывают физиологические процессы, участвующие в распределении веществ по тканям и органам. Около 70% компаний в фармацевтической отрасли используют этот подход в рамках доКИ. Такое распространение стало возможным благодаря коммерчески доступным платформам PBPK и рекомендациям к их использованию от регуляторных агентств.
Следует сказать, что почти все описанные здесь модели in silico используют уже накопленные данные о веществах и их токсичности, поэтому инициативы, связанные с выкладыванием данных в общий доступ, поощряются, и существует множество подобных баз данных [27]. Например, проект Etox агрегирует данные по токсикологии, чтобы более точно предсказывать токсичность молекул in vivo. Исследователи могут свободно пользоваться этими данными для своих моделей. Компанией PMI, в свою очередь, была запущена инициатива INTERVALS — открытая онлайн-платформа для совместной работы с большими данными, которая призвана облегчать планирование новых экспериментов, например, используя уже полученные ранее результаты для проверки формулируемых вновь гипотез.
«Филип Моррис Интернэшнл» (PMI, или ФМИ) входит в число тех компаний, которые применяют инновационные методы исследований, альтернативные тестам на животных. В своих испытаниях ученые ФМИ основываются на практиках, уже много лет применяющихся в фармацевтической отрасли, а также используют все перечисленные выше методы — компьютерные модели, клеточные культуры и «органы на чипе».
Исследования ФМИ
Компания «Филип Моррис Интернэшнл» создала научную платформу PMI Science на базе научно-исследовательского центра The Cube в Швейцарии. Платформа предназначена для проведения исследований по созданию бездымных продуктов, которые снижают вред от потребления табака, а также для изучения их воздействия на организм человека. Более 940 ученых участвуют в разработке бездымных продуктов, проводят исследования в области химии, биологии, информатики и медицины. На сегодняшний день опубликовано более 425 статей в научных журналах, таких как American Journal of Physiology [28], Nature Biotechnology [29] и Regulatory Toxicology and Pharmacology [30].
О том, как ФМИ реализует научные инициативы в области неклинической стадии токсикологических исследований, а также какие классические и инновационные методологии она имеет в своем арсенале, вы узнаете как от представителей компании, так и от независимых признанных экспертов.
О своей работе рассказывает Давид Сьюссио (Davide Sciuscio), PhD в области токсикологии, менеджер по доклинической токсикологической оценке в ФМИ:
Бездымные продукты разработаны для совершеннолетних курильщиков, которые в противном случае продолжили бы курить. Они не безвредны и содержат никотин, вызывающий привыкание. Лучший выбор, который может сделать любой курильщик, — это полностью отказаться от сигарет и никотина.
Затем мы переходим к стадии in vitro, где используем изолированные клетки тканей, которые подвергаются воздействию аэрозоля, так мы получаем информацию о его токсичности. Только после этого наступает черед in vivo, где моделью выступает целый организм.
Почему мы выбрали этот путь? Прежде всего, мы считаем такой способ наиболее эффективным с точки зрения экономии денежных затрат и времени. Конечно, мы осознаем, что предсказательная ценность методов in vitro невысока, потому что в этом случае вы имеете дело лишь с клетками, и только потом переходите к более сложной системе — исследованию на животных. Но нельзя забывать, что каждый последующий этап, дающий более релевантные данные, является и более трудоемким.
Мы придерживаемся стратегии, позволяющей максимально сократить издержки и в то же время подойти к исследованию с участием добровольцев подготовленными. Вы не можете сразу приступить к клиническому испытанию молекулы, о которой ничего не знаете, ведь нужно обеспечить безопасность людей, участвующих в исследованиях, а значит, изучение токсикологии должно быть комплексным. Поэтому ни один из этапов нельзя назвать излишним. Все они служат для того, чтобы максимально снизить риски нежелательных эффектов на стадии работы с людьми.
Не конец, а начало пути
Перед тем, как вещество преодолеет путь от создания в лаборатории до применения (bench-to-bedside), его тщательно исследуют. В частности, на этапе доКИ ученым предстоит выяснить, стоит ли препарату вообще попадать в живой организм и какие побочные эффекты он может вызвать. Долгое время практически единственным способом получить такую информацию были животные — в наше время за год для исследований может быть использовано 9,39 млн лабораторных животных в одном лишь Евросоюзе. При этом большинство молекул-кандидатов вовсе не доходят до выпуска на рынок, ведь на любом этапе возможен провал и сворачивание проекта.
В ответ на существующие вызовы ученые изобретают всё больше новых способов подтвердить безопасность и эффективность новых веществ — in silico с помощью компьютерных моделей и in vitro на 3D-клеточных культурах и «органах на чипах». Возможно, мы еще застанем то время, когда для поиска лекарственного вещества не нужно будет причинять страдания ни одному животному, а все исследования будут проводиться на более близких к людям моделях.