Дозозависимые побочные эффекты что это
Дозозависимые побочные эффекты что это
Эффект лекарственного средства зависит от его количества, поступившего в организм, т. е. от дозы. Если назначенная доза ниже пороговой (подпороговая), эффект отсутствует. В зависимости от природы эффекта повышение дозы может привести к его усилению. Так, действие жаропонижающих или гипотензивных препаратов можно количественно выразить с помощью графика, на котором указывается, соответственно, степень снижения температуры тела или АД.
Вариации зависимости эффекта препарата от дозы обусловлены чувствительностью конкретного человека, принимающего препарат; для достижения одинакового эффекта разным пациентам требуются разные дозы. Различия в чувствительности особенно ярко проявляются в феноменах по типу «все или ничего».
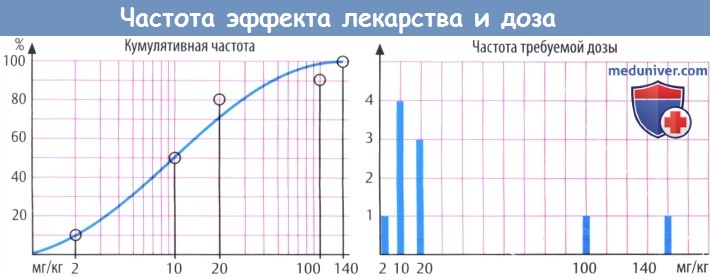
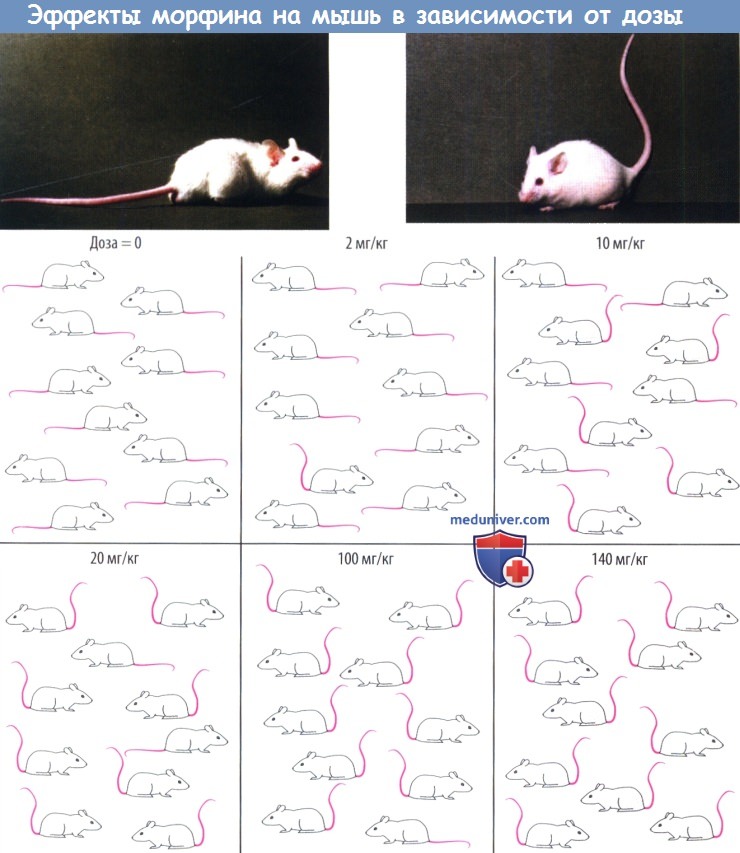
При введении низкой дозы реагируют только наиболее чувствительные особи, при повышении дозы число реагирующих растет, и при максимальной дозе эффект развивается у всех животных в группе. Существует взаимосвязь между количеством реагирующих особей и введенной дозой. При дозе 2 мг/кг реагирует 1 из 10 животных; при дозе 10 мг/кг — 5 из 10 животных. Эта зависимость частоты развития эффекта и дозы является результатом различной чувствительности особей, для которой, как правило, характерно логарифмически нормальное распределение.
Если кумулятивную частоту (общее количество животных, у которых развивается реакция на конкретную дозу) отметить на логарифме дозы (ось абсцисс), появляется S-образная кривая. Нижняя точка кривой соответствует дозе, на которую реагирует половина животных в группе. Диапазон доз, охватывающий зависимость дозы и частоты эффекта, отражает вариации индивидуальной чувствительности к препарату. График зависимости дозы и частоты эффекта напоминает по форме график зависимости эффекта от дозы, однако имеются некоторые отличия. Дозозависимость можно оценить у одного человека, т. е. она представляет собой зависимость эффекта от концентрации препарата в крови.
Оценка зависимости эффекта от дозы в группе затруднена вследствие разной чувствительности у отдельных пациентов. Чтобы оценить биологические вариации, измерение проводят в репрезентативных группах, а результат усредняют. Таким образом, рекомендуемые терапевтические дозы оказываются адекватными для большинства пациентов, но не всегда для конкретного человека.
В основе вариаций чувствительности лежат различия в фармакокинетике (одинаковая доза — различная концентрация в крови) либо разная чувствительность органа-мишени (одинаковая концентрация в крови — различный эффект).
Для усиления терапевтической безопасности специалисты по клинической фармакологии пытаются выяснить причины, определяющие различия в чувствительности у разных пациентов. Эта область фармакологии называется фармакогенетикой. Часто причиной бывает разница в свойствах или активности ферментов. Кроме того, наблюдаются этническая вариабельность чувствительности. Зная об этом, врач должен постараться выяснить метаболический статус пациента, прежде чем назначать тот или иной препарат.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Глюкокортикоидная терапия сегодня: эффективность и безопасность
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Ступенчатое включение: дозозависимый эффект антидепрессантов

Дозозависимое действие велаксина, селективного ингибитора обратного захвата серотонина и норадреналина, позволяет корректировать лёгкие депрессивные расстройства, купировать состояния с психомоторной заторможенностью и устранять психотические проявления.
Мультитаргетный механизм действия является преимуществом для препарата с антидепрессивным действием. Дело в том, что сегодня, с ростом распространённости депрессии и необходимости её амбулаторного лечения, увеличивается потребность в антидепрессантах (АД) с более мощным и управляемым эффектом. Усилить эффективность антидепрессантов удалось путем расширения их нейрохимического профиля, что стало основой синтеза нового поколения антидепрессантов – селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН).
На отечественном рынке представителем СИОЗСиН является Велаксин® (венлафаксин). Велаксин® воздействует на три системы нейромедиаторов: серотонин (отвечает за фон настроения), норадреналин (активирует, концентрирует внимание) и дофамин (повышает мотивацию) [1]. Благодаря широкому терапевтическому диапазону доз, ингибиция обратного захвата моноаминов происходит не единовременно, а последовательно, в зависимости от концентрации активной молекулы препарата.
В соответствии с концепцией ступенчатого влияния на нейромедиаторные системы, венлафаксин последовательно проявляет серотонинергические, норадренергические и дофаминергические эффекты [2]. При включении новых нейрохимических «мишеней» венлафаксина наблюдается расширение спектра его клинической эффективности [3]. Так, в дозе 75-125 мг венлафаксин проявляет серотонинергическое действие. Это означает, что Велаксин® в дозировке до 150 мг в сутки позволяет корректировать лёгкие депрессивные расстройства, сопровождающиеся гипотимией и тревогой, обсессиями и компульсией. При повышении дозы до 225 мг – включаются уже норадренергические эффекты. Эта дозировка позволяет с помощью Велаксина® купировать депрессивные состояния с психомоторной заторможенностью, рассеянностью. Дальнейшее увеличение дозы до 375 мг приводит к появлению дофаминергического эффекта, и этот диапазон подходит для устранения психотических проявлений (дезорганизации, дезориентации, бреда и др.) [1]. Соответственно, первые два эффекта широко применяются в амбулаторной практике, а последний подходит для использования в условиях стационара.
Дозозависимая нейрофармакология Велаксина® выгодно отличает его от СИОЗС, у которых ожидаемыми эффектами являются только серотонинергические [2]. В отдельных исследованиях венлафаксин в дозе 75 мг у амбулаторных больных с депрессией показал эффективность и переносимость, сравнимую с флуоксетином (20 мг) [4]. Но при повышении дозировки до 150 мг и выше венлафаксин превосходил стандартные дозы флуоксетина, флувоксамина и на уровне тенденций имипрамина [5]. Градуированность терапевтического действия позволяет гибко проводить наращивание дозы и использовать Велаксин® максимально эффективно и безопасно при спектре депрессивных расстройств различной степени выраженности.
Материал предназначен для медицинских работников.
Реакции гиперчувствительности при лекарственной терапии
Я остановлюсь на схеме токсического действия парацетамола только для того, чтобы проиллюстрировать дозозависимые и ожидаемые побочные действия лекарств на данном примере. Парацетамол – излюбленный препарат, который применяется англичанами для самоубийства, смысл действия этого препарата состоит в том, что, попадая в организм в больших дозах, ( к примеру в руках самоубийцы), превращение парацетамола в печени в системе цитохрома Р450 приводит к образованию N-ацетил-P-бензохинонимина. Это соединение приводит, в конечном счете, к целому каскаду неблагоприятных побочных действий, в частности, происходит связывание этого соединения с глютатионом, основной разменной монетой гепатоцита, в частности, при обеспечении всех транспортных процессов. Далее, N-ацетил-P-бензохинонимин связывается с внутриклеточными белками, образует необратимые комплексы, под влиянием этого соединения происходит интенсификация пероксидации липидов клеточных мембран, цитоплазматических мембран, внутриклеточных мембран, митохондриальной мембраны, и так далее, и устойчиво повышается клеточный кальций за счет выхода кальция из внутриклеточных депо.
В конечном итоге, такое действие N-ацетил-P-бензохинонимина приводит к истощению запасов клеточного глютатиона, что, собственно, лежит в основе оксидативного стресса. Далее повышается проницаемость мембран, и под влиянием высоких концентраций внутриклеточного кальция стимулируется активность кальций-зависимых протеиназ, в конечном счете, это приводит к смерти клетки посредством механизма или некроза, или апоптоза. Итак, это классический пример дозозависимого или ожидаемого побочного действия лекарства при его передозировке.
Теперь мы поговорим о дозонезависимых и непредсказуемых побочных действиях лекарств. Их можно так же разделить на две группы. Первая – это лекарственная аллергическая реакция или реакция лекарственной гиперчувствительности, которая определяется Рэнгом как «нежелательное побочное действие лекарства, в основе которого лежит доказанный иммунологический механизм», вот это следует подчеркнуть: необходимо доказать наличие иммунологического механизма.
И второй тип – это реакция лекарственной идиосинкразии или лекарственной псевдоаллергии, это патологическая, как правило, повреждающая реакция, иммунологический механизм которой не доказан, и она наблюдается у небольшого числа лиц.
В свою очередь, аллергические реакции или реакции лекарственной гиперчувствительности делятся на 4 подтипа. В основе всех этих типов лежит дисбаланс активности Т-клеток, Т-лимфоцитов.
Итак, первый тип – иммуноглобулин-Е опосредованная или анафилактическая гиперчувствительность, здесь приведен целый ряд примеров – это сенная лихорадка, бронхиальная астма или бронхообструктивная реакция, крапивница, и, обратите внимание, анафилактический шок. В конце лекции будет приведен пример неблагоприятной реакции, где присутствовал в клинической картине анафилактический шок.
Тип 2 – антителозависимая гиперчувствительность, она реализуется на клиническом уровне такими неблагоприятными реакциями, как агранулоцитоз, тромбоцитопеническая пурпура или аутоиммунный тиреоидит, и так далее.
Третий тип – это гиперчувствительность, опосредованная иммунными комплексами. Этот тип часто часто встречается в практической деятельности врача – это экзогенно-аллергический альвеолит, чаще всего антибиотик-зависимый, аутоиммунный гломерулонефрит, васкулит, обращаю на это внимание, поскольку ниже будет приведен клинический пример иммунокомплексного васкулита у пациентки в нашей клиники, это может быть системная красная волчанка; как классический экспериментальный патофизиологический пример – феномен Артюса, хорошо известный нам из курса патологической физиологии.
И, наконец, четвертый тип реакции лекарственной гиперчувствительности – это клеточно-опосредованная гиперчувствительность, и она нам также хорошо известна на примере туберкулиновой реакции, на примере различных кожных сыпей, ревматоидного артрита, множественного склероза и инсулинозависимого сахарного диабета, сахарного диабета первого типа.
Теперь поговорим о реакциях лекарственной идиосинкразии или реакциях лекарственной псевдоаллергии. Их можно подразделить на две большие группы: идиопатические реакции, природа которых практически не установлена. В качестве примера такой тяжелой идиопатической реакции можно привести редко наблюдаемые, но, как правило, заканчивающиеся весьма печально, примеры тяжелой апластической анемии на введение различных лекарств, в частности, на прием хлорамфеникола.
И, наконец, четыре варианта генетически детерминированных реакций лекарственной идиосинкразии. В основе первого подтипа лежит дефицит глюкоза-6-фосфатдегидрогеназы. Эта ситуация наблюдается, скажем, при развитии тяжелой анемии, чаще всего гемолитической анемии, на фоне приема целого ряда препаратов – Примахин, Дапсон, Доксорубицин. Подобные анемии вызывают бобы Vicia faba, поэтому у пациентов, дефицитных по глюкоза-6-фосфатдегидрогеназе, при приеме этих бобов или перечисленных препаратов развивается тяжелая анемия, которая также носит название «фавизм».
Далее – тип, обусловленный существованием печеночных порфирий, в основе которых лежит нарушение синтеза гема, и накопление порфиринсодержащих предшественников гема. При наличии скрытых печеночных порфирий прием ряда лекарственных препаратов – барбитуратов, карбамазепина, эстрогенов – может приводить к острым приступам абдоминальной боли, нередко приводящим пациентов на хирургический стол, или к тяжелым преходящим нервно-психическим расстройствам.
Третий подтип лекарственной идиосинкразии – это реакции, обусловленные дефицитом каналов выходов кальция из саркоплазматического ретикулума скелетных мышц и сердца, так называемых рианодин-рецепторов. Классическим примером служит пример злокачественной гипертензии, которая развивается у этих пациентов при однократном приеме Суксаметония.
И, наконец, довольно распространенный пример реакции лекарственной идиосинкразии, который мы все наблюдаем в практике, но редко подозреваем, что речь идет о лекарственной идиосинкразии – это алкоголь-индуцированная гиперемия и тошнота, которая развивается чаще всего у лиц восточного происхождения. На фоне приема алкоголя дополнительное назначение тех или иных препаратов, в частности, хлорпропамида, вследствие ингибирования альдегиддегидрогеназы, приводит к этому «флешу», к этой тяжелой вспышке неприятной, главным образом, гиперемии у таких пациентов.
Как часто встречается побочно действие лекарств в стационарах? К сожалению, как и по многим показателям, в нашей российской действительности мы не располагаем такой статистикой, но вот примеры из других стран. В частности, в Англии проведено изучение около 19 000 пациентов, лечившихся в различных стационарах, и побочные действия лекарств выявлены у 6,5%, причем доминировали дозозависимые, то есть предсказуемые реакции – 95%, и наблюдались дозонезависимые, непредсказуемые – в 5% случаев.
Во французском исследовании, в котором использовался французский регистр анафилаксии при проведении общей анестезии, наблюдение продолжалось в течение 2 лет, из 13 000 случаев общей анестезии, в 6% случаев были выявлены анафилаксия и идиосинкразия, т.е.примерно 1 на 16 случаев анестезии, причем, лекарственная идиосинкразия наблюдалась в 34% случаев, и иммуноглобулин-Е опосредованная анафилаксия – в 66% случаев. Интересные данные приводят в своей работе Гомес и Доннелли, которые также изучали частоту побочных действий лекарств в стационарах. Оказывается, что побочные действия лекарств приводят в стационар, к госпитализации, около 5% пациентов. Среди самих госпитализированных пациентов побочные действия развиваются у 7 и более процентов пациентов. Надо отметить, что почти 60% пациентов с побочными действиями лекарств, поступающих в стационар, не распознаются врачами, то есть врачи не знают симптомов побочных действий лекарств, и мало думают о возможности побочного действия лекарства, как причины госпитализации. Обращает на себя внимание низкая декларируемость врачами побочных действий лекарств, развивающихся у их пациентов в стационарах, она составляет всего 12%. В целом побочные действия лекарств в стационарах по тяжести распределяются, как тяжелые – в 33%, и летальность среди пациентов с побочными действиями лекарств достаточно высокая и составляет в среднем 3,3%, но приводятся данные значительно выше – 8,5%.
Продолжая рассмотрение проблемы побочного действия лекарств в стационарах, следует отметить, что наиболее частые провоцирующие факторы, приводящие к неблагоприятным реакциям, обусловлены антибиотиками, среди них доминирующее место занимает пенициллин и бета лактамы, нестероидные противовоспалительные препараты, диуретики, в этом списке классы препаратов приведены по частоте вызываемых ими побочных действий, седативные препараты, антикоагулянты, противоэпилептические средства, блокаторы нейромышечной передачи и рентгеноконтрастные вещества.
В большом исследовании Тонг, проведенном в Гонконге, было показано, что в стационарах лекарственная аллергия наблюдается примерно в 4,2 случаях на 1000 госпитализированных, причем, в спектр побочных действий лекарств входят такие клинические проявления, как кожная реакция – почти у всех пациентов, далее, симптомы системного поражения различных органов и систем – 30%, тяжелые реакции – более 5%. Среди тяжелых реакций Тонг отмечает наличие синдрома Стивена Джонса, токсический эпидермальный некроз и генерализованный эксфолиативный дерматит.
Что мы можем отметить среди амбулаторных пациентов? Среди амбулаторных пациентов частота лекарственной аллергии колеблется, по данным Гомеса, от 2 до 8%, составляя в среднем 5,5%, причем, доминируют иммунологически опосредумые реакции немедленного типа, то есть дозонезависимые – 43%. В первый день лечения частота их составляет 79%, среди них кожные реакции имеют 64% пациентов, наиболее часто провоцирующими факторами служат пенициллины и другие антибиотики – 45%, аспирин и нестероидные противовоспалительные препараты – 12%, другие лекарственные группы – 15%, и в ряде случаев в силу полипрагмазии не удается установить конкретный препарат в общей группе препаратов, назначаемых пациентам, который вызывает побочное действие лекарства. Надо сказать, что наиболее грозным осложнением является анафилактический шок. По данным английских авторов, острая анафилаксия наблюдается в 8,4 на 100 тысяч населения в год, в США регистрируется 1500 случаев смерти в год среди лиц с острой лекарственной анафилаксией, в Голландии летальность составляет 2,5% среди лиц с острой лекарственной анафилаксией, в Дании частота смерти от анафилаксии составляет 0,3 на миллион населения в год. Наиболее частыми провоцирующими факторами по данным целого ряда авторов, приведенных здесь, служат лекарства, продукты питания и укусы насекомых.
Какова структура наиболее частых причин смерти от острой лекарственной анафилаксии и идиосинкразии в общетерапевтических стационарах? Я привожу здесь свои данные, они базируются на исследованиях в ряде военных госпиталей. Итак, анафилактический шок представлен в 37% случаев, аллергический альвеолит – 37% случаев, фульминантная печеночная недостаточность – 11%, острая костномозговая аплазия – 7,5%, синдром Стивена Джонсона – 3,7%, и токсический эпидермальный некролиз – 3,7%.
Каковы факторы риска, может ли врач прогнозировать появление реакции лекарственной гиперчувствительности? В ряде случаев такую настороженность врач может проявить. Факторами риска являются факторы, зависящие непосредственно от лекарств, далее – факторы, зависящие от режима лечения, и факторы, зависимые от пациента. Среди последних необходимо выделять возраст – чем старше пациент, тем больше риск развития побочных действий, пол – чаще у женщин, чем у мужчин, конкурирующие заболевания, то есть полиморбидность, и, наконец – аллергологический анамнез на вводимые в прошлом лекарственные средства и развивавшиеся лекарственные реакции. Вот последнее положение часто недоучитывается врачами, и при тщательном рассмотрении анамнеза жизни таких пациентов, выявляется, что в детском возрасте они переносили очень тяжелые побочные лекарственные реакции, и нередко, к сожалению, об этом приходится узнавать от их матерей уже тогда, когда состояние пациентов становится практически безнадежным.
Говоря о зависимости от лекарства, следует отметить, что само по себе подавляющее большинство лекарств представляет из себя гаптен, и молекулярная масса лекарств менее 1000 дальтон, и в этой ситуации лекарство не может представлять из себя аллерген. Далее, соединяясь с белком – с гликопротеином или с нуклеиновой кислотой, лекарство образует комплекс, и вот этот комплекс с молекулярной более 1000 дальтон, уже является полным аллергеном, способным вызвать тот или иной тип лекарственной реакции. В результате образования полного аллергена в конечном счете мы можем иметь дело или с антителами и антителозависимой реакцией, или с иммунными комплексами, и, соответственно, с иммунокомплексной патологией или с сенситизированными лимфоцитами, с цитотоксическими лимфоцитами. В случае антителозависимой гиперчувствительности речь может идти о гемолитической анемии, о костномозговой красноклеточной аплазии, я привожу только отдельные примеры, или иммуноглобулин-Е острой анафилаксии. В случае иммунокомплексной патологии речь может идти о сывороточной болезни или об аллергическом бронхоальвеолите. Как примеры, реакции могут быть самые разнообразные. И, наконец, при сенситизации лимфоцитов речь может идти о кожных реакциях, от относительно невинных, в частности, нейровазомоторных реакциях, до тяжелого, тотального некролиза.
Режим лечения также имеет большое значение. По данным Родена, к факторам риска развития гиперчувствительности относятся прерывистые и повторные назначения лекарств, в частности, это более опасно по сравнению с непрерывным лечением. Далее, парентеральное введение служит фактором риска, местное применение – даже введение глазных капель может приводить к тяжелым лекарственным реакциям. И, наконец, полипрагмазия, скажем, при приеме пациентом шести разных лекарств риск развития побочного действия составляет 5%, но при приеме 15 разных лекарств, речь идет о приеме в период госпитализации или амбулаторном лечении, не обязательно одномоментно, риск побочного действия лекарств может возрастать уже до 40% применительно к каждому пациенту. Гиперчувствительность пациентов определяется полом, во-первых, женщины реагируют чаще, как я уже говорил, чем мужчины, и соотношение довольно выраженное – 70% и 30 соответственно, далее – пожилой возраст, и, наконец – полиморбидность, в частности, пожилой возраст во многом служит фактором риска гиперчувствительности. Большое значение имеют и генетические особенности пациентов, в частности, отмечаются этнические различия в лекарственном метаболизме. Например, при применении ингибиторов ангиотензинпревращающих ферментов, крапивница чаще отмечается у афроамериканцев, а тяжелый кашель чаще наблюдается у африканского населения и у населения Дальнего Востока. Независимыми факторами риска развития побочных действий лекарств служит китайское происхождение, наличие любого хронического заболевания и наличие бронхиальной астмы. Важен генетический полиморфизм, в частности, учитывая распределение всех на быстрых и медленных ацетиляторов, можно предполагать, что медленные ацетиляторы дают гораздо чаще побочные лекарственные реакции, и такими примерами служат реакции на гидралазин, на прокаинамид, изониазид, кожные реакции и так далее. Далее, имеет значение, как выявлено в последнее время, полиморфизм тумор-некротизирующего фактора, и у таких пациентов определяется, в частности, тяжелая гиперчувствительность к карбамазепину, полиморфизм цитохрома Р-450 – у этих пациентов отмечается гиперчувствительность к нестероидным противовоспалительным препаратам.
В заключении я хочу привести пример тяжелой лекарственной гиперчувствительности у пациентки с циррозом печени и неспецифическим язвенным колитом. Это пациентка пожилого возраста 68 лет.
Поступила к нам в клинику с жалобами на боли в левом и правом подреберьях постоянного характера, увеличение в объеме живота, отечность голеней и стоп, высыпания на коже живота и левой голени – болезненные высыпания, на тошноту и рвоту после еды, на жажду, сухость во рту и на выраженную общую слабость.
Анамнез заболевания включает диагноз до 2002 года у пациентки неспецифического язвенного колита и цирроза печени, обусловленного инфекцией вируса гепатита В, на фоне приема 5-аминосалициловой кислоты, в частности, салофалька, это не тотальный колит – дистальный колит, активность этого дистального язвенного колита существенно уменьшилась – практически больная перешла в ремиссию. Прием Зеффикса привел к тому, что на протяжении двух лет у пациентки произошла элиминация вируса гепатита В по тем лабораторным данным, которыми мы располагали, и до 2004 года больная чувствовала себя относительно хорошо. В 2004 году вновь было обнаружено наличие в ДНК вируса гепатита В, и вновь пациентке был назначен Зеффикс, Ламивудин в дозе 100 мг в сутки. В 2005 году при ультразвуковом исследовании у пациентки было обнаружено очаговое образование в седьмом сегменте печени, была проведена биопсия, и в биопсийном материале морфолог выявил доброкачественную нодулярную гиперплазию печени. В марте 2006 года у пациентки произошло обострение заболевания: стали нарастать отеки, увеличился живот в объеме, нарастал асцит, больная отмечала резкое нарастание слабости, присоединились в мае боли в животе. Появление болей в животе, вздутие живота и задержка стула привели к тому, что врач поликлиники, а затем врач бригады Скорой медицинской помощи поставил диагноз «кишечная непроходимость», и больная была направлена на госпитализацию в одну из больниц. При поступлении в больницу в приемном отделении у пациентки исключен острый живот, проведена дезинтоксикационная терапия, и в связи с повышением температуры тела больной назначен ампициллин – повышение температуры было расценено, как наличие пневмонии. Через 2 часа после введения антибиотика у пациентки появились геморрагические высыпания на животе, а в последующем в течение двух суток отмечалась задержка мочеотделения, нарастала олигурия, нарастали явления интоксикации: отсутствие аппетита, тошнота, присоединилась рвота. Такая ситуация была расценена лечащими врачами как неэффективность антибактериальной терапии в лечении пневмонии ампициллином, и ампициллин был заменен на цефазолин. На фоне приема цефазолина геморрагические высыпания распространились: они стали более обширными, появились высыпания на левой голени, усилились явления интоксикации, олигурия практически трансформировалась в анурию.
Вот в этом состоянии больная госпитализирована в нашу клинику. При поступлении объективный статус включал тяжелое состояние пациентки, была нормальная температура, отмечались геморрагические высыпания сливного характера на коже живота и передней поверхности голени, ритмичный пульс сердца, низкое артериальное давление – 80/60 мм ртутного столба. Трудно было выявить, какое артериальное давление наблюдалось на протяжении предшествующих двух суток. То есть практически больная поступила в состоянии шока. Живот увеличен в объеме за счет асцита, печень выступала на 2 см, наблюдалась олигурия. Наличие такого низкого артериального давления, по всей вероятности, можно было объяснить развитием у пациентки лекарственной аллергической реакции первого типа, то есть иммуноглобулин Е-зависимой реакции, приведшей к развитию коллапса.
Так выглядела кожа, кожные высыпания у нашей пациентки, геморрагические сливные высыпания у этой пациентки, которые постепенно распространялись.
В процессе наблюдения с 11 на 12 мая отмечалось распространение геморрагических высыпаний по ногам, животу, поясничной области, появление булл на левой голени, то есть начинался эпидермолиз, нарастала адинамия у пациентки, и, в соответствии с критериями Глазго, нарастали явления энцефалопатии – вплоть до комы. В течение всего периода имела место анурия, и, несмотря на активно проводимые мероприятия – введение вазотоников, глюкокортикостероидов – артериальное давление у пациентки с исходно нормального, и даже тенденцией к высокому, оставалось низким.
Таким образом, больной был поставлен клинический диагноз в форме основного заболевания, сочетанного заболевания, системный аллергический васкулит, обусловленный, по всей вероятности, введением ампициллина, и далее – цирроз печени вирусной этиологии – класс С по Чайлду-Пью. В число осложнений основного заболевания вошли анафилактический шок – по всей вероятности, на основе аллергической реакции первого типа, синдром диссеминированного внутрисосудистого свертывания, кома смешанного генеза, острая почечная недостаточность как следствие развившегося шока. Далее – портальная гипертензия, печеночная недостаточность, тромбоцитопения, лейкопения, спонтанный бактериальный перитонит. В качестве сопутствующего заболевания – неспецифический язвенный колит. Таким образом, у этой пациентки, по всей вероятности, доминировали как реакции первого типа (резкое падение артериального давления), так и реакция третьего типа – иммунокомплексная опоследованная реакция в виде системного васкулита.
Пациентка погибла, несмотря на все проводимые мероприятия.
В заключении следует отметить, что реакция лекарственной гиперчувствительности регистрируется примерно у 10-20% госпитализированных и у 7% амбулаторных пациентов получение точных эпидемиологических данных затруднено по данным наших зарубежных коллег главным образом по двум причинам: во-первых, вследствие недоучета, обусловленного нежеланием или неспособностью врачей сообщить о побочных действиях лекарства своим пациентам, и, во-вторых, переучетом вследствие не всегда обоснованного применения термина «аллергия», ибо в подавляющем большинстве случаев речь не идет об истиной аллергии, ведь доказать участие иммунологических механизмов очень сложно. И, наконец, вследствие неверной трактовки истории так называемой лекарственной аллергии. Это приводит к неблагоприятным результатам по отношению к пациентам: во-первых, начинает применяться ошибочная тактика лечения, и, во-вторых, отменяются препараты, которые на самом деле не являются виновниками так называемой лекарственной аллергии. Спасибо за внимание.