Дуодарт или финастерид что лучше
Гиперплазия предстательной железы: заболевания и лекарства
ч. 2 В организме человека встречаются 2 вида 5-альфа-редуктазы: I и II типа. Их распределение в тканях неодинаково: I тип встречается, главным образом, в коже головы, спины и груди, в сальных железах, в печени, надпочечниках и почках.
Ферментные препараты: ингибиторы 5-альфа-редуктазы
В тканях предстательной железы фермент I типа обладает незначительной биологической активностью. Фермент 5-альфа-редуктаза II типа локализуется в простате, яичках и их придатках, головке полового члена, мошонке, семенных везикулах, печени, в грудной клетке. Он наиболее активен в тканях предстательной железы и преобразует мужской половой гормон тестостерон в более сильнодействующий андроген — дигидротестостерон (ДГТ). Изоферменты (или изоэнзимы) данного фермента отличаются по аминокислотной последовательности, но выполняют одну и ту же каталитическую функцию. Оба изоэнзима определяются в нормальной простатической ткани. При доброкачественной гиперплазии предстательной железы (ДГПЖ) отмечается их гиперэкспрессия, которая приводит к гиперплазии стромальных и эпителиальных клеток в транзиторной зоне и парауретральных железах. Избыточная продукция ДГТ может привести к таким андрогензависимым состояниям, как ДГПЖ, рак простаты, акне, алопеция и др. Для лечения и профилактики прогрессирования ДГПЖ, уменьшения ее размеров, улучшения мочеиспускания и снижения риска возникновения острой задержки мочи применяют Финастерид и Дутастерид. После применения этих препаратов эффективно снижается концентрация ДГТ в сыворотке крови и в ткани предстательной железы, индуцируется апоптоз простатических эпителиальных клеток. При длительном курсовом применении уменьшается объем простаты в среднем на 15–25%, увеличивается пиковая скорость мочеиспускания и, таким образом, снижается выраженность симптомов и устраняется механический компонент обструкции при ДГПЖ.
Финастерид (Finasteride) — ТН «Альфинал», «Простерид», «Пенестер», табл. 5 мг, — синтетическое производное 4-азаандростана, конкурентного специфического ингибитора 5-альфа-редуктазы II типа. У пациентов с ДГПЖ, которые принимали Финастерид в дозе 5 мг/сут. в течение 3 лет, наблюдалось снижение концентрации ДГТ в сыворотке крови примерно на 70% и уменьшение объема предстательной железы примерно на 27% по сравнению с исходными значениями. Концентрация ПСА снижалась приблизительно на 50% по сравнению с исходными значениями, что способствует уменьшению роста эпителиальных клеток предстательной железы. Концентрация тестостерона в сыворотке крови увеличивалась примерно на 10–20%.
Установлено, что длительное (более 4 лет) применение Финастерида у пациентов снижало риск развития урологических осложнений и хирургических вмешательств на 51%. Препарат не обладает сродством к рецепторам андрогенов, не оказывает влияния на липидный профиль и на содержание в плазме крови кортизола, эстрадиола, пролактина, тиреотропного гормона и тироксина. Прием пищи не влияет на биодоступность, которая составляет 80%. Максимальная концентрация в плазме крови достигается примерно через 2 часа после приема внутрь. Рекомендуемая доза составляет 1 табл. 1 раз в день. Абсорбция не зависит от приема пищи. Продолжительность лечения до 6 месяцев, при необходимости лечение может быть продолжено до достижения фармакотерапевтического эффекта.
Важно! При применении препарата очень часто могут развиться следующие побочные эффекты: импотенция, снижение либидо, нарушения эякуляции, уменьшение объема эякулята, кожная сыпь, крапивница, ангионевротический отек губ и лица. Однако у большинства пациентов эти явления носили транзиторный характер.
Дутастерид (Dutasteride) — ТН «Дутастерид Бактэр», «Аводарт», капс. 0,5 мг — двойной ингибитор 5-альфа-редуктазы, подавляет активность изоферментов 5-альфа-редуктазы I и II типа. Максимальное влияние Дутастерида на снижение концентрации ДГТ является дозозависимым и наблюдается через 1–2 недели после начала лечения: при приеме препарата в дозе 0,5 мг в сутки средние значения концентрации ДГТ в сыворотке крови снижаются на 85 и 90% соответственно. После приема одной дозы (0,5 мг) максимальная концентрация Дутастерида в сыворотке крови достигается в течение 1–3 ч. Абсолютная биодоступность составляет около 60%, по отношению к 2-часовой в/в инфузии. Биодоступность не зависит от приема пищи, обладает высокой степенью связывания с белками плазмы (>99,5%). Имеет большом объем распределения — от 300 до 500 л. При ежедневном приеме концентрация препарата в сыворотке крови достигает 65% от стабильного уровня через 1 месяц и примерно 90% от стабильного уровня — через 3 месяца.
Капсулу препарата следует глотать целиком не разжевывая, не раскрывая, поскольку ее содержимое может вызвать раздражение слизистой ротоглотки. Специфического антидота у Дутастерида нет, поэтому при подозрении на передозировку достаточно проводить симптоматическое и поддерживающее лечение.
Бовгиалуронидаза азоксимер (Bovhyaluronidasum azoximerum) — ТН «Лонгидаза», лиофилизат для приготовления р-ра д/инъек. 1500 МЕ или 3000 МЕ, применяется подкожно или внутримышечно. 1 ампула или флакон содержит конъюгат протеолитического фермента гиалуронидаза с высокомолекулярным носителем, обладая всем спектром фармакологических свойств, присущим препаратам с гиалуронидазной активностью. Специфическим субстратом гиалуронидазы являются гликозаминогликаны — «цементирующие» вещества соединительной ткани. В результате гидролиза уменьшается вязкость гликозаминогликанов, способных связывать воду и ионы металлов. В результате увеличивается проницаемость тканей, улучшается трофика, уменьшаются отеки, рассасываются гематомы, повышается эластичность рубцово-измененных участков, устраняются контрактуры (лат. contractura — стягивание, сужение) и спайки (разрастание соединительной ткани). Эффект наиболее выражен в начальных стадиях патологического процесса.
Клинический эффект бовгиалуронидаза азоксимер значительно превосходит, а аллергизирующие свойства и раздражающие снижены, по сравнению с нативной гиалуронидазой. Конъюгация повышает устойчивость фермента к действию температуры и ингибиторов, увеличивается его активность, что приводит к пролонгированию действия. Ферментативная активность препарата сохраняется при нагревании 37°С в течение 20 суток, в то время как нативная гиалуронидаза в этих же условиях утрачивает свою активность в течение суток. Бовгиалуронидаза азоксимер обладает хелатирующей, антиоксидантной, противовоспалительной, иммуномодулирующей активностью и оказывает противофиброзное действие.
Важно! Противопоказанием служат гиперчувствительность к препарату, острые инфекционные заболевания, злокачественные новообразования, возраст до 18 лет, острая почечная недостаточность. Способы применения выбираются врачом в зависимости от диагноза, тяжести заболевания, клинического течения, возраста больного.
Комбинированные препараты
В настоящее время на фармацевтическом рынке имеются два комбинированных препарата, содержащие α1А-адреноблокатор тамсулозин с ингибиторами 5-альфа-редуктазы — финастеридом и дутастеридом. При совместном применении комбинированных препаратов рекомендуется соблюдать осторожность, т.к. одновременное использование этих препаратов может потенциально привести к симптоматической артериальной гипотензии. Следует информировать пациентов о возможности возникновения симптомов, связанных с ортостатической гипотензией, таких как головокружение сильной интенсивности, расплывчатость зрения, судороги в руках и ногах, спутанность сознания, слабость, потливость и др.
Тамсулозин + Финастерид — ТН «Сонирид Дуо», выпускаемый в наборе: тамсулозин (капс. с модифицированным высвобождением, 0,4 мг) и финастерид (табл., покр. пленочной обол., 5 мг). Сонирид Дуо предназначен для лечения и контроля симптомов доброкачественной гиперплазии предстательной железы (ДГПЖ) при необходимости комбинированного лечения с целью:
Важно! Сонирид Дуо можно применять только при увеличении предстательной железы (объем предстательной железы более 40 см 3 ). При таком увеличении предстательной железы комбинированное лечение облегчает симптомы ДГПЖ и замедляет клиническое прогрессирование заболевания эффективнее, чем при монотерапии указанными препаратами. Для полного терапевтического эффекта необходимо длительное применение препарата Сонирид Дуо.
Тамсулозина + Дутастерида — ТН «Дуодарт», капс. 0,5 мг + 0,4 мг —представляет собой комбинацию двух компонентов с взаимодополняющими механизмами действия, способствующих устранению симптомов у пациентов с ДГПЖ. Препарат с модифицированным высвобождением содержит мягкую желатиновую капсулу с дутастеридом и пеллету, содержащую тамсулозина гидрохлорид. Применение: для лечения и профилактики прогрессирования ДГПЖ посредством уменьшения ее размеров, устранения симптомов, увеличения скорости мочеиспускания, снижения риска возникновения острой задержки мочи и необходимости оперативного вмешательства. Дуодарт принимают по 1 капсуле каждого компонента 1 раз в сутки, спустя приблизительно 30 мин. после одного и того же приема пищи. Капсулы следует принимать целиком, не разжевывая и не раскрывая их, запивая водой. Между препаратом Дуодарт и одновременным приемом отдельных капсул дутастерида и тамсулозина была выявлена биоэквивалентность.
Важно! Контакт содержимого твердой капсулы внутри мягкой желатиновой со слизистой оболочкой ротовой полости может вызвать воспалительные явления со стороны последней.
Специфические препараты антител
Человечество уже давно открыло для себя действие антител. Это особые молекулы, которые вырабатываются клетками иммунной системы для распознавания чужеродных антигенов. В дальнейшем происходит антигенсвязывание и их уничтожение. Антитела обладают специфичностью. Это значит, что они узнают только свой антиген или детерминантную группу (отдельный фрагмент). В одном антигене может быть несколько таких детерминантных групп и к ним будут образовываться разные антитела. При введении антигена в организм образуется большое количество разных видов антител, направленных исключительно на один вид антигена. Это позволяет обеспечить адекватную иммунную защиту. Антитела широко используются при лечении многих заболеваний.
Антитела к простатоспецифическому антигену аффинно-очищенные модифицируют функциональную активность эндогенного ПСА. Усиливается регуляторное влияние антигена на функциональные и метаболические процессы в ткани предстательной железы.
Препарат оказывает выраженное противовоспалительное, противоотечное и вегетостабилизирующее действие. Совместное применение компонентов улучшает сперматологические показатели: увеличение концентрации половых гормонов, количества сперматозоидов и их подвижности, снижение вязкости семенной жидкости, нормализации секрета предстательной железы. Активируются регенеративно-репарационные процессы у пациентов, перенесших оперативное вмешательство и уменьшается вероятность развития осложнений после операции. Возможно проведение повторного курса лечения через 1–4 месяца. Курс лечения и дозировку (первичные и повторные) определяет лечащий врач.
«Афала», табл. д/рассас. — активным компонентом препарата являются антитела к простатоспецифическому антигену аффинно–очищенные по 0,003 г. При применении препарата уменьшается воспаление и отек, улучшается уродинамика, снижается объем остаточной мочи, уменьшаются дизурические расстройства и нормализуются тонус нижних отделов мочевыводящих путей и функциональное состояние в предстательной железе. Применяют препарат при ДГПЖ I и II стадии. Препарат входит в состав комплексной терапии острого и хронического простатита, в качестве противовоспалительного и обезболивающего средства. Применяется при дизурических расстройствах, таких как частые позывы на мочеиспускание, включая ночные, затруднение при мочеиспускании, боль или дискомфорт в области промежности.
Важно! Противопоказанием служит повышенная индивидуальная чувствительность к компонентам препарата. Не рекомендуется для применения у пациентов в возрасте до 18 лет в связи с недостаточностью данных по эффективности и безопасности для этого возраста. Афала не оказывает влияния на способность управления транспортными средствами и другими потенциально опасными механизмами.
БАД
Простамол Уно, капс.320 мг — препарат для лечения ДГПЖ растительного происхождения. В 1 капсуле содержится спиртовой экстракт плодов пальмы ползучей (9–11:1). Экстракт Serenoa repens оказывает антипролиферативный антиандрогенный, противовоспалительный и противоотечный эффекты. Местное антипролиферативное действие препарата проявляется снижением активности факторов роста (прежде всего эпидермального и фибробластического), торможением связывания рецепторов пролактина с последующим нарушением процессов передачи сигнала в клетки простаты и ускорением процессов апоптоза клеток простаты, что отражается в торможении роста объема предстательной железы.
Механизм местного антиандрогенного действия обусловлен ингибированием синтеза ДГТ и его фиксации к цитозольным рецепторам клеток простаты. Механизм местного противовоспалительного действия обусловлен тем, что экстракт плодов пальмы ползучей (Serenoa repens) ингибирует активность фосфолипазы А2, 5-липоксигеназы и высвобождение арахидоновой кислоты, тем самым уменьшает синтез простагландинов и лейкотриенов, которые являются медиаторами воспаления.
Простамол Уно уменьшает проницаемость капилляров и сосудистый стаз, уменьшает отечность и воспалительный процесс в простате, устраняет компрессию шейки мочевого пузыря и мочевыводящего канала, улучшая показатели уродинамики. Препарат не оказывает влияния на уровень половых гормонов в плазме крови, не влияет на потенцию, либидо и не изменяет уровень ПСА в плазме крови. Рекомендуемая продолжительность курса терапии — не менее трех месяцев, по 1 капс. один раз в сутки в одно и то же время, после еды, не разжевывая, запивая достаточным количеством жидкости.
Биопрост, суппоз. ректал., №10 — препарат для лечения хронического бактериального и небактериального простатита и для симптоматического лечения ДГПЖ. В одной суппозитории содержится: 0,5 г масла семян тыквы и 0,1 г — тимол. Обладает противовоспалительным, бактериостатическим и анальгезирующим действием. Уменьшает боль в области простаты и облегчает мочеиспускание.
Простаты экстракт — ТН «Витапрост», «Простатилен» — препараты животного происхождения, содержат экстракт простаты молодых бычков, достигших половой зрелости. При экстракции выделяют комплексы белков и нуклеиновых кислот, особые пептиды (короткие цепочки аминокислот) — цитомедины. Цитомедины человека и других млекопитающих почти идентичны, в норме они присутствуют в каждом человеческом органе и регулируют жизненные процессы как внутри клеток, так и между ними. Правильная работа клеток обеспечивает нормальное функционирование только того органа, из которого они были получены. Данные препараты оказывают органотропное действие на предстательную железу. При их применении возникает стимуляция мышечного тонуса мочевого пузыря, уменьшается степень отека, нормализуется секреторная функция эпителиальных клеток, увеличивается число лецитиновых зерен в секрете ацинусов, которые уменьшаются при простатите (от них зависит мужское здоровье, либидо и эрекция). В предстательной железе улучшается микроциркуляция, за счет уменьшения тромбообразования, возникает антиагрегантный эффект.
Применяют препараты при хроническом простатите и состояниях до и после оперативных вмешательств на предстательной железе. Прежде чем начать курс лечения необходимо убедиться, что патология носит доброкачественный характер. До начала лечения хронического простатита и при необходимости в процессе лечения рекомендуется проводить анализ секрета предстательной железы.
«Витапрост» выпускается в форме суппоз. 10 мг и 50 мг; суппоз. форте 20 мг и табл., покр. обол. кишечнорастворимой. При остром и хроническом бактериальном простатите, который сопровождается воспалением мочеполового тракта, применяют «Суппозитории плюс» — это комбинированная лекарственная форма, состоящая из фторхинолона — Ломефлоксацина 400 мг + простаты экстракта 20 мг.
«Простатилен» выпускается в форме суппоз. 30 мг и 50 мг и виде лиофилизата д/приг. р-ра д/инъек. 5 мг.
Важно! Препараты противопоказаны при гиперчувствительности и в детском возрасте до 18 лет. Препараты не влияют на способность управлять транспортными средствами, работать с движущимися механизмами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Перед применением необходима консультация специалиста.
Снять отечность простаты, освободив тем самым уретру, помогают товары медицинского назначения: свечи с тамбуканской грязью и прополисом «Тамбуил» и аппликатор лечебный грязевой — Тамбуканский 20×30 см; 15×20 см.
Хорошим способом поддержания здоровья мочеполовой системы является активный образ жизни, периодический прием природных (естественных) иммуномодуляторов. Раз в год следует проходить профилактический осмотр у уролога. Мужчинам после 50 лет рекомендуется контролировать состояние предстательной железы (пальпаторно) или при помощи УЗИ. Сдавать кровь на простатический специфический антиген. Для профилактики циститов, уретритов и простатита следует избегать незащищенных половых контактов, переохлаждений, злоупотребления алкоголем.
Длительное лечение больных с аденомой предстательной железы дутастеридом (препаратом Аводарт)
Высокая распространенность аденомы предстательной железы (АПЖ) у мужчин определяет актуальность проблем лечения этого заболевания. В связи с увеличением продолжительности жизни число мужчин, страдающих АПЖ, с каждым годом растет [1]. По данным отечественных и зарубежных исследователей [2, 3], клинические проявления АПЖ имеют место у 25–35% мужчин в возрасте 40–50 лет, их частота увеличивается с возрастом и достигает 75–80% у мужчин старше 70 лет.
Многочисленные клинические симптомы АПЖ крайне разнообразны, но многие из них существенно снижают качество жизни больных. При прогрессировании заболевания могут возникнуть серьезные осложнения (острая задержка мочи, хроническая почечная недостаточность, камни мочевого пузыря и др.), которые потребуют выполнения оперативного вмешательства. В настоящее время около 30% мужчин, страдающих АПЖ, подвергаются хирургическому лечению, однако, по данным ряда авторов, у 25–35% прооперированных больных выявляют различные интраоперационные и послеоперационные осложнения [2, 3].
В последние годы предложены десятки препаратов для лечения больных аденомой предстательной железы. Однако установлено, что из многих препаратов, применяемых для лечения пациентов с АПЖ, только ингибиторы 5-альфа-редуктазы способны оказывать патогенетически направленное действие и предупреждать прогрессирование заболевания [1–3]. С учетом ведущей роли фермента 5-альфа-редуктазы в патогенезе АПЖ, с 1992 г. для лечения этой болезни стали применять ингибитор 5-альфа-редуктазы II типа финастерид. В 2005 г. в России был зарегистрирован и разрешен для лечения пациентов с АПЖ новый препарат этого класса – дутастерид под коммерческим названием Аводарт (производство компании GlaxoSmithKline, Великобритания), который обладает способностью ингибировать 5-альфа-редуктазу не только II, но и I типа.
За последнее десятилетие были опубликованы работы, доказывающие высокую эффективность дутастерида у больных АПЖ [4–6]. Так, по данным метаанализа 2004 г., проведенного F. Debuyne и соавт., через 24 месяца приема этого препарата объем предстательной железы в среднем снизился на 26%, симптоматика болезни по Международной шкале оценки простатических симптомов (International Prostate Symptom Score, IPSS) уменьшилась на 4,4 балла, уровень дигидротестостерона в сыворотке крови снизился на 93,7%, уровень простатспецифического антигена (ПСА) – на 57,2%, а максимальная скорость потока мочи выросла на 2,2 мл/с [5]. В последние годы появились работы, в которых изучалась целесообразность применения дутастерида у больных с АПЖ перед трансуретральной резекцией простаты для уменьшения размера железы и профилактики геморрагических осложнений [7, 8].
Однако одним из спорных вопросов терапии больных АПЖ дутастеридом является определение оптимальной длительности лечения. Некоторые авторы [9] отмечают положительный эффект (уменьшение объема простаты и снижение симптоматики) от приема дутастерида уже через 3 месяца лечения, тогда как другие для достижения эффекта рекомендуют принимать этот препарат в течение как минимум 6 месяцев, далее продолжая терапию в течение 12 месяцев [10] или даже 48 месяцев [5]. В связи с этим целью проведенного нами исследования была оценка эффективности длительного лечения больных с АПЖ дутастеридом.
Материалы и методы
Под нашим наблюдением находились 188 больных с АПЖ, которые получали дутастерид по 0,5 мг 1 раз в сутки. В зависимости от длительности приема дутастерида больные были разделены на 3 группы. У 28 (14,9%) больных (первая группа) курс лечения продолжался в течение 6 месяцев, у 63 (33,5%) больных (вторая группа) – в течение 12 месяцев, а у 97 (51,6%) больных (третья группа) – в течение 24 месяцев непрерывно. Других препаратов для лечения АПЖ пациенты всех трех групп в процессе терапии дутастеридом не получали.
Все больные были обследованы перед назначением дутастерида, в процессе приема препарата и сразу же после завершения курса лечения. Кроме того, 28 пациентов первой группы, 53 из 63 пациентов второй группы и 89 из 97 пациентов третьей группы были обследованы спустя 12–36 месяцев после окончания приема дутастерида для изучения отдаленных результатов проведенной терапии.
Средний возраст пациентов перед назначением дутастерида составил 63,5 ± 4,4 года (от 52 до 80 лет). В исследование не включались больные с увеличением средней доли предстательной железы, склерозом шейки мочевого пузыря, камнями и дивертикулами мочевого пузыря, стриктурами уретры, после оперативных вмешательств на органах малого таза, с выраженными кардиологическими и цереброваскулярными нарушениями, почечной и печеночной недостаточностью.
Исходные показатели симптоматики болезни у наблюдаемых нами пациентов были следующими:
Результаты и обсуждение
К концу лечения показатели клинического течения заболевания улучшились у всех больных АПЖ первой, второй и третьей групп (табл. 1), однако более существенно – у больных третьей группы, получавших дутастерид в течение 24 месяцев непрерывно. Так, у больных первой группы, которые получали дутастерид в течение 6 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 3,3 балла (с 14,1 ± 2,9 до 10,8 ± 3,0), качество жизни (QoL) улучшилось на 1,7 балла (с 4,2 ± 0,6 до 2,5 ± 0,8 баллов), объем предстательной железы уменьшился на 6,2 см3, или на 11% (с 56,5 ± 10,3 до 50,3 ± 8,8 см3), максимальная скорость потока мочи (Qmax) возросла на 2,1 мл/с (с 8,9 ± 0,8 до 11,0 ± 0,9 мл/с).
У больных второй группы, которые получали дутастерид в течение 12 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 6,9 баллов (с 14,1 ± 2,9 до 7,2 ± 2,5), качество жизни (QoL) улучшилось на 2,2 балла (с 4,2 ± 0,6 до 2,0 ± 0,7 баллов), объем предстательной железы уменьшился на 10,3 см3, или на 18,2% (с 56,5 ± 10,3 до 46,2 ± 9,1 см3), максимальная скорость потока мочи (Qmax) возросла на 4,3 мл/с (с 8,9 ± 0,8 до 13,2 ± 0,5 мл/с).
У больных третьей группы, которые получали дутастерид в течение 24 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 9,2 балла (с 14,1 ± 2,9 до 4,9 ± 1,2), качество жизни (QoL) улучшилось на 2,6 балла (с 4,2 ± 0,6 до 1,6 ± 0,8 баллов), объем предстательной железы уменьшился на 14,6 см3, или на 25,9% (с 56,5 ± 10,3 до 41,9 ± 7,1 см3).
Одним из важных объективных показателей эффективности проводимого медикаментозного лечения больных АПЖ является уменьшение объема предстательной железы к концу терапии. Согласно нашим наблюдениям, оказалось, что через 6 месяцев лечения дутастеридом объем предстательной железы уменьшился в среднем на 11%, тогда как через 12 месяцев – уже на 18,2% (p
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
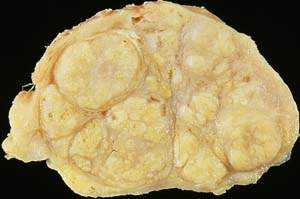 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.