Dupixent что это за препарат
Dupixent что это за препарат
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или желтоватого цвета.
| 1 мл | 1 шприц a | |
| дупилумаб | 150 мг | 300 мг |
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или желтоватого цвета.
| 1 мл | 1 шприц b | |
| дупилумаб | 175 мг | 200 мг |
× На каждую пачку картонную нанесен антиконтрафактный стикер.
a В расчете на 2 мл препарата.
b В расчете на 1.14 мл препарата.
c Содержание L-гистидина и L-гистидина гидрохлорида приведено в пересчете на L-гистидин (М=155.16 г/моль), исходя из общей концентрации гистидина в препарате 20 мМ.
d Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174,2 г/моль), исходя из молярной концентрации L-аргинина в препарате 25 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210.66 г/моль) в одном шприце составляет 10.5 мг.
e Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174.2 г/моль), исходя из молярной концентрации L-аргинина в препарате 50 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210.66 г/моль) в одном шприце составляет 9.93 мг.
f Содержание натрия ацетата тригидрата и уксусной кислоты ледяной приведено, исходя из общей концентрации ацетат иона в препарате 12.5 мМ.
g Содержание сахарозы приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации сахарозы в препарате 5%.
h Содержание полисорбата 80 приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации полисорбата 80 в препарате 0.2%.
Фармакологическое действие
Препарат Дупиксент является рекомбинантным человеческим моноклональным антителом (IgG4), которое блокирует передачу сигналов интерлейкина-4 (ИЛ-4) и интерлейкина-13 (ИЛ-13) путем специфического связывания с IL-4Rα-субъединицей, общей для рецепторных комплексов ИЛ-4 и ИЛ-13. Препарат Дупиксент блокирует передачу сигналов ИЛ-4 через рецепторы I типа (IL-4Rα/γc) и общую передачу сигналов ИЛ-4 и ИЛ-13 через рецепторы II типа (IL-4Rα/IL-13Rα). ИЛ-4 и ИЛ-13 являются ключевыми цитокинами воспаления 2 типа (в т.ч. продуцируемые и Th2-лимфоцитами), вовлеченными в патогенез атопических заболеваний.
Дупилумаб производится с помощью технологии рекомбинантной ДНК в суспензионной культуре клеток яичника китайского хомячка.
Дупилумаб имеет молекулярную массу приблизительно 147 кДа.
В клинических исследованиях лечение препаратом Дупиксент приводило к снижению в сыворотке крови концентраций биомаркеров, связанных с цитокинами воспаления 2 типа, таких как тимус-ассоциированного регуляторного хемокина (TARC/CCL17), общего сывороточного иммуноглобулина Е и аллерген-специфического иммуноглобулина Е. Также наблюдалось снижение активности ЛДГ, биомаркера, связанного со степенью тяжести атопического дерматита и его активностью. Препарат Дупиксент уже в начале 2-й недели лечения вызывал супрессию хемокина TARC по сравнению с плацебо, с тенденцией продолжения его снижения до максимальной и устойчивой супрессии к 12-й неделе лечения.
В соответствии с ингибированием передачи сигналов ИЛ-4 и ИЛ-13, лечение дупилумабом заметно уменьшало уровень FeNO и концентрации эотаксина-3, общего иммуноглобулина Е, аллерген-специфического иммуноглобулина Е, TARC и периостина у пациентов с бронхиальной астмой по сравнению с плацебо. Эти снижения уровней биомаркеров воспаления были сопоставимы для режимов дозирования 200 мг 1 раз в 2 недели и 300 мг 1 раз в 2 недели и были близки к максимальному подавлению через 2 недели лечения, за исключением иммуноглобулина Е, который уменьшался медленнее. Описанные эффекты были устойчивыми во время лечения.
Хронический полипозный риносинусит
У участников исследований с хроническим полипозным риносинуситом (ХПРС) на фоне лечения дупилумабом также наблюдалось снижение в моче уровня лейкотриена 4 (LTE4), маркера, связанного с активацией тучных клеток, базофилов и эозинофилов.
Эффективность и безопасность препарата Дупиксент в монотерапии или в сочетании с топическими ГКС оценивали в трех основных рандомизированных, двойных слепых, плацебо-контролируемых исследованиях (SOLO1, SOLO2 и CHRONOS) с участием 2119 пациентов в возрасте 18 лет и старше со среднетяжелым и тяжелым течением атопического дерматита.
16-недельные исследования монотерапии (SOLO1 и SOLO2)
Эффекты лечения в подгруппах (с распределением на подгруппы по массе тела, возрасту, полу, расе и сопутствующей терапии, в т.ч. с применением иммунодепрессантов) в исследованиях SOLO1 и SOLO2 в целом согласуются с результатами, полученными в общей исследуемой популяции.
52-недельное клиническое исследование с одновременным применением топических ГКС (CHRONOS)
У пациентов, которым не рекомендовалось лечение циклоспорином или оно было неэффективно, монотерапия препаратом Дупиксент в обеих группах лечения, приводила к значительному улучшению признаков и симптомов атопического дерматита по сравнению с плацебо. Больший процент пациентов, получавших Дупиксент, по сравнению с группой плацебо достигал IGA 0 или 1 и снижения по сравнению с исходным значением на ≥2 балла к 16-й неделе (29.5% против 6.8%), EASI-75 к 16-й неделе (38% против 11.4%), а также снижения не менее чем на 4 балла индекса тяжести зуда от исходного значения к 16-й неделе (34.9% по сравнению с 8%) (р Подростки в возрасте от 12 до 17 лет
Эффективность и безопасность применения препарата Дупиксент в монотерапии у пациентов оценивалась в мультицентровом, рандомизированном, двойном-слепом, плацебо-контролируемом исследовании (AD-1536) с участием 251 пациента в возрасте от 12 до 17 лет с атопическим дерматитом средне-тяжелого и тяжелого течения. Соответствующие пациенты, включенные в данное исследование, продемонстрировали неадекватный ответ на предварительную терапию топическими препаратами.
Пациенты получали: начальную дозу 400 мг препарата Дупиксент (2 инъекции по 200 мг) с последующим введением 200 мг каждые 2 недели для пациентов с базовой массой тела менее 60 кг или начальную дозу препарата Дупиксент 600 мг (2 инъекции по 300 мг) с последующим введением 300 мг каждые 2 недели для пациентов с базовой массой тела более 60 кг; либо начальную дозу препарата Дупиксент 600 мг (2 инъекции по 300 мг) с последующим введением 300 мг каждые 4 недели независимо от массы тела; либо плацебо.
Дупиксент вводят п/к. При необходимости контролировать недопустимые симптомы пациентам разрешалось получать скоропомощное лечение по решению исследователя. Пациенты, которые получали такое лечение, были оценены как не отвечающие на терапию препаратом Дупиксент.
В данном исследовании средний возраст пациентов составлял 14.5 лет, средний вес 59.4 кг, 41.0% пациентов были женщины, 62.5% белокожие, 15.1% азиаты и 12.0% темнокожие. В целом, 92.0% пациентов имели как минимум одно коморбидное аллергическое состояние; у 65.5% пациентов наблюдался аллергический ринит; у 53.6% пациентов была бронхиальная астма и у 68% пациентов наблюдалась пищевая аллергия.
Показателя общей оценки исследователя (IGA) 0 или 1 («чистая» или «почти чистая кожа») к 16-й неделе лечения в исследовании AD-1526 достигли 24.4% пациентов, получавших Дупиксент в дозе 300 мг 1 раз в 2 недели (≥ 60 кг) или 200 мг 1 раз в 2 недели ( Дети в возрасте от 6 до 11 лет
Эффективность и безопасность применения препарата Дупиксент у пациентов детского возраста в сочетании с топическими ГКС изучалась в многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании (AD-1652) с участием 367 пациентов в возрасте от 6 до 11 лет с атопическим дерматитом, характеризующимся значениями IGA ≥4 (по шкале от 0 до 4), EASI ≥21 (по шкале от 0 до 72), а также минимальной пораженной площади поверхности тела ≥15%. У подходящих пациентов, включенных в это исследование, ранее наблюдался недостаточный ответ на топические препараты. Пациентов стратифицировали в зависимости от массы тела на исходном уровне ( Клинический ответ
Показателя общей оценки исследователя (IGA) 0 или 1 («чистая» или «почти чистая кожа») к 16-й неделе лечения в исследовании AD-1652 достигли 29.5% пациентов c массой тела менее 30 кг, получавших Дупиксент в дозе 300 мг 1 раз в 4 недели, против 13.1% в группе плацебо; 39.0% пациентов с массой тела 30 и более кг, получавших Дупиксент в дозе 200 мг 1 раз в 2 недели, против 9.7% в группе плацебо.
Улучшение не менее чем на 75% от исходного значения по индексу тяжести и площади экземы (EASI-75) к 16-й неделе лечения в исследовании AD-1652 достигли 75.4% пациентов c массой тела менее 30 кг, получавших Дупиксент в дозе 300 мг 1 раз в 4 недели, против 27.9% в группе плацебо; 74.6% пациентов с массой тела 30 и более кг, получавших Дупиксент в дозе 200 мг 1 раз в 2 недели, против 25.8% в группе плацебо.
Не менее чем 4-бального уменьшения зуда по пиковым значениям числовой шкалы оценки выраженности зуда (NRS) к 16-й неделе лечения в исследовании AD-1652 достигли 54.1% пациентов c массой тела менее 30 кг, получавших Дупиксент в дозе 300 мг 1 раз в 4 недели, против 11.7% в группе плацебо; 61.4% пациентов с массой тела 30 и более кг, получавших Дупиксент в дозе 200 мг 1 раз в 2 недели, против 12.9% в группе плацебо.
Значительно больший процент пациентов, получавших Дупиксент, достигал быстрого улучшения по шкале оценки тяжести зуда NRS по сравнению с пациентами в группе плацебо (определяемого как ≥ 4-балльное улучшение уже на 2-й неделе), причем процент пациентов, у которых наблюдалось уменьшение тяжести зуда по шкале NRS, продолжал увеличиваться в течение всего периода лечения.
Значительно больший процент пациентов, рандомизированных на терапию препаратом Дупиксент в сочетании с топическими ГКС, достиг быстрого улучшения по шкале оценки выраженности зуда (NRS) по сравнению с плацебо (улучшение ≥4 балла на 4-й неделе).
Долгосрочная эффективность терапии препаратом Дупиксент в сочетании с топическими ГКС у пациентов детского возраста с атопическим дерматитом, которые принимали участие в предшествующих клинических исследованиях препарата Дупиксент в сочетании с топическими ГКС изучалась в продолженном открытом исследовании (AD-1434). Данные по эффективности из этого исследования позволяют предположить, что клиническое улучшение, наблюдавшееся на 16 неделе, сохранялось в течение 52 недель терапии включительно.
Было проведено три рандомизированных, двойных слепых, плацебо-контролируемых, многоцентровых исследования в параллельных группах (DRI12544, QUEST и VENTURE) продолжительностью от 24 до 52 недель с участием 2888 пациентов (в возрасте 12 лет и старше). Во все три исследования пациенты были включены независимо от минимального исходного уровня эозинофилов или другого биомаркера воспаления 2 типа (например, уровня FeNO или иммуноглобулина Е).
Обострения бронхиальной астмы
В объединенном анализе исследований DRI12544 и QUEST частота тяжелых обострений, приводящих к госпитализации и/или посещениям отделений неотложной помощи, снизилась на 25.5% и 46.9% при применении препарата Дупиксент в дозах 200 мг или 300 мг 1 раз в 2 недели соответственно.
Кумулятивное среднее число тяжелых обострений было более низкое у пациентов, получавших препарат Дупиксент по сравнению с плацебо в исследованиях DRI12544, QUEST и VENTURE (в общей популяции и в популяции с исходным числом эозинофилов ≥150 клеток/мкл или FeNO ≥25 ppb) в течение 24- или 52-недельного периода лечения в обеих группах режимов дозирования препарата.
В исследовании QUEST у пациентов, получавших ингаляционные ГКС в средней дозе, наблюдалось сходное снижение частоты тяжелых обострений астмы по сравнению с пациентами, получавшими ингаляционные ГКС в высокой дозе.
Клинически значимое увеличение предбронходилатационного значения объема форсированного выдоха за 1-ю секунду (ОФВ1) наблюдалось на 12-й неделе в общей популяции независимо от уровня эозинофилов или других биомаркеров воспаления 2 типа (например, FeNO или иммуноглобулин Е). В исследованиях DRI12544, QUEST и VENTURE, по сравнению с плацебо, большее улучшение ОФВ1 наблюдалось также у пациентов с FeNO ≥25 ppb. Улучшение ОФВ1 было одинаковым, независимо от того, получали ли пациенты ингаляционные ГКС в средней дозе, ингаляционные ГКС в высокой дозе или пероральные ГКС.
Значительные улучшения ОФВ1 наблюдались уже в течение второй недели (DRI12544, QUEST и VENTURE) после первой инъекции препарата Дупиксент в дозе как 200 мг, так и 300 мг и сохранялись в течение 24 недель (DRI12544 и VENTURE) и 52 недель (QUEST).
Скорректированная средняя разность абсолютных значений ОФВ1 была 0.20 л и 0.14 л в группах, получавших Дупиксент 200 мг 1 раз в 2 недели, по сравнению с плацебо; 0.16 и 0.13 л в группах, получавших 300 мг 1 раз в 2 недели по сравнению с плацебо, соответственно в исследованиях DRI12544 и QUEST. Соответствующее процентное изменение ОФВ1 составляло от 9.2 до 11.9% для дозы 200 мг 1 раз в 2 недели и от 9.4 до 11.7% для дозы 300 мг 1 раз в 2 недели. Скорректированная средняя разность абсолютных значений пре-бронходилатационного ОФВ1 от исходного уровня к 24-й неделе (достаточное время для достижения максимального снижения дозы пероральных ГКС) в исследовании VENTURE составила 0.22 л в группе применения препарата Дупиксент по сравнению с плацебо, что соответствовало улучшению на 15.1% по сравнению с исходным уровнем.
Кроме того, у пациентов, получавших препарат Дупиксент, значительно улучшился пост-бронходилатационный показатель ОФВ1 по сравнению с исходным уровнем на 12-й и 52-й неделях по сравнению с плацебо, что указывает на то, что препарат Дупиксент улучшает фиксированную обструкцию дыхательных путей. В группе применения препарата Дупиксент в течение года наблюдения не было зарегистрировано снижения функции легких с учетом значения пост-бронходилатационного значения ОФВ1.
Снижение дозы пероральных ГКС
В исследовании VENTURE оценивалось влияние препарата Дупиксент на снижение применения поддерживающих пероральных ГКС. Исходная средняя доза пероральных кортикостероидов составляла 11.75 мг в группе плацебо и 10.75 мг в группе, получавшей препарат Дупиксент. По сравнению с плацебо, у пациентов, получавших Дупиксент, отмечалось большее снижение ежедневной дозы пероральных ГКС при сохранении контроля над астмой. Среднее общее снижение ежедневной дозы пероральных ГКС при сохранении контроля над астмой составляло 70.1% по сравнению с исходным уровнем у пациентов, получавших Дупиксент и 41.9% в группе плацебо.
Исходы, сообщаемые пациентами
Кроме того, во всех 3 исследованиях Дупиксент обеспечил клинически значимое улучшение показателей контроля бронхиальной астмы в общей популяции по сравнению с группой плацебо, о чем свидетельствуют показатели ACQ-5 и соответствующее улучшение качества жизни, измеренное по шкале AQLQ(S). Улучшение показателей ACQ-5 и AQLQ(S) были зарегистрированы уже через 2 недели, и это улучшение сохранялось на протяжении 24 недель в исследовании DRI12544 и 52 недель в исследовании QUEST. В общей популяции исследования QUEST доля пациентов, ответивших на лечение, что выражалось в достижении минимального клинически значимого различия показателей ACQ-5 и AQLQ(S), была существенно выше к 52-й неделе в группе, получавшей обе дозы препарата Дупиксент.
Долгосрочное продленное исследование (TRAVERSE)
Долгосрочную эффективность препарата Дупиксент у 2282 взрослых и подростков со среднетяжелой и тяжелой бронхиальной астмой, и у взрослых пациентов с гормонозависимой астмой, которые принимали участие в предыдущих клинических исследованиях препарата Дупиксент, оценивали в рамках открытого продленного исследования (TRAVERSE). В данном исследовании препарата Дупиксент улучшение клинических показателей, в т.ч. снижение количества обострений и улучшение функции легких, сохранялось в течение 96 недель. У пациентов с гормонозависимой астмой, несмотря на продолжающееся снижение или отмену пероральных ГКС, отмечалось снижение количества обострений и устойчивое улучшение функции легких в течение 96 недель.
Хронический полипозный риносинусит
Регистрационный номер:
Торговое наименование препарата:
Международное непатентованное наименование:
Лекарственная форма:
раствор для подкожного введения.
Состав
| Ингредиент | Количество (дозировка 50 мг/мл) | Количество (дозировка 175 мг/мл) | ||
| в 1 мл | в шприце a | в 1 мл | в шприце b | |
| Действующее вещество | ||||
| Дупилумаб | 150 мг | 300 мг | 175 мг | 200 мг |
| Вспомогательные вещества | ||||
| L-гистидин | 3,1 мг c | 6,2 мг c | 3,1 мг c | 3,54 мг c |
| L-гистидина гидрохлорида моногидрат | ||||
| L-аргинина гидрохлорид | 4,35 мг d | 8,7 мг d | 10,51 мг e | 12,01 мг e |
| Натрия ацетата тригидрат | 0,75 мг f | 1,5 мг f | 0,75 мг f | 0,86 мг f |
| Уксусная кислота ледяная | ||||
| Сахароза | 50 мг g | 100 мг | 49,88 мг g | 57,00 мг |
| Полисорбат-80 | 2 мг i | 4 мг | 2 мг i | 2,28 мг |
| Вода для инъекций | до 1,0 мл | до 2,0 мл | до 1,0 мл | до 1,14 мл |
a ) В расчете на 2,0 мл препарата.
b ) В расчете на 1,14 мл препарата.
c ) Содержание L-гистидина и L-гистидина гидрохлорида приведено в пересчете на L-гистидин (М=155,16 г/моль), исходя из общей концентрации гистидина в препарате 20 мМ.
d ) Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174,20 г/моль), исходя из молярной концентрации L-аргинина в препарате 25 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210,66 г/моль) в одном шприце составляет 10,5 мг.
e ) Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М= 174,20 г/моль), исходя из молярной концентрации L-аргинина в препарате 50 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210,66 г/моль) для дозировки 175 мг/мл составляет 9,93 мг.
f ) Содержание натрия ацетата тригидрата и уксусной кислоты ледяной приведено, исходя из общей концентрации ацетат иона в препарате 12,5 мМ.
g ) Содержание сахарозы приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации сахарозы в препарате 5%.
h ) Содержание полисорбата-80 приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации полисорбата-80 в препарате 0,2%.
Описание
Прозрачная или слегка опалесцирующая, бесцветная или желтоватого цвета жидкость.
Фармакотерапевтическая группа:
Код ATX:
Фармакологические свойства
Механизм действия
Препарат Дупиксент ® является рекомбинантным человеческим моноклональным антителом (IgG4), которое блокирует передачу сигналов интерлейкина-4 (ИЛ-4) и интерлейкина-13 (ИЛ-13) путем специфического связывания с 1L-4Rа-субъединицей, общей для рецепторных комплексов ИЛ-4 и ИЛ-13. Препарат Дупиксент ® блокирует передачу сигналов ИЛ-4 через рецепторы I типа (IL-4Rα/γc) и общую передачу сигналов ИЛ-4 и ИЛ-13 через рецепторы II типа (IL-4Rα/IL-13Ra). ИЛ-4 и ИЛ-13 являются ключевыми цитокинами воспаления 2-го типа (в том числе продуцируемые и Th2-лимфоцитами), вовлеченными в патогенез атопических заболеваний.
Воспаление 2-го типа играет важную роль в патогенезе многих атонических заболеваний, включая бронхиальную астму, способствует ограничению воздушного потока и увеличивает риск обострений. ИЛ-4 и ИЛ-13 выступают в качестве основных факторов воспаления 2-го типа, активируя множественные типы клеток (например, тучные клетки, лимфоциты, эозинофилы, нейтрофилы, макрофаги) и индуцируя множественные медиаторы (например, иммуноглобулин Е, гистамин, эйкозаноиды, лейкотриены, хемокины и цитокины, включая эотаксин/CCL11, TARC/CCL17 и ИЛ-5), участвующие в воспалении 2-го типа. Блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом у пациентов снижает концентрации многих из этих маркеров воспаления 2-го типа, включая иммуноглобулин Е, периостин и множественные провоспалительные цитокины и хемокины (например, эотаксин, TARC), а также снижает уровень фракции оксида азота в выдыхаемом воздухе (FeNO) – маркер воспаления в легких. Было показано, что блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом в гуманизированных моделях животных предотвращает последующие действия этих цитокинов и хемокинов, в том числе гиперплазию бокаловидных клеток, гиперреактивность гладкомышечных клеток дыхательных путей, эозинофильное воспаление в легких, другие воспалительные процессы в легких, а также предотвращает нарушение функции легких; при этом снижение выраженности эозинофильного воспаления в легких происходит независимо от нормального или повышенного уровня эозинофилов в крови.
Дупилумаб производится с помощью технологии рекомбинантной ДНК в суспензионной культуре клеток яичника китайского хомячка.
Дупилумаб имеет молекулярную массу приблизительно 147 кДа.
Показания к применению
Противопоказания
Повышенная чувствительность к дупилумабу или любому из вспомогательных веществ препарата (см. раздел «Особые указания).
Детский возраст до 18 лет у пациентов с атопическим дерматитом среднетяжелого и тяжелого течения в связи с неустановленными эффективностью и безопасностью.
Детский возраст до 12 лет у пациентов с бронхиальной астмой среднетяжелого и тяжелого течения в связи с неустановленными эффективностью и безопасностью.
С осторожностью
При беременности (только если ожидаемая польза превышает потенциальный риск для плода).
Применение при беременности и в период грудного вскармливания
Беременность
Имеются лишь ограниченные данные по применению дупилумаба у беременных женщин. В исследованиях, проведенных на животных, прямых и косвенных неблагоприятных эффектов в отношении репродуктивной токсичности не обнаружено. Препарат Дупиксент ® можно применять во время беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Неизвестно, экскретируется ли дупилумаб в грудное молоко человека. Следует, с учетом пользы грудного вскармливания для ребенка и преимущества дальнейшего применения препарата для матери, принять решение о прекращении кормления грудью или отмене препарата Дупиксент ® в течение периода грудного вскармливания.
Способ применения и дозы
Общие рекомендации
Препарат Дупиксент ® вводится подкожно.
Атопический дерматит
• Рекомендуемая доза препарата Дупиксент ® у взрослых пациентов: начальная доза – 600 мг (2 инъекции по 300 мг), далее – по 300 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно.
В случае пропуска дозы пациент должен получить инъекцию как можно скорее и затем продолжить лечение в соответствии с назначенным ему режимом введения препарата.
Особые группы пациентов
Дети
Безопасность и эффективность препарата Дупиксент ® у детей и подростков до 18 лет с атопическим дерматитом не установлена.
Безопасность и эффективность препарата Дупиксент ® у детей в возрасте до 12 лет с бронхиальной астмой не установлена.
Пациенты пожилого возраста
У пациентов пожилого возраста коррекции дозы не требуется (см. раздел «Фармакокинетика»).
Печеночная недостаточность
Отсутствуют данные по применению препарата у пациентов с печеночной недостаточностью (см. раздел «Фармакокинетика»).
Почечная недостаточность
У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. Отсутствуют данные по применению препарата у пациентов с тяжелой почечной недостаточностью (см. раздел «Фармакокинетика»).
Масса тела
Не требуется коррекции режима дозирования в зависимости от массы тела пациента (см. раздел «Фармакокинетика»).
Побочное действие
Атопический дерматит
Для описания частоты встречаемости нежелательных реакций используется следующая классификация: очень часто ≥10%; часто ≥1% и a
Профиль безопасности комбинированного лечения препаратом Дупиксент ® + топические ГКС в течение 52 недель соответствует профилю его безопасности, наблюдавшемуся к 16-й неделе.
Бронхиальная астма
Табл. 2. Нежелательные реакции, наблюдавшиеся в клинических исследованиях у пациентов с бронхиальной астмой
| Системно-органный класс | Частота | Нежелательные реакции |
| Общие нарушения и нарушения в месте введения препарата | Очень часто | Эритема в месте инъекции (14,6%) |
| Часто | Отек в месте инъекции (4,8%) | |
| Часто | Зуд в месте инъекции (4,7%) | |
| Очень редко | Анафилаксия (0,04%) |
Взаимодействие с другими лекарственными средствами
Живые вакцины
Применение препарата Дупиксент ® с живыми вакцинами не изучалось.
Во время лечения препаратом Дупиксент ® не следует проводить вакцинацию живыми вакцинами.
Неживые (инактивированные) вакцины
Иммунные реакции на вакцинацию изучались в исследовании, в котором пациенты с атопическим дерматитом получали еженедельно препарат Дупиксент ® в дозе 300 мг в течение 16 недель. После 12 недель терапии дупилумабом пациентов вакцинировали вакциной Tdap (Т-клеточно-зависимая, Adacel ® ) и менингококковой полисахаридной вакциной (Т-клеточно-независимая, Menomune ® ) и оценивали иммунные реакции по истечении 4 недель. У пациентов, получавших как дупилумаб, так и плацебо, реакции с образованием антител к противостолбнячной и менингококковой полисахаридной вакцинам были сходными. В этом исследовании не было обнаружено нежелательных взаимодействий между любой из этих неживых вакцин и дупилумабом.
Взаимодействие с субстратами изоферментов СУР450
В клиническом исследовании, проведенном у пациентов с атопическим дерматитом, оценивались эффекты дупилумаба на фармакокинетику субстратов изоферментов CYP. Данные, полученные в этом исследовании, не указывают на клинически значимое влияние дупилумаба на активность изоферментов CYP1A2, CYP3A, CYP2C19, CYP2D6 или CYP2C9.
Взаимодействие с другими лекарственными средствами для лечения бронхиальной астмы
Влияние дупилумаба на фармакокинетику одновременно назначаемых препаратов не ожидается. Данные, полученные на основании популяционного анализа, не указывают на влияние одновременно назначаемых препаратов на фармакокинетику дупилумаба у пациентов со среднетяжелым или тяжелым течением бронхиальной астмы.
Особые указания
Влияние на способность управлять транспортными средствами и механизмами
Препарат Дупиксент ® не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами.
Форма выпуска
Раствор для подкожного введения, 150 мг/мл, 175 мг/мл.
Для дозировки 150 мг/мл:
По 2,00 мл в одноразовый шприц/шприц с системой защиты из прозрачного стекла (тип I), снабженный несъемной иглой из нержавеющей стали, защищенной колпачком из мягкого эластомера с/без твердой крышкой(-и).
По 1 или 2 шприца/шприца с системой защиты с инструкцией по применению в картонную пачку с заклеенными клапанами.
Или
По 2 шприца/шприца с системой защиты в промежуточную картонную упаковку, по 3 промежуточных картонных упаковки с инструкцией по применению в картонную пачку с заклеенными клапанами.
На каждую картонную пачку нанесен анти контрафактный стикер.
Для дозировки 175 мг/мл:
По 1,14 мл в одноразовый шприц с системой защиты из прозрачного стекла (тип I), снабженный несъемной иглой из нержавеющей стали, защищенной колпачком из мягкого эластомера с/без твердой крышкой(-и).
По 1 или 2 шприца с системой защиты с инструкцией по применению в картонную пачку с заклеенными клапанами.
Или
По 2 шприца с системой защиты в промежуточную картонную упаковку, по 3 промежуточных картонных упаковки с инструкцией по применению в картонную пачку с заклеенными клапанами.
На каждую картонную пачку нанесен анти контрафактный стикер.
Условия хранения
Хранить при температуре от 2 до 8 °С в оригинальной упаковке для защиты от света. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
Для дозировки 150 мг/мл – 24 мес.
Для дозировки 175 мг/мл – 18 мес.
Не использовать после окончания срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение
АО Санофи-авентис груп, Франция.
Производитель
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Кук Фармика ЛЛС, США (150 мг/мл; шприцы)
Фасовщик (первичная упаковка)
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Кук Фармика ЛЛС, США (150 мг/мл; шприцы)
Упаковщик (вторичная (потребительская) упаковка)
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Кук Фармика ЛЛС, США (150 мг/мл; шприцы)
Выпускающий контроль качества
Санофи-Авентис Дойчланд ГмбХ, Германия (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Sanofi-Aventis Deutschland GmbH, Germany.
Industriepark Hoechst – Brueningstrasse 50
H500, H590, H600 65926 Frankfurt am Main, Germany.
Санофи Винтроп Индустрия, Франция (150 мг/мл, 175 мг/мл; шприцы, шприцы с системой защиты)
Sanofi Winthrop Industrie, France.
1051 boulevard Industriel 76580 Le Trait, France.
Претензии потребителей направлять по адресу в России:
АО «Санофи Россия».
125009, г. Москва, ул. Тверская, 22.
Перед началом применения препарата Дупиксент ® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
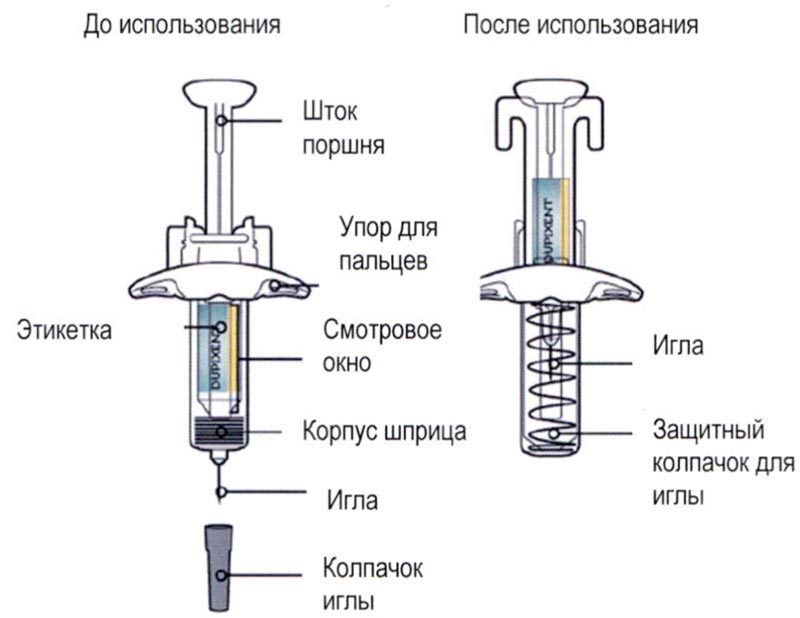
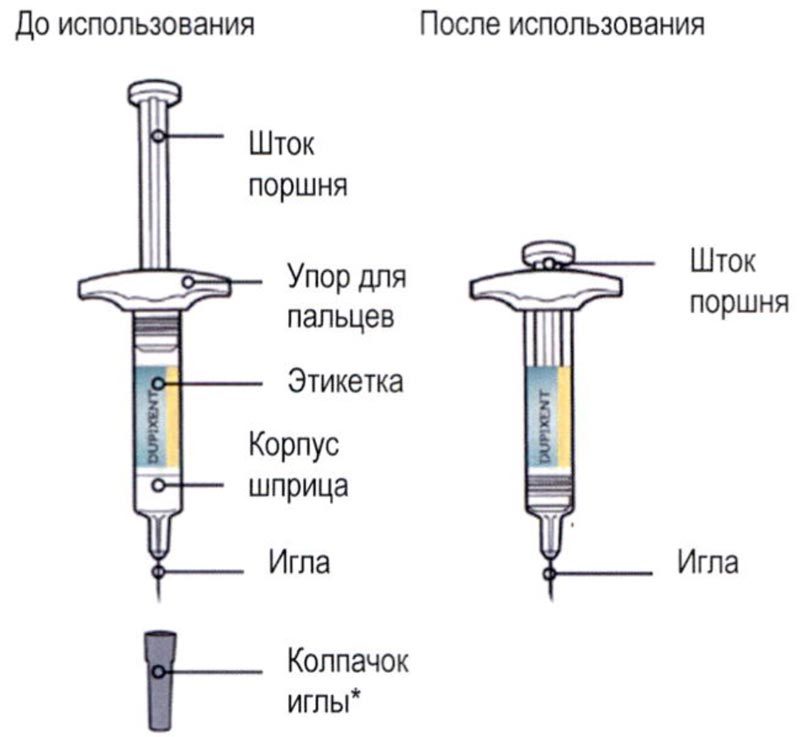
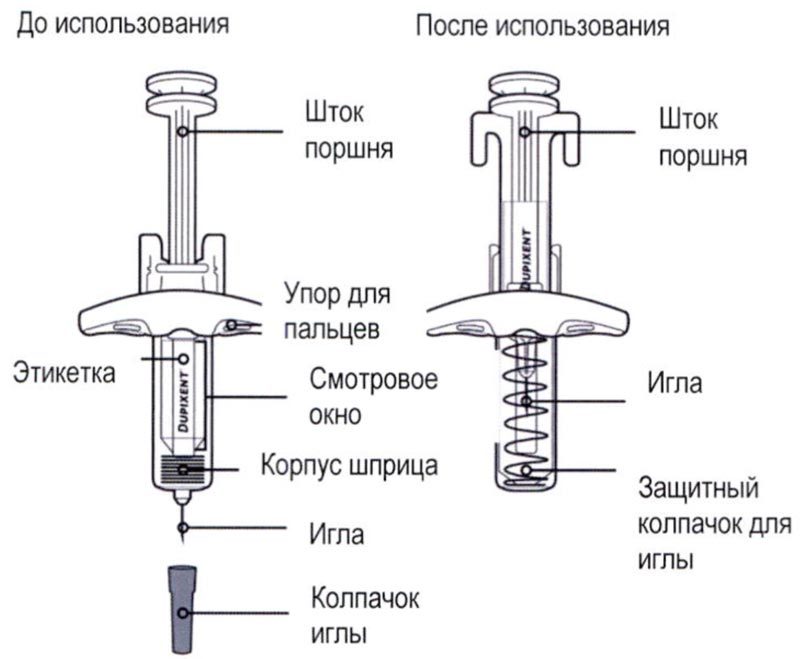
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:
Важная информация
Как хранить шприц
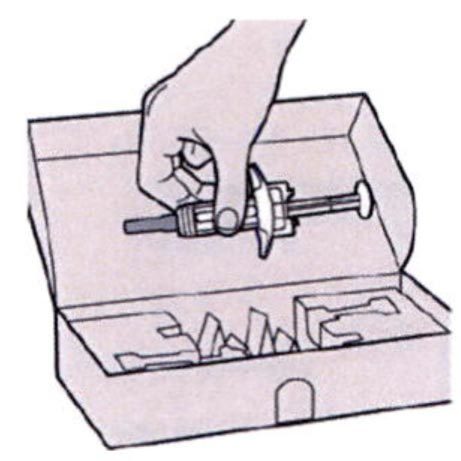
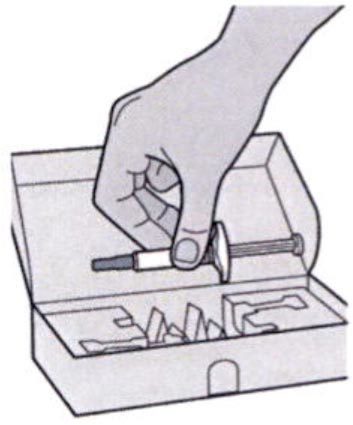
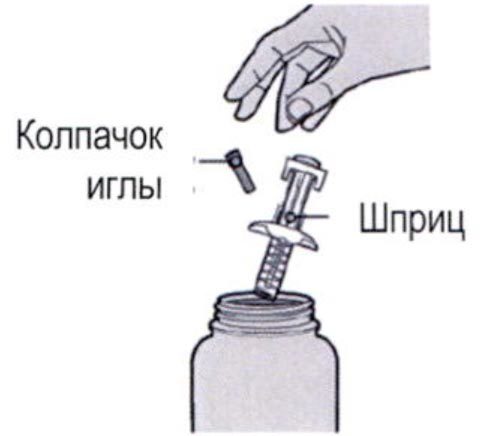
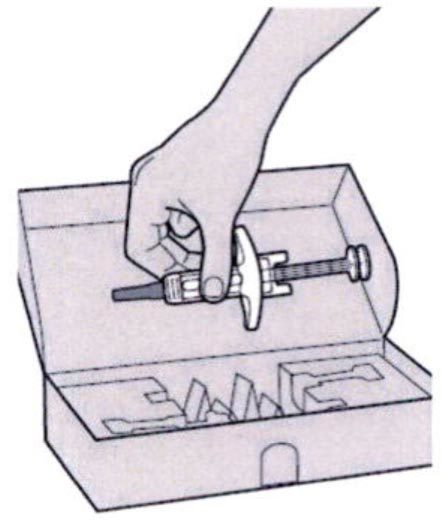
Шаг 1: Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твёрдую поверхность или повреждён.
Шаг 2: Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
— предварительно заполненный шприц;
— 1 салфетка, смоченная спиртом;*
— 1 ватный тампон или марлевая салфетка;*
— устойчивый к проколам контейнер* (см. Шаг 12).
* не содержатся в картонной упаковке.
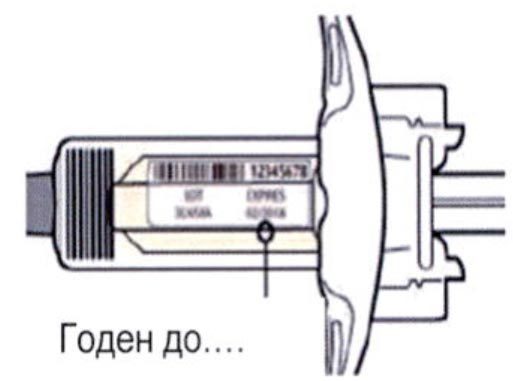
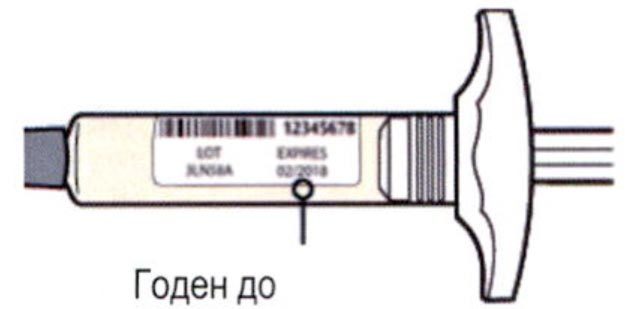
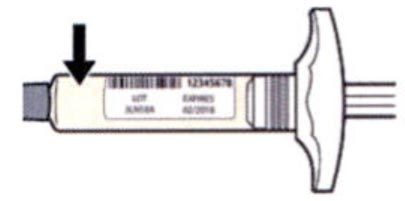
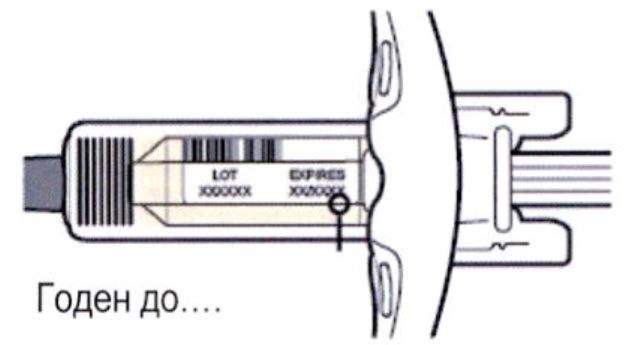
Внимательно проверьте маркировку:
— проверьте дату истечения срока годности;
— убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.
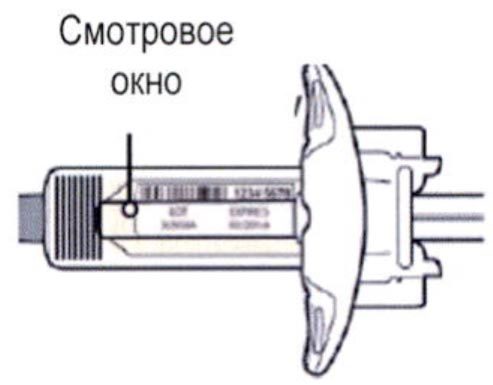
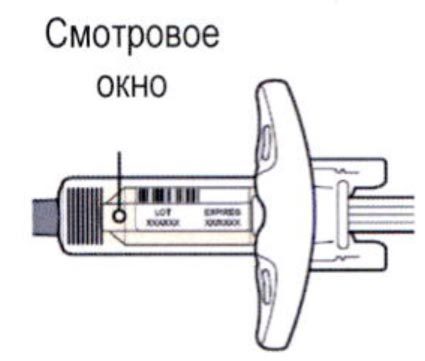
Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.
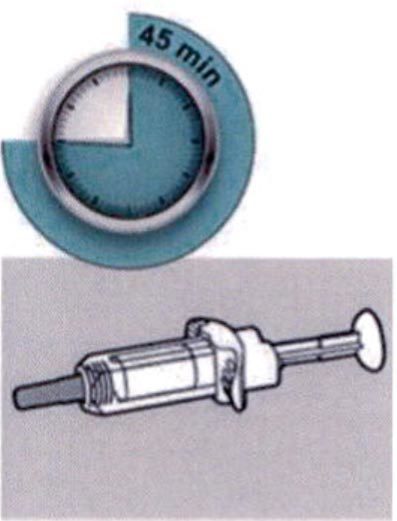
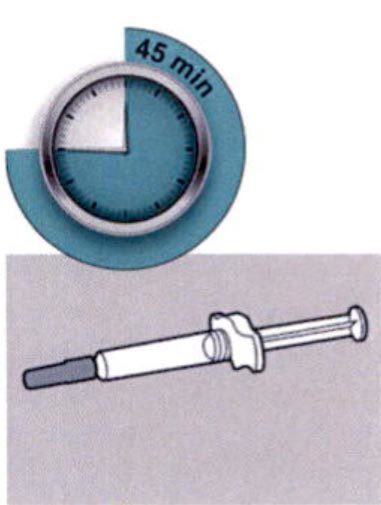
Шаг 4: Подождите 45 мин
Положите шприц на плоскую поверхность, не менее чем на 45 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
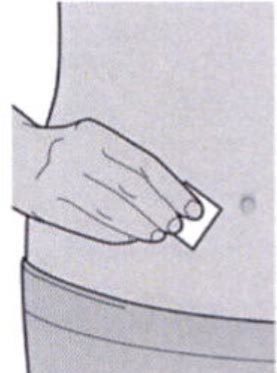
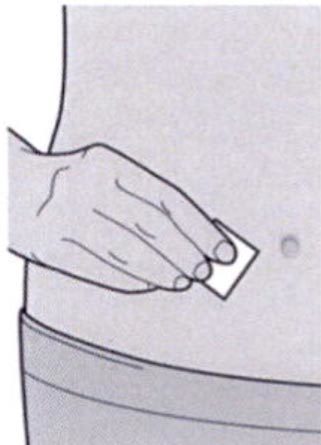
Шаг 5: Выбор места инъекции
Выберите место инъекции.
— Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
— Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент ® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.
Шаг 6: Обработка места инъекции
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.
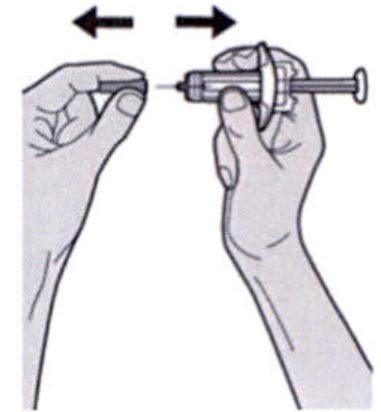
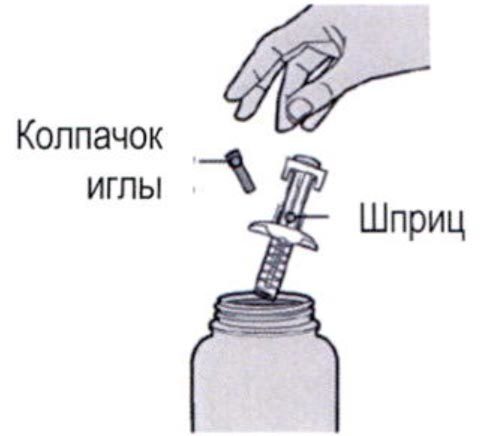
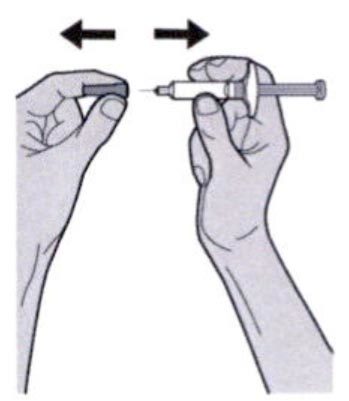
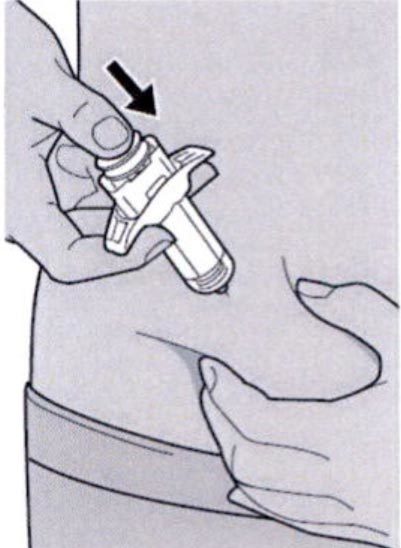
Шаг 7: Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас, и снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
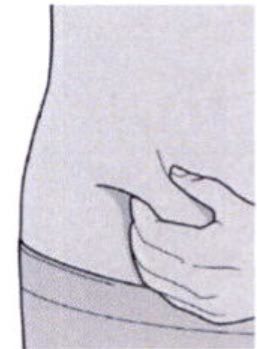
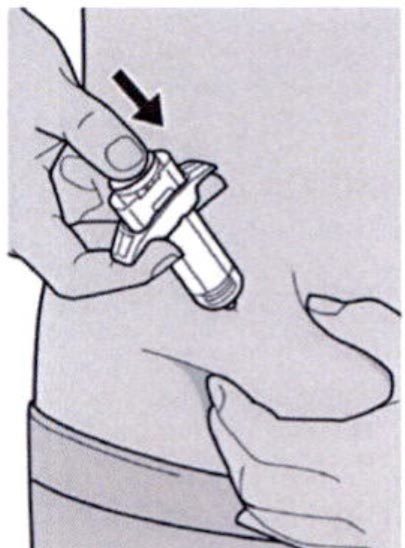
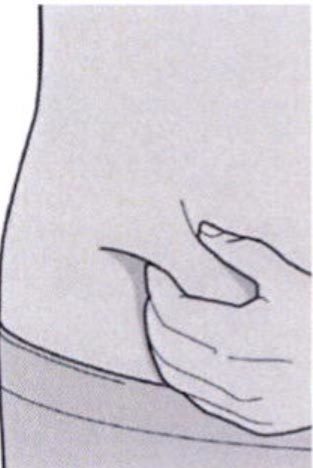
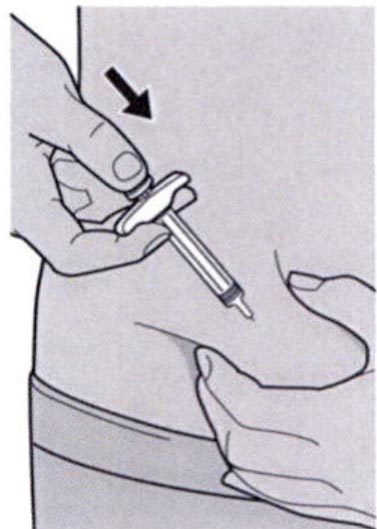
Шаг 8: Формирование складки кожи
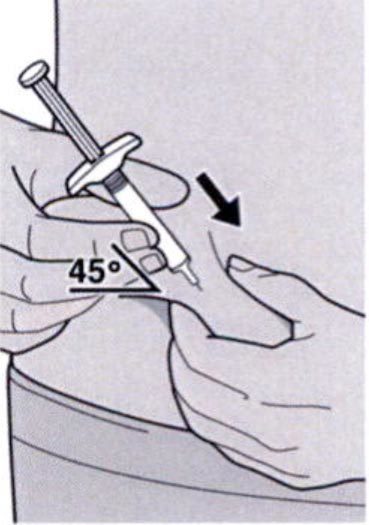
Сформируйте складку кожи в месте инъекции, как показано на рисунке.
Шаг 9: Введение иглы
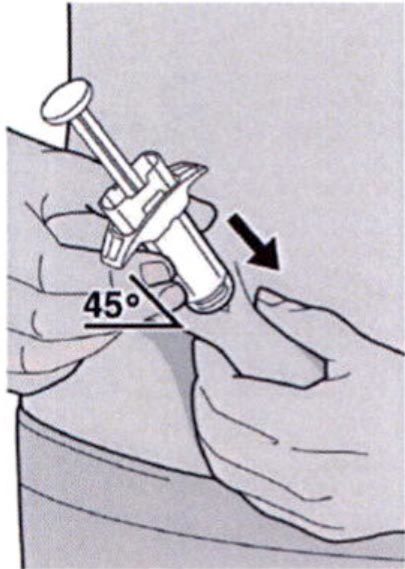
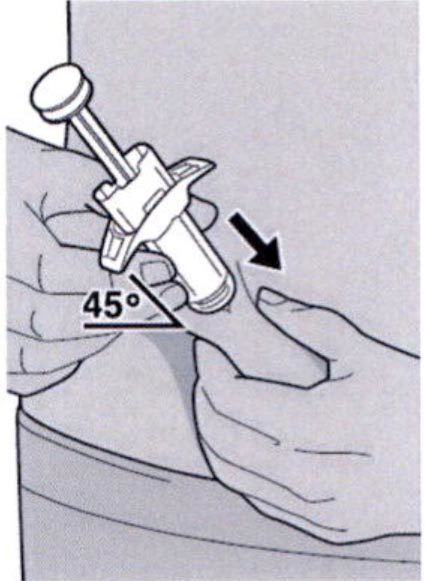
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.
Шаг 10: Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
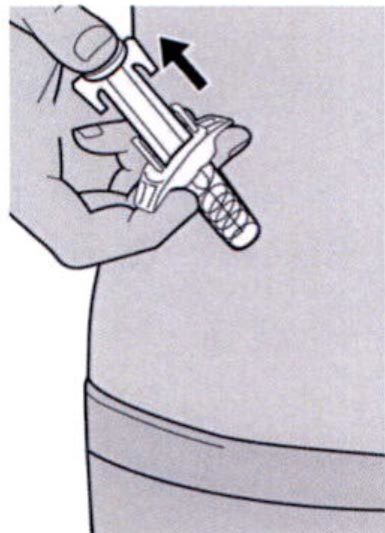
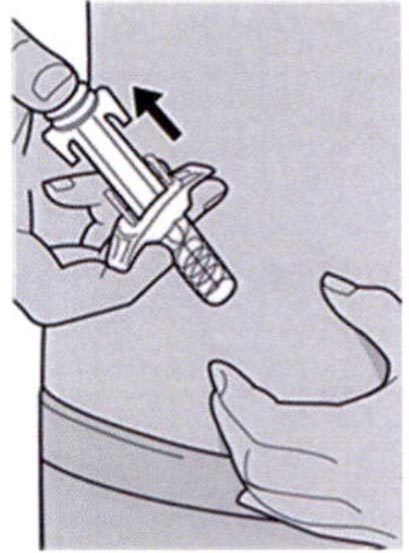
Шаг 11: Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы, а затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.
Шаг 12: Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
Перед началом применения препарата Дупиксент ® в предварительно заполненном одноразовом шприце внимательно прочитайте эту инструкцию. Элементы предварительно заполненного шприца показаны на рисунке ниже:
Важная информация
Как хранить шприц
Шаг 1: Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он был повреждён.
Шаг 2: Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
— предварительно заполненный шприц;
— 1 салфетка, смоченная спиртом;*
— 1 ватный тампон или марлевая салфетка;*
— устойчивый к проколам контейнер* (см. Шаг 12).
* не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
— проверьте дату истечения срока годности;
— убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.
Шаг 3. Проверка
Осмотрите раствор в шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок. Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.
Шаг 4: Подождите 45 мин
Положите шприц на плоскую поверхность, не менее чем на 45 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей. Шприц нельзя хранить при комнатной температуре более 14 дней.
Шаг 5: Выбор места инъекции
Выберите место инъекции.
— Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
— Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент ® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.
Этап 6: Обработка участка инъекции
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.
Шаг 7: Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас, и снимите колпачок иглы.
Не надевайте колпачок иглы обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
Шаг 8: Формирование складки кожи
Сформируйте складку кожи на участке инъекции, как показано на рисунке.
Шаг 9: Введение иглы
Полностью введите иглу в сформированную складку под углом приблизительно 45°.
Шаг 10: Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
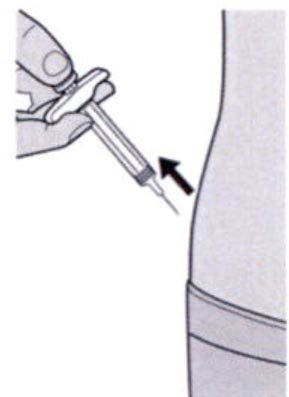
Шаг 11: Извлечение иглы
Извлеките иглу из кожи под тем же углом, под которым она была введена.
Не надевайте колпачок иглы снова на иглу.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не растирайте кожу после инъекции.
Шаг 12: Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.
Перед началом применения препарата Дупиксент ® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:
Важная информация
Как хранить шприц
Шаг 1: Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твёрдую поверхность или повреждён.
Шаг 2: Подготовка
Убедитесь, что у Вас есть все необходимое для проведения инъекции:
— предварительно заполненный шприц;
— 1 салфетка, смоченная спиртом;*
— 1 ватный тампон или марлевая салфетка;*
— устойчивый к проколам контейнер* (см. Шаг 12).
* не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
— проверьте дату истечения срока годности;
— убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.
Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.
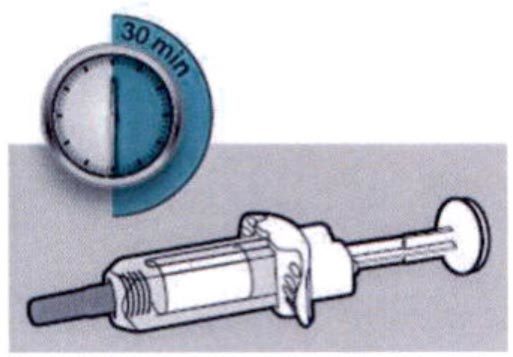
Шаг 4: Подождите 30 мин
Положите шприц на плоскую поверхность, не менее чем на 30 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
Шприц нельзя хранить при комнатной температуре более 14 дней.
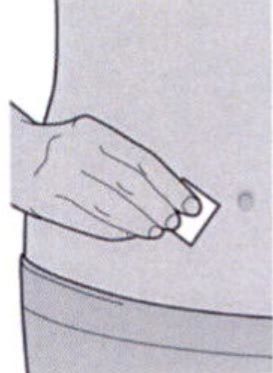
Шаг 5: Выбор места инъекции
Выберите место инъекции.
— Вы можете сделать инъекцию в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка.
— Если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент ® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.
Шаг 6: Обработка места инъекции
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.
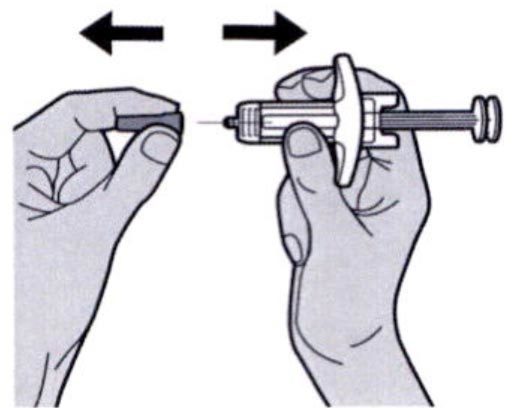
Шаг 7: Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас, и снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.
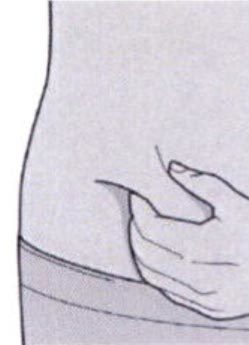
Шаг 8: Формирование складки кожи
Сформируйте складку кожи в месте инъекции, как показано на рисунке.
Шаг 9: Введение иглы
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.
Шаг 10: Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.
Шаг 11: Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы, а затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если Вы заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.
Шаг 12: Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.