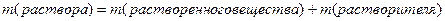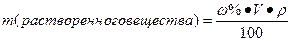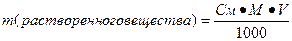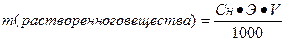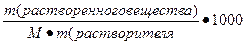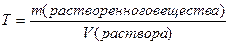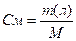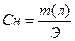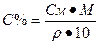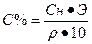Двумолярный раствор что значит
Форум химиков
Как сделать «2М раствор»?
Как сделать «2М раствор»?
Сообщение AlexX » Ср дек 29, 2004 3:24 pm
Сообщение Satyros » Ср дек 29, 2004 3:59 pm
«2 М» раствор читается, как «двухмолярный раствор». Это значит, что на литр растворителя (воды) приходится два моля растворённого вещества.
Дальше считайте сами, мне лень. Чистая арихметика осталась.
Сообщение slavert » Ср дек 29, 2004 8:37 pm
Сообщение ИСН » Чт дек 30, 2004 12:54 am
Сообщение Леонид » Вт янв 04, 2005 12:27 am
Сообщение Bell » Пн янв 10, 2005 3:11 pm
Сообщение Borrel » Чт янв 13, 2005 7:52 pm
Сообщение slavert » Чт янв 13, 2005 8:23 pm
Сообщение Bell » Сб янв 15, 2005 10:16 pm
У нас, у танкистов спокон веков принято делать так:
Взять чистый сухой граненый стакан, взвесить на бытовых настольных весах и запомнить вес пустого стакана. Налить на треть раствор соляной кислоты и довести, приливая тонкой струйкой по лезвию ножа, до веса 100 г + вес стакана.
Потом вылить все в пол-литровую банку и долить ее дистиллированной водой почти до краев (ну разве что оставить 5 мм до края). Банку закрыть полУэтиленовой крышкой и поставить в надежное место.
В результате мы поимеем в своих крепких руках пол-литра 2М раствора HCl (с точностью +-5% или даже лучше)
Не, если у вас дома дохрена мерных цилиндров и таблиц плотности раствора HCl.
А мы, танкисты прекрасно обходимся без спецоборудования! Тока смекалка и находчивость!
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Урок 15. Моляльность и молярность
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Растворитель и растворенное вещество
Расчет концентрации раствора
Молярная концентрация
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
Число молей растворенного сульфата аммония равно:
Завершающий шаг! Молярность раствора равна:
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Число молей уксусной кислоты в 5 г равно:
Масса 1 л этанола равна:
Последний этап. Найдем моляльность полученного раствора:
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
где с 1 и V 1 — молярная концентрация и объем раствора до разбавления, с 2 и V 2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Молярная концентрация
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Концентрация. Способы выражения концентрации



Концентрация –показывает, сколько вещества растворено в данном растворе или растворители.
Концентрации вещества можно выразить:
I. Массовая доля (w%), процентная концентрация (С%) – показывает сколько единиц массы вещества растворено в 100 единицах массы раствора (количество грамм растворенного вещества в 100 граммах раствора).
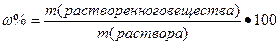
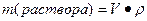
где V – объем раствора, P- плотность раствора.
Нахождение массы растворенного вещества:
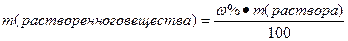
Это значит, что в 100 грамм этого раствора содержится 5 грамм поваренной соли и 95 грамм воды.
II. Молярная концентрация раствора (См) – количество вещества растворенного в 1000 мл раствора (1 л) (выражается числом молей в одном литре раствора).
1М одномолярный раствор = 1 моль/л
2 М двумолярный раствор =2 моль/л
0,1 М децимолярный раствор
0,2 М двудецимолярный раствор
0,01 М сантимолярный раствор
0,001 М милимолярный раствор
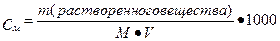
где М – молярная масса растворенного вещества, V – объем полученного раствора
или 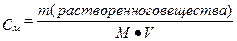
Нахождение массы растворенного вещества:
m(Na2SО4)=142 
Отвешиваем 14,2 г сульфата натрия, высыпаем в мерную колбу и доливаем воды до 1 литра.
2. Приготовить 600 мл 2 м раствора карбоната натрия.
1. Сколько грамм тиосульфата натрия Na2S2O3 
3. Вычислите молярность раствора, приготовленного в мерной колбе на 500 мл из 4,98 г КI.
4. Рассчитайте массу вещества Na2СО3, содержащегося в 200 мл 0,24 М раствора.
5. Определите молярную концентрацию вещества в растворе CuSO4, приготовленном в мерной колбе на 500 мл из 11,25 г кристаллогидрата CuSO4 
Какая масса сульфата бария ВаSO4 получится при сливании 200 мл 0,5 м раствора сульфата алюминия Al2(SO4)3 и 150 мл 2 м раствора хлорида бария ВаСl2
III. Нормальная концентрация или эквивалентная (Сн, Сэ, СN) –выражается числом эквивалентов растворенного вещества в 1 л раствора.

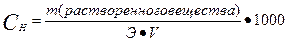
где Э – эквивалент растворенного вещества, V – объем
или 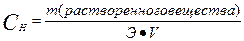
Нахождение массы растворенного вещества:
Эквивалент – реальная или условная частица вещества, которая химически равноценна одному иону водорода (для обменных реакций) или одному электрону (для окислительно – восстановительных реакций). Фактически это частица, обладающая одной единицей валентности или оперирующая одним электроном.
Эквиваленты сложных веществ находятся:
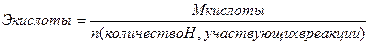
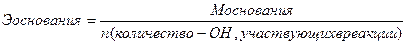
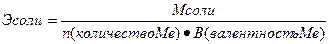
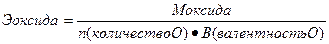
Сн=0,01 н
М(Na2SO4)=142 г/моль преобразуем формулу
Э(Na2SO4)=71
m(Na2SO4)=0,01 
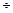
2. Определить нормальную концентрацию раствора содержащего 30 г хлорида алюминия в 500 мл раствора.
| Дано | Решение |
| m (AlCl3)=30 г V=500 мл Найти Сн-? | 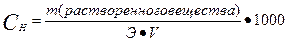 Э (AlCl3)= Э (AlCl3)= 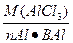 Э (AlCl3)=133,5:3=44,5 Сн= Э (AlCl3)=133,5:3=44,5 Сн= 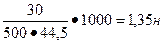 |
IV. Моляльная концентрация (Сm)– выражается числом молей растворенного вещества в 1000 гр растворителя
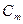
V. Титр (T)- сколько грамм растворенного вещества содержится в 1 мл раствора.
Переходы концентраций.
Переход от процентной концентрации к молярной концентрации:
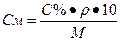
Переход от процентной концентрации к нормальной концентрации:
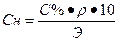
Переход от молярной концентрации к процентной концентрации:
Переход от нормальной концентрации к процентной концентрации:
| Дано | Решение |
| С%=20 % ρ (H2SO4) = 1,14 г/см 3 Найти Сн-? | 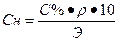 , , 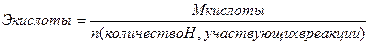 Э (H2SO4) = Э (H2SO4) = 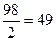 Сн = Сн = 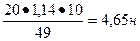 Ответ: Сн=4,65 н Ответ: Сн=4,65 н |