Ec rep что означает маркировка
Ec rep что означает маркировка
Определение классификации продукции с помощью приложения IX Директиву для медицинских изделий (MDD):
Класс I (нестерильные, без фунции измерения),Класс I (стерильные, с фунцией измерения),Класс IIa,Класс IIb или Класс III/AIMD*.
* Активные имплантируемые медицинские изделия подлежат тем же нормативными требованиями как изделия Класса III
Для всех устройств, кроме Класса I (нестерильные, без функции измерения), осуществить Систему Менеджмента Качества (СМК),
в соответствии с Приложением II или Приложением V директивы MDD.
Для продуктов Класса III/AIMD, подготовить Дизайн Досье (Design Dossier*).
Для всех остальных устройств, подготовить ЕС Технический файл, который содержит подробную информацию подтверждающую соответствие медицинского изделия
директиве MDD 93/42/ЕЭС.
* Для устройств Класса III / AIMD будут необходимыми данные клинического исследования. Клинические испытания в Европе должны быть предварительно одобрены европейским нотифицированным органом.
Назначить Европейского Авторизованного Представителя (EC REP), который расположенный в Европе.
Поместить название и адрес ЕС REP в инструкции по применению и на упаковке.
Авторизованный
Представителт
Подготовка Декларации Соответствия, которая является документом имеющим обязательную юридическую силу, подготовленным изготовителем с указанием,
что устройство соотвечает приенимым Директивам.
Для всех медицинских изделий и средств IVD в Европейском Союзе, сертификат CE является необходим. Эта сертификация подтверждает, что устройство соответствует всем нормативным требованиям «Медицинских Директив».
СЕ маркировка правила условия нанесения, экспорт, Mark, сертификация продукции в Европейском Союзе, Kennzeichnung, декларация, оценка соответствия, EC Declaration of Conformity, знак, обозначение
2014/34/EU (ATEX) Оборудование и защитные системы, предназначенным для использования в потенциально взрывоопасных средах Equipment and protective systems intended for use in potentially explosive atmospheres
Компания не имеет аккредитации и нотификации по следующим Директивам ЕС:
Директива 2014/35/ЕС низковольтные системы (LVD) электротехническое оборудование, предназначенное для работы в определенных пределах напряжения
Директива 90/385/EEC Активные имплантируемые медицинские устройства
Директива 92/42/EEC Водогрейные котлы
Директива 93/42/EEC Медицинские приборы
Директива 98/79/EC Медицинские приборы для диагностики in vitro
Директива 2009/48/EC Безопасность игрушек
Директива 2010/35/EU Транспортируемое оборудование под давлением Transportable pressure equipment
Директива 2013/29/EU о пиротехнических изделиях Pyrotechnic articles
Директива 2013/53/EU прогулочные и личные плавсредства Recreational craft and personal watercraft
Директива 2014/28/EU Взрывчатые вещества для гражданского использования Explosives for civil uses
Директива 2014/29/EU Простые сосуды под давлением Simple pressure vessels
Директива 2014/31/EU Неавтоматические весы Non-automatic weighing instruments
Директива 2014/32/EU по измерительным приборам Measuring Instruments Directive
Директива 2014/33/EU Лифты и компоненты безопасности для лифтов Lifts and safety components for lifts
Директива 2014/53/EU Радиооборудование Radio equipment
Директива 2014/68/EU Оборудование под давлением Pressure equipment
Директива 2014/90/EU Морское оборудование Marine equipment
Регламент (ЕС) 2016/424 Канатные дороги Cableway installations
Регламент (ЕС) 2016/426 Приборы, работающие на газообразном топливе Appliances burning gaseous fuels
Регламент (EU) 2017/746 о медицинских устройствах для диагностики in vitro on in vitro diagnostic medical devices
Регламент (ЕС) 2016/425 Средства индивидуальной защиты Personal protective equipment
Регламент (EU) 2017/745 о медицинских приборах Medical devices
Австрия CE-Kennzeichnung Zeichen
Бельгия Marquage
Великобритания Marking
Болгария маркировката
Венгрия jelölés
Германия Kennzeichnung
Греция, Кипр σήμανση
Дания mærkning
Испания Marcado
Италия Marcatura
Ирландия Marcáil
Латвия marķējums
Литва ženklinimas
Мальта marka
Нидерланды markering
Португалия Marcação
Польша Oznaczenie
Румыния Marcajul
Словакия označenie
Словения oznaka
Финляндия merkintä
Франция Marquage
Чехия Označení
Швеция märkning
Эстония märgistus
*Продукция классов IIb и III с большой вероятностью потребует большого количества клинических данных. В ряде случаев могут использоваться существующие научные данные, но нередко требуется проведение клинических исследований. Клинические исследования, проводимые в ЕС должны быть одобрены Европейскими регуляторными агентствами. Планы и отчеты по клиническим испытаниям помещаются в соответствующий раздел технической документации.
***CE-Сертификат не выдается продуктам класса I (нестерильным, без функции измерения), поскольку для медицинских изделий данного класса соответствие требованиям Регламента ЕС 2017/745 заявляется производителем в порядке самодекларации.
Скачать брошюру «CE-маркировка для медицинских изделий» в PDF-формате
Как зарегистрировать медицинское изделие в ЕС. Читать статью.
MDRC помогает производителям изделий медицинского назначения достичь соответствия регуляторным требованиям Европейского Союза, зарегистрировать и вывести на европейский рынок их продукцию.
Классификация изделий медицинского назначения
В ЕС определение класса изделий медицинского назначения осуществляется на основе ряда правил, изложенных в приложении VIII Регламента ЕС 2017/745. Поэтому медицинский продукт определенного класса по классификации РФ, США, Китая или другой страны, не входящей в Европейский Союз, в ЕС может относиться к другому классу продукции. Правильное определение класса вашей продукции является критически важным, поскольку от класса будет зависеть то, каким образом будет осуществляться регистрация и вывод на рынок ваших продуктов. Мы поможем вам правильно классифицировать вашу продукцию.
Обучение: CE-маркировка и регуляторная система ЕС для медицинских изделий
Технические файлы и досье разработки
ISO 13485 и система менеджмента качества (СМК)
У MDRC имеются готовые процедуры и шаблоны документов, которые соответствуют регуляторным требованиям большинства стран и которые могут быть имплементированы в любой компании. Большинство компаний предпочитают использовать стандарт ISO 13485. Мы готовы помочь вам с внедрением СМК. Если у вас уже имеется СМК, мы поможем вам добиться ее соответствия европейским требованиям.
MDR (EU 2017/745) и IVDR (EU 2017/746) требуют наличия у производителя медицинских изделий PRRC (Person Responsible for Regulatory Compliance).
Авторизованное представительство в ЕС (EC REP)
Компании, находящиеся вне Европейского Союза, должны назначить Авторизованного Представителя в ЕС (EC REP), который будет представлять их в регуляторных органах ЕС. Хотя эту роль может выполнять дистрибьютор, наличие независимого Авторизованного Представителя несет в себе большие преимущества, поскольку позволяет менять дистрибьюторов в любое удобное для вас время. Наше германское представительство готово взять на себя роль Авторизованного Представителя для вашей компании.
Аудиты на соответствие требованиям Регламента ЕС 2017/745 и ISO 13485
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, должны ежегодно проходить аудит Нотифицированной Организации. Мы поможем вам подготовиться к аудиту. Помимо этого мы можем провести для ваших работников тренинги по процедурам получения CE-марки, Регламенту ЕС 2017/745, а также внутреннему аудиту.
Взаимодействие с Нотифицированной Организацией
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, взаимодействуют с регуляторными оранами ЕС через Нотифицированные Организации. За поиск и выбор Нотифицированной организации, а также коммуникацию с ней отвечает сам производитель. Мы имеем большой опыт работы с Нотифицированными Организациями из разных стран ЕС и готовы помочь вам выбрать подходящую организацию и наладить взаимодействие с ней.
Оценка и квалификация дистрибьюторов
Получение UDI и регистрация в системе EUDAMED
*Продукция классов IIb и III с большой вероятностью потребует большого количества клинических данных. В ряде случаев могут использоваться существующие научные данные, но нередко требуется проведение клинических исследований. Клинические исследования, проводимые в ЕС должны быть одобрены Европейскими регуляторными агентствами. Планы и отчеты по клиническим испытаниям помещаются в соответствующий раздел технической документации.
***CE-Сертификат не выдается продуктам класса I (нестерильным, без функции измерения), поскольку для медицинских изделий данного класса соответствие требованиям Регламента ЕС 2017/745 заявляется производителем в порядке самодекларации.
MDRC помогает производителям изделий медицинского назначения достичь соответствия регуляторным требованиям Европейского Союза, зарегистрировать и вывести на европейский рынок их продукцию.
Классификация изделий медицинского назначения
В ЕС определение класса изделий медицинского назначения осуществляется на основе ряда правил, изложенных в приложении VIII Регламента ЕС 2017/745. Поэтому медицинский продукт определенного класса по классификации РФ, США, Китая или другой страны, не входящей в Европейский Союз, в ЕС может относиться к другому классу продукции. Правильное определение класса вашей продукции является критически важным, поскольку от класса будет зависеть то, каким образом будет осуществляться регистрация и вывод на рынок ваших продуктов. Мы поможем вам правильно классифицировать вашу продукцию.
Обучение: CE-маркировка и регуляторная система ЕС для медицинских изделий
Технические файлы и досье разработки
ISO 13485 и система менеджмента качества (СМК)
У MDRC имеются готовые процедуры и шаблоны документов, которые соответствуют регуляторным требованиям большинства стран и которые могут быть имплементированы в любой компании. Большинство компаний предпочитают использовать стандарт ISO 13485. Мы готовы помочь вам с внедрением СМК. Если у вас уже имеется СМК, мы поможем вам добиться ее соответствия европейским требованиям.
Авторизованное представительство в ЕС (EC REP)
Компании, находящиеся вне Европейского Союза, должны назначить Авторизованного Представителя в ЕС (EC REP), который будет представлять их в регуляторных органах ЕС. Хотя эту роль может выполнять дистрибьютор, наличие независимого Авторизованного Представителя несет в себе большие преимущества, поскольку позволяет менять дистрибьюторов в любое удобное для вас время. Наше германское представительство готово взять на себя роль Авторизованного Представителя для вашей компании.
MDR (EU 2017/745) и IVDR (EU 2017/746) требуют наличия у производителя медицинских изделий PRRC (Person Responsible for Regulatory Compliance).
Аудиты на соответствие требованиям Регламента ЕС 2017/745 и ISO 13485
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, должны ежегодно проходить аудит Нотифицированной Организации. Мы поможем вам подготовиться к аудиту. Помимо этого мы можем провести для ваших работников тренинги по процедурам получения CE-марки, Регламенту ЕС 2017/745, а также внутреннему аудиту.
Взаимодействие с Нотифицированной Организацией
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, взаимодействуют с регуляторными оранами ЕС через Нотифицированные Организации. За поиск и выбор Нотифицированной организации, а также коммуникацию с ней отвечает сам производитель. Мы имеем большой опыт работы с Нотифицированными Организациями из разных стран ЕС и готовы помочь вам выбрать подходящую организацию и наладить взаимодействие с ней.
Оценка и квалификация дистрибьюторов
Получение UDI и регистрация в системе EUDAMED
Скачать брошюру «CE-маркировка для медицинских изделий» в PDF-формате
Как зарегистрировать медицинское изделие в ЕС. Читать статью.
CE-маркировка для медицинских изделий: заблуждения, практические рекомендации, примеры из практики

Несмотря на прозрачность и понятность европейских регуляторных процедур, среди неевропейских производителей существует множество заблуждений, относительно «получения» СЕ-маркировки, «сертификации продукции для продажи в ЕС», «регистрации» продукции для продажи в ЕС и т.п. Отсутствие понимания регуляторных процессов ЕС зачастую становится причиной неверной оценки производителем своих возможностей и ресурсов.
В данной статье речь пойдет о том, какие шаги вам надо предпринять, чтобы иметь право нанести на ваше изделие СЕ-марку и легально продавать его на территории ЕС, а также о том, каковы наиболее распространенные заблуждения и ошибки, касающиеся европейских регуляторных процессов.
Скачать эту статью в PDF-формате
Но для начала давайте убедимся в том, что соблюдать регуляторные требования ЕС действительно важно.
Что будет, если продавать медицинское изделие в ЕС без СЕ-маркировки?
Надо заметить, что это скорее теоретическая ситуация. Если на вашем изделии медицинского назначения нет CE-маркировки, с вами не станет работать ни один нормальный авторизованный представитель и дистрибьютор. Авторизованные представители и дистрибьюторы несут ответственность за продукцию, которая попадает на рынок ЕС при их участии. Они обязаны проверять наличие СЕ-марки на всех медицинских изделиях, проходящих через их руки. Как и любая медицинская организация, аптека или розничная сеть. Так что продать медицинское изделие без СЕ-марки вам вряд ли удастся.
Тем не менее даже если вы только попытаетесь продавать медицинские изделия без СЕ-марки, ваша продукция будет рассматриваться как фальсификат. Наказание за распространение фальсифицированной продукции различается в отдельных странах ЕС и зависит от ряда обстоятельств. Распространителю может грозить до нескольких лет заключения или крупные денежные штрафы. Фальсифицированная продукция обычно изымается и уничтожается.
Что будет, если нанести СЕ-маркировку на продукцию, не соответствующую требованиям ЕС?
Согласно статье 2 (пункт 9) MDR, если производитель (или иной субъект) предоставляет фальсифицированную документацию и/или информацию и неправомерно наносит СЕ-марку на свою продукцию, то такая продукция также рассматривается как фальсификат со всеми вытекающими последствиями (см. выше).
Что будет, если нанести CE-маркировку на продукцию, частично несоответствующую требованиям ЕС?
Если производитель непреднамеренно наносит СЕ-марку на продукцию, частично несоответствующую требованиям Европейского Союза, согласно MDR, речь идет о «непреднамеренном несоответствии» (unintentional non-compliance). Если несоответствий много и они носят серьезный характер, такой продукт может быть удален с рынка. Если несоответствия не столь значительны, от производителя потребуют проведения корректирующих действий, и продукт останется на рынке.
Здесь следует заметить, что подобная ситуация возможна только для нестерильной и не имеющей измерительных функций продукции класса I, поскольку только эта категория изделий не требует привлечения нотифицированных организаций (см. ниже). Во всех остальных случаях несоответствия будут выявлены нотифицированной организацией и CE-маркировка не будет нанесена на несоответствующую продукцию.
Заблуждение 1. Для медицинских изделий класса I не требуется соблюдения требований MDR.
Медицинские изделия класса I не требуют привлечения нотифицированных организаций, которые контролируют соответствие производителя и его продукции требованиям регламента ЕС 2017/745 (MDR). Однако это не значит, что производители изделий класса I освобождаются от этих требований. Точно так же как и все остальные производители медицинских изделий, они должны иметь технические файлы, систему менеджмента качества, систему оценки рисков, систему пострегистрационного надзора и т.д.
Заблуждение 2. Чтобы получить СЕ-сертификат для одного продукта, достаточно привести в порядок документацию, относящуюся только к этому продукту, в остальном документация предприятия может оставаться в состоянии хаоса.
Регуляторная система Европейского Союза, в отличие, скажем, от систем США, России или Японии, ориентирована не столько на сам продукт, сколько на процессы и процедуры, направленные на разработку и производство этого продукта. Эти процессы и процедуры должны быть задокументированы надлежащим образом. Это первое, на что смотрят нотифицированные организации, когда приходят к производителю с аудитом.
Невозможно привести в порядок (и соответствие MDR) некую изолированную часть процессов, связанных с одним продуктом. Нотифицированные организации интересуются всей системой процессов предприятия. Поэтому иногда, проверяя, как задокументирован жизненный цикл одного продукта, они вполне могут заинтересоваться смежными процессами, относящимися к другим продуктам. И если они выявляют несоответствия, которые, казалось бы, не связаны напрямую с данным продуктом, все равно фиксируют их как находки аудита и требуют устранить их.
Поэтому, прежде чем запускать процесс оценки какого-либо продукта нотифицированной организацией, убедитесь в том, что ваши процессы и остальные продукты не вызывают излишних подозрений. Вряд ли нотифицированная организация будет очень внимательно изучать документацию продукции, не входящей в план данной инспекции, но взглянуть на нее может захотеть.
Заблуждение 3. Чтобы «получить» СЕ-марку достаточно подать (куда-то) пакет документов, для оценки регуляторными органами.
Это заблуждение связано с тем, что производители, привыкшие к регуляторным процедурам собственных стран, переносят представления о них на европейскую регуляторику. В ЕС нет как таковых регистрационных досье и регуляторных подач. Нотифицированные организации проверяют не специально составленный для регистрации пакет документов, а производственную документацию и документацию разработки, которая, как предполагается, не столько создана для регистрации, сколько является естественным результатом разработки и производства.
Поэтому вопрос «какие документы нам надо послать, чтобы зарегистрировать продукт?» изначально некорректен. Нотифицированная организация хочет видеть не некий «пакет документов», а документацию, охватывающую весь жизненный цикл продукта и все процессы, ведущие к созданию этого продукта (и даже смежные процессы).
Заблуждение 4. Однажды пройдя регуляторные процедуры ЕС, вы можете бессрочно использовать CE-маркировку и продавать продукцию в Европе.
Заблуждение 5. Медицинские изделия для индивидуального применения не должны соответствовать требованиям MDR.
Медицинские изделия, изготовленные по индивидуальному заказу, не подлежат СЕ-маркированию. Тем не менее, для таких изделий должна существовать техническая документация, они подлежат классификации, требуют пострегистрационного надзора и должны быть соответствующим образом маркированы, а процессы их создания должны быть задокументированы (MDR, приложение XIII, а также ст. 10 п. 4, ст. 15 п. 1(b), ст. 21 пп. 1-3).
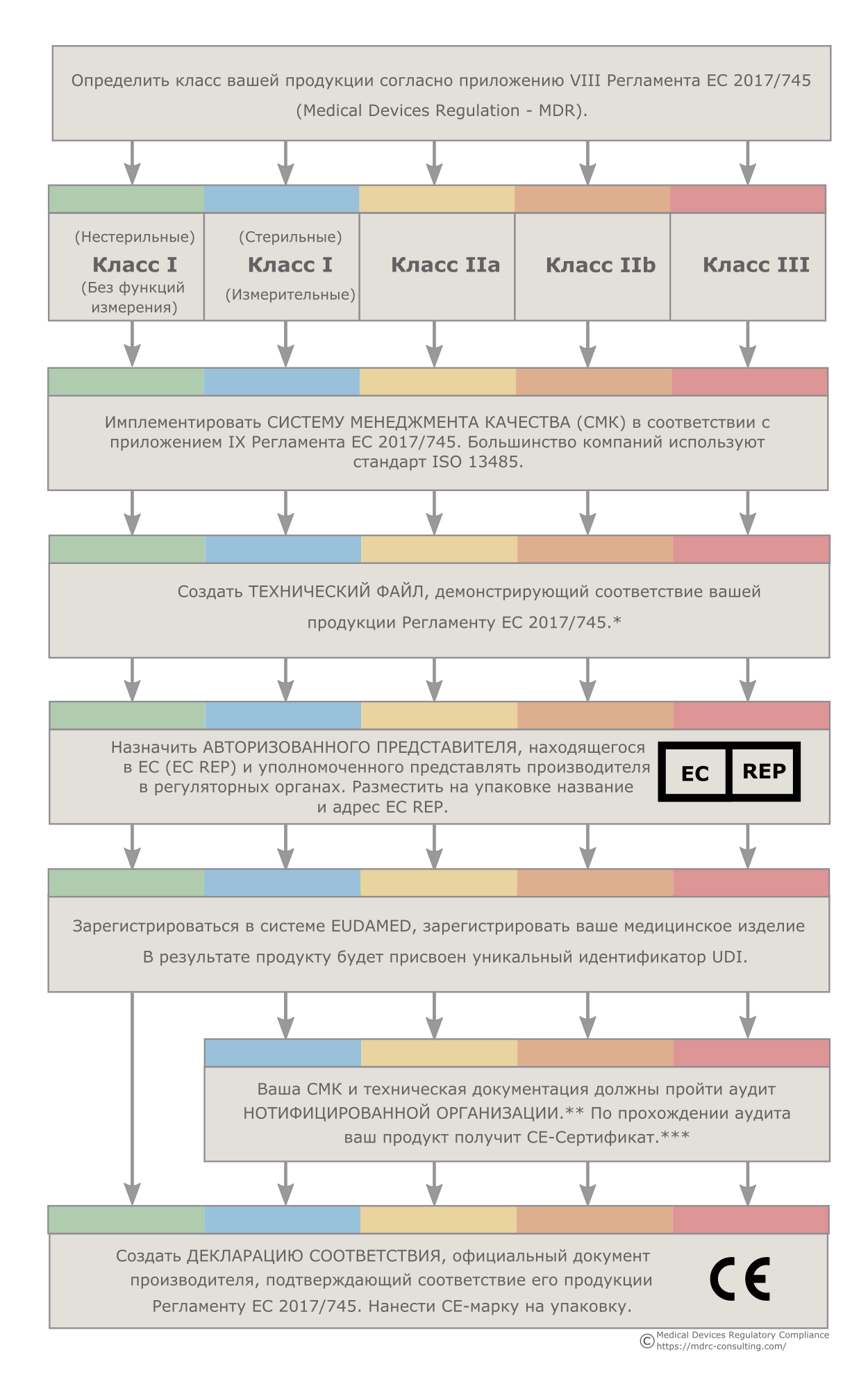
CE-марка: алгоритм действий
На рис. 2 приводится последовательность действий, необходимых для приведения производителя, продукции и документации в соответствие требованиям MDR. После того как все указанные шаги пройдены, производитель получает право наносить на свою продукцию CE-маркировку и получает доступ на рынок Европейского Союза.
Рис. 2. CE-марка для медицинских изделий: алгоритм действий
Первым шагом на европейский рынок является определение класса риска медицинского изделия. От класса продукта будут зависеть все последующие этапы. Как мы видим, изделия всех классов должны пройти одни и те же регуляторные процедуры. Однако для каждого класса каждая из процедур имеет свои особенности. И чем выше класс изделия, тем сложнее (а значит, дольше и дороже) будут регуляторные процессы, ведущие к установлению соответствия требованиям MDR и получению права наносить на свой продукт СЕ-марку.
Несколько в стороне от большинства медицинских изделий стоят нестерильные и не предназначенные для измерений продукты класса I. Регуляторная процедура для этой категории изделий значительно проще, короче и дешевле, чем для всех остальных классов изделий. Производитель имеет право продавать их в ЕС без одобрения нотифицированной организации.
Тем не менее, это не значит, что изделие класса I не должно отвечать требованиям MDR. Производитель обязан иметь адекватную систему менеджмента качества, хранить у себя техническую документацию, назначить авторизованного представителя и зарегистрироваться в системе EUDAMED. Только после выполнения этих условий он может декларировать свое соответствие MDR, создать соответствующий документ (декларацию соответствия) и начать наносить на продукт СЕ-марку.
Что касается остальных классов изделий, для них требуется участие нотифицированной организация, чья задача состоит в оценке соответствия производителя, продукта и документации требованиям MDR. Степень участия нотифицированной организации может быть разной в зависимости от класса риска. В случае стерильных изделий класса I или изделий класса I с измерительными функциями ее участие сведено к минимуму. Когда же речь идет о классе III, роль нотифицированной организации в регуляторном процессе значительно возрастает.
CE-марка: примеры из практики
Назофарингеальный зонд по сути представляет собой такую же палочку-тампон и по правилам классификации также попадает в класс I (правило 5). Но при этом он стерильный, и поэтому регуляторный процесс для него несколько усложняется.
Для проведения оценки соответствия такого продукта требованиям MDR потребуется участие нотифицированной организации, Однако, поскольку речь идет о классе I, роль нотифицированной организации будет ограничена контролем только тех аспектов, которые связаны с обеспечением стерильности продукта.
Для медицинских изделий класса IIa регуляторный процесс будет еще сложнее, а нотифицированная организация будет участвовать в нем еще активнее. Примером такого продукта является обычный спирометр (например, соединяемый с компьютером через USB-порт).
Проводя оценку такого продукта, документации и самого производителя, нотифицированная организация, скорее всего, будет выборочно анализировать различные аспекты системы менеджмента качества и оценивать техническую документацию.
И, наконец, самому строгому контролю подлежат производители изделий класса III. Возьмем, к примеру, кохлеарный имплант. Это активное имплантируемое медицинское изделие, относящееся к классу III (правило 8).
Существенное отличие класса III (и отчасти IIb) состоит в том, что для таких изделий требуется больше клинических данных, чем для всех остальных. В большинстве случаев, когда речь идет о классе III, избежать проведения клинических исследований не удается. И именно клинические данные становятся объектом особо пристального внимания нотифицированных организаций, работающих с производителями изделий класса III.
Следует заметить, что в случае изделий классов IIb и III к авторизованному представителю также предъявляются более строгие требования. Ведь авторизованный представитель обязан контролировать производителя и его продукты. Он несет ответственность за соответствие MDR наряду с производителем и дистрибьюторами и его система менеджмента качества должна отражать его умение работать с продуктами высоких классов риска.
Заключение
Скачать эту статью в PDF-формате
1. European Union, 2017. Medical Device Regulation (Regulation (EU) 2017/745)
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.