Единичные макрофаги в молочной железе что это
Иммунные клетки помогают перестраиваться молочной железе
Когда молочной железе становятся ненужными некоторые протоки, образовавшиеся в период вскармливания, их съедают местные иммунные клетки.
Когда приходит время кормить молоком детёныша, молочные железы меняются – в них разрастаются молочные протоки, собирающие молоко от скоплений железистых клеток. Когда период вскармливания заканчивается, молочная железа снова меняется: разветвлённые многочисленные протоки исчезают, их клетки отмирают. Естественно, всё это подчиняется гормональным сигналам, однако в самой железе должны быть механизмы, обеспечивающие такие перестройки в структуре.
Исследователи из Медицинского института Уолтера и Элизы Холл вместе с коллегами из Мельбурнского университета сообщают в Nature Cell Biology, что им удалось обнаружить клетки, которые помогают избавиться молочной железе от лишних протоков. Это макрофаги – иммунные клетки, которые есть во многих органах и тканях; они активно ползают между другими клетками, образующими орган, и в буквальном смысле поедают всё подозрительное и ненужное: бактерий, вирусы, молекулярные обломки, оставшиеся от погибших клеток, и т. д. Макрофаги, обслуживающие конкретный орган, называют резидентными макрофагами – если не случается ничего чрезвычайного, они свой орган не покидают.
Авторы работы утверждают, что те макрофаги, которые обнаружились в молочной железе – это новая их разновидность, до сих пор никому не известная. Звездообразные макрофаги сидят в молочных протоках, они малоподвижны, стиснуты между двумя слоями клеток, и образуют что-то вроде сети. Когда клетки протоков начинают отмирать за ненадобностью, макрофаги протягивают к ним свои «руки»-отростки и поедают их. То есть новые макрофаги помогают молочной железе вернуться в некормящее состояние. Никакие другие иммунные клетки эту работу делать не могут: когда местные макрофаги удаляли из протоков молочной железы, ненужные клетки оставались несъеденными.
Притом макрофаги должны понимать, когда молочные протоки нужно уничтожать и когда не нужно. Рак молочной железы, одна из самых распространённых злокачественных опухолей, начинается с клеток протоков молочной железы, и, по словам исследователей, число макрофагов увеличивается по мере роста опухоли. Иммунитет должен уничтожать раковые клетки, но, возможно, макрофаги мешают другим иммунным клеткам делать своё дело, потому что полагают, что сейчас просто настало время молочной железе разрастаться.
Возможно, опухоли груди будет легче лечить, если найти способ если как-то подействовать на эти грудные макрофаги, сделать так, чтобы они мешали другим иммунным клеткам атаковать раковые клетки, а ещё лучше – чтобы они сами начали их уничтожать.
Фиброзно-кистозная мастопатия – болезнь цивилизации

Врачи нередко при обращении к ним женщин с жалобами на боли, нагрубание молочных желез ставят диагноз мастопатии. Но далеко не всякий дискомфорт молочных желез является мастопатией.
Для обоснованной постановки данного диагноза женщина должна пройти всестороннее обследование:
Диагноз мастопатии ставят при обнаружении комплекса следующих патологических проявлений.
Классификация мастопатии
Предложено несколько классификаций мастопатии. В практике наиболее часто пользуются клинической классификацией, которая делит мастопатию на 3 формы.
1. Масталгия (мазоплазия, мастодиния). При этой форме преобладающим являются выраженные боли в молочных железах, которые требуют назначения обезболивающих препаратов.
2. Диффузная мастопатия. При этом в тканях молочных желез выявляются диффузные уплотнения и кисты. В свою очередь, диффузная мастопатия делится на 2 подтипа:
а) диффузная фиброзная мастопатия, преобладают фиброзные (соединительнотканные) участки уплотнений;
б) диффузная фиброзно-кистозная мастопатия, на фоне фиброзных уплотнений выявляются кисты.
3. Локализованная мастопатия (локализованный фиброаденоматоз).
При этом в каком-либо квадранте молочной железы выявляется четко отграниченный участок. Данную форму выделяют специально, так как при выявлении отграниченного узла в молочной железе необходимо исключить наличие рака. Поэтому при локализованном фиброаденоматозе обязательно проводят маммографию и исследование клеток или тканей из узла. Иногда природу узла в молочной железе можно выявить только во время операции. В таком случае женщине предлагают операцию, под наркозом проводят секторальную резекцию молочной железы с подозрительным участком, и направляют удаленную ткань на срочное гистологическое исследование.
Лечение мастопатии
Диффузная мастопатия лечится консервативным путем. При мастопатии рекомендуется ограничение в пище животных жиров, молочно-растительная диета, увеличение потребления овощей и фруктов, сои и других бобовых, пищевых волокон с отрубями злаковых; оптимизация веса тела; нормализация режима сна и бодрствования; увеличение двигательной активности и лечебная физкультура. Применяют в лечении мастопатии санаторно-курортное лечение, минеральные воды, физиотерапию, аутотренинг, психотерапию.
Применяемые лекарственные препараты можно разделить на 2 группы:
1. Гормональные средства: препараты на основе женских половых гормонов
2. Негормональные средства: витамины, адаптогены, мочегонные, успокаивающие, улучшающие работу печени, препараты калия, ферменты, обезболивающие, препараты йода. В лечении мастопатии используются фитотерапия и препараты на основе природных биологически активных веществ, биологически активные добавки к пище.
При сопутствующей патологии, вызывающей мастопатию, необходимо дополнительное лечение выявленных заболеваний: лечение гинекологических болезней, лечение заболеваний щитовидной железы, регулирование и стабилизация обменных процессов, лечение заболеваний печени и желчного пузыря, устранение венозного застоя в малом тазу, ликвидация синдрома дисбактериоза толстого кишечника и запоров.
Хирургическое лечение при мастопатии проводится лишь в нескольких случаях.
При наличии крупной кисты с жидким содержимым проводят пункцию кисты, отсасывают содержимое. Иногда для того, чтобы стенки кисты спались, внутрь нее вводят склерозирующие вещества. Подобные операции выполняются, как правило, в амбулаторных условиях. При локализованном фиброаденоматозе, как уже говорилось выше, нередко женщину приходится госпитализировать и с диагностической целью проводить секторальную резекцию молочной железы. При фиброаденоме молочной железы иногда в стационарных условиях проводят оперативное лечение: вылущивание опухоли молочной железы, секторальная резекция молочной железы. В большинстве случаев фиброаденому не удаляют, а проводят за ней динамическое наблюдение.
Занимайтесь самообследованием, запомните: положительный результат возможен лишь при очень аккуратном, последовательном и длительном лечении по схеме, рекомендованной врачом.
Это не предрак: шесть мифов в диагностике заболеваний молочных желез
В течение жизни многие женщины сталкиваются с заболеваниями молочной железы. Хорошая новость в том, что большинство из них никак не связано с раком и приходится на доброкачественные новообразования. Однако в России многие из этих состояний диагностируются как предраковые заболевания, что приводит к ненужному и, порой, вредному лечению. Мы рассмотрели основные такие диагнозы и международные стандарты их лечения.
Для начала стоит отметить, что изменения груди — это нормально. Большинство из них связаны с естественными процессами — состояние груди может меняться до и во время менструации, беременности или менопаузы. Также на него влияют возраст и принимаемые женщиной гормоны и контрацептивы.
Миф 1: фиброаденомы нужно удалять
Это не так. Фиброаденомы — это небольшие новообразования в груди по форме напоминающие твердые шарики, которые легко перемещаются при нажатии и не вызывают болевых ощущений. Чаще всего фиброаденомы появляются у молодых женщин в возрасте 20-30 лет, риск их появления снижается у женщин в период после менопаузы.
Некоторые фиброаденомы можно прощупать самостоятельно. Но большинство выявляется во время маммографии или ультразвука. Показанием к удалению фиброаденомы считается быстрый рост новообразования. В остальном врачи сходятся во мнении, что фиброаденомы не требуют удаления, если они:
— не влияют на форму груди;
— не мешают самой женщине.
В некоторых случаях удаление подобных новообразований скорее противопоказано — например, у пациенток с множественными, но не растущими фиброаденомами. Поскольку при удалении опухолей могут быть задеты или удалены и здоровые ткани молочной железы.
Миф 2: мастопатия — это предраковое заболевание
Вовсе нет. На самом деле, мастопатия даже не входит в международную классификацию болезней, поскольку является нормальным состоянием груди в определенные жизненные периоды. Появление мастопатии связывают с изменением гормонального уровня в организме, именно поэтому симптомы могут усиливаться и уменьшаться в течение цикла.
Более половины женщин в возрасте 20-50 лет сталкиваются с мастопатией. При этом состоянии характерны изменения текстуры ткани молочной железы — она становится более узловатой, появляются бугорки внутри груди. У многих мастопатия протекает почти бессимптомно, у других же появляются ярко выраженные симптомы, такие как:
— боль или дискомфорт в груди, которые обычно становятся сильнее перед началом менструации и уменьшаются во время критических дней;
— грудь кажется опухшей и тяжелой;
— повышается чувствительность груди;
— боль или дискомфорт в подмышечных впадинах;
— могут образовываться «шишки» в груди, которые увеличиваются перед началом менструации, и уменьшаются после нее;
— также могут появляться зеленые или темно-коричневые выделения из груди.
Мастопатия не повышает риски возникновения рака груди. Согласно международным рекомендациям это состояние также не требует лечения, если симптомы выражены в слабой или средней степени. Для уменьшения дискомфорта могут быть рекомендованы обезболивающие, теплые компрессы, а также более облегающий бюстгальтер.
Лечение мастопатии необходимо только если симптомы мешают женщине и вызывают сильную боль в груди. В таком случае врач может назначить гормональную терапию. Хирургическое вмешательство не рекомендуется.
Миф 3: мастит способствует появлению рака груди
Нет, это не правда. Мастит — это воспаление тканей молочной железы, в большинстве случаев вызванное инфекцией или закупоркой молочных протоков. При мастите грудь может покраснеть и стать теплой на ощупь, появляются болевые ощущения. В некоторых случаях заболевание также вызывает схожие с гриппом симптомы — повышение температуры и появление головных болей. Обычно мастит проявляется только на одной груди.
Наиболее часто это заболевание появляется у женщин, кормящих грудью. По данным ВОЗ в 95% случаев заболевание появляется в первые 12 недель после родов. Инфекция развивается из-за закупорки молочного протока или попадания бактерий внутрь соска при кормлении.
Согласно международным исследованиям, мастит не влияет на повышение риска развития рака молочной железы. При лечении не рекомендуется хирургическое вмешательство. Антибиотики, назначенные лечащим врачом, помогут снять боль и температуру. В случае возникновения абсцесса груди (скопления гноя) требуется удалить его хирургическим путем и затем принимать антибиотики.
Миф 4: все кисты необходимо удалять
Не совсем так. Все зависит от размера кисты. Кисты представляют собой мягкие, легко перемещающиеся комки внутри груди. По форме они обычно круглые или овальные, наполнены жидкостью. Кисты могут появиться в одной или обеих железах. В некоторых случаях также могут возникнуть болевые ощущения в груди перед началом менструации.
Кисты — одно из самых распространенных доброкачественных поражений молочной железы, встречающееся у каждой третьей женщины в возрасте от 35 до 50 лет. Эти новообразования не являются раковыми и не увеличивают шансы развития онкологического заболевания. Однако множественные кисты могут затруднить выявление и диагностику других новообразований в тканях молочной железы.
Небольшие кисты обычно не причиняют неудобств женщине, поэтому они не требует особого лечения или удаления. Многокомпонентные кисты незначительно повышают риск развития рака молочной железы в будущем. Поэтому врач может порекомендовать сделать биопсию ткани груди. Крупные кисты (могут достигать до 2,5-5 см в диаметре) также могут вызывать дискомфорт и болевые ощущения, поскольку оказывают давление на соседние ткани. В таком случае следует обратиться к врачу для удаления жидкости из кисты, это поможет уменьшить неприятные ощущения.
Удаление кист хирургическим путем рекомендуется крайне редко. Хирургическое лечение назначают, если киста содержит жидкость кровяного оттенка или регулярно появляется через определенное время и вызывает неудобства.
Миф 5: травмы груди приводят к раку
Исследований, подтверждающих такую связь, нет.
Посттравматические олеогранулёмы (некроз жировых тканей) молочной железы возникают после операций или лучевой терапии, а также в результате травмирования жировых тканей груди. Это доброкачественное заболевание, при котором в жировых тканях появляются небольшие круглые и твердые новообразования, кожа вокруг которых выглядит покрасневшей и поврежденной. Обычно эти новообразования не вызывают болевых ощущений, но иногда некроз жировых тканей также сопровождается появлением кист, наполненных маслянистой жидкостью. Однако не стоит переживать из-за этого — небольшие кисты не требуют удаления и могут со временем исчезнуть самостоятельно.
Постравматические олеогранулёмы могут появляться у женщин и мужчин любого возраста, но наиболее они распространены среди женщин с избыточным весом и большим размером груди.
Согласно международной практике, удаление посттравматических олеогранулём не требуется, поскольку обычно они не вызывают болевых ощущений и не несут в себе риск развития рака молочной железы. Кроме того, операция может привести к поражению соседних тканей. Однако хирургическое вмешательство рекомендовано в следующих случаях:
— если биопсия ткани не дает достаточно информации, чтобы быть уверенным в диагнозе;
— новообразования не исчезают со временем, но становятся больше;
— если постравматические олеогранулёмы вызывают дискомфорт.
Миф 6: цистаденопапилломы повышают риск рака
Цистаденопапиллома, или внутрипротоковая папиллома — это небольшое доброкачественное образование внутри молочного протока, расположенное ближе к соску. Оно может сопровождаться прозрачными или кровяными выделениями из одной груди и болевыми симптомами. Чаще всего с заболеванием сталкиваются женщины от 35 до 50 лет.
Исследования доказывают, что одиночные папилломы не повышают риск развития рака молочной железы. Однако следует проявить осторожность и сделать биопсию, если:
— у женщины множественные папилломы;
— есть семейная история раковых заболеваний/ предрасположенность;
— папилломы появились в возрасте до 35 лет.
Лечение внутрипротоковых папиллом предполагает хирургическое удаление опухоли.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
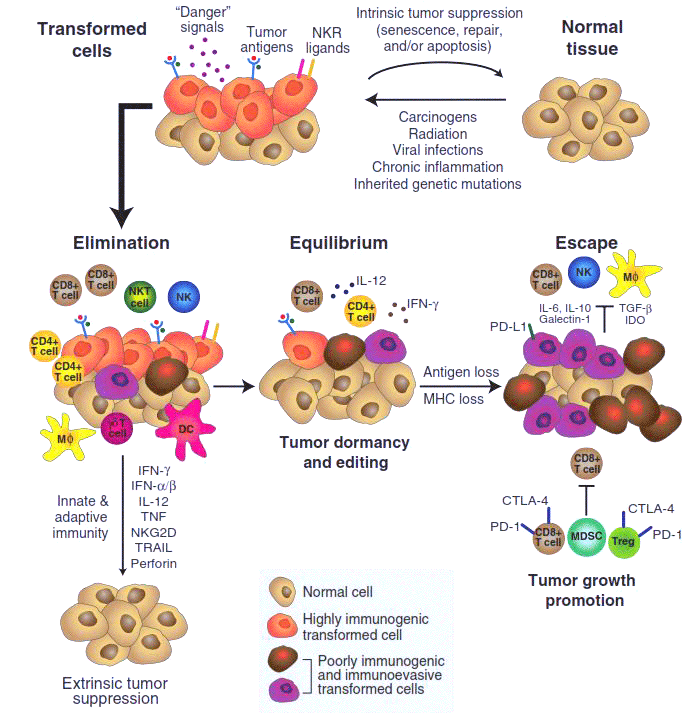
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
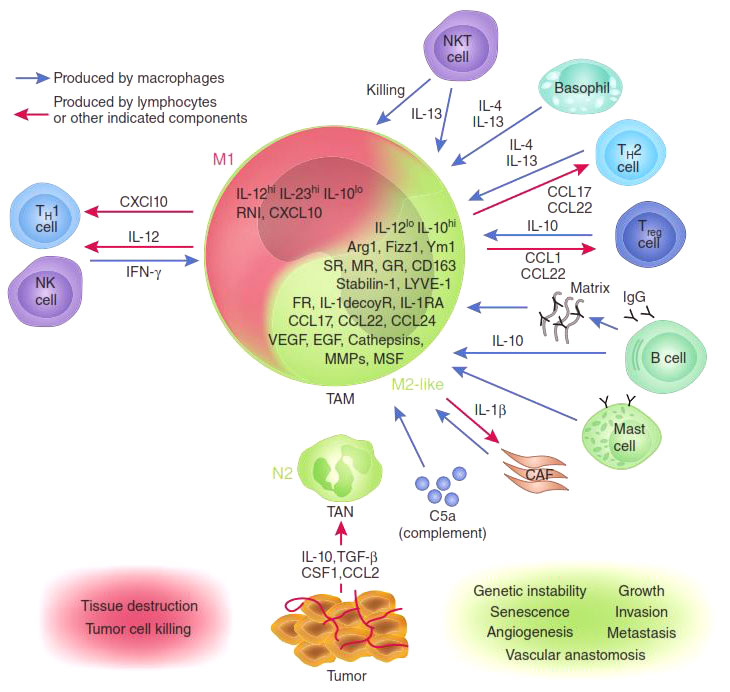
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.