Erythema migrans что такое
Erythema migrans что такое
Часто основным заболеванием при этом является иерсиниозная инфекция. Типичный патогенетический механизм в этом случае представляет собой иммунный ответ организма-хозяина на циркулирующие иммунные тела. При этом могут возникать иммунные комплексы, которые способствуют развитию болезни. При воспалительных заболеваниях кишечника узловатая эритема является результатом повышенной проницаемости кишечника для эндо- и экзогенных антигенов.
Заболевание может быть и результатом нарушенной функции клеточного иммунитета. Недавние исследования показали разницу в использовании p-цепи вариабельного домена молекул Т-клеточного рецептора при узловатой эритеме, ассоциированной с воспалительным заболеванием кишечника, что предполагает потенциальную роль суперантигенов.
Узловатая эритема может также вызываться лучевой терапией. Продукты распада раковых клеток, разрушенных облучением, могут активировать циркулирующие антитела и комплемент, что способствует образованию иммунных комплексов и, следовательно, запуску соответствующей реакции.Лучевая терапия, как известно, активизирует еще некоторые реактивные дерматозы.
Заболевание представляет собой септальный гранулематозный панникулит.
Острая узловатая эритема
Хроническая узловатая эритема
Мигрирующая узловатая эритема (болезнь Вилановы)
Выделяют также поверхностно-инфильтративную форму мигрирующей узловатой эритемы, характеризующуюся плоскими поверхностными склеродермоподобными инфильтратами, склонными к периферическому увеличению.
Лепрозная узловатая эритема
(Реактивные состояния II типа). Возникает у половины больных лепроматозной проказой, как правило, в первые 2 года после начала лечения. На коже появляются множественные воспаленные подкожные узлы.
Для постановки диагноза, как правило, достаточно клинических данных. Биопсия кожи показывает септальный панникулит и помогает исключить лобулярный панникулит, узловатый васкулит и узелковый периартериит. Биоптат берут из центрального участка очага и достаточно глубоко, чтобы захватить подкожную жировую ткань.
Общие терапевтические рекомендации
Лечение острой формы
Йодид калия (препарат, состоящий из 76% йода и 23% калия) является лечением выбора.После попадания внутрь йодид калия быстро всасывается в пищеварительном тракте и распределяется по межклеточному пространству. Йод концентрируется в щитовидной железе, а также в других тканях, таких как слюнные железы, слизистая оболочка желудка и молочная железа.Йодид калия может оказывать свое действие достаточно быстро, так что бывает легко оценить эффективность лечения. Препарат назначают внутрь по 300 мг 3 раза в день. Полная ремиссия очагов происходит за 10-14 дней после назначения лекарства, особенно если препарат начинают принимать сразу после начала заболевания. Самый лучший ответ наблюдают у пациентов с ЭУ, которая ассоциируется с системными симптомами, такими как лихорадка, боли в суставах и присутствие С-реактивного белка. Иногда бывают тошнота и рвота, но обычно при этом нет необходимости прекращать лечение. Нежелательные кожные реакции могут включать эритематозные, пурпуроподобные, уртикарные, акнеформные, узловатые, пустулезные и вегетативные очаги. Кроме этих довольно незначительных побочных эффектов, могут быть более существенные побочные реакции у беременных женщин и у пациентов с заболеваниями почек и щитовидной железы в анамнезе. Сообщалось о развитии выраженного гипотиреоидизма вторично к экзогенному приему йодида. Блокировка органического его связывания в щитовидной железе при избытке йодида, результатом которой является прекращение синтеза тиреоидных гормонов, известна как эффект Вольфа-Чайкоффа (Wolf- Chaikoff).
Механизм, посредством которого йодид калия оказывает свое действие не выяснен. Одна из гипотез предполагает, что йодид калия может вызывать высвобождение гепарина из тучных клеток, а гепарин, в свою очередь, подавляет клеточный иммунитет. Лекарство может также модулировать функцию нейтрофилов, подавляя производство перекиси водорода и гидроксильных радикалов. Эти промежуточные продукты кислорода являются до такой степени реактивными, что могут повреждать ткань. Йодид калия, препятствуя производству промежуточных продуктов кислорода, осуществляет защиту ткани от повреждения вследствие самоокисления.
Лечение хронической формы
Узловатая эритема является изнурительным хроническим заболеванием, для которого было предложено много вариантов лечения, но ни один из них не является универсально эффективным. Хотя пациенты быстро реагируют на кортикостероиды, риск их хронического применения вынуждает к поискам альтернативного подхода.
В хронических случаях часто не реагирует на большие дозы аспирина, но может драматически отвечать на противовоспалительное действие индометацина в дозах 100-150 мг/день. Подавление процесса индометацином связано с блокировкой активности синтеза простагландина в подкожной жировой ткани, что влияет как на клеточный, так и на гуморальный иммунный ответ.
Хроническую форму можно также успешно лечить напроксеном. Однако индометацин превосходит системные кортикостероиды и, возможно, имеет также преимущества над другими, менее мощными нестероидными противовоспалительными препаратами.
Гидроксихлорохин является эффективной и безопасной альтернативной терапией для некоторых пациентов в дозе 200 мг 2 раза в день, которую затем снижают до 200 мг 1 раз в день в течение 4 мес.
Лечение лепрозной узловатой эритемы
Некролитическая мигрирующая эритема как диагностический маркер рака поджелудочной железы

К паранеопластическим синдромам относят заболевания, возникающие вследствие развития злокачественного новообразования и проявляющиеся симптомами, отдаленными от локализации самой опухоли и ее метастазов.
Abstract. Paraneoplastic syndromes include diseases that arise as a result of the development of a malignant neoplasm, manifested by symptoms that are remote from the localization of the tumor itself and its metastases. Paraneoplastic dermatoses are a large group of various skin manifestations that indicate the possibility of the presence of a tumor, including at an early asymptomatic stage of development. One of these dermatoses is necrolytic migrating erythema, a skin pathology associated with glucagonoma, an alpha – cell tumor of the pancreas that produces glucagon. The description of the clinical case presented in the article will help to improve the understanding of the common pathogenetic aspects between neoplasm and dermatosis, increase the oncological alertness of related specialists and organize effective interdisciplinary interaction, as a result, improving the quality of life of patients with tumor-associated dermatoses. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Masko D. I., Kozyr Ya. V. Necrolytic migrating erythema as a diagnostic marker of pancreatic cancer // Lechaschy Vrach. 2021; 8 (24): 45-47. DOI: 10.51793/OS.2021.24.8.007
Резюме. К паранеопластическим синдромам относят заболевания, возникающие вследствие развития злокачественного новообразования и проявляющиеся симптомами, отдаленными от локализации самой опухоли и ее метастазов. Паранеопластические дерматозы – это многочисленная группа различных кожных проявлений, указывающих на возможность наличия опухоли, в том числе на ранней бессимптомной стадии развития. Одним из таких дерматозов является некролитическая мигрирующая эритема – патология кожи, имеющая ассоциацию с глюкагономой – альфа-клеточной опухолью поджелудочной железы, продуцирующей глюкагон. Представленное в статье описание клинического случая поможет улучшить понимание общности патогенетических аспектов между новообразованием и дерматозом, повысить онкологическую настороженность смежных специалистов и организовать эффективное междисциплинарное взаимодействие, улучшив качество жизни больных с опухоль-ассоциированными дерматозами.
Паранеопластические синдромы (ПС) рассматриваются как результат опосредованного воздействия злокачественного новообразования на регуляторные системы организма, проявляющегося отдаленными симптомами, не связанными с локализацией и метастазированием опухолевых клеток [1]. Обширную группу среди ПС представляют паранеопластические дерматозы – кожные заболевания, являющиеся первыми и часто единственными маркерами бессимптомного опухолевого роста, ранняя диагностика которых имеет колоссальную прогностическую значимость для жизни пациентов [2, 3].
Одним из таких дерматозов является некролитическая мигрирующая эритема (НМЭ) – патология кожи, имеющая ассоциацию с глюкагономой – альфа-клеточной опухолью поджелудочной железы, продуцирующей глюкагон [4]. Предполагается, что именно устойчивый высокий уровень глюкагона вызывает гликогенолитические и глюконеогенные эффекты, приводящие к истощению эпидермального белка и увеличению концентрации арахидоновой кислоты, вызывающие дальнейшее воспаление и некролиз [5]. НМЭ является распространенной (до 70% случаев) дерматологической находкой при глюкагономе [6]. Дерматологическая картина представлена эритематозными шелушащимися очагами, быстро растущими по периферии, располагающимися преимущественно в естественных складках кожи, на коже туловища, конечностей, а также в местах постоянного трения, давления и травматизации [4]. Кожные проявления сопровождаются мучительным зудом и болезненностью, за счет присоединения вторичной инфекции возможно возникновение глоссита и хейлита [6]. Другими клиническими проявлениями, указывающими на наличие альфа-клеточной опухоли, наряду с НМЭ могут быть психоневрологические расстройства, рецидивирующий тромбоз глубоких вен, нормохромная нормоцитарная анемия, сахарный диабет (СД) [5].
Важным аспектом диагностического поиска является тот факт, что НМЭ как проявление ПС может формироваться параллельно с развитием опухоли или задолго до ее клинического дебюта [3]. Раннее установление верного диагноза и своевременное хирургическое лечение до начала метастазирования опухоли являются важнейшими факторами благоприятного прогноза для пациента [1]. Коморбидный статус пациента с ПС требует интегральной тактики ведения [7]. В связи с трудностью дифференциальной диагностики и частыми ошибками дерматологов при постановке диагнозов приводим описание собственного клинического наблюдения.
Клиническое наблюдение
Пациентка Л., 49 лет, считает себя больной с июля 2018 г., когда впервые появились высыпания на коже нижних конечностей, которые связывает с перенесенным стрессом. Обратилась к дерматологу по месту жительства, выставлен диагноз «дерматит неуточненный», назначена терапия топическими глюкокортикостероидами, после которой пациентка отмечала незначительное улучшение. Спустя 2 недели отметила появление новых высыпаний в складках под молочными железами. Вновь обратилась к дерматологу по месту жительства, выставлен диагноз «микоз гладкой кожи», после проведения курсового лечения высыпания не регрессировали, а имели тенденцию к распространению на кожу рук и ног. С января 2019 г. неоднократно обращалась к различным специалистам – дерматологу, терапевту, аллергологу. Выставлялись различные диагнозы: «микоз гладкой кожи», «токсикодермия», «микотическая экзема, аллергиды распространенные». Проводилась дезинтоксикационная, гипосенсибилизирующая, седативная и другая симптоматическая терапия, без видимого эффекта.
В январе 2019 г. пациентка обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ Минздрава России.
На момент осмотра пациентка предъявляла жалобы на высыпания, периодический зуд в течение дня, жжение в очагах, ноющие боли в тазобедренных суставах. Также отмечала повышенную утомляемость, подавленность настрое-ния, снижение массы тела на 12 кг за последние 6 месяцев. Со стороны других органов и систем жалоб не предъявляла.
Из представленной медицинской документации стало известно: 1) пациентка неоднократно обращалась к психотерапевту по поводу депрессивного расстройства, однако прием медикаментов отрицает; 2) состоит на диспансерном учете у эндокринолога по месту жительства: «СД 2 типа. Целевой уровень гликозилированного гемоглобина менее 6,5%».
Объективно: на коже туловища (в области живота, спины, с переходом на крестец и ягодицы), коже рук (в области разгибательных поверхностей плеч, предплечий, тыльной стороне кисти) и ног (передняя и задняя поверхность бедер и голеней) визуализируются множественные единичные и сгруппированные милиарные папулы ярко-розового цвета, четко отграниченные, возвышающиеся над поверхностью кожи. На коже в складках под молочными железами, паховых складках, межъягодичной области располагаются пятна ярко-красного цвета, с четкими границами, с участками экзематизации и мокнутия (рис. 1-3).
При общем осмотре: периферические лимфатические узлы не увеличены. Сердечные тоны приглушены, ритм правильный. Артериальное давление
Результаты лабораторно-инструментальных исследований:
Рентгенограмма легких без патологии.
Заключение УЗИ гепатобилиарной зоны: «Признаки гепатомегалии, аномалия формы желчного пузыря – загиб тела; выраженные диффузно-неоднородные изменения эхоструктуры поджелудочной железы, солидное образование (Tumor?) тела поджелудочной железы».
Консультация терапевта: «Объемное образование поджелудочной железы? Анемия неясного генеза».
На основании данных анамнеза, лабораторных исследований, а также имеющейся клинической картины выставлен предварительный диагноз: «Некролитическая мигрирующая эритема? Кандидоз крупных складок».
С целью установления окончательного клинического диагноза назначен дополнительный метод исследования – компьютерная томограмма (КТ) органов брюшной полости.
Описание: на серии КТ-срезов получено изображение органов брюшной полости, забрюшинного пространства в нативном виде и после болюсного контрастного усиления Ультравист 370.
Печень имеет четкие ровные контуры, не увеличена, паренхима однородная, ее плотностные характеристики в пределах нормы – 55 ед. Н. Признаков портальной и билиарной гипертензии не выявлено. Краниокаудальный размер правой доли – 169 мм, левой – 54 мм. Желчный пузырь грушевидный, патологических образований не содержит. Холедох и внутрипеченочные протоки не расширены.
Поджелудочная железа нерезко увеличена в размерах. На уровне головки толщина – 26 мм, тело – 24 мм, хвост – 19 мм. В паренхиме на границе тела и хвоста железы определяется очаг пониженной плотности в нативном виде до 25 ед. Н, с размытыми контурами, размером 12 × 9 × 7 мм. После контрастного усиления определяется повышение плотности в очаговом образовании до 52 ед. Н. Вирсунгов проток не расширен.
Селезенка с продольным размером 86 мм, толщина – 44 мм, паренхима однородная. Почки не увеличены, контрастирование паренхимы адекватное. Чашечно-лоханочная система не расширена.
Увеличенных лимфоузлов на исследованном уровне не выявлено. После контрастного усиления зон патологического повышения плотности в паренхиматозных органах не определяется.
Заключение КТ органов брюшной полости: «КТ-признаки очагового образования поджелудочной железы (не исключен c-r)» (рис. 4, а-в).
После получения результатов обследования и на основании кожного патологического процесса выставлен окончательной клинический диагноз: «Некролитическая мигрирующая эритема. Кандидоз крупных складок», назначена топическая терапия комбинированными ГКС, анилиновые красители. Для определения дальнейшей тактики ведения пациентка переведена в Клинический онкологический диспансер № 1.
Таким образом, представленный нами клинический случай демонстрирует, что своевременная диагностика НМЭ является определяющим фактором раннего выявления рака поджелудочной железы. Понимание общности патогенетических аспектов между новообразованием и дерматозом, онкологическая настороженность смежных специалистов и полноценный комплекс диагностических мероприятий позволят организовать эффективное междисциплинарное взаимодействие и оказать своевременное лечение, повысив качество жизни больных с опухоль-ассоциированными дерматозами.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
* ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
** ГБУЗ ДККБ Минздрава Краснодарского края, Краснодар, Россия
Некролитическая мигрирующая эритема как диагностический маркер рака поджелудочной железы/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Д. И. Масько, Я. В. Козырь
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Масько Д. И., Козырь Я. В. Некролитическая мигрирующая эритема как диагностический маркер рака поджелудочной железы // Лечащий Врач. 2021; 8 (24): 45-47. DOI: 10.51793/OS.2021.24.8.007
Теги: кожа, дерматоз, эритема, опухоль, метастазы
Erythema migrans что такое
ГОУ ВПО МГУПП НИУВ, Москва
Государственный институт усовершенствования врачей МО РФ, Москва
Мигрирующая эритема: кожная манифестация болезни Лайма
Журнал: Клиническая дерматология и венерология. 2015;14(6): 8-14
Сорокина Е. В., Масюкова С. А. Мигрирующая эритема: кожная манифестация болезни Лайма. Клиническая дерматология и венерология. 2015;14(6):8-14.
Sorokina E V, Masiukova S A. Erythema migrans: the cutaneous manifestation of Lyme disease. Klinicheskaya Dermatologiya i Venerologiya. 2015;14(6):8-14.
https://doi.org/10.17116/klinderma20151468-14
ГОУ ВПО МГУПП НИУВ, Москва
Представлены современные данные об этиологии, эпидемиологии, патогенезе, клинических признаках, диагностике и лечении мигрирующей эритемы (МЭ). МЭ является наиболее распространенной клинической презентацией ранней локализованной формы болезни Лайма (БЛ), проявлением инфекции, вызванной Borrelia burgdorferi. Множественные МЭ характерны для ранней диссеминированной стадии. Системные симптомы могут сопровождать развитие МЭ, однако их характер не является специфичным. В большинстве случаев факт клещевой инокуляции остается не замеченным больными. Серологические анализы часто дают ложноотрицательные результаты и не являются обязательными для диагностики. Поэтому диагноз МЭ устанавливают, как правило, на основании клинических проявлений. Однако, несмотря на характерную клиническую картину МЭ, которую считают патогномоничным признаком БЛ, необходимо проводить дифференциальную диагностику с другими фигурными эритемами и дерматозами, характеризующимися эритематозными очагами фигурных очертаний. Этиотропная терапия МЭ включает назначение антибиотиков. Ранняя фаза инфекции при своевременно начатой этиотропной терапии позволяет достичь излечения этой потенциально системной инфекции, поэтому очень важно своевременно диагностировать МЭ. Цель данного обзора — привлечь внимание специалистов к проблеме БЛ не только в эндемичных регионах, указать на необходимость диагностических мероприятий, а также своевременной антимикробной и патогенетической терапии, что позволит предотвратить развитие поздних форм БЛ с системным поражением и в ряде случаев инвалидизацией.
ГОУ ВПО МГУПП НИУВ, Москва
Государственный институт усовершенствования врачей МО РФ, Москва
В структуре группы фигурных эритем одно из значимых мест занимает мигрирующая эритема Афцелиуса—Липшютца (МЭ), являющаяся патогномоничным признаком Лайм-боррелиоза, широко распространенного трансмиссивного заболевания практически на всех континентах. В Российской Федерации ежегодно количество заболевших клещевыми боррелиозами колеблется от 7 до 9 тыс. [7, 8]. В 2011 г. частота заболеваемости иксодовым клещевым боррелиозом составила 7,02 на 100 тыс. населения [4]. В последние десятилетия отмечается рост частоты тяжелых, хронических, торпидных форм болезни Лайма (БЛ) [7, 8, 24, 45].
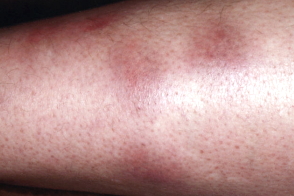
МЭ относится к ранней кожной манифестации БЛ, проявлением воспалительно-аллергической реакции кожи на присасывание клеща, наблюдающейся у 50—80% больных, а при существовании более 4 нед может быть отнесена к хронической. Иксодовый клещевой боррелиоз (БЛ) — природно-очаговое трансмиссивное инфекционное заболевание, которое было впервые описано в Европе, в том числе и в России, еще в конце XIX века [5, 27, 48]. В начале ХХ века (1908) шведский врач-дерматолог Арвид Афзелиус [10] установил взаимосвязь между появлением на коже кольцевидной МЭ («эритема Афзелиуса», «мигрирующий дерматит») и присасыванием клеща. Современное название было дано исследователем Липшютцем в 1913 г. [37]. В 1975 г. в США, в городке Лайм, впервые были описаны случаи клещевого боррелиоза у группы детей в сочетании с кольцевидной МЭ после присасывания клеща [39, 41]. До начала 80-х годов XX века БЛ и хроническая МЭ рассматривались как два самостоятельных заболевания с неясной этиологией. В 1982 г. американский микробиолог Вилли Бургдорфер [19] впервые выделил и идентифицировал неизвестные ранее спирохетоподобные микроорганизмы из клещей Ixodes dammini (современное название — Ixodes scapularis). Позднее эти микроорганизмы были выделены из крови, биоптатов кожи, спинномозговой жидкости больных людей [13, 16, 40]. Возбудители Б.Л. относятся к порядку Spirochaetales, семейству Spirochaetaceae, роду Borrelia. Для Евразии наиболее важное эпидемиологическое значение в развитии БЛ имеют клещи Ixodes ricinus и Ixodes persulcatus, в США — I. scapularis. Боррелии попадают в организм человека со слюной клеща. На коже в месте его присасывания развивается кольцевидная МЭ. С током лимфы и крови возбудитель попадает во внутренние органы. Под воздействием факторов неспецифической защиты макроорганизма часть боррелий погибает, выделяя эндотоксин, который запускает каскад иммунопатологических реакций [34]. В настоящее время доказана патогенность 3 видов B. burgdorferi sensu lato: B. burgdorferi sensu stricto, B. garinii и B. afzelii. Патогенные для человека виды боррелий комплекса B. burgdorferi sensu lato адаптировались в процессе эволюции к выживанию в различных биологических объектах окружающей среды: в клещах и их «прокормителях» — позвоночных животных, что достигается за счет функционирования различных регуляторных генов, изменяющих уровень экспрессии ряда белков на протяжении жизненного цикла [12, 29, 48]. Боррелии имеют группы антигенов: поверхностные (OspA, OspB, OspD, OspE и OspF), жгутиковый и цитоплазматический. Поверхностные антигены характеризуются вариабельностью. Белки внешней оболочки определяют видовую принадлежность возбудителя и являются основными иммуногенами.
Инкубационный период составляет 3—30 дней (в среднем 7 дней). Способность боррелий к самостоятельным поступательным движениям в тканях находит свое отражение в особенностях местного воспаления. В центре эритемы (в месте первоначального накопления возбудителя) боррелии подвергаются активному воздействию факторов воспаления, они теряют свою подвижность и их количество уменьшается, результатом чего является формирование в центре эритемы зоны просветления. Появление новых колец гиперемии связано с новыми генерациями боррелий и обычно приводит к развитию характерной МЭ.
Патогистологическая картина в ранние сроки развития МЭ (первые 15 сут) характеризуется признаками экссудативно-продуктивного воспаления и представлена субэпидермальными и подроговыми пузырями, характерными для центральных участков эритемы. В эпидермисе отмечается гиперкератоз, гидропическая дистрофия эпителиоцитов базального слоя, редко — койлоцитоз. В сосочковом слое дермы наблюдают выраженный отек, перикапилляриты и интерстициальные полосовидные клеточные инфильтраты, состоящие из лимфоидных и небольшого количества плазматических клеток, гистиоцитов, эозинофилов, редко нейтрофилов. В капиллярах выявляется стаз, редко — эритроцитарные тромбы. В периферических участках эритемы обнаруживаются гидропическая дистрофия эпителия шиповатого слоя и перикапилляриты в сосочковом слое дермы. Там же выявляются разной степени выраженности диффузные или очаговые клеточные инфильтраты. В центральных участках эритемы в более поздние сроки (15—40 дней) выявляют наличие перикапилляритов и фиброзирование стенок сосудов, редко — гидропическую дистрофию эпителиоцитов [9, 23].
Дифференциальную диагностику МЭ необходимо проводить прежде всего с другими фигурными эритемами: кольцевидной центробежной эритемой Дарье, ревматической эритемой Лендорфа—Лейнера, фигурной персистирующей эритемой, нейтрофильной эритемой, эозинофильной кольцевидной эритемой, извилистой ползучей эритемой Гаммела. Проблема дифференциальной диагностики МЭ также обусловлена многообразием неспецифических экзантематозных высыпаний фигурных очертаний, чаще вызванных вирусными инфекциями. Дифференциальный диагноз МЭ в виде гомогенного очага следует проводить с эритемной формой рожистого воспаления, пятнистой формой токсидермии, в том числе с фиксированной эритемой, с реакцией на укусы насекомых, кольцевидной гранулемой, микробной экземой и другими дерматозами, проявляющимися очагами кольцевидной формы.
Прогноз при МЭ обычно благоприятный. МЭ регрессирует спонтанно (как правило, в течение 1—2 мес), но может длительно персистировать от 6 до 12 мес [30]. Терапия Б.Л. наиболее эффективна на ранних стадиях инфекции, благоприятный исход заболевания и выздоровление зависят от своевременности начатого этиотропного лечения. Поэтому М.Э. требует проведения этиотропной терапии. Терапия М.Э., как и других проявлений БЛ, включает назначение антибиотиков. Препаратом первой линии являются доксициклин и цефуроксим, может применяться амоксициллин и эритромицин. Амоксициллин может стать препаратом выбора при лечении детей и беременных. Длительность антибактериальной терапии составляет обычно 14—21 день. Однако исследование показало одинаковую высокую эффективность применения 10- и 20-дневного курса терапии доксициклином М.Э. Эффективность антимикробной профилактики с использованием доксициклина в дозе 200 мг однократно в первые 72 ч после присасывания клеща спорна [33]. Хороший эффект был получен в результате применения в терапии МЭ азитромицина по схеме 1000 мг в 1-й день и по 500 мг ежедневно в течение последующих 4 дней [15]. Парентеральное введение цефтриаксона в суточной дозе 2 г или пенициллина G IV по 18—24 млн МЕ ежедневно в течение 10—14 дней может применяться в случаях множественной МЭ и у пациентов с иммунодефицитом [31]. Антибактериальная терапия на I стадии инфекции значительно снижает вероятность развития неврологических, кардиальных и артралгических осложнений, способствует исчезновению эритемы в более короткий срок, а главное, предотвращает развитие поздних стадий БЛ [20, 47].
С целью профилактики БЛ применяют вакцины, содержащие антитела против поверхностного липопротеина, А спирохет — OspA (Lymerix), эффективность которых составляет 70—80% [42]. Однако накопились данные о неблагоприятном воздействии вакцинации и наличии поствакцинальных осложнений, обусловленных артритогенным потенциалом липопротеина OspA. В настоящее время исследователи [44] акцентируют внимание на потенциальных антигенах для второй генерации вакцин (OspC, DbpA, OspB, p35, p37, p66).
Несмотря на мощную антибиотикотерапию МЭ с длительным курсом и относительно большими разовыми дозами, формирование хронических форм инфекции наступает у 3,5—30% больных. При лечении хронических форм БЛ эффективность этиотропной терапии снижается и составляет 43,2—48,7% [6].
По субпопуляционному составу лимфоцитов периферической крови при острой и хронической формах БЛ различий не было выявлено [1]. При Лайм-боррелиозе гуморальный иммунитет характеризуется преимущественным синтезом IgG1 и IgG3 субклассов антител, участвующих в активации комплемента и процессе опсонизации боррелий. Продукция иммуноглобулинов подкласса IgG2 незначительна, а IgG4 — отсутствует [8].
Таким образом, на современном этапе МЭ, являясь наиболее распространенной нозологической формой в группе фигурных эритем и патогномоничным признаком ранней стадии часто встречаемого трансмиссивного заболевания — БЛ, характеризуется торпидным хроническим течением и сопровождается нарушениями в системе врожденного и адаптивного иммунитета. Развитие М.Э. при БЛ происходит на фоне недостаточности клеточных и/или гуморальных факторов неспецифической резистентности организма, что определяет необходимость своевременного проведения этиотропной терапии и направленность патогенетической терапии ранней стадии БЛ с целью предотвращения развития тяжелых торпидных форм.
_575x.png)
.png)
